Усовершенствованные векторы экспрессии млекопитающих и их применение
Иллюстрации
Показать всеГруппа изобретений относится к области биотехнологии. Вектор экспрессии содержит: (a) ориджин репликации OriP, полученный из вируса Эпштейна-Барр (EBV), где ориджин репликации содержит: 1) элемент симметрии второго порядка (DS); и 2) участок дупликации (FR), который содержит участок связывания EBNA; (b) ориджин репликации SV40; (c) участок инсерции для вставки представляющего интерес гена; (d) промотор EF-1б, функционально связанный с участком инсерции; (e) сигнал поли-A; (f) бактериальный ориджин репликации; (g) селектируемый маркер; и необязательно содержащий (h) последовательность нуклеиновой кислоты, кодирующую константную область тяжелой или легкой цепи антитела, функционально связанную с участком инсерции. Причем ориджин репликации OriP связан с действующим извне фактором инициации репликации EBNA 1, который не кодируется вектором экспрессии. Использование вектора экспрессии в выделенной клетке-хозяине, наборе и способе получения рекомбинантного белка обеспечивает получение обильной экспрессии белка. 4 н. и 22 з.п. ф-лы, 25 ил., 3 табл., 4 пр.
Реферат
Родственные заявки
Данная заявка испрашивает приоритет предварительной заявки США № 61/021282, поданной 15 января 2008, и предварительной заявки США № 61/104546, поданной 10 октября 2008, содержание которых включено в данное описание ссылкой во всей полноте.
Уровень техники изобретения
Стабильную продукцию белков, включающую получение биопрепаратов, можно осуществлять путем трансфекции клеток-хозяев векторами, которые содержат ДНК, кодирующую белок. Сохранение вектора в клеточной линии можно обеспечить с помощью ряда способов, включающих экстрахромосомальную репликацию с использованием эписомальных ориджинов репликации. Эписомальные векторы содержат ориджин репликации, который инициирует репликацию вектора после связывания последовательности с фактором инициации репликации. Эписомальные векторы имеют несколько преимуществ по сравнению с векторами, которые требуют внедрения в геном хозяина. Например, использование эписомальных векторов позволяет уменьшить фенотипические изменения, возникающие в результате интеграции вектора в геном хозяина. Кроме того, эписомальные векторы можно выделить из трансфицированных клеток с помощью стандартных методов экстракции ДНК.
По мере развития значимости терапевтических белков, т.е. биопрепаратов, нужно предпринимать усилия по оптимизации продукции белков при увеличении общей эффективности процесса продукции. Так, повышение эффективности необходимо соизмерять с производительностью вектора в отношении продукции белка. Существует потребность в усовершенствованных системах экспрессии, которые обеспечивают условия эффективного клонирования, а также высокие уровни целевого белкового продукта. Предпочтительно уменьшить число стадий клонирования в процессе продукции биопрепаратов, в особенности антител, поскольку это позволяет уменьшить затраты времени и минимизировать стоимость. Также предпочтительно использовать векторы, которые обеспечивают удовлетворительную продукцию белка как в мелкомасштабных, так и в крупномасштабных клеточных культурах. Настоящее изобретение направлено на преодоление недостатков, связанных с применением традиционных векторов, путем использования дополнительных преимуществ, которые станут ясны из приведенного ниже подробного описания.
Сущность изобретения
Рекомбинантные белки можно получить путем транзиторной трансфекции клеток млекопитающих, в частности, в процессе разработки фармацевтических средств. Для экспрессии белков можно использовать ряд клеток-хозяев, включая клетки млекопитающих, такие как клетки COS и эмбриональные клетки почек человека (HEK). Активность эписомальных векторов обусловлена присутствием ориджина репликации и действующего извне фактора инициации репликации, который связывается с ориджином репликации. Факторы инициации репликации, такие как ядерный антиген вируса Эпштейна-Барр (EBNA), который связывается с OriP вируса Эпштейна-Барр, можно клонировать в эписомальном векторе или, альтернативно, можно экспрессировать в клетке-хозяине, трансфицированной таким вектором. Таким образом, эписомальные векторы могут быть специфичными для некоторых клеточных линий, которые экспрессируют действующий извне фактор, необходимый для активации репликации через ориджин репликации.
Настоящее изобретение устраняет потребность в разных скелетах эписомальных векторов, используемых для экспрессии рекомбинантных белков. Настоящее изобретение предлагает эписомальные векторы, содержащие, по меньшей мере, два разных эписомальных ориджина репликации, которые позволяют использовать один и тот же вектор для экспрессии белка в разных типах клеток. Разные ориджины репликации позволяют использовать вектор в разных типах клеток млекопитающих, которые предоставляют необходимые действующие извне факторы репликации и обеспечивают репликацию вектора. Путем устранения потребности повторного клонирования представляющих интерес генов при получении белка настоящее изобретение повышает эффективность и уменьшает стоимость путем снижения числа векторов, сохраняя при этом прежний уровень продукции белка. Неожиданный аспект данного изобретения заключается в том, что добавление нуклеотидов к вектору, т.е. второго ориджина репликации, не оказывает негативного влияния на способность вектора продуцировать белок на желательном уровне.
В предпочтительном варианте осуществления векторы данного изобретения содержат константные участки тяжелой или легкой цепи. Следовательно, вариабельный участок тяжелой или легкой цепи можно клонировать в векторе выше константного участка тяжелой или легкой цепи, соответственно, дополнительно улучшая эффективность системы экспрессии. Эписомальные векторы обеспечивают высокоэффективную продукцию белка в клетках млекопитающих, экспрессирующих SV40 T Ag или ядерный антиген вируса Эпштейна-Барр (например, в клетках COS7 или HEK293-6E).
Настоящее изобретение предлагает сочетание элементов, оптимальное для получения высокого выхода белка, высокой эффективности продуцирования и пониженной стоимости, причем указанные элементы играют важную роль в производстве белка, особенно в фармацевтической промышленности и при получении биологических белков, таких как антитела. Другие признаки и преимущества данного изобретения описаны в подробном описании и формуле изобретения, приведенных ниже.
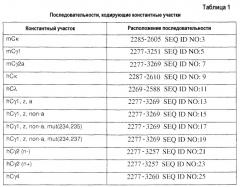
В одном аспекте изобретение предлагает вектор экспрессии, содержащий: a) ориджин репликации OriP, полученный из вируса Эпштейна-Барр (EBV); (b) ориджин репликации SV40; (c) участок инсерции для вставки представляющего интерес гена; и (d) нуклеотидную последовательность, кодирующую константный участок тяжелой или легкой цепи антитела, функционально связанный с участком инсерции. В одном варианте осуществления представляющий интерес ген кодирует вариабельный участок тяжелой или легкой цепи антитела, например, вариабельный участок тяжелой или легкой цепи мышиного, гуманизированного, химерного или человеческого антитела. В конкретном варианте осуществления вариабельный участок тяжелой цепи антитела представляет собой вариабельный участок тяжелой цепи антитела, выбранного из группы, состоящей из адалимумаба ABT-325 и ABT-874. В другом конкретном варианте осуществления вариабельный участок легкой цепи антитела представляет собой вариабельный участок легкой цепи антитела, выбранного из группы, состоящей из адалимумаба, ABT-325 и ABT-874. Константный участок тяжелой цепи может быть получен, например, из мышиного, гуманизированного, химерного или человеческого антитела, и может представлять собой константный участок тяжелой цепи антитела, выбранный из группы, состоящей из гамма 1, z, a; гамма 1, z, non-a; гамма 2, n+; гамма 2, n-; и гамма 4. Константный участок тяжелой цепи антитела гамма 1, z, non-a может дополнительно содержать аланиновую мутацию в положении 234 константного участка тяжелой цепи. В другом варианте осуществления константный участок тяжелой цепи антитела гамма 1, z, non-a может дополнительно содержать аланиновую мутацию в положении 235 или 237 константного участка тяжелой цепи антитела.
В одном варианте осуществления константный участок легкой цепи антитела относится к каппа-изотипу человеческой цепи или к лямбда-изотипу человеческой цепи. В одном варианте осуществления константный участок тяжелой цепи антитела относится к гамма 1 изотипу мышиной цепи или к гамма 2a изотипу мышиной цепи. В другом варианте осуществления константный участок легкой цепи антитела относится к каппа-изотипу мышиной цепи. В одном варианте осуществления константный участок тяжелой цепи антитела представляет собой домен Fc. В одном варианте осуществления вариабельный участок тяжелой или легкой цепи антитела находится в 5'-направлении по отношению к участку инсерции.
В одном варианте осуществления вектор экспрессии дополнительно содержит промотор, функционально связанный с участком инсерции, где промотор представляет собой либо промотор EF-1α, либо промотор цитомегаловируса (CMV).
В одном варианте осуществления вектор экспрессии дополнительно содержит селектируемый маркер, такой как ген устойчивости к ампициллину.
В одном варианте осуществления промотор CMV содержит нуклеотидную последовательность, которая, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98% или, по меньшей мере, на 99% идентична нуклеотидам 1-608 последовательности SEQ ID NO:1. В конкретном варианте осуществления промотор CMV содержит нуклеотиды 1-608 последовательности SEQ ID NO:1.
В одном варианте осуществления промотор EF-1α является человеческим. В одном варианте осуществления промотор EF-1α содержит нуклеотидную последовательность, которая, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98% или, по меньшей мере, на 99% идентична нуклеотидам 76-1267 последовательности SEQ ID NO:2. В конкретном варианте осуществления промотор EF-1α содержит нуклеотиды 76-1267 последовательности SEQ ID NO:2.
В одном варианте осуществления ориджин репликации OriP содержит нуклеотидную последовательность, которая, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98% или, по меньшей мере, на 99% идентична нуклеотидам 1795-3545 последовательности SEQ ID NO:1.
В одном варианте осуществления ориджин репликации SV40 содержит нуклеотидную последовательность, которая, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98% или, по меньшей мере, на 99% идентична нуклеотидам 5834-6140 последовательности SEQ ID NO:1. В конкретном варианте осуществления ориджин репликации SV40 содержит нуклеотиды 5834-6140 последовательности SEQ ID NO:1.
Типичный вектор экспрессии данного изобретения содержит нуклеотидную последовательность, которая, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98% или, по меньшей мере, на 99% идентична последовательности, выбранной из группы, состоящей из последовательностей SEQ ID NO:1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31 и 32. В конкретных вариантах осуществления вектор экспрессии содержит нуклеотидную последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO:1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31 и 32.
Векторы экспрессии данного изобретения также приведены на фиг.1, 2 и 14-25. Другие векторы данного изобретения изображены на фиг.8-13.
В другом аспекте изобретение предлагает клетку-хозяина млекопитающего, содержащую вектор данного изобретения. В качестве клетки-хозяина млекопитающего можно использовать клетку COS, такую как клетка COS 7, или эмбриональную клетку человеческой почки (HEK), такую как клетка HEK-293.
В другом аспекте изобретение предлагает набор, содержащий вектор данного изобретения.
В другом аспекте изобретение предлагает способ получения рекомбинантного белка, включающий введение вектора экспрессии данного изобретения в клетку-хозяина млекопитающего, культивирование клетки-хозяина млекопитающего в подходящих условиях, обеспечивающих экспрессию белка, и выделение белка.
В другом аспекте изобретение предлагает вектор экспрессии, содержащий нуклеотидную последовательность, кодирующую сигнальный пептид. В одном варианте осуществления представляющий интерес ген функционально связан с нуклеиновой кислотой, кодирующей сигнальный пептид.
Краткое описание фигур
Вышеописанные и другие цели, признаки и преимущества настоящего изобретения, а также само изобретение, разъясняются более полно в нижеследующем подробном описании предпочтительных вариантов осуществления в сочетании с прилагаемыми фигурами, на которых:
На фиг.1 изображена карта пустого вектора pHyb-C. Элементы вектора включают эукариотический ориджин репликации SV40, эукариотический экспрессионный промотор цитомегаловируса (pCMV), трехчленную лидерную последовательность (TPL), донорный участок сплайсинга (SD), основной поздний энхансер аденовируса (enh MLP), акцепторный участок сплайсинга (SA), участок открытой рамки считывания (ORF), содержащий представляющий интерес ген с последующим сигналом поли-A (pA), элемент симметрии второго порядка (DS), эукариотический ориджин репликации вируса Эпштейна-Барр (OriP), участок дупликации (FR), маркер устойчивости к ампициллину (AmpR) и бактериальный ориджин репликации (pMB1ori).
На фиг.2 изображена карта пустого вектора pHyb-E. Элементы вектора включают эукариотический ориджин репликации SV40, эукариотический промотор EF-1a, участок открытой рамки считывания (ORF), содержащий представляющий интерес ген с последующим сигналом поли A (pA), элемент симметрии второго порядка (DS), эукариотический ориджин репликации вируса Эпштейна-Барр (OriP), участок дупликации (FR), маркер устойчивости к ампициллину (AmpR) и бактериальный ориджин репликации (pMB1ori).
На фиг.3 показаны титры рекомбинантного гибридного белка Fc, продуцируемого клетками COS, трансфицированными векторами pBOS, pTT3, pHybC и pHybE с использованием метода электропорации.
На фиг.4 показаны титры рекомбинантного гибридного белка Fc, продуцируемого клетками HEK-293-6E, трансфицированными векторами pBOS, pTT3, pHybC и pHybE с использованием метода PEI.
На фиг.5 показаны титры антитела, продуцируемого HEK-293-6E, трансфицированными с использованием метода PEI векторами pBOS, pTT3, pHybC и pHybE, обеспечивающими экспрессию антитела IgG.
На фиг.6 показаны титры антитела, продуцируемого клетками COS, трансфицированными с использованием метода электропорации векторами pBOS, pTT3, pHybC и pHybE, обеспечивающими экспрессию антитела IgG.
На фиг.7 показаны титры антитела, продуцируемого клетками COS, трансфицированными с использованием метода электропорации векторами pHyb-E-SwaI (v1) или pHyb-E (v2), обеспечивающими экспрессию антитела IgG.
На фиг.8 изображена карта вектора pHybC-mBR3-mCg2a (также обозначаемого "pHybC-mBR3-Fc").
На фиг.9 изображена карта вектора pHybE-mBR3-mCg2a (также обозначаемого "pHybE-mBR3-Fc").
На фиг.10 изображена карта вектора pHybC-E7-hCk (также обозначаемого "pHybC-E7").
На фиг.11 изображена карта вектора pHybC-D2-hCg1,z,a (также обозначаемого "pHybC-D2").
На фиг.12 изображена карта вектора pHybE-D2-hCg1,z,a (также обозначаемого "pHybE-D2").
На фиг.13 изображена карта вектора pHybE-E7-hCk (также обозначаемого "pHybE-E7").
На фиг.14 изображена карта pHybE-hCg1,z,a V2 (также обозначаемого "pJP182").
На фиг.15 изображена карта pHybE-hCgl,z,non-a V2 (также обозначаемого "pJP183").
На фиг.16 изображена карта pHybE-hCg1,z,non-a,mut(234,235) V2 (также обозначаемого "pJP184").
На фиг.17 изображена карта pHybE-hCg1,z,non-a,mut (234,237) V2 (также обозначаемого "pJP185").
На фиг.18 изображена карта pHybE-hCg2,n+ V2 (также обозначаемого "pJP186").
На фиг.19 изображена карта pHybE-hCg2,n- V2 (также обозначаемого "pJP187").
На фиг.20 изображена карта pHybE-hCg4 V2 (также обозначаемого "pJP188").
На фиг.21 изображена карта pHybE-mCg1 V2 (также обозначаемого "pJP189").
На фиг.22 изображена карта pHybE-mCg2a V2 (также обозначаемого "pJP190").
На фиг.23 изображена карта pHybE-hCk V2 (также обозначаемого "pJP191").
На фиг.24 изображена карта pHybE-hCl V2 (также обозначаемого "pJP192").
На фиг.25 изображена карта pHybE-mCk V2 (также обозначаемого "pJP193").
Подробное описание изобретения
I. Определения
Чтобы облегчить понимание данного изобретения, в настоящем описании вначале приводятся определения некоторых терминов.
Термин "нуклеиновая кислота" или "молекула нуклеиновой кислоты", используемый в данном описании, обозначает ДНК, РНК, мРНК, кДНК, геномную ДНК и их аналоги. Молекула нуклеиновой кислоты может быть одноцепочечной или двухцепочечной, но предпочтительно представляет собой двухцепочечную ДНК. Нуклеиновая кислота может быть выделенной или интегрированной в другую молекулу нуклеиновой кислоты, такую как вектор экспрессии или хромосома эукариотической клетки-хозяина.
"Выделенная" молекула нуклеиновой кислоты представляет собой молекулу, которая отделена от других молекул нуклеиновых кислот, присутствующих в природном источнике нуклеиновой кислоты. Например, в отношении геномной ДНК термин "выделенная" включает молекулы нуклеиновых кислот, отделенные от хромосомы, с которой геномная ДНК связана в природе. Предпочтительно, "выделенная" нуклеиновая кислота не содержит последовательностей, которые в природе фланкируют нуклеиновую кислоту (т.е. примыкают к 5'- и 3'-концам нуклеиновой кислоты) в геномной ДНК организма, из которого получена нуклеиновая кислота. Более того, "выделенная" молекула нуклеиновой кислоты, такая как молекула кДНК, по существу не содержит другого клеточного вещества или культуральной среды в случае получения рекомбинантными методами, по существу не содержит химических предшественников или других химических веществ в случае получения химическим синтезом.
Термины "рекомбинантный вектор" или "вектор" в данном описании используются как взаимозаменяемые и относятся к молекуле нуклеиновой кислоты, способной транспортировать другую нуклеиновую кислоту, с которой она связана. Одним из типов векторов является "плазмида", которая представляет собой циклическую двуспиральную петлю ДНК, в которую могут быть лигированы другие сегменты ДНК. Альтернативно, вектор может быть линейным. Другим типом векторов является вирусный вектор, позволяющий лигировать другие сегменты ДНК в вирусный геном. Некоторые векторы могут автономно реплицироваться в клетке-хозяине, в которую они введены (например, бактериальные векторы, содержащие бактериальный ориджин репликации, и эписомальные векторы млекопитающих). Другие векторы (например, неэписомальные векторы млекопитающих) могут интегрироваться в геном клетки-хозяина и, следовательно, реплицироваться вместе с геномом хозяина. В предпочтительном варианте осуществления векторы данного изобретения представляют собой эписомальные векторы млекопитающих. Термин "конструкция" в данном описании также относится к вектору.
Некоторые векторы способны управлять экспрессией генов, с которыми они функционально связаны. "Вектор экспрессии" или "рекомбинантный вектор экспрессии" представляет собой молекулу нуклеиновой кислоты, которая кодирует ген, экспрессирующийся в клетке-хозяине, и, кроме того, содержит элементы, необходимые для управления экспрессией гена. Как правило, вектор экспрессии содержит промотор транскрипции, представляющий интерес ген и терминатор транскрипции. Экспрессия гена обычно находится под контролем промотора, и в таком случае говорят, что ген "функционально связан" с промотором. Подобным образом, регуляторный элемент и основной промотор называют функционально связанными, если регуляторный элемент модулирует активность основного промотора. В одном варианте осуществления вектор экспрессии данного изобретения содержит несколько ориджинов репликации, что позволяет не ограничивать применение вектора одним типом клеток.
Используемый в данном описании термин «эписомально реплицирующийся вектор» или "эписомальный вектор" относится к вектору, который обычно и предпочтительно не интегрируется в геном клетки-хозяина, а существует параллельно. Эписомально реплицирующийся вектор, в соответствии с настоящим описанием, реплицируется в процессе клеточного цикла, и копии вектора, образующиеся в результате данной репликации, распределяются в новых клетках статистически, в зависимости от числа копий, присутствующих до и после деления клетки. Предпочтительно, эписомально реплицирующийся вектор находится в ядре клетки-хозяина и предпочтительно реплицируется в течение S-фазы клеточного цикла. Кроме того, эписомально реплицирующийся вектор реплицируется, по меньшей мере, один раз, т.е. один или несколько раз, в ядре клетки-хозяина в течение S-фазы клеточного цикла. В более предпочтительном варианте осуществления эписомально реплицирующийся вектор реплицируется один раз в ядре клетки-хозяина в течение S-фазы клеточного цикла.
В данном описании термины "последовательности ориджина репликации" или "ориджин репликации" используют как взаимозаменяемые для обозначения последовательностей, которые, в случае присутствия в векторе, инициируют репликацию. Ориджин репликации может распознаваться фактором инициации репликации или, альтернативно, ДНК-геликазой.
Используемый в данном описании термин "рекомбинация" относится к процессу, в результате которого вещество нуклеиновой кислоты, например ДНК, распределяется между двумя молекулами нуклеиновых кислот, например, в микроорганизме. Используемый в данном описании термин "гомологичная рекомбинация" относится к процессу, в результате которого вещество нуклеиновой кислоты распределяется между двумя молекулами нуклеиновых кислот через участки или сегменты гомологии последовательностей или, предпочтительно, идентичности последовательностей (например, имеющих высокую степень идентичности последовательностей). В иллюстративных вариантах осуществления вещество нуклеиновой кислоты находится на хромосоме или эписоме микроорганизма. В других иллюстративных вариантах осуществления вещество нуклеиновой кислоты находится вне хромосомы, например, на плазмиде. Рекомбинация может происходить между линейными и/или циклическими молекулами ДНК.
Используемый в данном описании термин "представляющий интерес ген" относится к экзогенной последовательности ДНК, которую добавляют в вектор данного изобретения. Представляющий интерес ген, например, может содержать кодирующую последовательность, которая может быть или отделена интронами, или которая может представлять собой кДНК, кодирующую открытую рамку считывания. Термин "представляющий интерес ген", используемый в данном описании, относится к последовательности ДНК, которую добавляют в вектор данного изобретения для конечной экспрессии белка. Участок вектора, в котором клонирован представляющий интерес ген, в данном описании называют "участком инсерции". Предпочтительно, представляющий интерес ген содержит последовательность, кодирующую фрагмент антитела или гибридного белка, который экспрессируют с использованием вектора данного изобретения. Например, последовательность, кодирующую вариабельный участок тяжелой цепи антитела адалимумаб, т.е. представляющий интерес ген, клонируют в векторе данного изобретения, который содержит константный участок тяжелой цепи.
В одном варианте осуществления данного изобретения вектор содержит последовательность, кодирующую константный участок легкой или тяжелой цепи антитела, которая находится в 3'-направлении по отношению к участку инсерции представляющего интерес гена и функционально связана с ним. Так, в одном варианте осуществления представляющий интерес ген кодирует вариабельный участок легкой или тяжелой цепи антитела и функционально связан с последовательностью, кодирующей константный участок легкой или тяжелой цепи антитела, которая входит в состав вектора данного изобретения.
Нуклеотидная последовательность считается "функционально связанной" с другой нуклеотидной последовательностью, если она находится в функциональной зависимости от нее. Например, ДНК, кодирующая сигнальный пептид, функционально связана с ДНК, кодирующей белок или полипептид, если в процессе экспрессии последовательности кодируют сигнальный пептид в одной рамке считывания с белком или полипептидом. Подобным образом, промотор или энхансер функционально связан с нуклеотидной последовательностью, кодирующей белок или полипептид, если экспрессия белка или полипептида регулируется указанным промотором или энхансером. В одном варианте осуществления функционально связанные нуклеотидные последовательности примыкают друг к другу (например, в случае сигнальных последовательностей). Альтернативно, функционально связанные нуклеотидные последовательности могут не примыкать друг к другу (например, в случае энхансеров). В одном варианте осуществления нуклеотидная последовательность, кодирующая константный участок легкой или тяжелой цепи антитела, функционально связана с представляющим интерес геном, например, кодирующим вариабельный участок тяжелой или легкой цепи.
Термин "промотор" включает любые нуклеотидные последовательности, достаточные для управления транскрипцией в эукариотической клетке, в том числе индуцируемые промоторы, репрессируемые промоторы и конститутивные промоторы. Как правило, промотор включает элементы, достаточные для обеспечения контроля за экспрессией управляемого промотором гена в клеточно-специфичной, ткане-специфичной или время-зависимой манере, или для индуцирования под действием внешних сигналов или факторов. Такие элементы могут находиться на 5'- или 3'-концах, или в участках последовательности интрона конкретного гена. Обычно используют конститутивную экспрессию гена, хотя при необходимости в настоящем изобретении можно использовать регулируемые промоторы. Экспрессию гена также можно контролировать путем регуляции транскрипции под действием тепла, света или металлов, например, используя гены металлотионина или гены белка теплового шока.
Термины "выше по ходу считывания" и "ниже по ходу считывания" относятся к относительному расположению двух элементов, присутствующих в нуклеотидной последовательности или векторе. Элемент, который находится "выше по ходу считывания", чем другой, расположен ближе к 5'-концу последовательности (т.е. ближе к концу молекулы, который содержит фосфатную группу, присоединенную к 5'-атому углерода рибозного или дезоксирибозного скелета, если молекула является линейной), чем другой элемент. Говорят, что элемент находится "ниже по ходу считывания", если он расположен ближе к 3'-концу последовательности (т.е. ближе к концу молекулы, который содержит гидроксильную группу, присоединенную к 3'-атому углерода рибозного или дезоксирибозного скелета линейной молекулы), чем другой элемент.
В данном описании термин "лишняя последовательность" относится к нуклеотидной последовательности, предпочтительно содержащейся в векторе, которая фланкируется участками ферментативной рестрикции по 5'- и 3'-концам. Лишняя последовательность находится в векторе в участке инсерции нуклеиновой кислоты, кодирующей представляющий интерес ген. В процессе клонирования лишнюю последовательность вырезают из вектора с использованием подходящих ферментов рестрикции, после чего в вектор на место лишней последовательности лигируют или вставляют посредством гомологичной рекомбинации нуклеиновую кислоту, кодирующую представляющий интерес ген. Предпочтительно, лишняя последовательность является достаточно большой, чтобы обеспечить достаточное расстояние между 5'- и 3'-участками ферментативной рестрикции, позволяющее ферментам рестрикции эффективно разрезать вектор. Кроме того, длина лишней последовательности предпочтительно отличается от длины нуклеиновой кислоты, кодирующей представляющий интерес ген, например, лишнюю последовательность, длина которой составляет примерно 300 пар оснований или менее, или примерно 400 пар оснований или более, можно использовать для вставки нуклеиновой кислоты, кодирующей представляющий интерес ген, длина которой составляет примерно 350 пар оснований. В другом варианте осуществления размер лишней последовательности составляет примерно 1 т.о.
Термин "рекомбинантная клетка-хозяин" (или просто "клетка-хозяин") в данном описании используется для обозначения клетки, в которую введен рекомбинантный вектор экспрессии. Следует понимать, что такие термины предназначены для обозначения не только конкретной исследуемой клетки, но и к потомству такой клетки. Поскольку в последующих поколениях могут происходить некоторые изменения вследствие мутаций или воздействий окружающей среды, такое потомство в действительности может быть не идентичным родительской клетке, однако оно еще входит в объем термина "клетка-хозяин", используемого в данном описании.
Термин "антитело" в соответствии с данным описанием включает целые антитела, а также любые их антиген-связывающие (т.е. "антиген-связывающий фрагмент") или одноцепочечные фрагменты. "Антитело" представляет собой гликопротеин, содержащий, по меньшей мере, две тяжелые (H) цепи и две легкие (L) цепи, соединенные дисульфидными связями, или его антиген-связывающий фрагмент. Каждая тяжелая цепь состоит из вариабельного участка тяжелой цепи (обозначаемого в данном описании VH) и константного участка тяжелой цепи. Константный участок тяжелой цепи состоит из трех доменов, CH1, CH2 и CH3. Каждая легкая цепь состоит из вариабельного участка легкой цепи (обозначаемого в данном описании VL) и константного участка легкой цепи. Константный участок легкой цепи состоит из одного домена, CL. Участки VH и VL можно дополнительно подразделить на участки гипервариабельности, называемые участками, определяющими комплементарность (CDR), которые перемежаются более консервативными участками, которые называются каркасными участками (FR). Каждый VH и VL состоит из трех CDR и четырех FR, расположенных, начиная от амино-конца к карбокси-концу, в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные участки тяжелых и легких цепей содержат связывающий домен, который взаимодействует с антигеном. Сочетание из шести CDR VH и VL образует антиген-связывающий участок. Если антитело состоит из двух H-цепей и двух L-цепей, то оно может содержать два одинаковых антиген-связывающих участка, два разных антиген-связывающих участка, которые связывают один и тот же антиген, или два антиген-связывающих участка, которые связывают разные антигены. Константные участки антител могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, включающими разные клетки иммунной системы (например, эффекторные клетки) и первый компонент (C1q) классической системы комплемента.
Термин "антиген-связывающий фрагмент" антитела (или просто "фрагмент антитела") в данном описании относится к одному или нескольким фрагментам антитела, которые сохраняют способность специфически связывать антиген (например, IL-1α, IL-1β). Антиген-связывающая функция антитела может быть выполнена фрагментами полноразмерного антитела. Примеры связывающих фрагментов, входящих в объем термина "антиген-связывающий фрагмент" антитела, включают (i) фрагмент Fab, моновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; (ii) фрагмент F(ab')2, бивалентный фрагмент, содержащий два фрагмента Fab, связанных дисульфидным мостиком в шарнирном участке; (iii) фрагмент Fd, состоящий из доменов VH и CH1; (iv) фрагмент Fv, состоящий из доменов VL и VH одного плеча антитела, (v) фрагмент dAb (Ward et al, (1989) Nature 341:544-546), который состоит из домена VH или VL; и (vi) выделенный гипервариабельный участок (CDR). Кроме того, хотя два домена фрагмента Fv, VL и VH, кодируются разными генами, их можно объединить рекомбинантными методами с использованием синтетического линкера, который позволяет получить одноцепочечный белок, в котором участки VL и VH соединены с образованием моновалентных молекул (известных как одноцепочечные Fv (scFv); см., например, Bird et al. (1988) Science 242:423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883). Такие одноцепочечные антитела также входят в объем термина "антиген-связывающий фрагмент" антитела. Указанные фрагменты антител, полученные традиционными методами, известными специалистам в данной области, подвергают скринингу на эффективность таким же способом, как и интактные антитела. В одном варианте осуществления данного изобретения фрагмент антитела выбирают из группы, состоящей из Fab, Fd, Fd', одноцепочечного Fv (scFv), scFva и доменного антитела (dAb).
Кроме того, антитело или его антиген-связывающий фрагмент могут быть частью более крупных молекул иммуноадгезии, образованных в результате ковалентной или нековалентной ассоциации антитела или фрагмента антитела с одним или несколькими другими белками или пептидами. Примеры таких молекул иммуноадгезии включают тетрамерные молекулы scFv, полученные с использованием стрептавидинового центрального участка (Kipriyanov et al. (1995) Human Antibodies and Hybridomas 6:93-101), и бивалентные и биотинилированные молекулы scFv, полученные с использованием цистеинового остатка, маркерного пептида и C-концевого полигистидинового маркера (Kipriyanov et al. (1994) Mol. Immunol. 31:1047-1058). Фрагменты антител, такие как фрагменты Fc, Fab и F(ab')2, можно получить из целых антител с помощью традиционных методов, таких как расщепление папаином или пепсином, соответственно. Кроме того, антитела, фрагменты антител и молекулы иммуноадгезии можно получить с помощью стандартных методов рекомбинантных ДНК.
Термин "домен" относится к уложенной структуре белка, которая сохраняет третичную структуру независимо от остальной части белка. Как правило, домены отвечают за отдельные функциональные свойства белков и зачастую могут быть добавлены, удалены или перенесены на другие белки без потери функции остальной части белка и/или домена. Под отдельным вариабельным доменом антитела подразумевается уложенный полипептидный домен, содержащий последовательности, типичные для вариабельных доменов антител. Следовательно, он включает вариабельные домены целых антител и модифицированные вариабельные домены, например, в которых одна или несколько петель заменены последовательностями, которые не являются типичными для вариабельных доменов антител, или вариабельные домены антител, которые были укорочены, или которые содержат N- или C-концевые добавления, а также уложенные фрагменты вариабельных доменов, которые сохраняют, по меньшей мере, отчасти, связывающую активность и специфичность полноразмерного домена.
Вариабельные домены данного изобретения могут быть объединены с получением группы доменов; например, могут быть объединены комплементарные домены, такие как домены VL и домены VH. Также могут быть объединены не комплементарные домены, например, домен VH и второй домен VH. Домены можно объединить с помощью ряда способов, включающих соединение доменов ковалентными или нековалентными связями.
Термин "dAb" или "доменное антитело" относится к полипептиду, представляющему собой один вариабельный домен антитела (VH или VL), который специфически связывает антиген. В одном варианте осуществления вектор данного изобретения используют для экспрессии dAb.
Фраза "рекомбинантное антитело" относится к антителам, которые получают, экспрессируют, создают или выделяют с помощью рекомбинантных способов, таким как антитела, экспрессированные с использованием рекомбинантного вектора экспрессии, трансфицированного в клетку-хозяина, антитела, выделенные из рекомбинантной, комбинаторной библиотеки антител, антитела, выделенные у животного (например, мыши), которое является трансгенным, поскольку несет гены человеческих иммуноглобулинов (см., например, Taylor et al. (1992) Nucl. Acids Res. 20:6287-6295), или к антителам, которые получают, экспрессируют, создают или выделяют с помощью любых других способов, включающих соединение последовательности гена конкретного иммуноглобулина (например, последовательность гена человеческого иммуноглобулина) с другими последовательностями ДНК. Примеры рекомбинантных антител включают химерные, CDR-привитые и гуманизированные антитела.
Термин "человеческое антитело" относится к антителам, содержащим вариабельные и константные участки, соответствующие последовательностям человеческого эмбрионального иммуноглобулина, как описано, например, Kabat et al. (см. Kabat, et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication № 91-3242), или полученные из них. Однако человеческие антитела данного изобретения могут содержать аминокислотные остатки, которые не кодируются последовательностями человеческого эмбрионального иммуноглобулина (например, мутантные остатки, введенные путем неспецифического или специфического мутагенеза in vitro или путем соматической мутации in vivo), например, в CDR, в частности, в CDR3.
Рекомбинантные человеческие антитела данного изобретения содержат вариабельные участки и, возможно, константные участки, полученные из последовательностей чел