Выделенная полинуклеотидная молекула, кодирующая вирус torque teno, молекула рнк и вектор экспрессии
Иллюстрации
Показать всеПредставленная группа изобретений относится к области биотехнологии и касается новых нуклеотидных последовательностей вируса Torque teno (TTV) и векторов, содержащих такие последовательности. Выделенная полинуклеотидная молекула, содержит полинуклеотидную последовательность, выбранную из группы, состоящей из: SEQ ID NO:4, последовательности, комплементарной SEQ ID NO:4 и полинуклеотида, который является, по меньшей мере, на 95% идентичным SEQ ID NO:4.
Представленные изобретения могут быть использованы при получении вакцин для предупреждения заболеваний свиней и других животных, вызванных вирусом Torque teno. 3 н. и 1 з.п. ф-лы, 7 ил., 3 табл., 10 пр.
Реферат
Настоящей заявкой испрашивается преимущество и приоритет согласно разделу 119 USC (свод законов США) 35 в отношении предварительной заявки на патент Соединенных Штатов 61/196468, поданной 16 октября 2008 года. Для целей национальной стадии Соединенных Штатов все содержание заявки 61/196468 включено сюда посредством ссылки во всей его полноте, как если бы оно было полностью изложенным здесь.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение направлено на новые нуклеотидные и аминокислотные последовательности вируса Torque teno ("TTV"), включая его новые генотипы, которые все являются полезными при получении вакцин для лечения и предупреждения заболеваний у свиней и других животных. Вакцины, предложенные согласно данному изобретению, являются эффективными против многих генотипов свиного TTV и его изолятов. Диагностические и терапевтические поликлональные и моноклональные антитела также представляют собой отличительный признак настоящего изобретения, как и инфекционные клоны, полезные при распространении вируса и при получении вакцин. Особенно важно то, что раскрыты вакцины, которые содержат в качестве антигена экспрессируемый белок отдельных открытых рамок считывания TTV, в особенности из ORF (открытая рамка считывания) 1 или ORF2, и также фрагменты полноразмерных белков, кодируемых ORF1 и ORF2.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Вирус Torque Teno ("TTV"), также называемый вирусом, передающимся при переливании крови, обычно относят к семейству Circoviridae. Обычно считается, что TTV был впервые получен от людей-пациентов, которым переливали кровь (см., например, Nishizawa et al., Biochem. Biophys. Res. Comm. vol. 241, 1997, pp.92-97). Впоследствии TTV или TTV-подобные вирусы были идентифицированы у других млекопитающих, включая свиней, и были опубликованы данные о многочисленных штаммах или изолятах (см., например, McKeown et al. Vet. Microbiol. vol. 104, 2004, pp. 113-117).
В последующей работе было показано, что TTV и TTV-подобные вирусы являются очень распространенными; однако, патогенез TTV и вклад, который он может вносить в другие болезненные состояния (например состояния, вызванные другими вирусами и бактериями), остаются неясными. Например, инфекции TTV, по-видимому, являются обычными у людей, включая даже здоровых индивидуумов, и такие инфекции часто являются бессимптомными и могут сохраняться в течение многих лет. Кроме того, общая неспособность размножать вирус в культуре клеток и отсутствие каких-либо ясных механистических моделей заболеваний сделали затруднительной какую-либо общую характеристику биологии TTV. Несмотря на то что виремия TTV повышена у пациентов-людей, пораженных другими вирусными заболеваниями (такими как гепатит или ВИЧ/СПИД), также существует большое количество медицинской литературы, свидетельствующей о том, что на самом деле вирусы TTV являются авирулентными, и ожидается подтверждение какой-либо ясной реально существующей связи с известными болезненными состояниями. Смотрите, например, Biagini et al., Vet. Microbiol. vol. 98, 2004, pp.95-101.
В отношении свиней ситуация является похожей. Существует значительное количество работ, свидетельствующих о том, что инфекция TTV ассоциирована с многочисленными заболеваниями, такими как цирковирусная болезнь свиней (и ее различные клинические проявления, такие как мультисистемный синдром истощения после отъема поросят от свиноматки и респираторное заболевание, осложненное поражениями легких) и заболевание, ассоциированное с PRRSV (вирус респираторного и репродуктивного синдрома свиней). Смотрите, например, опубликованные международные заявки на патент WO 2008/150275 и WO 2008/127279. Krakowka et al. также сообщают о заболевании у свиней, которое часто является смертельным, называемом PDNS (синдром свиного дерматита и невропатии), которое описывают как проявление диссеминированного внутрисосудистого коагулирования, и в которое возможно была вовлечена комбинированная инфекция серотипом 1 TTV и вирусом PRRSV (Am. J. Vet Res, vol 69(12), 2008, pp.1615-1622). Заболевание PDNS также коррелировало со свиным цирковирусным заболеванием (в особенности PCV-2), а также с бактериальными инфекциями. Соответственно, хотя и была проведена значительная работа, остается мало работ, которые определенно устанавливают связь инфекции свиным TTV с конкретными патологиями. Тем не менее, стало достаточно очевидным то, что инфекция TTV может усиливать многочисленные болезненные состояния. Соответственно, существует потребность в разных классах реагентов против TTV, таких как высокоаффинные антитела, и, например, пептидные фрагменты TTV или целые вирионы, которые являются сильно иммунизирующими, как для развития нашего понимания общей биологии TTV, так и для вакцинации, прямой или непрямой, против многочисленных болезненных состояний, которым может способствовать TTV.
Таким образом, несмотря на то что существует возможность того, что TTV является основным фактором, вызывающим заболевания у свиней, более вероятным кажется то, что многочисленные заболевания свиней либо требуют присутствия более чем одного вируса, либо то, что первичный эффект определенных «первичных» патогенов усиливается инфекцией TTV. Как утверждается, существует вероятность того, что многочисленные заболевания свиней можно лечить или облегчать введением агентов против TTV пораженным или потенциально пораженным животным. Несмотря на весьма устоявшийся интерес к TTV, эффективные вакцины не появились.
TTV является маленьким безоболочечным вирусом, содержащим одноцепочечную кольцевую ДНК с отрицательной полярностью. Геном включает три главные открытые рамки считывания, ORF1, ORF2 и ORF3, которые перекрываются, и ORF1 кодирует белок капсида (Biagini et al., выше). Что касается их подробного обсуждения, смотрите следующие ссылки, которые включены посредством ссылки: Kakkola et al., Virology, vol. 382 (2008), pp.182-189; Mushahwar et al., Proc. Natl. Acad. Sci. USA, vol 96, (1999) pp.3177-3182; и Т. Kekarainen and J. Segales, "Torque teno virus infection in the pig and its potential role as a model of human infection", The Veterinary Journal, принята 13 декабря 2007 года для публикации в 2008 году.
Несмотря на относительно простой геном, обычно было очень сложно размножать данный вирус в культуре клеток или другими способами in vitro. Настоящее изобретение направлено на рекомбинантные конструкции, посредством которых TTV можно размножать in vitro, включая размножение посредством инфекционных клонов. Более конкретно, изобретение направлено на открытие, согласно которому эффективные вакцины на самом деле могут быть сделаны из TTV, наиболее конкретно, когда антиген TTV представляет собой продукт экспрессии одной ORF или ее фрагмента. В предпочтительном воплощении согласно изобретению предложены вакцины на основе белка ORFI.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Согласно настоящему изобретению предложен способ лечения или предупреждения заболевания или расстройства у животного, вызванного инфекцией вирусом torque teno (TTV), включая болезненные состояния, которые непосредственно вызваны TTV, и болезненные состояния, которым способствует TTV или которые усиливает TTV. В предпочтительном примере животное, которое лечат, представляет собой свинью. Болезненные состояния у свиней, которые могут усиливаться посредством TTV, и которые также можно лечить или предупреждать при использовании данного изобретения, включают болезненные состояния, вызванные свиным цирковирусом (PCV) и свиным вирусом репродуктивного и респираторного синдрома (PRRS) или связанные с ними.
Настоящее изобретение также включает вариант введения комбинированной вакцины, то есть бивалентной или мультивалентной комбинации антигенов, которая может включать живые, модифицированные живые или инактивированные антигены против патогена, не являющегося TTV, с подходящим выбором адъюванта.
Частично основываясь на уникальных аминокислотных последовательностях TTV, как здесь раскрыто, согласно настоящему изобретению также предложен диагностический набор для различения между свиньями, вакцинированными вышеописанными вакцинами против TTV, и свиньями, инфицированными полевыми штаммами TTV.
Показательные воплощения изобретения включают выделенную полинуклеотидную последовательность, которая содержит полинуклеотид, выбранный из группы, состоящей из:
(a1) ДНК последовательности TTV13 (SEQ ID NO:1) генотипа 2; ДНК последовательности TTV10 (SEQ ID NO:2) генотипа 2; или ее фрагмента, который кодирует белок капсида TTV или фрагмент указанного белка;
(a2) ДНК последовательности генотипа 1, выбранной из группы, состоящей из ttvg1-7 (SEQ ID NO:4), ttvGT1-17 (SEQ ID NO:5), ttvGT-1-21 (SEQ ID NO:6), ttvgt1-27 (SEQ ID NO:3), ttvgt1-178 (SEQ ID NO:7) или ее фрагмента, который кодирует белок капсида TTV или фрагмент указанного белка;
(б) последовательности, комплементарной любой последовательности из (а);
(в) полинуклеотида, который гибридизуется с последовательностью из (а) или (б) в жестких условиях, определенных как гибридизация с ДНК, связанной с фильтром, в 0,5 М NaHPO4, 7% SDS (додецилсульфат натрия), 1 мМ EDTA (этилендиаминтетрауксусная кислота) при 65°С и промывка в 0,1×SSC (раствор цитрата и хлорида натрия)/0,1% SDS при 68°С.
(г) полинуклеотида, который является по меньшей мере на 70% идентичным полинуклеотиду из (а) или (б);
(д) полинуклеотида, который является по меньшей мере на 80% идентичным полинуклеотиду из (а) или (б);
(е) полинуклеотида, который является по меньшей мере на 90% идентичным полинуклеотиду из (а) или (б); и
(ж) полинуклеотида, который является по меньшей мере на 95% идентичным полинуклеотиду из (а) или (б).
Согласно изобретению дополнительно предложены молекулы полинуклеотидов РНК, которые представляют собой последовательности, комплементарные любой такой полинуклеотидной последовательности ДНК, и векторы и плазмиды для экспрессии любых таких полинуклеотидов РНК или ДНК, и вирус TTV, который экспрессируется с таких нуклеотидных последовательностей, где указанный вирус является живым либо полностью, или частично ослабленным.
Согласно изобретению также предложена ДНК вакцина, которая содержит полинуклеотидную последовательность, как упомянуто выше, и соответствующие нуклеотидные последовательности, которые функционируют в качестве инфекционных клонов.
Согласно изобретению предложен полипептид, кодируемый любой из открытых рамок считывания полинуклеотидов TTV13 (SEQ ID NO:1) генотипа 2 или TTV10 (SEQ ID NO:2) генотипа 2, или полипептид, который является по меньшей мере на 90% идентичным ему, или его фрагменту, включая такой вариант, что дополнительные, в другом случае идентичные аминокислоты, заменены консервативными заменами.
Согласно изобретению также предложен полипептид, кодируемый любой из открытых рамок считывания (все относятся к серотипу 1) полинуклеотидов ORF1 ttvg1-7 (SEQ ID NO:10), ttvGT1-17 (SEQ ID NO:11), ttvGT1-21 (SEQ ID NO:12), ttvgt1-27 (SEQ ID NO:13) и ttvgt1-178 (SEQ ID NO:9), или полипептид, который является по меньшей мере на 90% идентичным ему, или его фрагменту, включая такой вариант, что дополнительные, в другом случае идентичные аминокислоты, заменены консервативными заменами.
Несмотря на продолжающиеся неудачи в попытках предоставить эффективные вакцины против TTV (или ограничить способность TTV усиливать другие заболевания), как сообщалось в данной области техники, согласно настоящему изобретению предложены такие эффективные вакцины, которые предпочтительно содержат полипептид, образующийся в результате экспрессии одной открытой рамки считывания TTV, или их смесь. В предпочтительном воплощении полипептид экспрессируется с ORF1, и предпочтительные смеси включают комбинацию полипептидов ORF1 и ORF2, и ORF1 и ORF3.
В дополнительном предпочтительном воплощении, и используя информацию по основной полипептидной последовательности, раскрытой здесь, дополнительно предложены полипептидные вакцины, где антиген определен (а) первыми 100 N-концевыми аминокислотами белка капсида TTV13 (SEQ ID NO:1) или TTV10 (SEQ ID NO:2); или (б) аминокислотной последовательностью, которая является по меньшей мере на 90 процентов идентичной им; или (в) их аргинин-богатой областью.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг.1 (панели А и Б) показывает детекцию белка ORF1 иммунологическими способами.
Фиг.2 демонстрирует успешную экспрессию белка кодон-оптимизированной ORF1 TTVg1 в E.coli, с 6-кратной His-меткой для аффинной очистки.
Фиг. 3 представляет карту вектора для конструкции Chromos экспрессионной плазмиды pcTV-TTV1-7 ORF1 (плюс дрожжевая инвертаза), с которой экспрессируется вакцинный белок ORF1 (после интеграции в искусственную хромосому в клетках СНО).
Фиг.4 представляет филогенетическое древо для разных штаммов TTV, включающее компиляцию процентных идентичностей.
Фиг.5 (панели А, Б и В) представляет идентификацию совместных богатых аргинином областей белков ORF1, как они экспрессируются из разных изолятов TTV.
Фиг.6 представляет карту вектора для TTVg1-178 в собранном виде.
Фиг.7 демонстрирует то, что Chromos-экспрессируемая ORF1 g1TTV значительно уменьшала поражения легких по сравнению с зараженными контролями и снижает величину и продолжительность виремии g1TTV, снова по сравнению с зараженными контролями.
КРАТКОЕ ОПИСАНИЕ ПЕРЕЧНЕЙ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO:1 представляет последовательность ДНК генотипа gt2 TTV 10.
SEQ ID NO:2 представляет последовательность ДНК генотипа 2 gt2 TTV 13.
SEQ ID NO:3 представляет последовательность ДНК генотипа 1 ttvgt1-27.
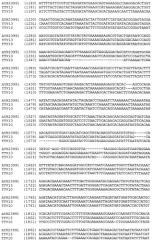
SEQ ID NO:4 представляет последовательность ДНК генотипа 1 ttvgt1-7.
SEQ ID NO:5 представляет последовательность ДНК генотипа 1 ttvgt1-17.
SEQ ID NO:6 представляет последовательность ДНК генотипа 1 ttvgt1-21.
SEQ ID NO:7 представляет последовательность ДНК генотипа 1 ttvg1-178.
SEQ ID NO:8 представляет аминокислотную последовательность ORF1 штамма AY823991 TTV.
SEQ ID NO:9 представляет аминокислотную последовательность ORF1 штамма ttvgt1-178 TTV (генотип 1 TTV).
SEQ ID NO:10 представляет аминокислотную последовательность ORF1 штамма ttvgt1-7 TTV.
SEQ ID NO:11 представляет аминокислотную последовательность ORF1 штамма ttvgt1-17 TTV.
SEQ ID NO:12 представляет аминокислотную последовательность ORF1 штамма ttvgt1-21 TTV.
SEQ ID NO:13 представляет аминокислотную последовательность ORF1 штамма ttvgt1-27 TTV.
SEQ ID NO:14 представляет аминокислотную последовательность ORF1 штамма gt2 TTV10 TTV (генотип 2).
SEQ ID NO:15 представляет аминокислотную последовательность ORF1 штамма gt2 TTV13 TTV.
SEQ ID NO:16 представляет последовательность ДНК известного штамма AY823991, генотип 2.
SEQ ID NO:17 представляет последовательность ДНК известного штамма AY823990, генотип 1.
SEQ ID NO:18 представляет последовательность 76057-3, кодирующую капсид TTV, кодон-оптимизированную для E.coli, как она клонирована в вектор pUC57 GenScript®.
SEQ ID NO:19 представляет последовательность 76057-4, кодирующую капсид TTV, кодон-оптимизированную для Е.coli, как она клонирована в экспрессионную плазмиду pET101/D-TOPO® от Invitrogen.
SEQ ID NO:20 представляет последовательность 76057-5, кодирующую капсид TTV, кодон-оптимизированную для Saccharomyces cerevisiae, как она клонирована в вектор pUC57 GenScript®.
SEQ ID NO:21 представляет последовательность ДНК для конструкции, которая кодирует ORF1 ttvgt1-7 с экспрессионной меткой дрожжевой инвертазы (YI).
SEQ ID NO:22 представляет пептидную последовательность ttvgt1 (нумерация основана на соответствующей последовательности AY823990) из ORF1 белка капсида, соответствующую остаткам 167-185, которая используется с С-концевой АК (аминокислота) в амидированной форме.
SEQ ID NO:23 представляет пептидную последовательность ttvgt1 (нумерация основана на соответствующей последовательности AY823990) из ORF1 белка капсида, соответствующую остаткам 459-479.
SEQ ID NO:24 представляет пептидную последовательность ttvgt1 (нумерация основана на соответствующей последовательности AY823990) из ORF1 белка капсида, соответствующую остаткам 612-637.
SEQ ID NO:25 представляет аминокислотную последовательность ORF1 штамма AY823990 TTV.
SEQ ID NO:26-29 определяют последовательности праймеров.
В связи с описаниями последовательностей специалист в данной области техники поймет, что для конкретных серотипов широко и взаимозаменяемо применяются многочисленные немного отличающиеся сокращения, например, g1TTV, TTVg1, генотип 1 TTV, серотип 1 TTV, gt1TTV и им подобные. Аналогичная ситуация имеет место для генотипа 2.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Следующие определения и вводные вопросы применяются в описании изобретения.
Термины «свиной» и «свиньи» используются здесь взаимозаменяемо и относятся к любому животному, которое является членом семейства Suidae, такому как, например, свинья. «Млекопитающие» включают любых теплокровных позвоночных класса Mammalia, включая людей.
«Инфекционная молекула ДНК» для целей настоящего изобретения представляет собой молекулу ДНК, которая кодирует необходимые элементы для вирусной репликации, транскрипции и трансляции в функциональный вирион в подходящей клетке-хозяине.
Подобным образом, термин «выделенная полинуклеотидная молекула» относится к композиции вещества, содержащей полинуклеотидную молекулу по настоящему изобретению, очищенную до какой-либо детектируемой степени из ее природного состояния, если таковое существует.
Для целей настоящего изобретения нуклеотидная последовательность второй полинуклеотидной молекулы (либо РНК, либо ДНК) является «гомологичной» нуклеотидной последовательности первой полинуклеотидной молекулы или имеет «идентичность» с указанной первой полинуклеотидной молекулой, когда нуклеотидная последовательность второй полинуклеотидной молекулы кодирует ту же самую полиаминокислоту, что и нуклеотидная последовательность первой полинуклеотидной молекулы на основе вырожденности генетического кода, или когда она кодирует полиаминокислоту, которая является достаточно сходной с полиаминокислотой, кодируемой нуклеотидной последовательностью первой полинуклеотидной молекулы так, чтобы быть полезной при использовании настоящего изобретения. Гомологичные полинуклеотидные последовательности также относятся к смысловым и антисмысловым нитям и, во всех случаях, к комплементарным последовательностям любой такой нити. Для целей настоящего изобретения полинуклеотидная молекула является полезной при использовании настоящего изобретения и, следовательно, гомологичной или имеющей идентичность, когда ее можно использовать в качестве диагностического зонда для детекции присутствия вируса TTV или вирусного полинуклеотида в жидкости или в образце ткани инфицированной свиньи, например, стандартными методиками гибридизации или амплификации. В общем, нуклеотидная последовательность второй полинуклеотидной молекулы является гомологичной нуклеотидной последовательности первой полинуклеотидной молекулы, если она имеет по меньшей мере примерно 70% идентичности нуклеотидной последовательности с нуклеотидной последовательностью первой полинуклеотидной молекулы, как показано на основе алгоритма BLASTN (Национальный центр биотехнологической информации, иначе известный как NCBI (Bethesda, Maryland, США) Национального института здоровья Соединенных Штатов). В конкретном примере расчетов согласно применению настоящего изобретения дана ссылка на BLASTP 2.2.6 [Tatusova ТА and TL Madden, "BLAST 2 sequences-a new tool for comparing protein and nucleotide sequences." (1999) FEMS Microbiol Lett. 174:247-250.]. Вкратце, две аминокислотные последовательности выравнивают для оптимизации показателей выравнивания с использованием штрафа на внесение делеции в выравнивание (gap opening penalty) 10, штрафа на продолжение делеции (gap extension penalty) 0,1 и матрицы подсчета "blosum62" от Henikoff and Henikoff (Proc. Nat. Acad. Sci. USA 89:10915-10919. 1992). Процент идентичности затем рассчитывают как общее число идентичных совпадений × 100/ деленное на длину более длинной последовательности + число пробелов, введенных в данную более длинную последовательность для выравнивания двух последовательностей.
Предпочтительно гомологичная нуклеотидная последовательность имеет по меньшей мере примерно 75% идентичности нуклеотидной последовательности, даже более предпочтительно по меньшей мере примерно 80%, 85%, 90% и 95% идентичности нуклеотидной последовательности. Поскольку генетический код является вырожденным, гомологичная нуклеотидная последовательность может включать любое число «молчащих» замен оснований, т.е. замен нуклеотидов, которые, тем не менее, кодируют ту же самую аминокислоту.
Гомологичная нуклеотидная последовательность может дополнительно содержать немолчащие мутации, т.е. замены, делеции или добавления оснований, приводящие к различиям аминокислот в закодированной полиаминокислоте, пока данная последовательность остается по меньшей мере примерно на 70% идентичной полиаминокислоте, кодируемой первой нуклеотидной последовательностью, или в других отношениях является полезной при использовании настоящего изобретения. В этом отношении могут быть сделаны определенные консервативные аминокислотные замены, которые обычно рассматриваются как не инактивирующие общую функцию белка: такие как, в отношении положительно заряженных аминокислот (и наоборот), лизина, аргинина и гистидина; в отношении отрицательно заряженных аминокислот (и наоборот), аспарагиновой кислоты и глутаминовой кислоты; и в отношении определенных групп нейтрально заряженных аминокислот (и во всех случаях также наоборот) (1) аланина и серина, (2) аспарагина, глутамина и гистидина, (3) цистеина и серина, (4) глицина и пролина, (5) изолейцина, лейцина и валина, (5) метионина, лейцина и изолейцина, (6) фенилаланина, метионина, лейцина и тирозина, (6) серина и треонина, (7) триптофана и тирозина, (8) и, например, тирозина, триптофана и фенилаланина.
Гомологичные нуклеотидные последовательности можно определить сравнением нуклеотидных последовательностей, например, посредством применения BLASTN, как указано выше. В качестве альтернативы, гомологичные нуклеотидные последовательности можно определять гибридизацией в выбранных условиях. Например, нуклеотидная последовательность второй полинуклеотидной молекулы является гомологичной SEQ ID NO:1 (или любой другой конкретной полинуклеотидной последовательности), если она гибридизуется с последовательностью, комплементарной SEQ ID NO:1 при умеренно жестких условиях, например, гибридизация с ДНК, связанной на фильтре, в 0,5 М NaHPO4, 7%-ном додецилсульфате натрия (SDS), 1 мМ EDTA при 65°С и промывка в 0,2×SSC/0,1% SDS при 42°С (см. Ausubel et al. editors, Protocols in Molecular Biology, Wiley and Sons, 1994, pp.6.0.3-6.4.10), или при условиях, которые, в противном случае, приведут к гибридизации последовательностей, которые кодируют вирус TTV, как определено ниже. Модификации условий гибридизации можно определить эмпирически или точно рассчитать на основе длины и процентного содержания пар оснований гуанозин/цитозин (GC) образца. Условия гибридизации можно рассчитать, как описано в Sambrook, et al., (Eds.), Molecular Cloning: A Laboratory Manual. Cold Spring Harbor Laboratory Press: Cold Spring Harbor, New York (1989), pp.9.47-9.51.
В другом воплощении вторая нуклеотидная последовательность является гомологичной SEQ ID NO:1 (или любой другой последовательности по изобретению), если она гибридизуется с последовательностью, комплементарной SEQ ID NO:1 в очень жестких условиях, например, гибридизация с ДНК, связанной на фильтре, в 0,5 М NaHPO4, 7%-ном (SDS), 1 мМ EDTA при 65°С и промывка в 0,1×SSC/0,1% SDS при 68°С, как известно в данной области техники.
Более того, следует понимать, что выделенные полинуклеотидные молекулы и выделенные молекулы РНК по настоящему изобретению включают как синтетические молекулы, так и молекулы, полученные посредством рекомбинантных технологий, таких как клонирование и транскрипция in vitro.
Полипептиды и полинуклеотиды по изобретению
Репрезентативные воплощения изобретения включают выделенную полинуклеотидную последовательность, которая содержит полинуклеотид, выбранный из группы, состоящей из:
(a1) ДНК последовательности TTV13 (SEQ ID NO:1) генотипа 2; ДНК последовательности TTV10 (SEQ ID NO:2) генотипа 2; или их фрагмента, который кодирует белок капсида TTV или фрагмент указанного белка;
(а2) ДНК последовательности генотипа 1, выбранной из группы, состоящей из ttvg1-7 (SEQ ID NO:4), ttvGT1-17 (SEQ ID NO:5), ttvGT1-21 (SEQ ID NO:6), ttvgt1-27 (SEQ ID NO:3), ttvgt1-178 (SEQ ID NO:7) или ее фрагмента, который кодирует белок капсида TTV или фрагмент указанного белка;
(б) последовательности, комплементарной любой последовательности из (а);
(в) полинуклеотида, который гибридизуется с последовательностью из (а) или (б) в жестких условиях, определенных как гибридизация с ДНК, связанной на фильтре, в 0,5 М NaHPO4, 7% SDS, 1 мМ EDTA при 65°С и промывка в 0,1×SSC/0,1% SDS при 68°С.
(г) полинуклеотида, который является по меньшей мере на 70% идентичным полинуклеотиду из (а) или (б);
(д) полинуклеотида, который является по меньшей мере на 80% идентичным полинуклеотиду из (а) или (б);
(е) полинуклеотида, который является по меньшей мере на 90% идентичным полинуклеотиду из (а) или (б); и
(ж) полинуклеотида, который является по меньшей мере на 95% идентичным полинуклеотиду из (а) или (б).
Согласно изобретению также предложен полипептид, кодируемый полинуклеотидами любой из открытых рамок считывания TTV13 (SEQ ID NO:1) генотипа 2 или TTV10 (SEQ ID NO:2) генотипа 2, или полипептид, который является по меньшей мере на 90% идентичным ему или его фрагменту, включая возможность того, что дополнительные, в другом случае идентичные аминокислоты, заменены консервативными заменами.
Согласно изобретению также предложен полипептид, кодируемый полинуклеотидами ORF1 любой из открытых рамок считывания (все серотипа 1) ttvg1-7 (SEQ ID NO:10), ttvGT1-17 (SEQ ID NO:11), ttvGT1-21 (SEQ ID NO:12), ttvgt1-27 (SEQ ID NO:13) и ttvgt1-178 (SEQ ID NO:9), или полипептид, который является по меньшей мере на 90% идентичным ему или его фрагменту, включая такой вариант, что дополнительные, в другом случае идентичные аминокислоты заменены консервативными заменами.
В предпочтительном воплощении данный полипептид экспрессируется с ORF1, и предпочтительные смеси включают комбинацию полипептидов ORF1 и ORF2, и ORF1 и ORF3.
В дополнительном предпочтительном воплощении дополнительно предложены вакцины на основе полипептидов TTV, где антиген определяется:
(а) первыми 300 N-концевыми аминокислотами белка капсида ORF1 TTV13 (SEQ NO:1) или TTV10 (SEQ ID NO:2); или (б) аминокислотной последовательностью, которая является по меньшей мере на 90 процентов идентичной им;
(б) первыми 200 N-концевыми аминокислотами белка капсида ORF1 TTV13 (SEQ NO:1) или TTV10 (SEQ ID NO:2); или (б) аминокислотной последовательностью, которая является по меньшей мере на 90 процентов идентичной им;
(в) первыми 100 N-концевыми аминокислотами белка капсида ORF1 TTV13 (SEQ NO:1) или TTV10 (SEQ ID NO:2); или (б) аминокислотной последовательностью, которая является по меньшей мере на 90 процентов идентичной им;
(г) первыми 300 N-концевыми аминокислотами белка капсида ORF1 любого из (все серотипа 1) ttvg1-7 (SEQ ID NO:10), ttvGT1-17 (SEQ ID NO:11), ttvGT1-21 (SEQ ID NO:12), ttvgt1-27 (SEQ ID NO:13) и ttvgt1-178 (SEQ ID NO:9), или полипептидом, который является по меньшей мере на 90% идентичным им;
(д) первыми 200 N-концевыми аминокислотами белка капсида ORF1 любого из (все серотипа 1) ttvg1-7 (SEQ ID NO:10), ttvGT1-17 (SEQ ID NO:11), ttvGT1-21 (SEQ ID NO:12), ttvgt1-27 (SEQ ID NO:13) и ttvgt1-178 (SEQ ID NO:9), или полипептидом, который является по меньшей мере на 90% идентичным им; и
(е) первыми 100 N-концевыми аминокислотами белка капсида ORF1 любого из (все серотипа 1) ttvg1-7 (SEQ ID NO:10), ttvGT1-17 (SEQ ID NO:11), ttvGT1-21 (SEQ ID NO:12), ttvgt1-27 (SEQ ID NO:13) и ttvgt1-178 (SEQ ID NO:9), или полипептидом, который является по меньшей мере на 90% идентичным им.
Дополнительные генетические манипуляции
Информация по последовательности ДНК и аминокислот, предоставленная настоящим изобретением, также делает возможным систематический анализ структуры и функции вирусных генов и кодируемых ими генных продуктов. Знание полинуклеотида, кодирующего вирусный генный продукт по изобретению, также делает доступными антисмысловые полинуклеотиды, которые распознают и гибридизуются с полинуклеотидами, кодирующими полипептид по изобретению или его фрагмент. Полноразмерные антисмысловые полинуклеотиды и их фрагменты являются полезными в этом отношении. Сотрудник обычной квалификации поймет, что фрагментированные антисмысловые молекулы по данному изобретению включают: (1) молекулы, которые специфически распознают специфичные РНК (как определено путем сравнения с последовательностью ДНК, кодирующей вирусный полипептид по изобретению) и гибридизуются с ними, а также (2) молекулы, которые распознают РНК, кодирующие варианты закодированных белков и гибридизуются с ними. Антисмысловые полинуклеотиды, которые гибридизуются с РНК/ДНК, кодирующими другие пептиды TTV, также являются идентифицируемыми посредством сравнения последовательностей для идентификации характерных или сигнатурных (signature) последовательностей для данного семейства молекул. Такие методики (см. Пример 8), более того, являются полезными в исследовании антигенных доменов в полипептидах TTV и также могут применяться для различения между инфекцией животного-хозяина отдаленно родственными членами Circoviridae, не являющимися TTV.
Пример 4 дает руководство по эффективной оптимизации кодонов для улучшенной экспрессии в дрожжах и Е.coli для конструкций по изобретению.
Вакцинные композиции
Вакцины по настоящему изобретению могут быть изготовлены, следуя общепринятому соглашению по включению приемлемых носителей для животных, включая людей (если это является применимым), таких как стандартные буферы, стабилизаторы, разбавители, консерванты и/или солюбилизаторы, и также могут быть приготовлены так, чтобы способствовать длительному высвобождению. Разбавители включают воду, физиологический раствор, декстрозу, этанол, глицерин и тому подобное. Добавки для изотоничности, среди прочих, включают хлорид натрия, декстрозу, маннит, сорбит и лактозу. Стабилизаторы, среди прочих, включают альбумин. Другие подходящие наполнители и добавки вакцин, включая наполнители и добавки, которые являются особенно полезными при приготовлении модифицированных живых вакцин, известны или будут очевидными специалистам в данной области. Смотрите, например, Remington's Pharmaceutical Science, 18th ed., 1990, Mack Publishing, которая включена сюда посредством ссылки.
Вакцины по настоящему изобретению могут дополнительно содержать один или более чем один дополнительный иммуномодулирующий компонент, такой как, например, среди прочих, адъювант или цитокин. Неограничивающие примеры адъювантов, которые можно использовать в вакцине по настоящему изобретению, включают адъювантную систему RIBI (Ribi Inc., Hamilton, MT), квасцы, минеральные гели, такие как гель на основе гидроксида алюминия, эмульсии типа «масло в воде», эмульсии типа «вода в масле», такие как, например, полный и неполный адъюванты Фрейнда, блоксополимер (CytRx, Atlanta GA), QS-21 (Cambridge Biotech Inc., Cambridge MA), SAF-M (Chiron, Emeryville CA), адъювант AMPHIGEN®, сапонин, Quil А или другие фракции сапонина, монофосфориллипид А, ионные полисахариды и липид-аминный адъювант Avridine. Неограничивающие примеры эмульсий типа «масло в воде», полезных в вакцине по изобретению, включают модифицированные препараты SEAM62 и SEAM 1/2. Модифицированный SEAM62 представляет собой эмульсию типа «масло в воде», содержащую 5% (об./об.) сквалена (Sigma), 1% (об./об.) детергента SPAN® 85 (ICI Surfactants), 0,7% (об./об.) детергента TWEEN® 80 (ICI Surfactants), 2,5% (об./об.) этанола, 200 мкг/мл Quil A, 100 мкг/мл холестерина и 0,5% (об./об.) лецитина. Модифицированный SEAM 1/2 представляет собой эмульсию типа «масло в воде», содержащую 5% (об./об.) сквалена, 1% (об./об.) детергента SPAN® 85, 0,7% (об./об.) детергента Tween 80, 2,5% (об./об.) этанола, 100 мкг/мл Quil А и 50 мкг/мл холестерина. Другие иммуномодулирующие агенты, которые могут быть включены в вакцину, включают, например, один или более чем один интерлейкин, интерферон или другие известные цитокины.
Дополнительные адъювантые системы допускают комбинацию как Т-хелперных, так и В-клеточных эпитопов, что приводит к одному или более чем одному типу ковалентно связанных структур Т-В эпитопов, которые могут быть дополнительно липидированными, как, например, структуры, описанные в WO 2006/084319, WO2004/014957 и WO2004/014956.
В предпочтительном воплощении настоящего изобретения белок ORFI TTV или другие белки TTV или их фрагменты приготовлены с 5% AMPHIGEN®.
Вакцины по настоящему изобретению возможно могут быть приготовлены в виде препаратов для длительного высвобождения вируса, инфекционной молекулы ДНК, плазмиды или вирусного вектора по настоящему изобретению. Примеры таких композиций с длительным высвобождением включают вирус, инфекционную молекулу ДНК, плазмиду или вирусный вектор в комбинации с композитами биосовместимых полимеров, таких как, например, поли(молочная кислота), поли(молочная-со-гликолевая кислота), метилцеллюлоза, гиалуроновая кислота, коллаген и тому подобное. Структура, выбор и применение деградируемых полимеров в носителях для доставки лекарственного средства рассмотрены в нескольких публикациях, включая А. Domb et al., 1992, Polymers for Advanced Technologies 3:279-292, которые включены сюда посредством ссылки. Дополнительное руководство по выбору и использованию полимеров в фармацевтических композициях можно найти в руководствах, известных в данной области, например, М. Chasin and R. Langer (eds), 1990, "Biodegradable Polymers as Drug Delivery Systems" in: Drugs and the Pharmaceutical Sciences. Vol.45, М. Dekker, NY, которая также включена сюда посредством ссылки. Альтернативно или дополнительно, вирус, плазмида или вирусный вектор могут быть микроинкапсулированы для улучшения введения и эффективности. Способы микроинкапсуляции антигенов хорошо известны в данной области и включают методики, описанные, например, в патенте США 3137631; патенте США 3959457; патенте США 4205060; патенте США 4606940; патенте США 4744933; патенте США 5132117 и международной публикации патента WO 95/28227, которые все включены сюда посредством ссылки.
Для обеспечения длительного высвобождения вируса, плазмиды, вирусного белка или вирусного вектора также можно использовать липосомы. Подробности, касающиеся того, как сделать и использовать липосомные композиции, можно найти, наряду с другими источниками, в патенте США 4016100; патенте США 4452747; патенте США 4921706; патенте США 4927637; патенте США 4944948; патенте США 5008050 и в патенте США 5009956, которые все включены сюда посредством ссылки.
Эффективное количество любой из вышеописанных вакцин можно определить традиционными способами, начиная с малой дозы вируса, вирусного белка, плазмиды или вирусного вектора, и затем увеличивая дозировку при мониторинге эффектов. Эффективное количество может быть достигнуто после однократного введения вакцины или после многократных введений вакцины. При определении оптимальной дозы для животного можно принимать во внимание известные факторы. Они включают вид, размер, возраст и общее состояние животного, присутствие других лекарственных средств в животном и тому подобное. Реальную дозировку предпочтительно выбирают после рассмотрения результатов из других исследований на животных (см., например, Примеры 2 и 3 ниже).
Одним способом детекции того, достигнут ли адекватный иммунный ответ, является определение сероконверсии и титра антител у животного после вакцинации. Расписание вакцинации и число повторных иммунизации, если таковые имеются, предпочтительно будут определяться врачом или ветеринаром на основе анализа всех релевантных факторов, некоторые из которых описаны выше.
Величину эффективной дозы вируса, белка, инфекционной молекулы ДНК, плазмиды или вирусного вектора по настоящему изобретению можно определить с использованием известных методик, принимая во внимание факторы, которые может определить обычный специалист в данной области, такие как масса животного, подлежащего вакцинации. Величина дозы вируса по настоящему изобретению в вакцине по настоящему изобретению предпочтительно варьирует от примерно 101 до примерно 109 БОЕ (бляшкообразующая единица), более предпочтительно от примерно 102 до примерно 108 БОЕ и наиболее предпочтительно от примерно 103 до примерно 107 БОЕ. Величина дозы плазмиды по настоящему изобретению в вакцине по настоящему изобретению предпочтительно варьирует от примерно 0,1 мкг до примерно 100 мг, более предпочтительно от примерно 1 мкг до примерно 10 мг, даже более предпочтительно от примерно 10 мкг до примерно 1 мг. Величина дозы инфекционной молекулы ДНК по настоящему изобретению в вакцине по настоящему изобретению предпочтительно варьирует от примерно 0,1 мкг до примерно 100 мг, более предпочтительно от примерно 1 мкг до примерно 10 мг, даже более предпочтительно от примерно 10 мкг до примерно 1 мг. Величина дозы вирусного вектора по настоящему изобретению в вакцине по настоящему изобретению предпочтительно варьирует от примерно 101 БОЕ до примерно 109 БОЕ, более предпочтительно от примерно 102 БОЕ до примерно 108 БОЕ и даже более предпочтительно от примерно 103 до примерно 107 БОЕ. Подходящий объем дозировки варьирует от примерно 0,5 мл до примерно 10 мл и более предпоч