Способ микробиологического синтеза целевого секретируемого белка в дрожжах saccharomyces cerevisiae
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и касается способа синтеза целевого секретируемого белка человека в клетках дрожжей Saccharomyces cerevisiae. Способ включает культивирование в подходящих условиях дрожжей Saccharomyces cerevisiae и секрецию целевого белка, причем секреция направлена лидерным полипептидом, имеющим аминокислотную последовательность SEQ ID NO1 и представляющим собой вариант про-области лидерного полипептида белка PpPIR1 Pichia pastoris. Представленное изобретение расширяет арсенал способов получения целевого белка в дрожжах Saccharomyces cerevisiae и увеличивает возможности для эффективного синтеза таких белков. 2 ил., 4 пр.
Реферат
Изобретение относится к области биотехнологии и касается способа синтеза целевого секретируемого белка человека в клетках дрожжей Saccharomyces cerevisiae.
Под секретируемыми белками будем понимать такие целевые растворимые белки, биосинтез которых в клетках дрожжей S. cerevisiae сопровождается их секрецией во внеклеточную среду.
Получение белков технического и медицинского назначения с использованием рекомбинантных эукариотических организмов является важным направлением биотехнологической промышленности. Значительное место в общем спектре продуктов занимают секретируемые белки, производство которых более экономично по сравнению с внутриклеточными, благодаря возможности применения упрощенной схемы их выделения и очистки. К числу микроорганизмов, используемых для этих целей, относят дрожжи S.cerevisiae.
Известно, что эффективность секреции белков в дрожжах зависит от выбора направляющих секрецию лидерных полипептидов (лидерных областей) [Romanos et al., 1992, Yeast, 8: 423-488; Simonen et al., 1994, J Biol Chem, 269(19): 13887-13892; Murasugi, 2010, Recent Patents Biotechnology, 4: 153-166]. В наиболее общем виде лидерный полипептид состоит из сигнальной части (пре-области) и про-области, каждая из них удаляется из состава секретируемого белка по мере выполнения своей функции.
К основным функциям лидерных полипептидов относят:
- направление белков по секреторному пути клетки (функция пре- и про-области);
- участие в процессах сворачивания и созревания секретируемых белков (в основном функция про-области) [Takagi & Takahashi, 2003, Appl Microbiol Biotechnol 63:1-9; Simonen et al., 1994, J Biol Chem, 269(19): 13887-13892];
- повышение растворимости, т.е. термодинамической стабильности секретируемых белков (функция про-области) [Kohara et al., 1994, Biosci Biotechnol Biochem, 58(4):779-81; Zhang et al., 2001, J Cell Biol. 153(6): 1187-98].
Способ с использованием лидерного пептида (пре-про области) α-фактора дрожжей S.cerevisiae, зарекомендовал себя как эффективный и универсальный способ синтеза целевых секретируемых белков [Romanos et al, 1992, Yeast 8, 423-488; Daly & Hearn, 2005, J. Mol. Recognit., 18: 119-138; Gellissen et al., 2005, FEMS Yeast Research 5: 1079-1096].
Другим известным секреторным лидером дрожжевого происхождения является пре-про-область гликопротеина HSP150 S. cerevisiae, положительное влияние которой на секрецию гетерологичных белков в клетках дрожжей установлено, например, для β-лактамазы [Simonen et al., 1994, J Biol Chem, 269: 13887-92] и внеклеточного домена рецептора фактора роста нервов крысы [Simonen et al., 1996, Yeast, 12: 457-66].
Примером последовательности искусственного происхождения, эффективно выполняющей в клетках дрожжей функции лидерного полипептида, является фрагмент белка интерлейкина-1-бета [Lee et al., 1999, Biotechnol Prog, 15: 884-890; WO98/54339A1].
Найден ряд модификаций про-областей лидерных полипептидов, которые обеспечивают улучшение процессинга целевых белков [Kjeldsen et al., 1996, Gene, 170: 107-112] и секреторной активности [Kjeldsen, 2000, Appl Microbiol Biotechnol, 54: 277-286]. В частности, известен искусственно сконструированный про-пептид, обеспечивающий 4-кратное увеличение секреции инсулина человека по сравнению со стандартным вариантом про-области α-фактора дрожжей [Kjeldsen, 2000, Appl Microbiol Biotechnol, 54: 277-286].
Однако ни один из известных лидерных полипептидов не может считаться универсальным инструментом для организации синтеза секретируемых белков в клетках дрожжей.
Например, в отношении продукции альбумина в клетках S.cerevisiae пре-про-область α-фактора опосредует не увеличение секреции, а 5-6-кратное увеличение деградации этого белка, тогда, как другие лидерные полипептиды подобных эффектов не обнаруживают [Sleep et al., 1990, Biotechnology, 8:42-46]. Дестабилизация целевого белка в присутствии α-факторного лидера отмечена и в экспериментах по экспрессии лизоцима шелковичного червя в клетках P.pastoris [Koganesawa et al., 2001, Protein Engeneering, 14(9):705-710].
Различные по протяженности фрагменты белка HSP1500 S. cerevisiae выполняют функцию эффективного секреторного лидера в дрожжах S.cerevisiae, при этом они обладают разными транспортными возможностями и разными возможностями по стимулированию корректного сворачивания секретируемого белка [Simonen et al., 1994, J Biol Chem, 269(19): 13887-13892; Simonen et al., 1996, Yeast, 12(5):457-66].
Также лишь один из вариантов лидеров на основе последовательности белка HSP150 обеспечивает секрецию высокоактивной бета-лактамазы в клетках S.cerevisiae, тогда как другие варианты лидеров вызывают накопление белка в клетках или секрецию неактивной формы белка [Simonen et al., 1994, J Biol Chem, 269(19): 13887-13892].
В этой связи расширение арсенала лидерных полипептидов, пригодных для решения задач, связанных с секрецией целевых белков в клетках дрожжей S.cerevisiae, является актуальной задачей.
В качестве ближайшего аналога заявляемого изобретения рассмотрим способ микробиологического синтеза целевого секретируемого белка в дрожжах S.cerevisiae с использованием лидерного полипептида, включающего 45 аминокислотных остатков субъединицы I белка HSP150 S.cerevisiae [WO93/18167].
Температуро-индуцируемый белок HSP150 клеточной стенки дрожжей S. cerevisiae, имеет процессируемый лидерный полипептид размером 72 аминокислотных остатка, из которых первые 18 остатков формируют сигнальный пептид, а последующие 54 остатка, образующие субъединицу I белка, выполняют функцию про-области [WO93/18167, Russo et al., 1992, Proc. Natl. Acad. Sci. USA, 89: 3671-3675].
В дополнение к возможностям по использованию лидерных фрагментов белка HSP150 в клетках S. cerevisiae [Simonen et al., 1994, J Biol Chem, 269(19): 13887-13892; Simonen et al., 1996, Yeast, 12(5):457-66] известно об эффективном использовании лидерной области белка HSP150 S.cerevisiae в качестве секреторного лидера в клетках дрожжей Pichia pastoris [Sievi et al., 2003, Biotechnol. Prog., 19: 1368-1371]. На модели секреции каталитического домена α2,3-сиалилтрансферазы крысы показано, что лидер HSP150 способен направлять корректное сворачивание и секрецию белка в клетках Р. pastoris. Эффективность этой лидерной области в дрожжах P. pastoris и в дрожжах S.cerevisiae сопоставима с эффективностью универсального α-факторного лидера [Sievi et al., 2003, Biotechnol. Prog, 19: 1368-1371].
С другой стороны известен белок PpPIR1 дрожжей Pichia pastoris, гомологичный белку HSP150 S. cerevisiae и также имеющий лидерный полипептид. Известно, что вариант лидерного полипептида белка PpPIR1 P.pastoris, имеющий размер 59 аминокислотных остатков и гомологичный лидерной области белка HSP150 S.cerevisiae, может служить секреторным лидером в клетках P.pastoris [Khasa et al., 2011, Yeast, 28(3):213-26].
Про-область лидерного полипептида белка HSP150 S. cerevisiae и про-область лидерного полипептида белка PpPIR1 Pichia pastoris гомологичны друг другу, однако содержат достаточно протяженные негомологичные участки и различаются по длине.
Задача заявляемого изобретения - расширение арсенала способов микробиологического синтеза целевых секретируемых белков в дрожжах Saccharomyces cerevisiae.
Задача решена путем разработки способа микробиологического синтеза целевого секретируемого белка путем культивирования в подходящих условиях дрожжей Saccharomyces cerevisiae, секреция целевого белка в клетках которых направлена лидерным полипептидом, в состав которого включен вариант про-области лидерного полипептида белка PpPIRl Pichia pastoris, соответствующий аминокислотной последовательности SEQ ID NO1.
Используемый в заявляемом изобретении вариант про-области лидерного полипептида белка PpPIR1 Pichia pastoris отличается:
- от известного варианта этой про-области [Khasa et al., 2011, Yeast, 28(3):213-26] тремя аминокислотными заменами, а именно, в положении 38 аминокислотный остаток Asp заменен на остаток Ser, в положении 39 аминокислотный остаток Lys заменен на остаток Met, а в положении 40 аминокислотный остаток Ilе заменен на остаток Glu,
- от фрагмента белка HSP150 S. cerevisiae, использованного в способе ближайшем аналоге, отличается размером (42 остатка в SEQ ID NO1 и не менее 45 остатков в ближайшем аналоге) и заменами не менее, чем в 50% аминокислотных позиций.
В заявляемом изобретении использован вариант полного лидерного полипептида белка PpPIR1, который отличается от опубликованного варианта [Khasa et al., 2011, Yeast, 28(3):213-26] указанными выше заменами в про-области и наличием дополнительного метионина на N- конце.
Эффективность заявляемого способа подтверждена на примерах синтеза в клетках дрожжей Saccharomyces cerevisiae сывороточного альбумина человека и интерферона альфа-2b человека
Способ в общем виде
Для амплификации фрагмента хромосомной ДНК дрожжей P. pastoris, кодирующей, лидерный полипептид белка PpPIR1. используют метод полимеразной цепной реакции (ПЦР). Для того чтобы в процессе амплификации изменить последовательность амплифицируемого фрагмента ДНК так, чтобы измененная последовательность содержала уникальный сайт узнавания эндонуклеазы рестрикции NcoI и кодировала вариант модифицированного полипептида SEQ ID NO1, используют дополнительные праймеры. Амплифицированный фрагмент ДНК методами генной инженерии сливают с последовательностью ДНК, обладающей функцией промотора в дрожжах S. cerevisiae, и результирующий фрагмент ДНК, прецизионно слитый с последовательностью ДНК, кодирующей целевой секретируемый белок, клонируют в экспрессионном векторе. При этом экспрессионным вектором может быть эписомный или интегративный вектор, способный стабильно и селективно поддерживаться в клетках дрожжей S. cerevisiae.
Сконструированным вектором трансформируют клетки реципиентного штамма дрожжей S. cerevisiae. Для этого используют одну из рутинных процедур трансформации. Селекцию трансформантов осуществляют за счет комплементации рецессивной хромосомной мутации реципиентного штамма с помощью функционального аллеля гена, локализованного в составе векторной ДНК, или за счет использования в составе векторной ДНК гена, кодирующего один из доминантных признаков (например, определяющего устойчивость клеток к действию антибиотика).
Полученные трансформанты используют для биосинтеза секретируемого целевого белка. Для этого культивирование клеток полученных трансформантов осуществляют в среде следующего состава, в мас.%: пептон 1-3; дрожжевой экстракт 0,5-3; глюкоза 1-3, вода - остальное, рН среды - естественный в течение 16-48 часов при температуре 22-32°С на качалке 100-350 об/мин.
В этих условиях клетки дрожжей секретируют в среду культивирования целевой белок.
Способ позволяет синтезировать различные целевые секретируемые белки, включая сывороточный альбумин и интерферон альфа-2b человека, в количествах, превосходящих или по крайней мере не уступающих количествам белков, синтезируемых с использованием способов, известных из предыдущего уровня развития техники.
Заявляемое изобретение проиллюстрировано следующими фигурами:
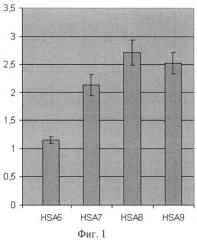
Фиг 1. Влияние лидерных полипептидов на уровень секреции сыворточного альбумина человека в дрожжах S.cerevisiae. Секреция сывороточного альбумина человека направлена следующими лидерными полипептидами:
HSA5 - сигнальным пептидом «ART» (штамм HSA5-Sc),
HSA7 - лидерным полипептидом на основе сигнального пептида «ART», слитого с про-областью белка HSP150 дрожжей S.cerevisiae (штамм HSA7-Sc),
HSA8 - полным лидерным полипептидом белка PpPIR1 дрожжей P.pastoris, включающим последовательность SEQ ID NO1 (штамм HSA8-Sc),
HSA9 - лидерным полипептидом на основе сигнального пептида «ART», слитого с последовательностью SEQ ID NO1 про-области белка PpPIR1 дрожжей P.pastoris (штамм HSA9-Sc).
Штаммы S.cerevisiae HSA5-Sc и HSA7-Sc используют лидерные полипептиды, известные из предыдущего уровня техники, и рассмотрены в качестве контроля к штаммам HSA8-Sc и HSA9-Sc, секретирующим альбумин человека с использованием лидерных полипептидов, включающих последовательность SEQ ID NO1, являющейся вариантом про-области белка PpPIR1 P.pastoris. Приведены сравнительные данные иммуноферментного анализа (ИФА) образцов культуральной жидкости из двух экспериментов. Данные усреднены по 3-10 клонам случайных трансформантов. Указаны величины среднеквадратичного отклонения.
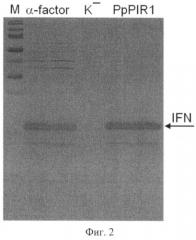
Фиг.2. Электрофореграмма образцов культуральной жидкости, полученных в результате культивирования штаммов дрожжей: IFN-F-Sc (дорожка «α-factor»), IFN-H-Sc (дорожка «PpPIR1»). Штамм S.cerevisiae IFN-F-Sc использует лидерный полипептид, известный из предыдущего уровня техники, и рассмотрен в качестве контроля к штамму IFN-H-Sc, секретирующему интерферон альфа-2b человека с использованием лидерного полипептида, включающего последовательность SEQ ID NO1.
На дорожки нанесены образцы, содержащие по 5 мкл культуральной жидкости каждого штамма. Маркерами молекулярного веса (дорожка М, слева приведены значения молекулярного веса белковых маркеров (в кДа) служили белки набора PageRuler Prestained Protein Ladder (#SM0671, "Fermentas"). В качестве отрицательного контроля (не способного синтезировать интерферон альфа-2b человека) нанесен образец культуральнгой жидкости реципиентного штамма S.cerevisiae G1L.
Заявляемое изобретение проиллюстрировано следующими примерами.
Пример 1. Клонирование фрагмента ДНК, кодирующего лидерный полипептид белка PpPIR1 P.pastoris, включающий SEP ID NO1
Этап 1. Амплификация геномного фрагмента ДНК
Фрагмент ДНК, кодирующий лидерный полипептид белка PpPIR1 P.pastoris получают в результате 2-х этапной ПЦР-амплификации фрагментов хромосомной ДНК штамма GS115 (Invitrogen, USA). Матрицей для амплификации служит хромосомная ДНК штамма GS115 P.pastoris, которую выделяют по методу Сидорука [Сидорук с соавт., 2009]. На 1-ом этапе осуществляют ПЦР-амплификацию фрагмента-1 с использованием пары праймеров N520 (5′-attaaatgatcaaccatgatgtacaggaactt) и N541 (5′-tgtgctccaaggttcggaa), а также фрагмента-2 - с использованием праймеров N540 (5′-ttccgaaccttggagcaca) и N521 (′-ttactcgagtctagatctcttttccatggaggcatctaaggacttaa). На 2-ом этапе осуществляют ПЦР-амплификацию фрагмента-3 с использованием праймеров N520/N521 и смеси фрагментов 1 и 2 в качестве матрицы.
Путем обработки эндонуклеазами рестрикции BclI и XhoI на концах амплифицированного фрагмента-3 ДНК открывают липкие концы соответствующих сайтов рестрикции и тем самым получают пригодный для последующего клонирования фрагмент ДНК, кодирующий лидерный полипептид белка PpPIR1 P.pastoris.
В результате 2-этапной амплификации в последовательности ДНК, кодирующей лидерный полипептид изменяют расположение уникального сайта узнавания рестриктазы NcoI.
Этап 2. Клонирование фрагмента ДНК, кодирующего лидерный полипептид белка PpPIR1 P.pastoris, включающий SEQ ID NO1
Плазмиду pUC18x-GAL1-hsp150pp получают в результате одновременного лигирования трех фрагментов ДНК: 1) HindIII/XhoI фрагмента, заключающего векторную часть лабораторной плазмиды pUC18x; 2) HindIII/BamHI фрагмента, заключающего последовательность промотора GAL1 дрожжей S.cerevisiae; 3) BclI/XhoI фрагмента ДНК, полученного на этапе 1 и кодирующего лидерный полипептид, белка PpPIR1 P.pastoris.
Результирующая плазмида pUC18x-GAL1-hspl50pp содержит в составе HindIII/NcoI фрагмента ДНК нуклеотидную последовательность промотора GAL1 дрожжей S.cerevisiae, слитую с последовательностью ДНК, кодирующей лидерный полипептид белка PpPIR1 P.pastoris.
Пример 2. Конструирование штаммов дрожжей S.cerevisiae для секреции сывороточного альбумина человека
Этап 1. Конструирование вектора pgkU::HSA8
С этой целью получают три фрагмента ДНК: 1) HindIII/SalI фрагмент ДНК, заключающий векторную часть интегративного вектора р91-3 [RU2420 567]; 2) Hindlll/Ncol фрагмент ДНК плазмиды pUC18x-GAL1-hsp150pp, заключающий нуклеотидную последовательность промотора GAL1 дрожжей S.cerevisiae, слитую с последовательностью ДНК, кодирующей лидерный полипептид белка PpPIR1 P.pastoris; 3) NcoI/XhoI фрагмент ДНК, кодирующий структурный ген HSA сывороточного альбумина человека, получаемый в результате открытия концевых сайтов рестрикции NcoI и XhoI во фрагменте ДНК, который амплифицируют в реакции ПЦР с использованием праймеров N522 (5'-tatccatggaaaagagagacgctcacaagtcagaa) и N169 (5'-gagcggataacaatttcacacagg) и ДНК вектора р69-63 (RU2009140367) в качестве матрицы.
Вектор pgkU::HSA8 получают в результате одновременного направленного лигирования этих трех фрагментов ДНК.
Вектор pgkU::HSA8 предназначен для экспрессии в клетках дрожжей S.cerevisiae под контролем промотора GAL1 гена сывороточного альбумина человека, секреция которого направляется модифицированным вариантом лидерного полипептида белка PpPIR1 P.pastoris.
Этап 2. Конструирование вектора pgU::HSA7
С этой целью HindIII/NcoI фрагмент ДНК вектора pgkU::HSA8, заключающий нуклеотидную последовательность промотора GAL1 дрожжей S.cerevisiae, слитую с последовательностью ДНК, кодирующей лидерный полипептид белка PpPIR1 P.pastoris, замещают на HindIII/NcoI фрагмент ДНК, заключающий нуклеотидную последовательность промотора GAL1 дрожжей S.cerevisiae, слитую с последовательностью ДНК, кодирующей искусственный сигнальный пептид «ART» (HindIII/PstI фрагмент ДНК вектора р69-35, RU2009140367), который в свою очередь слит с последовательностью ДНК, кодирующей про-область белка HSP150 дрожжей S.cerevisiae (PstI/NcoI фрагмент ДНК вектора р91-16, RU2420567).
В результате получают вектор pgkU::HSA7, который предназначен для экспрессии в клетках дрожжей S.cerevisiae под контролем промотора GAL1 гена сывороточного альбумина человека, секреция которого направлена лидерным полипептидом на основе сигнального пептида «ART», слитого с про-областью белка HSP150 дрожжей S.cerevisiae.
Этап 3. Конструирование вектора pgkU::HSA9
С этой целью PstI/NcoI фрагмент ДНК вектора pgkU::HSA7, заключающий нуклеотидную последовательность, кодирующую про-область белка HSP150 дрожжей S.cerevisiae, замещают на PstI/NcoI фрагмент ДНК, кодирующий про-область белка PpPIR1 P.pastoris. PstI/NcoI фрагмент ДНК, кодирующий про-область белка PpPIR1 P.pastoris, получают в результате ПЦР-амплификации соответствующего фрагмента ДНК плазмиды pUC18x-GAL1-hsp150pp с использованием праймеров
N542 (5′-tgcctgcagctttgggtgcctacgttccttccgaaccttggagcaca) и
N521 (5′-ttactcgagtctagatctcttttccatggaggcatctaaggacttaa) и последующего открытия липких концов амплифицированного фрагмента путем обработки эндонуклеазами рестрикции PstI и NcoI.
В результате получают вектор pgkU::HSA9 для экспрессии гена сывороточного альбумина человека в клетках S.cerevisiae под контролем промотора GALL Секреция этого белка направлена лидерным полипептидом на основе сигнального пептида «ART», слитого с последовательностью SEQ ID NO1 про-области белка PpPIR1 P.pastoris.
Этап 4. Конструирование штаммов дрожжей S.cerevisiae HSA5-Sc, HSA7-Sc, HSA8-Sc и HSA9-Sc
С этой целью осуществляют трансформацию реципиентного штамма S. cerevisiae G1L, маркированного четырьмя ауксотрофными мутациями (RU2420567), вектором р69-35 (RU2009140367) или pgkU::HSA7 или pgkU::HSA8 или pgkU::HSA9, соответственно.
Трансформацию реципиентого штамма дрожжей G1L проводят по методу Ито с соавт.(Ito Н., Fukuda Y., Murata К., Kimura А. 1983. J Bacteriol., 153: 163-168). Для отбора трансформантов используют синтетическую среду с добавлением аминокислот или оснований, соответствующих ауксотрофным мутациям конструируемого штамма, до конечной концентрации 30 мкг/л. Состав синтетической среды, мас.%: КН2РО4 - 0,1, MgSO4 - 0,05, NaCl - 0,01, CaCl2 - 0,01, (NH4)2SO4 - 0,35, глюкоза - 2, тиамин (витамина В1) - 0,02, рибофлавин (витамина В2) - 0,02, никотиновая кислота (витамина РР) - 0,02, п-аминобензойная кислота - 0,02, пантотенат кальция - 0,02, биотин - 0,0002, пиридоксин (витамина В6) - 0,02, инозит - 1, фолиевая кислота - 0,02, вода - остальное.
Непосредственно перед трансформацией ДНК каждого вектора обрабатывают рестриктазой XhoI, тем самым удаляя из состава интегрируемого вектора бактериальную часть и направляя интеграцию вектора в локус PGK1 хромосомы дрожжей.
В результате трансформации получают по 2 независимых клона штаммов дрожжей S.cerevisiae HSA5-Sc, HSA7-Sc, HSA8-Sc и HSA9-Sc, соответственно. Секреция сывороточного альбумина человека в клетках полученных штаммов дрожжей направлена сигнальным пептидом «ART» (HSA5-Sc), лидерным полипептидом на основе сигнального пептида «ART», слитого с про-областью бежа HSP150 дрожжей S.cerevisiae (HSA7-Sc), лидерным полипептидом на основе сигнального пептида «ART», слитого с последовательностью SEQ ID NO1 про-области белка PpPIR1 дрожжей P.pastoris (HSA9-Sc) или полным лидерным полипептидом белка PpPIR1 дрожжей P.pastoris, содержащим последовательность SEQ ID NO1 про-области (HSA8-Sc).
Штаммы S.cerevisiae HSA5-Sc и HSA7-Sc рассматрены в качестве контроля к штаммам HSA8-Sc и HSA9-Sc, секретирующим альбумин человека с использованием лидерных полипептидов, включающих последовательность SEQ ID NO1 про-области белка PpPIR1 P.pastoris.
Пример 3. Конструирование штаммов дрожжей S.cerevisiae для секреции интерферона альфа-2b человека
Этап 1. Конструирование рекомбинантной плазмиды pUC18x-IFN
С этой целью осуществляют лигирование двух фрагментов ДНК: 1) BamHI/XhoI фрагмента, заключающего векторную часть лабораторного вектора pUC18x; 2) BamHI/XhoI фрагмента ДНК, который получают в результате ПЦР-амплификации фрагмента ДНК плазмиды pUC18x-GAL1ppI-IFN2b (RU2427645) с использованием праймеров N499 (5'-ataggatccteteatctecctcaaacccac) и N169 (5-gagcggataacaatttcacacagg) и последующего открытия его липких концов с использованием рестриктаз BamHI и XhoI.
Плазмида pUC18x-IFN заключает нуклеотидную последовательность структурного гена интерферона альфа-2b человека в составе BamHI/XhoI фрагмента ДНК. Этап 2. Конструирование вектора pPDX2H-sIFN
С этой целью осуществляют одновременное лигирование трех фрагментов ДНК: 1) HindIII/XhoI фрагмента ДНК, заключающего векторную часть рекомбинантной плазмиды pPDX2-IFN2b (RU2427645); 2) HindIII/BgIII фрагмента ДНК плазмиды pUC18x-GALl-hsp150pp, заключающего нуклеотидную последовательность промотора GAL1 дрожжей S.cerevisiae, слитую с последовательностью ДНК, кодирующей лидерный полипептид белка PpPIR1 P.pastoris; 3) BamHI/XhoI фрагмента ДНК плазмиды pUC18x-IFN, заключающего нуклеотидную последовательность структурного гена интерферона альфа-2b человека.
В результате получают репликативный вектор pPDX2H-sIFN, который предназначен для экспрессии в клетках дрожжей S.cerevisiae под контролем промотора GAL1 гена рекомбинантного интерферона альфа-2b человека, секреция которого направлена лидерным полипептидом белка PpPIR1 P.pastoris.
Этап 3. Конструируирование вектора pPDX2F-sIFN
С этой целью HindIII/NcoI фрагмент ДНК плазмиды pPDX2H-sIFN заменяют на HindIII/NcoI фрагмент ДНК плазмиды pUC18x-GAL1ppI-IFN2b [RU2427645], заключающий нуклеотидную последовательность промотора GAL1 дрожжей S.cerevisiae, слитую с последовательностью ДНК, кодирующей лидерный полипептид α-фактора дрожжей S.cerevisiae (пре-про-область α-фактора дрожжей S.cerevisiae).
В результате получают репликативный вектор pPDX2F-sIFN, который предназначен для экспрессии в клетках дрожжей S.cerevisiae под контролем промотора GAL1 гена рекомбинантного интерферона альфа-2b человека, секреция которого направлена лидерным полипептидом α-фактора дрожжей S.cerevisiae.
Этап 4. Конструирование штаммов дрожжей S.cerevisiae IFN-H-Sc и IFN-F-Sc
С этой целью осуществляют трансформацию реципиентного штамма S. cerevisiae G1L, маркированного четырьмя ауксотрофными мутациями (RU2420567), вектором pPDX2H-sIFN или pPDX2F-sIFN, соответственно.
Трансформацию реципиентого штамма дрожжей G1L и селекцию трансформантов осуществляют как в примере 2 за исключением того, что используют кольцевые формы векторных ДНК, не подвергая их расщеплению.
В результате трансформации получают по 2 независимых клона штаммов дрожжей S.cerevisiae IFN-H-Sc и S.cerevisiae IFN-F-Sc, соответственно. Секреция рекомбинантного интерферона альфа-2b человека в штамме S.cerevisiae IFN-H-Sc направлена лидерным полипептидом белка PpPIR1 P.pastoris (IFN-H-Sc), а в штамме S.cerevisiae IFN-F-Sc, который является контролем, лидерным полипептидом α-фактора дрожжей S.cerevisiae (IFN-F-Sc).
Пример 4. Культивирование дрожжей S.cerevisiae и анализ уровня секреции целевых белков
Для выращивания штаммов дрожжей S.cerevisiae IFN-H-Sc, IFN-F-Sc, HSA5-Sc, HSA7-Sc, HSA8-Sc и HSA9-Sc используют комплексную среду YPD следующего состава, мас.%: пептон -2, дрожжевой экстракт -1, глюкоза -2, вода - остальное. Дрожжи культивируют при температуре +28°С на качалке (250 об/мин) в течение 42 часов при плотности засева 5×105 мл-1.
Сравнительный анализ уровня секреции интерферона альфа-2b человека в клетках штаммов IFN-H-Sc и IFN-F-Sc осуществляют путем электрофорез белков культуральной жидкости в 15% ПААГ в денатурирующих редуцирующих условиях с использованием системы Mini-PROTEAN Tetra Cell (#165-8000, "BioRad") по инструкции, прилагаемой к системе. Приготовление буферов, подготовку образцов культуральной жидкости, нанесение на гель и электрофорез проводят согласно инструкции, прилагаемой к системе. Используют маркеры молекулярного веса PageRuler Prestained Protein Ladder (#SM0671, "Fermentas"). Окрашивание геля нитратом серебра проводят при помощи набора PageSilver Silver Staining Kit "Fermentas" (#K0681, "Fermentas") согласно инструкции, прилагаемой к киту.
Сравнительный анализ уровня секреции сывороточного альбумина человека осуществляют, используя метод и протокол ИФА Albumin Human Bioassay ELISA Kit (A 1274-85, "US Biological"). В качестве отрицательного контроля (не способного синтезировать сывороточный альбумин) используют реципиентный штамм дрожжей S.cerevisiae G1L.
Результаты сравнительного анализа (фиг.1) демонстрируют, что эффективность синтеза в дрожжах Saccharomyces cerevisiae секретируемого сывороточного альбумина человека с использованием лидерных полипептидов, включающих вариант про-области, SEQ ID NO1, превышает (штамм HSA8-Sc) или, по крайней мере, не уступает (штамм HSA9-SC) эффективности синтеза этого белка с использованием лидерных полипептидов, известных из предыдущего уровня техники (штаммы HSA5-Sc и HSA7-Sc).
Данные сравнительного анализа (фиг.2) свидетельствуют, что эффективность синтеза секретируемого интерферона альфа-2b человека с использованием лидерного полипептида белка PpPIR1 P.pastoris, включающего вариант про-области с аминокислотной последовательностью SEQ ID NO1 (штамм IFN-H-Sc), не уступает эффективности синтеза этого белка с помощью «универсального» лидерного полипептида α-фактора дрожжей, используемого в качестве контроля (штамм IFN-F-Sc). Кроме того, видно (фиг.2), что целевой продукт, синтезированный заявляемым способом с использованием штамма IFN-H-Sc отличается более высоким качеством, чем целевой продукт, синтезированный контрольным штаммом IFN-H-Sc, так как содержит значительно меньшее количество фоновых белков.
Таким образом, вариант про-области лидерного полипептида белка PpPIR1 Pichia pastoris, соответствующий аминокислотной последовательности SEQ ID NO1, с использованием которой разработан заявляемый способ, пополняет арсенал известных фрагментов лидерных пептидов для микробиологического синтеза секретируемых целевых белков в дрожжах Saccharomyces cerevisiae и увеличивает возможности для эффективного синтеза этих белков.
Заявляемый способ позволяет использовать для секреции целевых белков в клетках дрожжей S.cerevisiae вариант про-области лидерного полипептида белка PpPIR1 Pichia pastoris, соответствующий аминокислотной последовательности SEQ ID NO1, в сочетании с различными пре-областями.
Источники научно-технической информации
Сидорук К.В., Левитин Е.И., Пиксасова О.В. (2009). Универсальный метод выделения высокомолекулярной ДНК из микроорганизмов, основанный на предварительной обработке биомассы раствором ацетата аммония. «Актуальные вопросы генетики, радиобиологии и радиоэкологии: Вторые чтения, посвященные памяти В.И.Корогодина и В.А.Шевченко». (Дубна, ОИЯИ, 12-13 января, 2009). Материалы тезисов и докладов. Стр.100.
Daly, R. and Hearn, M.T.W. (2005) Expression of heterologous proteins in Pichia pastoris: A useful experimental tool in protein engineering and production. JMol Recognit, 18:119-138. Gellissen G., Kunze G., Gaillardin C, Cregg J.M., Berardi E., Veenhuis M., van der Klei I. (2005). New yeast expression platforms based on methylotrophic Hansenula polymorpha and Pichia pastoris and on dimorphic Arxula adeninivorans and Yarrowia lipolytica - a comparison. FEMS Yeast Res. 2005, 5(11):1079-96.
Ito H., Fukuda Y, Murata K, Kimura A.(1983) Transformation of intact yeast cells treated with alkali cations. J.Bacteriol. 153:163-168.
Khasa Y.P., Conrad S., Sengul M., Plautz S., Meagher M.M., Inan M. (2011). Isolation of Pichia pastoris PIR genes and their utilization for cell surface display and recombinant protein secretion. Yeast, 28(3): 213-226.
Kjeldsen T. Yeast secretory expression of insulin precursors. Appl Microbiol Biotechnol. 54 (2000) 277-286.
Kjeldsen T, Brandt J, Andersen AS, Egel-Mitani M, Hach M, Pettersson AF, Vad К. A removable spacer peptide in an alpha-factor-leader/insulin precursor fusion protein improves processing and concomitant yield of the insulin precursor in Saccharomyces cerevisiae. Gene 170 (1996) 107-112.
Koganesawa N, Aizawa T, Masaki K, Matsuura A, Nimori T, Bando H, Kawano K, Nitta K. (2001). Construction of an expression system of insect lysozyme lacking thermal stability: the effect of selection of signal sequence on level of expression in the Pichia pastoris expression system. Protein Eng, 14(9): 705-710.
Kohara A, Yamamoto Y, Kikuchi M. (1994) Processing and secretion of human growth hormone with an artificial signal sequence. Biosci Biotechnol Biochem., 58(4):779-781
Lee J., Choi S.-I., Jang J.S., Jang K., Moon J.W., Bae C.S., Yang D.S., Seong B.L. (1999) Novel secretion system of recombinant Saccharomyces cerevisiae using an N-terminus residue of human IL-1β as secretion enhancer. Biotechnol Prog, 15: 884-890.
Murasugi A. (2010) Secretory Expression of Human Protein in the Yeast Pichia pastoris by Controlled Fermentor Culture. Recent Patents on Biotechnology, 4: 153-166.
Romanos M.A., Scorer C.A., Clare J.J. (1992). Foreign gene expression in yeast: a review. Yeast, 8: 423-488.
Russo P., Kalkkinen N., Sareneva H., Paakkola J., Makarow M. A heat shock gene from Saccharomyces cerevisiae encoding a secretory glycoprotein. Proc. Natl. Acad. Sci. USA 89 (1992)3671-3675.
Sievi E., Halnninen A.-L., Salo H., Kumar V., Makarow M. Validation of the HSP150 Polypeptide Carrier and HSP150 Promoter in Expression of Rat r2,3-Sialyltransferase in Yeasts. Biotechnol. Prog. 2003,19, 1368-1371
Simonen M., Jamsa E., Makarow M. The role of the carrier protein and disulfide formatioinn the folding of p-lactamase fusion proteins in the endoplasmic reticulum of yeast. The Journal of Biological Chemisitry 269 (1994) 13887-13892 Simonen M, Vihinen H, Jänsä E, Arumäe U, Kalkkinen N, Makarow M. The hsp150 delta-carrier confers secretion competence to the rat nerve growth factor receptor ectodomain in Saccharomyces cerevisiae. Yeast 12 (1996) 457-466.
Sleep D., Belfield G.P., Goodey A.R. (1990) The secretion of human serum albumin from the yeast Saccharomyces cerevisiae using five different leader sequences. Biotechnology, 8: 42-46
Takagi H, Takahashi M. (2003). A new approach for alteration of protease functions: pro-sequence engineering. Appl Microbiol Biotechnol, 63(1):1-9.
Zhang X, Kiechle F. (2001). Hoechst 33342-induced apoptosis is associated with decreased immunoreactive topoisomerase I and topoisomerase I-DNA complex formation. Ann Clin Lab Sci., 31(2):187-198.
Способ микробиологического синтеза целевого секретируемого белка путем культивирования в подходящих условиях дрожжей Saccharomyces cerevisiae, секреция целевого белка в клетках которых направлена лидерным полипептидом, отличающийся тем, что в состав лидерного полипептида включен вариант про-области лидерного полипептида белка PpPIR1 Pichia pastoris, соответствующий аминокислотной последовательности SEQ ID NO 1.