Способ диагностики туберкулезного инфицирования
Иллюстрации
Показать всеИзобретение относится к клинической медицине, а именно к способу диагностики туберкулезного инфицирования. Сущность способа состоит в том, что осуществляют взятие периферической крови пациента, проводят инкубацию цельной крови с микобактериальными антигенами, представляющими собой смесь белков ESAT-6, CFP-10, ТВ 7.7, и без них, центрифугирование проб с отделением плазмы, определение в супернатантах содержание IL-2 и диагностирование наличия заболевания по разнице его концентраций в пробах по сравнению с выбранной пороговой величиной. В качестве пороговой величины устанавливают разницу в концентрации IL-2 между антигениндуцированной и спонтанной его продукцией 36 пг/мл и при разнице в концентрации 36 пг/мл и более делают вывод о туберкулезном инфицировании, а при значении ниже порогового - об отсутствии инфицирования. Использование заявленного способа позволяет сократить число сомнительных результатов и повысить надежность диагностики туберкулезного инфицирования. 2 табл., 3 ил., 5 пр.
Реферат
Изобретение относится к клинической медицине, точнее к фтизиатрии и иммунологии, а именно к ускоренным способам диагностики инфицирования больных туберкулезом легких (ТБ).
В последние годы во многих странах, независимо от уровня их экономического развития, отмечается увеличение заболеваемости и распространения туберкулеза, который все чаще упоминается среди так называемых "возрождающихся" инфекций. Для предотвращения распространения туберкулеза актуальное значение приобретает возможность диагностики этого заболевания, в частности, выявления контингента, больного туберкулезом в активной форме, и представляющего опасность для окружающих. Это особенно актуально в условиях широкого распространения латентной формы туберкулеза, не представляющей серьезной опасности для окружающих и ограниченных возможностях лечебных учреждений.
В настоящее время наиболее широко распространена диагностика заболеваний с использованием пробы Манту и, при наличии положительной реакции, бактериологических методов анализа. Однако, результат постановки внутрикожной аллергической пробы Манту учитывают через 72 часа, причем в связи с высоким процентом инфицированности населения ТБ частота подтверждения диагноза заболевания в разных возрастных группах составляет от 25 до 50% (Бородулина Е.А., Бородулин Б.Е. Дифференциальная диагностика поствакцинальной и инфекционной туберкулиновой аллергии у детей с атопическими заболеваниями. // Проблемы туберкулеза и болезней легких, - №1, 2006, - с.9-12). На результаты пробы Манту оказывают влияние предыдущая вакцинация, неконтролируемый прием антибиотиков широкого спектра действия и наличие сопутствующей патологии, в том числе аллергопатологии (Аксенова В.А., Овсянкина Е.С., Александрова Т.М. Методы контроля качества работы при массовой туберкулинодиагностике. // Проблемы туберкулеза. - 2002, №2. - С.3-5). Недостатками бактериологических методов являются низкая частота выявления Mycobacterium tuberculosis (МБТ) и длительный рост МБТ на питательных средах (до 30 дней). Все перечисленное определяет сложность клинико-лабораторной диагностики туберкулеза и обуславливает необходимость разработки более быстрых и надежных способов лабораторной диагностики туберкулезной инфекции.
Известен ускоренный способ бактериологической диагностики туберкулеза по методу Прайса, позволяющий выделить и идентифицировать МБТ через 7-14 дней (Медицинская микробиология, вирусология и иммунология. / Под ред. А.А.Воробьева. М.: Медицинское информационное агенство, 2004. - 671 с.), однако и эти сроки также достаточно велики, а надежность метода достаточно низка.
Широко используется для диагностики туберкулеза метод иммуноферментного анализа (ИФА), позволяющий определять наличие туберкулезной инфекции по концентрации (титру) специфических иммуноглобулинов классов А, М, G, Е (Авдеенко В.Г. с соавт. Повышение эффективности иммунодиагностики туберкулеза путем применения моноклональных антител против иммуноглобулина G человека. / Клиническая лабораторная диагностика. - 1999, №6. - С.22-35; Авдеенко В.Г. с соавт. Противотуберкулезные IgE-антитела. Иммунодоминантные антигены. // Проблемы туберкулеза. - 2002, ч.1, №2. - С.30-33). Недостатком данного способа является необходимость повторного исследования сывороток крови через 10-14 дней для выявления нарастания титра антител к МБТ, свидетельствующего об активном инфекционном процессе в организме.
Общим недостатком вышеперечисленных методов является длительность анализа, их недостаточная селективность, невозможность подразделить контингент больных на пациентов с латентной и активной формами туберкулеза, что не позволяет своевременно проводить активные мероприятия с больными второй из вышеперечисленных групп.
Одним из наиболее перспективных направлений диагностики туберкулеза (ТБ) является проведение анализа in vitro с использованием антигенов, специфических для Mycobacterium tuberculosis. Как показывают обобщенные аналитические данные, клеточные тесты in vitro обладают высокой специфичностью: у 99% вакцинированных лиц наблюдаются отрицательные реакции, а у 78% больных туберкулезом - положительные реакции (Menzies Т. Meta-analysis: New tests for the diagnosis of latent tuberculosis infection: areas of uncertainty and recommendations for research march / Т. Menzies, M. Pai, G. Comstock // Annals. Intern. Med. - 2007. - Vol.146 - P.340-354; Pai M. T-cell based assays for the diagnosis of latent tuberculosis infection: an update / M.Pain, A.Zwerling, D.Menzies // Arm. Intern. Med. - 2008. - Vol.149. - P.177-184).
В настоящее время прошел сертификацию тест T-SPOT, являющейся экспресс-аналогом стандартной диагностики туберкулеза на основе кожных реакций замедленного типа (Кожная проба с препаратом "ДИАСКИНТЕСТ"-новые возможности идентификации туберкулезной инфекции / Под ред. Академика РАН и РАМН М.А.Пальцева. Второе издание, переработанное и дополненное. - М.: Издательство "Шико", 2011. 256 с). Способ иммунологической диагностики и мониторинга туберкулезной инфекции Т-SPOT (Oxford Immunotec, USPTO Applicaton №20070196878), основан на определении количества клеток, продуцирующих интерферон-гамма (IFNy) в присутствии таких специфических индукторов, как белки ESAT-6 (ранний секретируемый антиген) и CFP-10 (белок культурального фильтрата), которые отсутствуют у микобактерий вакцинного штамма М. bovis (BCG) и большинства нетуберкулезных микобактерий окружающей среды, за исключением Mycobacterium marinum и Mycobacterim kansasii. При этом предварительная БЦЖ-вакцинация не оказывает значительного влияния на результаты индукции IFNy in vitro, а повышение его количества свидетельтвует о наличии туберкулезной инфекции (Мордовская Л.И Индукция IFNγ в образцах цельной венозной крови in vitro - тест для определения туберкулезного инфицирования детей и подростков / Л.И. Мордовская, М.А. Владимирский, В.А. Аксенова, Е.Е. Ефремов, Г.И. Игнашенкова, Т.Н. Власик // Проблемы туберкулеза и болезней легких - 2009. - №6. - С.19-24).
Основными недостатками этого теста является его сложность и трудоемкость, необходимость культивирования клеток в стерильных условиях, а также невозможность на его основе диагностировать носит ли заболевание латентный или активный характер.
Наиболее близким по своей сущности к методу, предлагаемому в данном изобретении, является способ, основанный на измерении уровня продукции IFNy клетками периферической крови при стимуляции образцов крови антигенами микобактерий (RUBBO P.F. et al Multicytokine detection improves latent tuberculosis diagnosis in health care workers. J. Clin Microbiol. 2012, may, 50(5), p.1711-7). Способ диагностики включает в себя взятие крови у пациента, последующее культивирование образцов цельной крови, стабилизированной гепарином с микобактериальными антигенами, которые представляют собой смесь белков ESAT-6, CFP-10 и ТВ 7.7 и без них методом иммунофер-ментного анализа (ИФА). После окончания культивирования пробирки центрифугируют, отбирают плазму и определяют в них содержание цитокина (IL-2, IFNγ) методом ИФА и диагностируют наличие заболевания по разнице его концентраций в пробах по сравнению с выбранной пороговой величиной.. При этом определение IFNγ проводят с использованием тест-системы "QuantiFERON-TB Gold In-Tube" ("Cellestis", Австралия). Результаты оцениваются с помощью программного обеспечения QFT 2.62. Результаты теста считаются положительными, если разность между антигениндуцированной и спонтанной продукций IFNγ более 0, 35 МЕ/мл.
Основным недостатком этого метода является то, что диапазон измеряемых концентраций IFNγ очень низкий (пороговое значение 0, 35 МЕ/мл или 17,5 пг/мл) и для его количественного обнаружения требуются очень чувствительные и дорогостоящие тест-системы. Кроме того, очень низкое пороговое значение увеличивает количество неопределенных результатов. Так, в недавней публикации [Pai.M Serial testing of Health Care Workers for Tuberculosis using Interferon-Gamma. Assay / M. Pai, R. Joshi, S. Dogra, D.K. Mendiratta, P. Narang, S. Kalantri, A.L. Reingold, J.M. Colford Jr, L.W. Riley, and Menzies // Am. J. Respir. Crit Care Med. - 2006. - Vol.174(3). - P.349-355.], основанной на применении теста "QuantiFERON-TB Gold In-Tube"(QFN-GIT) было показано, что существует значительный риск ложноположительных и ложноотрицательных результатов теста. В свою очередь при использовании IL-2 авторами было выбрано пороговое значение на малой выборке обследуемых.
Задачей изобретения являлась разработка способа диагностики туберкулезного инфицирования, позволяющего повысить его надежность.
Техническая задача решалась в результате нахождения биомаркера ТБ с высоким пороговым значением и его использованием для обеспечения надежности результатов.
Технический результат достигался тем, что цельную кровь инкубировали в пробирках с микобактериальными антигенами - смесью белков ESAT-6, CFP-10 и ТВ 7.7 и без антигенов, определяли содержание интерлейкина-2 (IL-2) в обеих пробах и разность между антигениндуцированной и спонтанной продукцией сопоставляли с пороговым значением и при его достижении или превышении диагностировали наличие туберкулезного инфицирования, а при значении ниже порогового - его отсутствие. В качестве порогового значения, при котором достигается чувствительность выявления инфицированных лиц 86% и 95%, была определена величина 36 пг/мл.
Как показали проведенные эксперименты, использование IL-2 в качестве биомаркера позволяет работать в существенно более широком диапазоне определяемых концентраций IL-2, что позволяет избежать получения сомнительных результатов и повысить надежность диагностики.
Предлагаемый способ осуществляют следующим образом. Образцы цельной крови (1000мкл), стабилизированной гепарином (50ед/мл), культивируют при 37°С в течение 18-24 часов в нулевой контрольной пробирке и в присутствии смеси антигенов микобактерий ESAT-6, CFP-10, ТВ 7.7. (Как правило, используют смесь антигенов из тест-системы "QuantiFERON-TB Gold In-Tube" или других аналогичных тест-систем). После окончания культивирования пробы центрифугируют, отделяют плазму и определяют в ней количество IL-2 с помощью общепринятых методик мультиплексного или иммуноферментного (ИФА) анализа. В частности, определение проводится с помощью технологии хМар при использовании магнитных частиц "Milliplex Mag"n анализатора "MagPix" ("Millipore", США). После чего, вычисляют разность между антигениндуцированной и спонтанной продукцией IL-2 и при значении 36 пг/мл и выше делают вывод о туберкулезном инфицировании. При значении ниже порогового констатируют отсутствие инфицирования микобактериями.
Для оценки надежности заявляемого способа были проведены клинические исследования 54 больных с преимущественно инфильтративным, туберкулезом легких до начала специфической противотуберкулезной терапии (n=54) и 47 лиц с латентной формой туберкулезной инфекции (ЛТБИ), для которых тест с гамма-интерфероном дает, как правило, значения, близкие к пороговой величине. (Последняя группа была представлена в основном сотрудниками стационаров противотуберкулезных учреждений).
У всех лиц, включенных в исследование (n=101) был проведен тест по методике ближайшего аналога (с использованием тест-системы QuantiFERON-TB Gold In-Tube) и оценка инфицирования по концентрации гамма-интерферона. Положительный результат(QFN+) был получен у 36 больных с активной формой ТБ и 26 лиц с ЛТБИ, отрицательный результат (QFN-) был получен у 18 больных и 21 лица с ЛТБИ. На данном этапе больные с активной формой ТБ и лица с ЛТБИ были разбиты на 2 группы в зависимости от результата теста: QFN+ и QFN-.
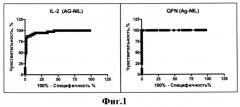
В плазме крови изучалась спонтанная (NIL) и антигениндуцированная (AG) продукция интерлейкина-2. Для статистических расчетов использовали значения спонтанной (NIL) продукции исследуемых биомаркеров, антигениндуцированной (AG) продукции и разности между ними (AG-NIL). Статистическую обработку проводили с помощью программы SPSS (версия 13.0). Для сравнения групп использовали критерий Манна - Уитни. Для сравнения диагностической значимости были построены характеристические ROC - кривые). Для оценки взаимосвязи между продукцией IL-2AG-NIL и IFNγAG-NIL использовали коэффициент корреляции Спирмена (r=0,86, р<0,005).
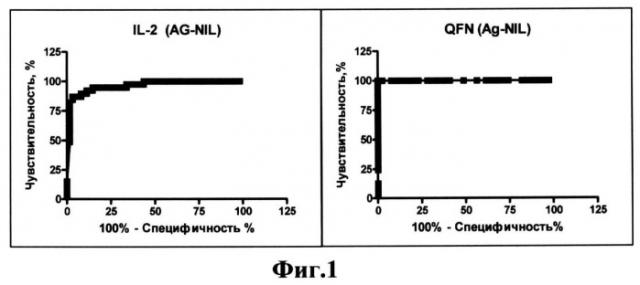
На фиг.1 приведены характеристические кривые операционной характеристики при сравнении группы QFN+и QFN-.
На фиг.2 приведена корреляционная зависимость между IL-2 и IFN-y при совместном анализе больных и контактных лиц. (n=101).
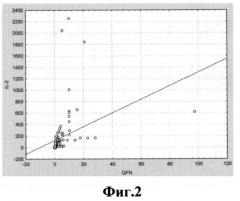
На фиг.3 приведены диаграммы значений IFN-γAG-NIL и IL-2AG-NIL в группе QFN+ и QFN-, демонстрирующие разброс количественных значений при использовании обсуждаемых биомаркеров.
Для сравнения тестов с использованием IL-2 и IFNγ по диапазону измеряемых концентраций были рассчитаны медианы с указанием межквартильного расстояния для группы QFN+, QFN-. Результаты представлены в таблице 1.
| Таблица 1 | |||
| Количественные значения медиан в обследуемы группах | |||
| Показатель | Все (n=101) | QFN+(n=62) | QFN-(n=39) |
| I.IFN-γAG-NIL (QFN-IT), МЕ/мл | |||
| Me [Q1;Q3] | 0,74 [0,11;3,70] | 2,6 [0,94;8,65] | 0,040 [-0,010;-0,170] |
| Минимальное значение | -0,3 | 0,4 | -0,3 |
| Максимальное значение | 97,39 | 97,39 | 0,34 |
| 2. IL-2AG-NIL, пг/мл | |||
| Me[Q1;Q3] | 48,49 [5,29;156,60] | 130,70 [57,73;252,46] | 1,4 [0;7,21] |
| Минимальное значение | -3 | 0 | -3 |
| Максимальное значение | 2255,78 | 2255,78 | 107,28 |
В связи с тем, что специфичность и чувствительность метода связаны между собой обратной связью, то, используя кривую операционной характеристики, в качестве порогового значения была выбрана оптимальная величина, равная 36пг/мл (таблица 2). При этом значении пороговой величины достигается чувствительность выявления инфицированных лиц 86% (ДИ 74,22-93,14) и специфичность выявления лиц неинфицированных лиц 95% (ДИ 82,68-99,37).
| Таблица 2 | ||
| Пороговые значения IL-2 AG-NIL (пг/мл), значения чувствительности и специфичности при разделении групп QFN+ и QFN- | ||
| Специфичность, % | Чувствительность, % | Пороговое значение, пг/л |
| 97 | ||
| 90 | 89 | 28,0 |
| 95 | 86 | 36 |
| 98 | 66 | 72 |
Полученные результаты показали преимущество заявляемого способа по сравнению с аналогами, особенно в случаях, когда разность между антигениндуцированной и спонтанной продукцией (AG-NIL) для IFNγ была близка к пороговому значению. Это обусловлено тем, что для биомаркера IL-2 диапазон измеряемых концентраций существенно выше, чем для IFNγ: от 0,3 до 97,39МЕ/мл для IFNγAG-NIL и от 48,49 до 2255,78 пг/мл для IL-2AG-NIL (фиг.3).
Сущность и преимущества способа иллюстрируются следующими примерами.
Пример 1. Больная Ф. Диагноз: инфильтративный туберкулез верхней доли правого легкого. Результат посева мокроты отрицательный. Результат теста на инфицирование М. tuberculosis (QuantiFERON-TB Gold in-tube): положительный (IFN-γAG-NIL=0,94МЕ/мл при пороговом значении 0,35МЕ/мл). Содержание IL-2AG-NIL в полученном супернатанте 55пг/мл (>36пг/мл). Результат положительный.
Заключение: больной инфицирован М. tuberculosis.
Пример 2. Сотрудник противотуберкулезного диспансера X. Результат теста на инфицирование М. tuberculosis (QuantiFERON-TB Gold in-tube): положительный (IFN-γAG-NIL=0,37МЕ/мл при пороговом значении 0,35МЕ/мл). Полученное значение очень близко к пороговому.
Содержание IL-2AG-NIL В полученном супернатанте 28 пг/мл при пороговом значении 36 пг/мл. Результат отрицательный.
Результаты рентгенологического обследования: изменений в легочной ткани не выявлено. Жалоб нет. Клинические признаки туберкулеза отсутствуют. Заключение: отсутствие инфицирования М. tuberculosis
Пример 3. Сотрудник противотуберкулезного диспансера X. Результат теста на инфицирование М. tuberculosis (QuantiFERON-TB Gold in-tube): положительный (IFN-γag-nil=0,56 МЕ/мл при пороговом значении 0,35 МЕ/мл. Содержание IL-2Ag-nil в полученном супернатанте 175 пг/мл (>36 пг/мл). Результат положительный.
Заключение: вероятность инфицирования M.tuberculosis.
Пример 4. Сотрудник противотуберкулезного диспансера X. Результат теста на инфицирование М. tuberculosis (QuantiFERON-TB Gold in-tube): отрицательный (IFN-γag-nil=0,34 МЕ/мл). Пороговое значение 0,35 МЕ/мл. Полученное значение очень близко к пороговому. Содержание IL-2Ag-nil В полученном супернатанте 72 пг/мл (превышение порогового значения 36 пг/мл в 2 раза). Результат положительный.
Заключение: вероятность инфицирования М. tuberculosis.
Пример 5. Больной 3. Диагноз: диссеминированный ТБ в фазе инфильтрации и распада. Результат посева мокроты положительный. Результат теста на инфицирование М. tuberculosis (QuantiFERON-TB Gold in-tube): отрицательный (IFN-γag-nil=0,21 МЕ/мл при пороговом значении 0,35 МЕ/мл). Содержание IL-2AG-nil в полученном супернатанте 36 пг/мл (равно пороговому значению 36 пг/мл). Результат положительный.
Таким образом, использование IL-2 в качестве биомаркера позволяет работать в расширенном диапозоне определяемых концентраций, что позволяет избежать получения сомнительных результатов. При анализе небольшого количества периферической крови способ обладает высокой диагностической значимостью в диагностике туберкулезной инфекции. Несомненным преимуществом является удобство для пациента, так как для оценки результатов не требуется повторного посещения врача. Заявляемый способ может использоваться как самостоятельно, так и вместе со способом, основанным на диагностировании гамма-интерферона для уточнения диагноза, особенно при его концентрации в пробе близкой к пороговой.
Способ диагностики туберкулезного инфицирования, включающий в себя взятие периферической крови пациента, инкубацию цельной крови с микобактериальными антигенами, представляющими собой смесь белков ESAT-6, CFP-10, ТВ 7.7, и без них, центрифугирование проб с отделением плазмы, определение в супернатантах содержания IL-2 и диагностирование наличия заболевания по разнице его концентраций в пробах по сравнению с выбранной пороговой величиной, отличающийся тем, что в качестве пороговой величины устанавливают разницу в концентрации IL-2 между антигениндуцированной и спонтанной его продукцией 36 пг/мл и при разнице в концентрации 36 пг/мл и более делают вывод о туберкулезном инфицировании, а при значении ниже порогового - об отсутствии инфицирования.