Фармацевтические композиции, обладающие желаемой биодоступностью
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности и представляет собой офтальмическую фармацевтическую композицию, включающую количество простагландина, пригодного для лечения глаукомы; полимерное соединение четвертичного аммония для консервирования композиции; сурфактант, где сурфактант является этоксилированным и/или гидрогенизированным касторовым растительным маслом в концентрации по меньшей мере 0,05 вес./об.%, но менее чем 0,4 вес./об.% композиции, где i) сурфактант, представляющий собой этоксилированное и/или гидрогенизированное касторовое растительное масло, является полностью или по существу полностью единственным сурфактантом в композиции; и ii) композиция свободна от бензалкония хлорида; и воду, где композиция пригодна для местного нанесения на глаз человека. Изобретение обеспечивает улучшенную биодоступность композиции и уменьшение количества сурфактанта. 2 н. и 15 з.п. ф-лы, 6 ил., 12 табл.
Реферат
Перекрестная ссылка на родственные заявки
Приоритет формулы изобретения настоящей заявки основан на предварительной заявке на патент США No.61/037117, поданной 17 марта 2008 года, и на предварительной заявке на патент США No.61/111920, поданной 6 ноября 2008 года.
Область техники, к которой относится изобретение
Настоящее изобретение относится к фармацевтическим композициям, содержащим различные концентрации сурфактанта, повышающие биодоступность терапевтического агента композиции. В частности, настоящее изобретение относится к фармацевтическим композициям для местного применения (например, многодозовым офтальмическим композициям), имеющим относительно низкие концентрации сурфактанта, повышающие биодоступность терапевтического агента (например, простагландина, такого как травопрост).
Уровень техники
Настоящее изобретение направлено на фармацевтические композиции изготовленные, чтобы обеспечить повышенную биодоступность терапевтического агента композиции. Такая композиция может также обладать другими дополнительными или альтернативными желаемыми характеристиками. Например, композиция может также быть стерильной, обладать желаемой антибактериальной или консервирующей эффективностью, обладать желаемой степенью стабильности, обладать комбинацией этих и им подобных характеристик.
Часто необходимо, чтобы терапевтические агенты фармацевтических композиций (например, офтальмические лекарственные средства) были стабильны в таких композициях. Как правило, нежелательно, чтобы терапевтические агенты или вся композиция разлагались на составные части или подвергались значительным химическим или физическим изменениям до нанесения этих агентов пациенту или в иных обстоятельствах. Для поддержания стабильности в рецептуру фармацевтических композиций, как правило, вводят ингредиенты, способные повышать эту стабильность или ингредиенты, способные минимизировать дестабилизирующее действие других факторов (например, химических веществ, условий окружающей среды или им подобных).
Сурфактанты являются той предпочтительной группой ингредиентов, которая показала значительную эффективность по стабилизации фармацевтических композиций и/или их терапевтических агентов (в частности водных офтальмических растворов, включающих относительно липофильные и/или относительно нерастворимые компоненты). Кроме того, обычно считается, что стабильность агента или композиции во многих случаях может быть достигнута за счет увеличения концентрации сурфактанта в этой фармацевтической композиции.
Наряду со стабильностью агентов или композиций, как правило, желательным является также то, чтобы терапевтические агенты фармацевтических композиций обладали относительно высокой степенью биодоступности. Такая биодоступность часто становится особенно важной в тех случаях, когда способ или метод применения или дозировка конкретной фармацевтической композиции дает терапевтическому агенту этой композиции только ограниченный промежуток времени для того, чтобы он абсорбировался или иным способом достиг биологической мишени, такой как глаз, ухо, горло или нос пациента. В качестве примера, офтальмические фармацевтические композиции для местного применения могут проникать внутрь глаза пациента или задерживаться на нем только в течение ограниченного промежутка времени (например, до тех пор, пока их не смоет слеза). Таким образом, во многих случаях желательно ограничивать концентрацию любого ингредиента фармацевтической композиции, способного ингибировать биодоступность терапевтического агента этой композиции.
Недавно было обнаружено, что сурфактанты, когда они используются в определенных высоких концентрациях, могут выступать в роли ингредиентов, способных ограничивать биодоступность терапевтического агента, в частности офтальмического терапевтического агента. Как следствие, добавление сурфактанта в фармацевтические композиции и в частности в офтальмические композиции может ограничить биодоступность и, в свою очередь, эффективность терапевтического агента данной композиции. Однако, как уже говорилось выше, сурфактанты могут также быть довольно желательны в составе фармацевтической композиции, так как они способны значительно повышать стабильность фармацевтической композиции или терапевтического агента.
Ввиду вышеизложенного, было бы желательно создать фармацевтическую композицию с пониженной концентрацией сурфактанта и/или повышенной биодоступностью терапевтического агента. Кроме того, также было бы желательно, хотя и не обязательно, если иное специально не оговорено, чтобы такая композиция обладала желаемым уровнем стабильности.
Сущность изобретения
Таким образом, настоящее изобретение относится к фармацевтической композиции, в частности к офтальмической композиции, которая сочетает терапевтический агент с относительно низкой концентрацией сурфактанта. В основном композиция будет обладать повышенной биодоступностью терапевтического агента, в частности, когда она будет использоваться для местного применения. В одном варианте осуществления изобретения обеспечивается такое эффективно низкое количество сурфактанта, при котором площадь под кривой концентрация/время, определенная для фармацевтической композиции настоящего изобретения, применительно к биологической мишени, составляет, по меньшей мере, 130%, как правило, по меньшей мере, 200% и даже возможно, по меньшей мере, 250% от площади под аналогичной кривой концентрация/время, определенной для контрольной композиции, применительно к биологической мишени. В этом варианте контрольная композиция, как правило, будет содержать сурфактант в количестве, по меньшей мере, вдвое большем, чем количество сурфактанта в фармацевтической композиции настоящего изобретения.
Было установлено, что настоящее изобретение пригодно в частности для использования в офтальмических композициях, а конкретнее в многодозовых офтальмических растворах, которые обычно являются водными, но могут быть и другими. Одним примером комбинации терапевтического агента и сурфактанта для таких композиций является комбинация простагландина (например, травопроста) с этоксилированным и/или гидрогенизированным растительным маслом (например, Полиэтиленгликоля 40 гидрогенизированное касторовое масло). В такой комбинации количество сурфактанта составляет обычно менее примерно 0,4 вес/об.% композиции и количество терапевтического агента составляет обычно менее примерно 0,01 вес/об.% композиции.
Краткое описание чертежей
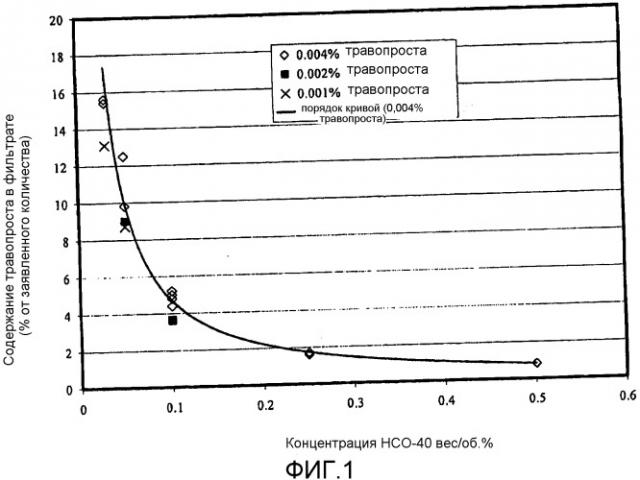
Фиг.1 представляет собой приведенную в качестве примера кривую зависимости количества свободного терапевтического агента от концентрации сурфактанта для взятой в качестве примера офтальмической композиции в соответствии с аспектом настоящего изобретения.
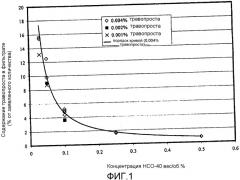
Фиг.2 представляет собой приведенную в качестве примера кривую изменения концентрации простагландинового терапевтического агента на биологической мишени в зависимости от времени.
Фиг.3 представляет собой приведенную в качестве примера кривую изменения концентрации простагландинового терапевтического агента на биологической мишени в зависимости от времени в соответствии с аспектом настоящего изобретения.
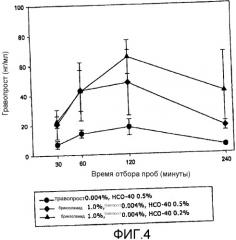
Фиг.4 представляет собой приведенную в качестве примера кривую изменения концентрации простагландинового терапевтического агента на биологической мишени в зависимости от времени в соответствии с аспектом настоящего изобретения.
Фиг.5 представляет собой приведенную в качестве примера кривую изменения концентрации терапевтического агента (а именно ингибитора карбоангидразы) на биологической мишени в зависимости от времени в соответствии с аспектом настоящего изобретения.
Фиг.6 представляет приведенную в качестве примера кривую изменения концентрации терапевтического агента (а именно ингибитора карбоангидразы) на биологической мишени в зависимости от времени в соответствии с аспектом настоящего изобретения.
Подробное описание изобретения
Целью настоящего изобретения является создание фармацевтической композиции, содержащей относительно небольшое количество сурфактанта и обладающей повышенной биодоступностью содержащегося в ней терапевтического агента. Особенно желательной является фармацевтическая композиция в форме раствора, пригодного для местного применения в биологические мишени тела человека, таких как ухо, нос, горло или глаз. В наиболее предпочтительном варианте, фармацевтическая композиция представляет собой водную или другого типа офтальмическую композицию, выполненную в форме раствора. Кроме того, предпочтительно, чтобы этот офтальмический раствор содержал терапевтический агент, пригодный для лечения одного или более глазных или офтальмических заболеваний, таких как аллергии, глаукома, сухость глаз, дегенерация желтого пятна, катаракта, их сочетания или чего-то им подобного. В качестве одного из наиболее предпочтительных примеров терапевтический агент, такой как травопрост, мог бы сочетаться в офтальмической композиции с относительно небольшим количеством сурфактанта для лечения глаукомы.
Если не указано иное, то процентное содержание ингредиентов в фармацевтической композиции настоящего изобретения приводится в весовых-объемных процентах (вес/об.%).
В соответствии с настоящим изобретением комбинация сурфактанта и терапевтического агента может быть использована для повышения биодоступности терапевтического агента в фармацевтической композиции. Такая комбинация сурфактанта и терапевтического агента может быть пригодна для различных фармацевтических композиций, таких как офтальмические, ушные, назальные и дерматологические композиции, но было установлено, что ее применение особенно целесообразно в офтальмических композициях. Примеры композиций включают: офтальмические фармацевтические композиции, такие как композиции местного применения используемые для лечения глаукомы, инфекций, аллергии или воспаления; композиции для обработки контактных линз, такие как, чистящие средства и средства, повышающие комфорт глаз у пациента, носящего контактные линзы; и различные другие типы офтальмических композиций, такие как смазывающие глазные средства, искусственные слезы, вяжущие средства и тому подобное. Композиции могут быть водные или неводные, но обычно они будут водные. Предполагается, что композиции могут представлять собой полностью водные растворы, суспензии или другие формы.
Композиции настоящего изобретения могут содержать различные типы терапевтических агентов. Изобретение может включать в себя неионные, анионные, катионные терапевтические агенты или их комбинации. В соответствии с настоящим изобретением терапевтический агент, обладающий повышенной биодоступностью, будет, как правило, по существу или полностью неионным. Композиции настоящего изобретения могут также включать в себя один или более терапевтических агентов, в тех случаях, когда концентрации сурфактанта не оказывают значительного влияния на биодоступность этих агентов, в то время как биодоступность одного или более других терапевтических агентов оказывается нарушенной. Например, один терапевтический агент из первой группы мог бы быть частью суспензии, в то время как другой терапевтический агент из второй группы может быть в растворе суспензии (например, быть растворенным в водном растворе).
Примеры терапевтических агентов, которые могут содержаться в офтальмических или других композициях настоящего изобретения, включают тимолол (например, тимолола малеат), олопатадин (например, олопатадина гидрохлорид), бринзоламид, тандоспирон, росковитин, непафенак, их комбинации и тому подобное. В соответствии с настоящим изобретением примеры терапевтических агентов, которые могут обладать повышенной биодоступностью, включают без ограничений гипотензивные липиды (например, биматопрост) и глюкокортикоиды (например, преднизолон, дексаметазон и лотепреднол). В соответствии с настоящим изобретением терапевтическими агентами, которые обычно обладают значительно повышенной биодоступностью, являются простагландины (например, латанопрост, травопрост и унопростон).
Предполагается, что используемый в рамках настоящего изобретения термин «простагландин» включает без ограничений природные простагландины, аналоги простагландинов, производные простагландинов или любые их комбинации.
Количество терапевтического агента в фармацевтической композиции будет зависеть от таких факторов как эффективность терапевтического агента в различных концентрациях, совместимость терапевтического агента с другими ингредиентами композиции, способности биологической мишени воспринимать различные количества терапевтического агента, комбинации этих факторов и тому подобного. В общем, фармацевтическая композиция может включать в себя, по меньшей мере, 0,0001% по весу или вес/об.%, по меньшей мере, 0,001% по весу или вес/об.%, или даже, по меньшей мере, 0,01% или 0,1% по весу или вес/об.% или больше терапевтического агента. Также, в общем, фармацевтическая композиция может включать в себя менее чем 90% по весу или вес/об.%, менее чем 40% по весу или вес/об.% и, что наиболее типично, менее чем 10% по весу или вес/об.% или меньше терапевтического агента.
В соответствии с настоящим изобретением терапевтический агент, обладающий желаемой степенью улучшенной биодоступности, обычно представляет собой агент, имеющий относительно низкую растворимость в воде. Поэтому, предполагается, что терапевтический агент фармацевтической композиции, в частности, когда он применяется в водных офтальмических композициях, может обладать растворимостью в воде меньшей, чем 0,1%, как правило, меньшей, чем 0,05%. Кроме того, обычно желательно, чтобы терапевтический агент был неионным, особенно в водных растворах. Также как правило, желательно, чтобы терапевтический агент был растворен в растворе офтальмической или фармацевтической композиции, которая обычно готовится с использованием сурфактанта.
Кроме того, в соответствии с настоящим изобретением терапевтический агент, обладающий желаемой степенью улучшенной биодоступности, обычно является липофильным, (то есть, он лучше растворяется в органической фазе по сравнению с водой или водной фазой). Такой агент обычно имеет относительно высокий коэффициент разделения октанол/вода. Поэтому предполагается, что терапевтический агент фармацевтической композиции, особенно когда он применяется в водных офтальмических композициях, обычно может иметь коэффициент разделения октанол/вода, по меньшей мере, 5 и, как правило, по меньшей мере, 10.
Предполагается, что терапевтический агент может быть частично или по существу полностью одним или несколькими терапевтическими агентами, имеющими вышеуказанную растворимость и/или разделительный компонент. В рамках настоящего изобретения термин «по существу полностью», в случае когда он используется для описания того, что ингредиент(ы) является частью компонента офтальмической композиции, означает, что предполагается, что этот компонент полностью образован из одного или нескольких определенных ингредиентов, или он образован по существу полностью из этих одного или нескольких определенных ингредиентов и только незначительная часть этого компонента (например, менее 5% или 10% по весу) образуется из отличных от этих одного или нескольких определенных ингредиентов.
Какой сурфактант будет входить в состав фармацевтической композиции настоящего изобретения, часто зависит от терапевтического агента и других ингредиентов этой композиции. Предпочтительно, в частности для композиций на водной основе, чтобы сурфактант мог повышать растворимость терапевтического агента и/или, по меньшей мере, способствовать равномерному распределению агента в композиции. Сурфактант также может стимулировать способность терапевтического агента проникать в ткани тела человека (например, в ткань роговицы глаза), тем самым дополнительно повышая биодоступность этого агента.
Количество сурфактанта обычно зависит от применяемого в композиции терапевтического агента. Количество применяемого сурфактанта как правило выбирается так, чтобы повысить биодоступность терапевтического агента. В общем, фармацевтическая композиция может включать в себя, по меньшей мере, 0,001% по весу или вес/об.%, по меньшей мере, 0,01% по весу или вес/об.%, по меньшей мере, 0,05% по весу или вес/об.%, или даже, по меньшей мере, 0,5% или 1,0% по весу или вес/об.% или больше сурфактанта. Также, в общем, фармацевтическая композиция может включать в себя менее чем 30% по весу или вес/об.%, менее чем 5% по весу или вес/об.%, менее чем 2% по весу или вес/об.%, что наиболее типично, и даже возможно менее чем 0,5% или 0,4% по весу или вес/об.%, сурфактанта.
Сурфактант может представлять собой неионный, анионный катионный или амфотерный или цвиттер-ионный сурфактант или комбинацию таких сурфактантов. Крайне предпочтительно, чтобы, по меньшей мере, часть сурфактанта или сурфактант по существу полностью были неионными, чтобы способствовать обеспечению повышенной биодоступности терапевтического агента. В рамках настоящего изобретения словосочетание «сурфактант по существу полностью», означает, что или ингредиент является полностью сурфактантом, или он является полностью сурфактантом за исключением свой незначительной части или оба эти варианта.
Примеры потенциально пригодных сурфактантов включают без ограничений эфиры жирных спиртов и/или алкиловые эфиры полиоксиэтилена, например, макроголовые эфиры, такие как цетомакрогол 1000, полиоксиэтиленовые производные касторового масла, полиоксиэтиленовые эфиры сорбита и жирной кислоты, например, коммерчески доступные ТвиныТМ, полиоксиэтилен стеараты, их комбинации и тому подобное.
В соответствии с настоящим изобретением, сурфактант, который способствует обеспечению желаемой степени биодоступности, состоит обычно из агента, который обладает относительно высоким гидрофильно-липофильным балансом (ГЛБ). Таким образом, предполагается, что сурфактант фармацевтической композиции, в частности офтальмической композиции, имеет значение ГЛБ больше 8, желательно больше 10 и даже по возможности больше 12.
Сурфактант может включать в себя полисорбат 20 (Твин 20)(полиоксиэтилен 20 сорбитан монолаурат), Твин 40, Твин 60, полисорбат 80 (Твин 80), Цвиттергент 312, TEEPOL HB7, SPAN 85, плуроник или полоксамеры, особенно, плуроник L62LF, L101 и L64, F68, L44, L121, F-84 и P-103, PEG1000, и/или TETRONIC 1501, 150R1, 701, 901, 1301 и 130R1, полоксамер 333, полоксамер 334 и полоксамер 335, сорбитанолеат, полисорбат 81, полисорбат 85, полисорбат 120, таурохолат натрия, деокситаурохолат натрия, хенодеоксихолевая кислота, урсодеоксихолевая кислота или их комбинации.
Сурфактант настоящего изобретения предпочтительно является неионным сурфактантом, производным масел из семян, орехов и/или растительных масел. Особенно предпочтительными являются масла из семян, орехов и/или растительные масла, которые были гидрогенизированы и/или этоксилированы. Такие сурфактанты включают, но не ограничиваются этим перечнем, масло бабассу, миндальное масло, кукурузное масло, пальмоядровое масло, касторовое масло, кокосовое масло, хлопковое масло, масло жожоба, льняное масло, горчичное масло, оливковое масло, арахисовое масло, сафлоровое масло, кунжутное масло, соевое масло, подсолнечное масло и масло зародышей пшеницы, их гидрогенизированные или этоксилированные производные или их комбинации. Предпочтительными маслами являются касторовое масло, масло бабассу, миндальное масло, кукурузное масло и пальмоядровое масло, наиболее предпочтительными - касторовое масло и масло бабассу.
Особо предпочтительные сурфактанты включают Полиоксиэтилена (ПОЭ)(40) гидрогенизированное касторовое масло (или Полиэтиленгликоля (ПЭГ)(40) гидрогенизированное касторовое масло)(HCO-40), ПОЭ(60) гидрогенизированное касторовое масло (HCO-60) и ПОЭ(200) гидрогенизированное касторовое масло (HCO-200).
Не вдаваясь в теорию, можно сказать, что считается, что использование больших количеств или более высоких концентраций сурфактанта по отношению к терапевтическому агенту может приводить к тому, что большие количества терапевтического агента абсорбируются мицеллами сурфактанов во время растворения терапевтического агента. В свою очередь, считается, что такая абсорбция может ограничить количество терапевтического агента, легкодоступного для биологической мишени (например, роговицы глаза человека) во время местного применения фармацевтической композиции (например, местного применения офтальмического раствора). Следует иметь в виду, что данная теория не связана с предметом настоящего изобретения, если иное специально не оговорено.
Предполагается, что фармацевтическая композиция настоящего изобретения может включать в себя такое эффективно малое количество сурфактанта, при котором концентрация терапевтического агента, находящегося на биологической мишени, будет существенно выше, чем концентрация терапевтического агента находящегося на той же биологической мишени после раздельного применения контрольной композиции. В рамках настоящего изобретения словосочетание «раздельное применение контрольной композиции» означает применение контрольной композиции к той же биологической мишени другого животного. Например, испытание может быть проведено на двух группах кроликов по десять голов в каждой, при этом композиция настоящего изобретения наносится на глаз каждого кролика в первой группе, в то время как контрольная композиция наносится на глаз каждого кролика во второй группе. В таком варианте осуществления изобретения контрольная композиция является по существу идентичной фармацевтической композиции за исключением того, что концентрация сурфактанта в контрольной композиции, по меньшей мере, в два, более предпочтительно в три и даже, как правило, в четыре раза больше, чем в фармацевтической композиции настоящего изобретения. Кроме того, фармацевтическая композиция настоящего изобретения применяется в количестве эквивалентном тому количеству, в котором применяется контрольная композиция.
Для количественного определения таких концентраций строится график, пример которого показан на фиг.2, отражающий зависимость концентрации на биологической мишени от времени, прошедшего с момента применения фармацевтической композиции. Концентрация на биологической мишени определяется трижды, через определенные интервалы времени. В частности, концентрация определяется через один, два и четыре часа после применения. Затем эти точки наносятся на график. Примеры таких точек 10, 12, 14 показаны на фиг.2. Затем эти точки соединяются отрезками, и площадь под этими отрезками 16 (называемая в настоящем изобретении площадь под кривой концентрация/время) является количественным выражением концентрации. Используя результаты измерения этой площади под кривой, было установлено, что площадь под кривой концентрация/время, определенная для фармацевтической композиции настоящего изобретения, применительно к биологической мишени, составляет, по меньшей мере, 130%, как правило, по меньшей мере, 150% и даже возможно, по меньшей мере, 200% от площади под кривой концентрация/время, определенной для контрольной композиции, применительно к биологической мишени. Один предпочтительный протокол по применению контрольной композиции и фармацевтической композиции, а также измерению концентрации терапевтического агента приводится ниже в разделе примеры.
В качестве примера определения площади под кривой приводится простейшая ситуация, когда концентрации через один, два и четыре часа для композиции настоящего изобретения составляют 20 нанограмм на миллилитр (нг/мл), а концентрации через один, два и четыре часа для контрольной композиции составляют 10 нг/мл. В таком случае площадь под кривой для композиции настоящего изобретения рассчитывается как 20 нг/мл х 3 ч, что равно 60, в то время как площадь под кривой для контрольной композиции составляет 10 нг/мл х 3 ч, что равно 30. В этом варианте площадь под кривой для композиции настоящего изобретения составляет 200% от площади под кривой для контрольной композиции.
Было обнаружено, что на биодоступность некоторых терапевтических агентов оказывает влияние количество сурфактанта, используемого совместно с этими терапевтическими агентами. Это в частности верно в том случае, когда фармацевтическая композиция настоящего изобретения является офтальмической композицией, такой как однодозовая или многодозовая водная офтальмическая композиция. Считается, что класс терапевтических агентов, определенных здесь как простагландины, обладает более высокой степенью биодоступности, когда применяется в сочетании с относительно низкими концентрациями сурфактантов, определенных здесь как сурфактанты растительного масла, масла из семян или орехов, в частности сурфактанты растительного масла. В частности было обнаружено, что травопрост обладает более высокой степенью биодоступности в водной офтальмической композиции настоящего изобретения, когда применяется в сочетании с относительно низкой концентрацией этоксилированного и/или гидрогенизированного сурфактанта растительного масла, такого как Полиоксиэтилена (ПОЭ)(40) гидрогенизированное касторовое масло (или Полиэтиленгликоля (ПЭГ)(40) гидрогенизированное касторовое масло)(HCO-40), ПОЭ(60) гидрогенизированное касторовое масло (HCO-60) и ПОЭ(200) гидрогенизированное касторовое масло (HCO-200) их комбинации и тому подобное. Соответственно предполагается, что сурфактант настоящего изобретения может быть полностью или по существу полностью одним или несколькими этоксилированным и/или гидрогенизированными растительными маслами, такими как Полиоксиэтилена (ПОЭ)(40) гидрогенизированное касторовое масло (или Полиэтиленгликоля (ПЭГ)(40) гидрогенизированное касторовое масло)(HCO-40), ПОЭ(60) гидрогенизированное касторовое масло (HCO-60) и ПОЭ(200) гидрогенизированное касторовое масло (HCO-200) их комбинации и тому подобное, а терапевтический агент может быть полностью или по существу полностью одним или несколькими простагландинами такими как латанопрост, травопрост и унопростон или их комбинацией.
В такой водной офтальмической композиции, содержащей простагландиновый терапевтический агент (например, травопрост) и гидрогенизированный и/или этоксилированный сурфактант растительного масла (например, HCO-40) количество такого терапевтического агента, как правило, составляет, по меньшей мере, 0,00001 вес/об.%, по меньшей мере, 0,0001% вес/об.%, или даже, по меньшей мере, 0,001 вес/об.% композиции. При этом, такая композиция, как правило, содержит менее чем 5 вес/об.%, более типично, менее чем 0,05 вес/об.%, и наиболее типично, менее чем 0,01 вес/об.% такого терапевтического агента. Кроме того, данная композиция, как правило, содержит, по меньшей мере, 0,005 вес/об.%, по меньшей мере, 0,01 вес/об.%, или даже, по меньшей мере, 0,03 вес/об.% такого сурфактанта. Данная композиция также, как правило, содержит менее чем 0,5 вес/об.%, более типично, менее чем 0,4 вес/об.%, даже более типично, менее чем 0,3 вес/об.% и даже возможно менее чем 0,15 вес/об.% такого сурфактанта.
Предполагается, что определение площади под кривой концентрация/время, как оно описано выше, будет проводиться конкретно для таких простагландин/сурфактант комбинаций. Офтальмическая композиция, содержащая простагландиновый терапевтический агент и гидрогенизированный и/или этоксилированный сурфактант растительного масла предпочтительно содержит эффективно низкое количество сурфактанта, при котором площадь под кривой концентрация/время, определенная для офтальмической композиции настоящего изобретения, примененной в отношении водянистой влаги глаза, составляет, по меньшей мере, 130%, как правило, по меньшей мере, 150% и даже возможно, по меньшей мере, 200% от площади под кривой концентрация/время, определенной для контрольной композиции, примененной в отношении водянистой влаги глаза. В таком варианте осуществления изобретения, контрольная композиция является по существу идентичной фармацевтической композиции за исключением того, что концентрация сурфактанта в контрольной композиции, по меньшей мере, в два, более предпочтительно в три и даже, как правило, в четыре раза больше, чем в офтальмической композиции настоящего изобретения. При этом, офтальмическая композиция настоящего изобретения применяется в количестве эквивалентном тому количеству, в котором применяется контрольная композиция. Кроме того, предполагается, что такие концентрации могут так же применятся для радужной оболочки и цилиарного тела.
Как предлагалось ранее, концентрации для композиции настоящего изобретения и контрольной композиции могут быть выбраны, в качестве, по меньшей мере, одного варианта осуществления настоящего изобретения, в соответствии с нижеприведенным протоколом испытаний.
Фармацевтические композиции настоящего изобретения, в частности, когда они являются офтальмическими композициями, как правило, готовятся в форме стерильных водных растворов. Эти композиции также готовятся так, чтобы быть совместимыми с тканями глаза и/или другими тканями, для нанесения на которые эти композиции предназначены. Офтальмические композиции, предназначенные для непосредственного нанесения на глаз, обычно готовятся так, чтобы иметь совместимые с глазом pH и тоничность. Также предполагается, что данные композиции могут быть суспензиями или другими типами растворов. Данные офтальмические композиции, как правило, будут иметь значение pH в диапазоне от 4 до 9, предпочтительно от 5,5 до 8,5 и более предпочтительно от 5,5 до 8,0. Особенно предпочтительно, чтобы значение pH находилось в интервале от 6,0 до 7,8, а именно в интервале от 6,4 до 7,2 или 7,5.
Фармацевтические композиции, в частности офтальмические композиции, настоящего изобретения могут включать в себя полимер или агент, регулирующий вязкость, который дополнительно повышает биодоступность, продляя время удерживания композиции в или на слезной пленке глаза, конъюнктивальном мешке глаза либо других местах глаза или другой биологической мишени. Предпочтительные полимеры включают в себя без ограничений гидроксиэтилцеллюлозу, гидроксипропилметилцеллюлозу, карбомер, карбопол, ксантановую камедь, любую их комбинацию и тому подобное.
В одном варианте осуществления изобретения фармацевтическая композиция настоящего изобретения является водным раствором или другим подобным раствором. Такой раствор, как правило, включает в себя консервирующую систему. В рамках настоящего изобретения термин «консервирующая система» означает один или группу ингредиентов, включенных в состав офтальмического раствора для поддержания в этом растворе антибактериальной активности. Раствор может быть самоконсервирующим раствором, если его ингредиенты сами по себе обладают антибактериальной активностью, и такой раствор еще включает в себя консервирующую систему. Примеры офтальмических растворов или пригодных для таких растворов ингредиентов, могущих пойти на пользу идее настоящего изобретения, раскрыты в патентах США №№ 3931319, 4027020, 4407791, 4525346, 4836986, 5037647, 5300287, 5817277, 6503497, 5741817, 6319464, 6348190, 6482799, 5320843, 5221664, 6034043, 4522806, 6017861 и публикации патентной заявки США 2002/0122831 и заявке PCT WO91/0953 (Dziabo et al.) и JP2003-104870, все эти документы включены в данную заявку путем ссылки полностью. Один конкретный офтальмический раствор, который может пойти на пользу идее настоящего изобретения, раскрыт в заявке на патент США с номером дела патентного поверенного 3464, озаглавленной как «Водные фармацевтические композиции, содержащие борат-полиоловые комплексы», поданной в тот же день, что и заявка на настоящее изобретения и включенной в данную заявку путем ссылки полностью.
Соответственно, консервирующая система фармацевтической композиции настоящего изобретения может включать в себя борат. В рамках настоящего изобретения термин «борат» относится к борной кислоте, солям борной кислоты и другим фарацевтически приемлемым боратам или их комбинациям. Наиболее подходящими являются борная кислота, борат натрия, борат калия, борат кальция, борат магния, борат марганца и другие подобные соли борной кислоты. Борат взаимодействует с многоатомными спиртами (полиолами), такими как глицерин, пропиленгликоль, сорбит и маннит, с образованием борат-полиоловых комплексов. Тип и доля таких комплексов зависят от числа OH-групп многоатомного спирта на соседних атомах углерода, которые не находятся в транс-конфигурации по отношению друг к другу. Следует понимать, что весовой-объемный процент многоатомного спирта и бората в составе композиции включает в себя как количество свободных многоатомного спирта и бората, так и количество этих ингредиентов в составе комплекса.
Когда борат используется в составе композиции настоящего изобретения, то его количество, как правило, составляет более чем примерно 0,001 вес/об.%, обычно более чем примерно 0,01 вес/об.%, и еще более типично более чем примерно 0,07 вес/об.% фармацевтической композиции. Кроме того, когда борат используется в составе композиции настоящего изобретения, то его количество, как правило, составляет менее чем примерно 5 вес/об.%, обычно менее чем примерно 1,2 вес/об.%, и еще более типично менее чем примерно 0,8 вес/об.% фармацевтической композиции.
Консервирующая система фармацевтической композиции может включать в себя один или более многоатомных спиртов. В рамках настоящего изобретения термин «многоатомный спирт» включает в себя любые химические соединения, имеющие по меньшей мере одну гидроксильную группу на каждом из двух соседних атомах углерода, которые не находятся в транс-конфигурации по отношению друг к другу. Многоатомные спирты могут быть линейными или циклическими, замещенными или незамещенными или их смесью, при условии, что получающийся в результате комплекс является водорастворимым и фармацевтически приемлемым. Примеры таких химических соединений включают в себя сахара, сахарные спирты, сахарные кислоты и уроновые кислоты. Предпочтительными многоатомными спиртами являются сахара, сахарные спирты и сахарные кислоты, включая, но, не ограничиваясь, маннит, глицерин, ксилит, сорбит и пропиленгликоль.
Когда многоатомный спирт используется в составе композиции настоящего изобретения, то его количество, как правило, составляет более чем примерно 0,001 вес/об.%, обычно более чем примерно 0,01 вес/об.%, и еще более типично более чем примерно 0,07 вес/об.% фармацевтической композиции. Кроме того, когда многоатомный спирт используется в составе композиции настоящего изобретения, то его количество, как правило, составляет менее чем примерно 5 вес/об.%, обычно менее чем примерно 1,2 вес/об.%, и еще более типично менее чем примерно 0,8 вес/об.% фармацевтической композиции.
Композиции настоящего изобретения могут включать консервант. Возможные консерванты включают в себя без ограничений перекись водорода, хлорсодержащие консерванты, такие как бензалконий хлорид или другие. Однако в предпочтительном аспекте офтальмическая композиция настоящего изобретения по существу не содержит никаких хлорсодержащих консервантов, в частности, по существу не содержит бензалконий хлорид. Крайне предпочтительными для офтальмического использования консервантами являются полимерные соединения четвертичного аммония. Следует отметить, что использование указанных в настоящем изобретении сурфактантов может повысить биодоступность таим образом, что это сможет, по меньшей мере, частично или по существу полностью компенсировать потерю биодоступности, которая может иметь место в тех случаях, когда бензалконий хлорид или другой подобный ингредиент не применяется.
В рамках настоящего изобретения словосочетание «по существу не содержит», когда оно относится к ингредиенту офтальмической композиции, означает, что офтальмический раствор или полностью не содержит определенного ингредиента или содержит только незначительное количество этого ингредиента.
Пригодными для использования в составе композиций настоящего изобретения, являются те полимерные соединения четвертичного аммония, которые обладают антибактериальным действием и являются офтальмич