Новое производное 5-фторурацила
Иллюстрации
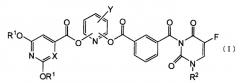
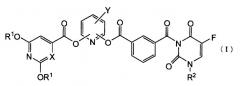
Показать всеИзобретение относится к новым производным 5-фторурацила общей формулы (I) или их фармацевтически приемлемым солям. Соединения обладают противоопухолевым действием, сбалансированным с уровнем токсичности, и могут быть использованы в качестве активного ингредиента для получения лекарственного средства для лечения злокачественных заболеваний. В общей формуле (I):
R1 представляет атом водорода или защитную группу гидроксигруппы, которую выбирают из C1-C6алифатической ацильной группы; C5-C6алициклической ацильной группы; ароматической ацильной группы, которую выбирают из бензоильной группы или галогенбензоильной группы, R2 представляет группу низшего алкоксинизшего алкила; Х представляет СН или атом азота и Y представляет атом галогена. 5 н. и 6 з.п. ф-лы, 4 cх., 4 табл., 24 пр.
Реферат
Область техники, к которой относится изобретение
Перекрестная ссылка на родственные заявки
Настоящая заявка испрашивает приоритет заявки на патент Японии JP № 2009-246400, поданной 27 октября 2009 г., полное содержание которой включено в настоящую заявку путем ссылки.
Настоящее изобретение относится к новому производному 5-фторурацила или его соли и к его применению.
Предшествующий уровень техники
5-Фторурацил (далее в настоящем описании именуемый 5-FU) широко применяется при лечении различных злокачественных заболеваний, главным образом злокачественных заболеваний желудочно-кишечного тракта, отдельно или в комбинации с другими противораковыми средствами. Однако сам 5-FU обладает лишь слабым противоопухолевым эффектом и вызывает различные побочные эффекты, такие как диарея, стоматит и другие, ввиду токсического действия на желудочно-кишечный тракт и миелосуппрессии. Поэтому трудно сказать, что 5-FU всегда легко применять у пациентов со злокачественными заболеваниями. Для разрешения указанных проблем в настоящее время разрабатываются различные перорально вводимые производные 5-FU; однако удовлетворительные клинические эффекты еще не были получены. Возможными причинами этого являются следующие. 5-FU быстро разрушается in vivo дигидропиримидин-дегидрогеназой (далее в настоящем описании именуемой DPD), которая содержится, в частности, в печени и опухолевых тканях; поэтому трудно достичь достаточного противоопухолевого эффекта, соответствующего его дозировке. 5-FU захватывается не только в раковые клетки, но также в нормальные клетки, такие как клетки костного мозга и клетки желудочно-кишечного тракта, и превращается в активные метаболиты действием оротат-фосфорибозил-трансферазой (далее в настоящем описании именуемой OPRT). Такие активные метаболиты вызывают повреждение клеток, т.е. они обладают цитотоксичностью; поэтому их противоопухолевый эффект и побочные эффекты недостаточно сбалансированы.
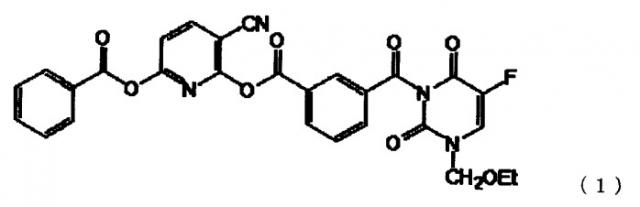
Сообщалось о соединениях, обладающих активностью ингибирования DPD и противоопухолевой активностью, в качестве примеров производных 5-FU (см. патентные ссылки 1-3). Среди них, в патентной ссылке 2, в частности, описывается Соединение (1), показанное ниже, которое представляет собой соединение, в целом известное как Эмитефур (также именуемое BOF-A2). Было проведено клиническое испытание для оценки Эмитефура; однако его разработка была прекращена, поскольку он имеет сильные побочные эффекты.
Как описано выше, еще не были разработаны производные 5-FU, которые могут усилить противоопухолевый эффект путем подавления разрушения 5-FU in vivo и в то же время уменьшить побочные эффекты. Поэтому необходима разработка нового производного 5-FU, имеющего усиленный противоопухолевый эффект и низкую токсичность для улучшения терапевтического эффекта при лечении пациентов со злокачественными заболеваниями.
Как описано выше, не было сообщений о производном, обладающем противоопухолевой активностью в дополнение к активности, ингибирующей DPD, и активности, ингибирующей OPRT, в одном соединении. Поэтому требуется разработка лекарственного средства, которое достигает баланса между эффектами и токсичностью, т.е. обладает сильным противоопухолевым эффектом на злокачественные опухоли у людей и сниженным повреждением желудочно-кишечного тракта, и которое улучшает качество жизни пациентов с онкологическими заболеваниями.
Список ссылок
Патентная литература
1: Не прошедшая экспертизу заявка на патент Японии № S63-201127.
2: Не прошедшая экспертизу заявка на патент Японии № S63-301880.
3: WO87/06582.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Техническая проблема
Целью настоящего изобретения является получение нового антиметаболического противоракового средства, проявляющего сильный противоопухолевый эффект на опухолевые клетки, в то же время уменьшая повреждение желудочно-кишечного тракта, т.е. имеющего сбалансированные эффекты и токсичность, за счет наличия активности, ингибирующей DPD, а также активности, ингибирующей OPRT in vivo.
Решение проблемы
Заявители провели обширные исследования для решения указанной выше проблемы. В результате они обнаружили, что производное 5-фторурацила, представленное ниже формулой (I) (далее в настоящем описании именуемое Соединением (I) по настоящему изобретению) или его солью, имеет (1) активность, ингибирующую DPD, и (2) активность, ингибирующую OPRT, и, в результате, (3) достигает баланса между сильным противоопухолевым эффектом и уменьшенным повреждением желудочно-кишечного тракта, т.е. превосходит известные производные 5-FU с точки зрения баланса между эффектами и токсичностью.
Настоящее изобретение было осуществлено на основании указанных полученных данных.
Конкретнее, настоящее изобретение относится к следующим предметам изобретения.
Пункт 1. Производное 5-фторурацила, представленное ниже формулой (I), или его соль:
где R1 представляет атом водорода или защитную группу гидроксигруппы, R2 представляет группу низшего алкоксинизшего аликила или тетрагидрофуранильную группу, X представляет атом углерода или атом азота и Y представляет атом галогена или цианогруппу.
Пункт 2. Производное 5-фторурацила или его соль по п.1, где группа, представленная следующей формулой в формуле (I), представляет собой:
группу, представленную формулой:
где R1 представляет атом водорода, аллильную группу, или замещенную, или незамещенную бензильную группу,
группу, представленную формулой:
группу, представленную формулой:
где R1 представляет атом водорода, аллильную группу, или замещенную, или незамещенную бензильную группу, или
группу, представленную формулой:
Пункт 3. Производное 5-фторурацила или его соль по п.1 или 2, где R1 представляет атом водорода, аллильную группу, бензильную группу, алифатическую ацильную группу, ароматическую ацильную группу или алициклическую ацильную группу, R2 представляет низшую алкоксиметильную группу, в которой часть низшего алкокси имеет от 1 до 6 атомов углерода или тетрагидрофуранильную группу, X представляет атом углерода или атом азота и Y представляет атом фтора или атом хлора.
Пункт 4. Производное 5-фторурацила или его соль по любому из пп.1-3, где R1 представляет атом водорода, бензильную группу, ацетильную группу, пропионильную группу, изобутирильную группу, пивалоильную группу, бензоильную группу, п-хлорбензоильную или циклопентанкарбонильную группу, R2 представляет низшую алкоксиметильную группу, в которой часть низшего алкокси имеет от 1 до 6 атомов углерода, X представляет атом углерода или атом азота и Y представляет атом фтора или атом хлора.
Пункт 5. Производное 5-фторурацила или его соль по любому из пп.1-4, где R1 представляет атом водорода или ацетильную группу, R2 представляет низшую алкоксиметильную группу, в которой часть низшего алкокси имеет от 1 до 6 атомов углерода, X представляет атом углерода или атом азота и Y представляет атом хлора.
Пункт 6. Производное 5-фторурацила или его соль по любому из пп.1-5, где R1 представляет атом водорода или ацетильную группу, R2 представляет низшую алкоксиметильную группу, в которой часть низшего алкокси имеет от 1 до 6 атомов углерода, X представляет атом углерода и Y представляет атом хлора.
Пункт 7. Производное 5-фторурацила или его соль по любому из пп.1-5, где R1 представляет атом водорода или ацетильную группу, R2 представляет этоксиметильную группу, X представляет атом углерода и Y представляет атом хлора.
Пункт 8. Лекарственное средство, содержащее производное 5-фторурацила или его соль по любому из пп.1-7 в качестве активного ингредиента.
Пункт 9. Противоопухолевое средство, содержащее производное 5-фторурацила или его соль по любому из пп.1-7 в качестве активного ингредиента.
Пункт 10. Противоопухолевое средство по п.9, где противоопухолевое средство применяется для лечения, по меньшей мере, одного злокачественного заболевания, выбранного из группы, состоящей из злокачественных опухолей головы и шеи, злокачественных опухолей пищевода, злокачественных опухолей желудка, злокачественных опухолей ободочной кишки, злокачественных опухолей прямой кишки, злокачественных опухолей печени, злокачественных опухолей желчного пузыря и желчных протоков, злокачественных опухолей желчевыводящих путей, злокачественных опухолей поджелудочной железы, злокачественных опухолей легких, злокачественных опухолей молочных желез, злокачественных опухолей яичников, злокачественных опухолей шейки матки, злокачественных опухолей эндометрия, злокачественных опухолей почек, злокачественных опухолей мочевого пузыря, злокачественных опухолей предстательной железы, злокачественных опухолей семенников, саркомы костей и мягких тканей, лейкоза, злокачественных лимфом, множественных миелом, злокачественных заболеваний кожи, опухолей головного мозга и мезотелиом.
Пункт 11. Способ лечения злокачественного заболевания, включающий введение эффективного количества производного 5-фторурацила или его соли по любому из пп.1-7 пациенту, страдающему злокачественным заболеванием.
Пункт 12. Применение производного 5-фторурацила или его соли по любому из пп.1-7 при получении противоопухолевого средства.
Преимущественные эффекты изобретения
Соединение (I) по настоящему изобретению или его соль проявляет превосходные противоопухолевые эффекты при уменьшенных побочных эффектах, таких как повреждение желудочно-кишечного тракта; поэтому оно может применяться в качестве противоопухолевого средства.
Примеры заболеваний, которые можно лечить введением лекарственного средства, содержащего соединение по настоящему изобретению, включают злокачественные опухоли головы и шеи, пищевода, желудка, ободочной кишки, прямой кишки, печени, желчного пузыря и желчных протоков, желчевыводящих путей, поджелудочной железы, легких, молочных желез, яичников, шейки матки, эндометрия, почек, мочевого пузыря, предстательной железы, семенников, саркомы костей и мягких тканей, лейкоза, злокачественных лимфом, множественных миелом, злокачественных поражений кожи, опухолей мозга и мезотелиом.
Описание вариантов осуществления изобретения
Настоящее изобретение относится к производному 5-фторурацила, представленному ниже формулой (I), или его соли:
где R1 представляет атом водорода или защитную группу гидроксигруппы, R2 представляет низшую алкоксинизшую алкильную группу или тетрагидрофуранильную группу, X представляет атом углерода или атом азота и Y представляет атом галогена или цианогруппу.
В настоящем изобретении производное 5-фторурацила, представленное выше формулой (I), или его соль, включает их таутомеры.
Конкретнее, настоящее изобретение включает производное 5-фторурацила, представленное выше формулой (I), или его соль, где группа, представленная следующей формулой:
представляет собой группу, представленную формулой:
где R1 представляет атом водорода или защитную группу гидроксигруппы;
группу, представленную формулой:
группу, представленную формулой:
где R1 представляет атом водорода или защитную группу гидрокси группы; или
группу, представленную формулой:
Определенными примерами групп, представленных формулой (I), являются следующие.
В формуле (I) R1 представляет атом водорода или защитную группу гидрокси группы.
Защитная группа гидроксигруппы, представленная R1, может представлять собой любую защитную группу, пока она может расщепляться химической процедурой, такой как гидрогенолиз, гидролиз, электролиз и фотолиз, такой как гидролиз, осуществляемый в организме человека. Ее определенные примеры включают ацильные группы, такие как замещенные или незамещенные алифатические ацильные группы, и замещенные или незамещенные ароматические ацильные группы или алициклические ацильные группы; низшие алкоксикарбонильные группы; низшие алкоксикарбамоильные группы; замещенные или незамещенные низшие алкильные группы; низшие алкенильные группы; замещенные или незамещенные алкенильные группы; силильные защитные группы; и аминокислотные остатки.
Примеры алифатических ацильных групп включают формильную группу, ацетильную группу, пропионильную группу, бутирильную группу, изобутирильную группу, пентаноильную группу, изовалерильную группу, пивалоильную группу, гексаноильную группу и тому подобные C1-6 линейные или разветвленные ацильные группы. Примеры ароматических ацильных групп включают бензоильную группу, α-нафтоильную группу и β-нафтоильную группу. Эти группы могут иметь от 1 до 3 заместителей, выбранных из низшей алкильной группы, низшей алкоксигруппы, атома галогена, нитрогруппы, карбоксигруппы и тому подобных.
Примеры алициклических ацильных групп включают циклобутанкарбонильную группу, циклопентанкарбонильную группу, циклогексанкарбонильную группу и тому подобные C3-6 циклоалкилкарбонильные группы.
Примеры низших алкоксикарбонильных групп включают метоксикарбонильную группу, этоксикарбонильную группу, н-пропоксикарбонильную группу, изопропоксикарбонильную группу, н-бутоксикарбонильную группу, изобутоксикарбонильную группу, втор-бутоксикарбонильную группу, трет-бутоксикарбонильную группу, пентилоксикарбонильную группу, гексилоксикарбонильную группу и тому подобные C2-7 линейные или разветвленные алкоксикарбонильные группы.
Примеры низших алкилкарбамоильных групп включают метилкарбамоильную группу, этилкарбамоильную группу, пропилкарбамоильную группу, бутилкарбамоильную группу, пентилкарбамоильную группу, гексилкарбамоильную группу, диметилкарбамоильную группу, диэтилкарбамоильную группу и подобные карбамоильные группы, моно- или дизамещенные C1-6 низшей алкильной группой.
Примеры низших алкильных групп включают метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу, н-пентильную группу, изопентильную группу, н-гексильную группу, изогексильную группу и тому подобные C1-6 линейные или разветвленные алкильные группы. Эти группы могут иметь от 1 до 3 заместителей, таких как атом галогена и низшая алкоксигруппа. Их определенные примеры также включают хлорметильную группу, метоксиметильную группу, этоксиметильную группу, метоксиэтильную группу, этоксиэтильную группу и подобные замещенные алкильные группы.
Примеры низших алкенильных групп включают этенильную группу, аллильную группу, бутенильную группу, бутадиенильную группу, гексатриенильную группу и подобные C2-6 линейные или разветвленные алкенильные группы.
Примеры арилалкильных групп включают бензильную группу, бензгидрильную группу и тритильную группу. Эти группы могут иметь от 1 до 5 или предпочтительно от 1 до 3 заместителей, таких как низшая алкильная группа, низшая алкоксигруппа, атом галогена и нитрогруппа.
Примеры силильных защитных групп включают триметилсилильную группу, трет-бутилдиметилсилильную группу, метилдиизопропилсилильную группу, триизопропилсилильную группу, тетраизопропилдисилоксильную группу (TIPDS) и дифенилметилсилильную группу.
Примеры аминокислотных остатков включают те, которые образованы удалением гидроксигруппы из карбоксигруппы аминокислоты. Определенные примеры подходящих для использования аминокислот включают глицин, аланин, β-аланин, валин и изолейцин; и могут использоваться любые аминокислотные остатки, описанные в не прошедшей экспертизу заявке на патент Японии № H1-104093.
Примеры низших алкильных групп, которые могут использоваться в качестве заместителя, включают те, которые перечислены выше.
Примеры низших алкоксигрупп включают метоксигруппу, этоксигруппу, н-пропоксигруппу, изопропилоксигруппу, н-бутилоксигруппу, изобутоксигруппу, втор-бутоксигруппу, трет-бутоксигруппу, н-пентилоксигруппу, н-гексилоксигруппу и тому подобные C1-6 линейные или разветвленные алкоксигруппы.
Примеры атомов галогена включают атом фтора, атом хлора, атом брома и атом йода.
R2 представляет низшую алкоксинизшую алкильную группу или тетрагидрофуранильную группу.
В формуле (I) примеры «низшей алкокси» части в «низшей алкоксинизшей алкильной группе», представленной R2, включают метоксигруппу, этоксигруппу, н-пропоксигруппу, изопропилоксигруппу, н-бутилоксигруппу, втор-бутилоксигруппу, трет-бутилоксигруппу, н-пентилоксигруппу, н-гексилоксигруппу и тому подобные C1-6 линейные или разветвленные алкоксигруппы. Примеры низших алкокси частей включают предпочтительно C1-3 алкоксигруппу, предпочтительнее, метоксигруппу и этоксигруппу и еще предпочтительнее этоксигруппу. Примеры «низшей алкильной группы» в «группе низшего алкоксинизшего алкила» включают метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу, н-пентильную группу, изопентильную группу, н-гексильную группу, изогексильную группу и подобные C1-6 линейные или разветвленные алкильные группы. Примеры низших алкильных частей включают предпочтительно C1-3 алкильную группу, предпочтительнее метильную группу и этильную группу, а еще предпочтительнее метильную группу.
Примеры «низших алкоксинизших алкильных групп» включают указанные выше низшие алкильные группы, имеющие «низкие алкоксичасти», описанные выше. Их определенные примеры включают алкоксиалкильные группы, такие как метоксиметильная группа, этоксиметильная группа, пропоксиметильная группа, метоксиэтильная группа, этоксиэтильная группа, пропоксиэтильная группа, 3-метоксипропильная группа, 4-этоксибутильная группа, 6-пропоксигексильная группа, 5-изопропоксипентильная группа, 1,1-диметил-2-бутоксиэтильная группа, 2-метил-3-трет-бутоксипропильная группа, 2-пентилоксиэтильная группа и 2-гексилоксиэтильная группа. Низшая алкоксинизшая алкильная группа представляет собой предпочтительно метоксиметильную группу, этоксиметильную группу или пропоксиметильную группу, а предпочтительнее этоксиметильную группу.
Примеры тетрагидрофуранильных групп включают 2-тетрагидрофуранильную группу и 3-тетрагидрофуранильную группу. Среди них предпочтительной является 2-тетрагидрофуранильная группа.
X представляет атом углерода или атом азота.
Y представляет атом галогена или цианогруппу. В формуле (I) примеры атомов галогенов, представленных Y, включают атом фтора, атом хлора, атом брома и атом йода.
Примеры групп в особенно предпочтительном варианте осуществления описаны ниже.
Предпочтительно, R1 представляет собой атом водорода, аллильную группу, бензильную группу, алифатическую ацильную группу, ароматическую ацильную группу или алициклическую ацильную группу, предпочтительнее атом водорода, бензильную группу, ацетильную группу, пропионильную группу, изобутирильную группу, пивалоильную группу, бензоильную группу, п-хлорбензоильную группу или циклопентанкарбонильную группу, а еще предпочтительнее атом водорода или ацетильную группу.
Предпочтительно, R2 представляет собой низшую алкоксиметильную группу, в которой низшая алкоксичасть имеет от 1 до 6 атомов углерода или 2-тетрагидрофуранильную группу, предпочтительнее низшую алкоксиметильную группу, в которой низшая алкоксичасть имеет от 1 до 6 атомов углерода, а еще предпочтительнее этоксиметильную группу.
Предпочтительно, X представляет собой атом углерода.
Предпочтительно, Y представляет собой атом фтора или атом хлора, а предпочтительнее атом хлора.
Предпочтительные варианты осуществления R1, R2, X и Y могут использоваться в любой комбинации.
Производное 5-фторурацила, представленное формулой (I) по настоящему изобретению, включает стереоизомеры, оптические изомеры, сольваты, такие как гидраты, и кристаллические полиморфизмы.
Производное 5-фторурацила, представленное формулой (I) по настоящему изобретению, может представлять собой соль. По существу, предпочтительна фармацевтически приемлемая соль. Ее примеры включают соли с неорганическими кислотами и соли с органическими кислотами.
Их определенные примеры включают соли с неорганическими кислотами, такими как хлористоводородная кислота, серная кислота, бромистоводородная кислота, йодистоводородная кислота, азотная кислота и фосфорная кислота.
Их определенные примеры включают соли с органическими кислотами, такими как муравьиная кислота, уксусная кислота, пропионовая кислота, малоновая кислота, янтарная кислота, глутаровая кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота, лимонная кислота, винная кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота и метансульфоновая кислота.
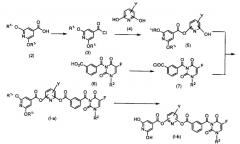
Соединение по настоящему изобретению может быть получено различными способами, и примером такого способа является тот, который иллюстрируется схемой, показанной ниже. Материалы, необходимые для синтеза соединения по настоящему изобретению, могут быть легко получены из коммерчески доступных продуктов или в соответствии со способом получения, описанным в статье, или тому подобным. Заместители в формуле (I) такие же, как заместители, определенные выше.
Схема 1
где R1' представляет аллильную группу, или замещенную, или незамещенную бензильную группу, R2 представляет низшую алкоксинизшую алкильную группу или тетрагидрофуранильную группу и Y представляет атом галогена или циано группу.
Синтез производного изоникотиновой кислоты (2)
Натриевую или калиевую соль аллилалкоголя, бензилового спирта или замещенного бензилового спирта растворяют в растворителе, который не воздействует на реакцию, таком как тетрагидрофуран, толуол и диметилформамид, и предпочтительно диметилформамид. Натриевую соль 2,6-дихлоризоникотиновой кислоты добавляют к полученному раствору при комнатной температуре. Полученную смесь перемешивают при 60-100ºC в течение 2-24 часов. Смеси дают возможность вступить в реакцию, предпочтительно при 80ºC в течение 4 часов. В данном случае от 2 до 10 эквивалентов, а предпочтительно 4 эквивалента количества алкоголята используют к натриевой соли 2,6-дихлоризоникотиновой кислоты. После завершения реакции к продукту реакции добавляют воду и водный слой отделяют с использованием этилацетата или подобного растворителя; pH водного слоя доводят до 5-6, используя 1N хлористоводородную кислоту или уксусную кислоту. Полученный в результате продукт подвергают экстракции с использованием этилацетата, смешанного растворителя из этилацетата и н-гексана, толуола или тому подобных. Экстракт сушат над сульфатом натрия, сульфатом магния и т.д. и затем концентрируют для получения производного изоникотиновой кислоты аллилокси, бензилокси или замещенного бензилокси (2) (в настоящем описании производное изоникотиновой кислоты аллилокси, бензилокси или замещенного бензилокси (2) может именоваться производным изоникотиновой кислоты (2)).
Стадия 1. Синтез производного изоникотиновой кислоты-хлорангидрида (3)
Производное изоникотиновой кислоты (2), полученное выше, растворяют в растворителе, который не воздействует на реакцию, такой как хлороформ, 1,2-дихлорэтан и толуол и предпочтительно толуол. Затем к полученному таким образом раствору по каплям добавляют тионилхлорид при комнатной температуре. Используемое количество тионилхлорида составляет от 1 до 10 эквивалентов и предпочтительно 5 эквивалентов относительно раствора. После завершения добавления по каплям полученную смесь перемешивают при кипячении в сосуде с обратным холодильником в течение 2-8 часов, а предпочтительно в течение 4 часов. После завершения реакции смесь концентрируют и остаток используют на следующей стадии без дополнительной обработки.
Синтез производного пиридина (4)
Производное пиридина (4) может быть получено способом, описанным в не прошедшей экспертизу заявке на патент Японии № H05-80451, в публикации Heterocycles, Vol. 36, No. 1, 145-148, 1993, и т.д.
Эти производные пиридина (4) присутствуют в виде таутомеров гидроксипиридиновой структуры и структуры 2(1H)-пиридона.
Стадия 2. Синтез вещества, связанного со сложным эфиром (5)
Производное пиридина (4), полученное выше, растворяют в соли органического амина, такой как триэтиламин, диизопропилэтиламин и диметиланилин, предпочтительно смеси триэтиламина с растворителем, который не воздействует на реакцию, таким как дихлорметан, ацетонитрил, диметилформамид, диметилацетамид и предпочтительно смесь триэтиламина с диметилацетамидом. Раствор диметилацетамида (3), полученный на стадии 1, по каплям добавляют к полученному веществу при охлаждении льдом. В данном случае используют от 1,0 до 1,2 эквивалентов производного изоникотиновой кислоты-хлорангидрида (3) и от 1,0 до 1,2 эквивалентов соли органического амина на производное пиридина (4). После предоставления возможности смеси прореагировать при комнатной температуре в течение 1-4 часов к смеси добавляют воду с последующей экстракцией с использованием этилацетата, смешанного растворителя этилацетата и н-гексана, толуола или тому подобных. Экстракт сушат над сульфатом натрия, сульфатом магния или тому подобными веществами, концентрируют до перекристаллизации, очищают колоночной хроматографией и затем доставляют на следующую стадию.
Синтез моноамида изофталевой кислоты 5-фторурацила (6)
Моноамид изофталевой кислоты 5-фторурацила (6) может быть получен способом, описанным в не прошедшей экспертизу заявке на патент Японии № H02-164871.
Стадия 3. Синтез моноамида изофтелевой кислоты 5-фторурацила-хлорангидрида (7)
Моноамид изофталевой кислоты 5-фторурацила (6) растворяют в растворителе, который не воздействует на реакцию, таком как дихлорметан, хлороформ, 1,2-дихлорэтан и толуол, и предпочтительно дихлорметан. К полученному раствору по каплям добавляют тионилхлорид при комнатной температуре. Количество тионилхлорида составляет от 1 до 4 эквивалентов и предпочтительно 1,2 эквивалента относительно раствора. После завершения добавления по каплям полученную смесь перемешивают в условиях кипячения в сосуде с обратным холодильником в течение 2-8 часов и предпочтительно 4 часов. После завершения реакции смесь концентрируют и остаток подают на следующую стадию без дополнительной обработки.
Стадия 4. Синтез соединения по настоящему изобретению (I-a)
Связанное со сложным эфиром вещество (5), полученное на стадии 2, растворяют в соли органического амина, такой как триэтиламин, диизопропилэтиламин и диметиланилин и предпочтительно триэтиламин, и растворителе, который не воздействует на реакцию, таком как дихлорметан, ацетонитрил и диметилформамид. К полученному таким образом раствору добавляют по каплям раствор дихлорметана моноамида изофталевой кислоты 5-фторурацила-хлорангидрида (7), полученный на стадии 3 в условиях охлаждения льдом. В данном случае используют от 1,0 до 1,2 эквивалента моноамида изофталевой кислоты 5-фторурацила-хлорангидрида (7) и от 1,0 до 1,2 эквивалента соли органического амина относительно связанного со сложным эфиром вещества (5). После предоставления смеси возможности прореагировать при комнатной температуре в течение 1-4 часов к продукту реакции добавляют воду с последующей экстракцией с использованием дихлорметана или подобного соединения. Экстракт сушат над сульфатом натрия, сульфатом магния или тому подобным веществом, концентрируют до перекристаллизации, очищают колоночной хороматографией и затем доставляют на следующую стадию.
Стадия 5. Синтез соединения по настоящему изобретению (I-b)
Снятие защиты выполняют в соответствии со способом, описанным в руководстве Green «Protective Group in Organic Synthesis» («Защитная группа в органическом синтезе»).
Схема 2
где группы R1', R2 и Y такие же, как определено выше.
Стадия 6. Синтез моноамида-моноэфира изофталевой кислоты (8)
Производное пиридина (4-TMS), которое было триметилсилилировано (TMS) в соответствии со способом, описанным в публикации Chem. Pharm. Bull. Vol. 41, No. 9, 1498-1506, 1993, растворяют в растворителе, который не воздействует на реакцию, таком как дихлорметан, ацетонитрил и диметилформамид и предпочтительно ацетонитрил. К полученному таким образом раствору добавляют по каплям раствор моноамида изофталевой кислоты 5-фторурацила-хлорангидрида (7) в условиях охлаждения льдом. В последующем к нему по каплям добавляют кислоту Льюиса, такую как хлорид четырехвалентного олова и тетрахлорид титана. В данном случае используют от 0,8 до 1,0 эквивалента моноамида изофталевой кислоты 5-фторурацила-хлорангидрида (7) и количество кислоты Льюиса относительно производного пиридина (4-TMS). После предоставления возможности смеси прореагировать при комнатной температуре в течение 1-4 часов к реакционной жидкости добавляют воду с последующей экстракцией с использованием дихлорметана или тому подобного соединения. Экстракт сушат над сульфатом натрия, сульфатом магния или тому подобным веществом, концентрируют до перекристаллизации, очищают колоночной хроматографией и затем доставляют на следующую стадию.
Стадия 7. Синтез соединения по настоящему изобретению (I-a)
Моноамид-моноэфир изофталевой кислоты (8) растворяют в смеси соли органического амина, такого как триэтиламин, диизопропилэтиламин и диметиланилин, предпочтительно триэтиламин, и растворителе, который не воздействует на реакцию, таком как дихлорметан, ацетонитрил и диметилформамид и предпочтительно дихлорметан. К полученной смеси по каплям добавляют раствор в дихлорметане производного изоникотиновой кислоты-хлорангидрида (3). В данном случае используют от 1,0 до 1,2 эквивалента производного изоникотиновой кислоты-хлорангидрида (3) и от 1,0 до 1,2 эквивалента соли органического амина относительно моноамида-моноэфира изофталевой кислоты (8). После представления возможности смеси прореагировать при комнатной температуре в течение 1-4 часов к реакционной жидкости добавляют воду с последующей экстракцией с использованием дихлорметана или тому подобного соединения. Экстракт сушат над сульфатом натрия, сульфатом магния или тому подобным веществом, концентрируют до перекристаллизации, очищают колоночной хроматографией и затем доставляют на стадию 5, показанную на схеме 1.
Схема 3
где R2 и Y представляют собой, как определено выше.
Синтез оротовой кислоты-хлорангидрида (9)
Тионилхлорид по каплям добавляют к оротовой кислоте при комнатной температуре вместе с растворителем, который не воздействует на реакцию, таким как хлороформ, 1,2-дихлорэтан и толуол, или без растворителя. В данном случае используют от 1 до 5 эквивалентов, предпочтительно 4 эквивалента относительно оротовой кислоты. После завершения добавления по каплям полученную смесь перемешивают в условиях кипячения в сосуде с обратным холодильником в течение 2-8 часов и предпочтительно в течение 4 часов. После завершения реакции, смесь концентрируют и остаток доставляют на следующую стадию без дополнительной обработки.
Стадия 8. Синтез соединения по настоящему изобретению (I-c)
Моноамид-моноэфир изофталевой кислоты (8) растворяют в смешанной жидкости из соли органического амина, такой как триэтиламин, диизопропилэтиламин и диметиланилин, предпочтительно триэтиламин, с растворителем, который не воздействует на реакцию, таким как дихлорметан, ацетонитрил и диметилформамид, и предпочтительно в смешанной жидкости триэтиламина с дихлорметаном. Раствор в дихлорметане оротовой кислоты-хлорангидрида (9) по каплям добавляют к полученному раствору при охлаждением льдом. В данном случае используют от 1,0 до 1,2 эквивалента оротовой кислоты-хлорангидрида (9) и от 1,0 до 1,2 эквивалента соли органического амина относительно моноамида-моноэфира изофталевой кислоты (8). После предоставления смеси возможности прореагировать при комнатной температуре в течение 1-4 часов к продукту реакции добавляют воду с последующей экстракцией с использованием дихлорметана или подобного соединения. Экстракт сушат над сульфатом натрия, сульфатом магния или подобным веществом, концентрируют до перекристаллизации и затем очищают колоночной хроматографией.
Схема 4
где X представляет атом углерода или атом азота, R3 представляет защитную группу гидроксигруппы, и R2 и Y являются такими же, как определено выше.
Стадия 9. Синтез соединения по настоящему изобретению (I-e), где R 1 представляет собой защитную группу гидроксигруппы
Производное пиридина (I-d), полученное по схемам 2 и 3, и хлорангидрид, представленный формулой R3-Cl, растворяют в растворителе, который не воздействует на реакцию, таком как диметоксиэтан, дихлорметан, ацетонитрил, диметилформамид и диметилацетамид и предпочтительно диметоксиэтан. К полученному раствору добавляют соль органического амина, такую как пиридин, триэтиламин, диизопропилэтиламин и диметиланилин, при охлаждении льдом. В данном случае используют от 2,2 до 4,0 эквивалентов хлорангидрида и от 2,2 до 4,0 эквивалентов соли органического амина относительно производного пиридина (I-d). После предоставления смеси возможности прореагировать в условиях охлаждения льдом в течение 0,5-4 часов, к реакционной жидкости добавляют воду с последующей экстракцией с использованием этилацетата, смешанного растворителя этилацетата и н-гексана, толуола или тому подобного соединения. Экстракт сушат над сульфатом натрия, сульфатом магния и т.д., концентрируют до перекристаллизации и затем очищают колоночной хроматографией и т.д.
Как описано выше, соединение (I) по настоящему изобретению и его соли проявляют превосходный противоопухолевый эффект при уменьшенных побочных эффектах, таких как повреждение желудочно-кишечного тракта; поэтому они могут применяться в качестве противоопухолевого средства. Соответственно, соединение (I) по настоящему изобретению и его соли эффективны при лечении злокачественных заболеваний. В настоящем изобретении способы лечения злокачественных заболеваний включают введение соединения (I) по настоящему изобретению или его соли для предотвращения рецидива злокачественного заболевания после его лечения лучевой терапией, хирургической операции и т.д.
Когда соединение (I) по настоящему изобретению или его соль применяется для лечения указанных выше заболеваний млекопитающих, включая людей, дозировка, число введений и тому подобные параметры должны варьироваться в зависимости от условий и тяжести подлежащего лечению заболевания и пути введения соединения (I) по настоящему изобретению. Дозировка, число введений и тому подобные параметры также варьируются в зависимости от возраста, массы тела, общего состояния здоровья, пола, рациона, времени введения, скорости выведения, сопутствующей медикаментозной терапии, реакции на лечение и тому подобных показателей. Соединение (I) по настоящему изобретению и его соли вводятся обычно перорально или парентерально. Дозировка в целом представляет собой терапевтически эффективное количество для лечения указанных выше заболеваний, т.е. от примерно 0,001 д