Антитела и содержащие их фармацевтические композиции, подходящие для ингибирования активности металлопротеинов
Иллюстрации
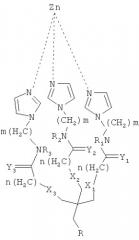
Показать всеНастоящее изобретение относится к соединению, имеющему общую формулу (I):
где m и n являются независимо целыми числами от 1 до 6; каждый из X1-X3 и Y1-Y3 является О; R1-R3 каждый независимо выбирают из группы, состоящей из водорода или алкила; и R является O-(CH2)x-C(=O)NR'-(CH2)y-NHR', причем: x и y каждый являются независимо целыми числами от 1 до 6; и R' выбирают из группы, состоящей из водорода и алкила. Также предложены антитело, содержащее область распознавания антигена, использование соединения, фармацевтическая композиция, применение антитела, способ ингибирования активности ММП-2 или ММП-9 в пробе и композиция для определения ММП-2 или ММП-9. Изобретение позволяет получить соединения, способные ингибировать активность ММП-2 и ММП-9. 7 н. и 4 з.п. ф-лы, 16 ил., 4 табл., 11 пр.
Реферат
ОБЛАСТЬ И УРОВЕНЬ ТЕХНИКИ
Настоящее изобретение относится к молекулам гаптена и антителам, направленным против них, которые могут быть использованы для ингибирования активности металлопротеинов, таких как металлопротеазы, а также к способам, в которых используются эти антитела для лечения таких заболеваний, как метастазирующий рак, которые связаны с аномальной активностью металлопротеина.
Матриксные металлопротеины (ММП) являются основными ферментами, участвующими в ремоделировании внеклеточного матрикса (ВКМ). Эти ферменты способны разрушать различные компоненты соединительной ткани суставного хряща или базальных мембран.
Семейство генов ММП человека состоит по меньшей мере из 28 структурно родственных белков (см. ФИГ.1), которые имеют сходную общую сферическую топологию (ФИГ.2 и Боркакоти, 1998). Каждый ММП секретируется как неактивный латентный профермент. Домен каталитического цинка состоит приблизительно из 180 аминокислот, где высоко консервативная последовательность HE-GH-LGL-H дает три гистидиновых (т.е., Н) остатков, которые связаны с ионом металлического цинка Zn(2+). Четвертый участок связывания иона каталитического цинка в проферменте связан с цистеиновым остатком (Моргунова и др., 1999), на котором ферментная активация отсоединяется от активного участка (Ван-Варт и Биркедаль-Хансен, 1990). В результате этого, четвертый участок связывания в активированном ММП занимает молекула воды, которая также имеет водородную связь с консервативным глутаминовым остатком. Этот процесс облегчает гидролиз пептидной связи целевого субстрата с активированной молекулой воды.
Неконтролируемое разрушение соединительной ткани металлопротеазами является признаком многих патологических состояний, вероятно являющихся результатом чрезмерной активности ММП или несбалансированного соотношения между естественными тканевыми ингибиторами ММП (ТИМП) и ММП. ТИМП ингибируют ММП путем формирования стехиометрических комплексов с активным участком связывания цинка (Гомес и др, 1997; Генриет и др., 1999; Боде и др., 1999; Уилл и др., 1996). Когда уровни ТИМП недостаточны, прогрессирующая медленная деградация ВКМ может приводить к потере матрикса хрящевой ткани при ревматоидном артрите (Валаковиц и др., Arthritis Rheum, 35:35-42, 1992) и остеоартрите (Дин и др., J. Clin. Invest. 84:678-685, 1989) или деградации матрикса костной ткани при остеопорозе (Хилл и др., Biochem. J. 308:167-175, 1995). В других ситуациях, таких как застойная сердечная недостаточность, может происходить быстрая деградация ВКМ сердца (Армстронг и др., Canadian J. Cardiol. 10:214-220, 1994).
Кроме того, как известно, ММП играют некоторую роль в мейозе цитокинов и хемокинов, таких как галестин-3 (Очиенг Дж., Biochemistry, 1994 33(47):14109-14), плазминоген (Паттерсон, Б.К., JBC, 1997 272(46):28823-5), интерлейкина-8, активирующего соединительную ткань пептида III, тромбоцитарного фактора-4 (Ван ден Стеен, 2000 Blood. 2000 Oct 15; 96(8):2673-81.), проинтерлейкина-1β (Шенбек, 1998), цепи α рецептора интерлейкина-2 [Шю, Б.К., Хсю, С.М., Хо, X., Лиен, Х.К., Хуанг, С.К., Лин, Р.Х. «Новая роль металлопротеиназы в опосредованном раком подавлении иммунного ответа», Cancer Research (2001) 61, 237-242] и протрансформирующего фактора-β роста [TGF-β, Ю, К., Стаменкович, И. «Локализованная на поверхности клеток матриксная металлопротеиназа-9 протеолитически активирует TGF-beta и способствует инвазии и ангиогенезу опухоли», Genes Dev (2000) 14, 163-176].
Другие патологические состояния, которые также связаны с нерегулируемой активностью ММП, включают быстрое ремоделирование ВКМ метастатическими опухолевыми клетками. В таких состояниях активируемые ММП или выражены раковыми клетками или окружающими тканями. Существует достаточно доказательств того, что ММП вовлечены в рост и распространение опухолей (см., например, Дэвидсон и др., Chemistry & Industry, 258-261, 1997, и указанные в статье справочные материалы). В процессе метастазирования опухоли ММП используются для разрушения ВКМ, что позволяет раковым клеткам первичной опухоли вторгаться в соседние кровеносные сосуды, откуда они транспортируются в различные органы и создают вторичные опухоли. Инвазивный рост в этих вторичных местах опосредован ММП, которая разрушает ткань. Кроме того, активность ММП способствует инвазивному росту новых кровеносных сосудов, также называемому ангиогенезом, вследствие которого опухоли вырастают больше определенного размера. Было продемонстрировано, что среди членов семейства ММП секретированная ММП-9 человека, также известная как гелатиназа В, играет главные роли не только в катаболизме внеклеточного матрикса (ВКМ), но и в обработке белковых веществ, которые релевантны для неврологических заболеваний, таких как рассеянный склероз (PC) (Опденаккер, 2003). Недавние исследования показали, что ММП-9 играет критическую роль в содействии аутоиммунным заболеваниям путем расщепления предварительно обработанного коллагена типа II (Ван ден Стеен, 2004). Продуктами являются фрагменты коллагена типа II, которые являются оставшимися эпитопами, которые, как считается, генерируют аутоиммунные заболевания.
Учитывая большую роль ММП в физиологии и патологии человека, неудивительно, что делаются многочисленные попытки создать лекарства, которые ингибируют чрезмерную активность ММП.
Попытки разработки лекарств фокусируются на тех классах ингибиторов, которые содержат функциональную группу, координирующую ион цинка и этим деактивирующую целевую ММП. Одним таким классом ингибиторов являются гидроксаматные ингибиторы, небольшие пептидные аналоги фибриллярных коллагенов, которые специфически взаимодействуют двунаправленным образом через гидроксильный и карбонильный кислород гидроксамовой группы с ионом цинка в каталитическом сайте [Грамс и др., (1995), Biochem. 34:14012-14020; Боде и др., (1994), EMBO J., 13:1263-1269].
Ингибиторы ММП на основе гидроксамата обычно состоят или из углеродного остова (WO 95/29892, WO 97/24117, WO 97/49679 и ЕР 0780386), пептидильного остова (WO 90/05719, WO 93/20047, WO 95/09841 и WO 96/06074) или пептидомиметического остова [Шварц и др., Progr. Med. Chem., 29:271-334(1992); Расмуссен и др., Pharmacol. Ther., 75:69-75 (1997); Денис и др., Invest. New Drugs, 15:175-185 (1997)]. Альтернативно, они содержат сульфоамидосульфонильную группу, которая связана на одной стороне с фенильным кольцом, и сульфоамидоазот, который связан с гидроксаматной группой через цепь из одного - четырех атомов углерода (ЕР 0757984 А1).
Другими ингибиторами ММП на основе пептидов являются тиоловые амиды, которые имеют активность, ингибирующую коллагеназу (патент США 4,595,700), N-карбоксиалкилпроизводные, содержащие бифенилэтилглицин, которые ингибируют ММП-3, ММП-2 и коллагеназу (Дюретт и др., WO-9529689), производные лактама, которые ингибируют ММП, TNF-alpha и аггреканазу (см. патент США 6,495,699), и трициклические сульфонамидные соединения (см. патент США 6,492,422).
Хотя ингибиторы ММП на основе пептидов имеют явный терапевтический потенциал, их использование в клинической терапии ограничено. Гидроксаматы на основе пептида дороги в производстве и имеют низкую метаболическую стабильность и оральную биодоступность [например, батимастат (ВВ-94)]. Эти соединения быстро глюкуронизируются, окисляются до карбоновой кислоты и выводятся в желчь [Сингх и др., Bioorg. Med. Chem. Lett. 5: 337-342, 1995; Ходгсон, "Ремоделирование ММПИ", Biotechnology 13: 554-557, 1995)]. Кроме того, ингибиторы ММП на основе пептидов часто оказывают такие же или сходные на каждый из ферментов ММП. Например, ба-тимастат по сообщениям имеет значения IC50 приблизительно от 1 до 20 нмоль против каждой из ММП-1, ММП-2, ММП-3, ММП-7 и ММП-9 [Расмуссен и др., Pharmacol. Ther., 75(1): 69-75 (1997)]. Кроме того, использование нескольких гидроксаматных ингибиторов было связано с серьезными побочными эффектами, такими как мышцеске-летные проблемы от маримастата (ВВ-2516), широко распространенная язвенная сыпь от CGS27023A (Novartis) [Левитт и др., 2001, Clin. Cancer Res. 7: 1912-1922] и нарушения работы печени, анемия, боли в плечах и спине, тромбоцитопения, тошнота, усталость, диарея и тромбоз вен от BAY12-9566 (Bayer) [Хис и др., 2001, Cancer Chemother. Pharmacol. 48: 269-274]. Более того, клинические испытания фазы III на пациентах с развившимся раком, которым назначали маримастат, приномастат (AG 3340, Agouron) и Bay 12-9566, не продемонстрировали клинической эффективности в ингибировании метастаз (Цукер и др., 2000, Oncogene 19: 6642-50).
Другими ингибиторами ММП являются химически модифицированные немикробные тетрациклины (ХМТ), которые блокируют выражение нескольких ММП in vitro. Однако, было выявлено, что эффективность этих соединений in vivo является ограниченной, например, ингибитор ХМТ, доксициклин, снижал тканевые уровни ММП-1, но не ММП-2, 3, или 9 в атеросклерозных бляшках в сонной артерии у людей (Аксиса и др., 2002, Строук 33: 2858-2864).
Недавно разработан ингибитор механизма ММП, SB-3CT, который основан на рентгеновской кристаллографической информации об активном сайте ММП (Браун и др., 2000). Рентгенографические абсорбционные исследования показали, что связывание этой молекулы с каталитическим цинком реконструирует конформационную среду вокруг иона металла в активном сайте обратно до среды профермента [Кляйфельд и др., 2001, J Biol. Chem. 276: 17125-31]. Однако терапевтическую эффективности этого вещества еще предстоит определить.
Еще одним классом естественных ингибиторов являются моноклональные антитела. Несколько антител были выбраны против специфических пептидных последовательностей в каталитическом домене ММП-1 (Гальвез и др., 2001, J. Biol. Chem., 276: 37491-37500). Однако, хотя эти антитела могли ингибировать активность ММП in vitro, результаты, демонстрирующие эффективность таких тел in vivo еще не получены.
Как сказано выше, каталитический сайт ММП включает координированный ион металла, который становится доступным для связывания субстрата после ферментной активации (см. ФИГ.2а-с). Таким образом, идея заключается в том, что традиционные антитела, направленные на первичную аминокислотную последовательность фермента, не будут отличать активную форму от неактивной формы фермента и, следовательно, не будут являться мощными ингибиторами таких ферментов.
Авторы настоящего изобретения ранее демонстрировали, что антитела, которые распознают электронные и структурные детерминанты каталитического сайта ММП, являются ее мощными ингибиторами и, как таковые, могут использоваться для лечения заболеваний, связанных с несбалансированной активностью ММП (см. публикацию РСТ WO 2004/087042).
Таким образом, существует признанная необходимость и желание получить специфические гаптеновые соединения, которые имитируют электронные и структурные детерминанты каталитического сайта металлопротеинов, как специфические антитела, направленные против них.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
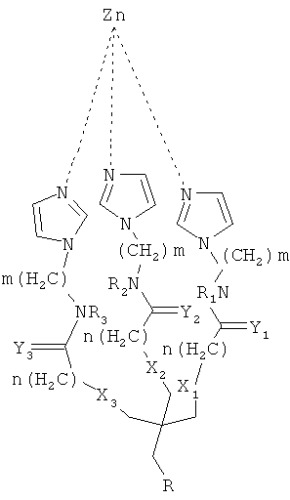
Согласно одному аспекту настоящего изобретения предложено соединение, имеющее общую формулу (I):
где:
m и n являются независимо целыми числами от 1 до 6;
X1-Х3 и Y1-Y3 являются независимо О или S;
R1-R3 независимо выбирают из группы, состоящей из водорода, алкила и циклоалкила; и R-(CH2)x-C(=O)NR'-(CH2)y-NR'R"
тогда как:
x и y являются независимо целыми числами от 1 до 6; и
R' и R" независимо выбирают из группы состоящей из водорода, алкила и циклоалкила.
Согласно другим признакам предпочтительных вариантов осуществления, описанных ниже, соединение имеет формулу (II):
где R=-CH2-C(O)NH-CH2-CH2-NH2
Согласно другому аспекту настоящего изобретения предложено соединение, имеющее формулу (II):
где R=-CH2-C(=O)NH-CH2-CH2-NH2
Согласно еще одному аспекту настоящего изобретения предложено антитело, содержащее участок распознания антигенов, способный специфически связывать вышеуказанное соединение.
Согласно другим признакам указанных предпочтительных вариантов осуществления участок распознания антигенов содержит аминокислотную последовательность CDR, выбираемую из группы, состоящей из SEQ ID NO:7, 8, 9, 10, 11 и 12.
Согласно другим признакам указанных предпочтительных вариантов осуществления аминокислотная последовательность CDR кодируется последовательностью нуклеиновой кислоты, выбираемой из группы, состоящей из SEQ ID NO:13, 14, 15, 16, 17 и 18.
Согласно другим признакам указанных предпочтительных вариантов осуществления антитело способно ингибировать активность металлопротеина.
Согласно другим признакам указанных предпочтительных вариантов осуществления металлопротеином является матриксная металлопротеаза.
Согласно другим признакам указанных предпочтительных вариантов осуществления матриксной металлопротеазой является гелатиназа.
Согласно другим признакам указанных предпочтительных вариантов осуществления гелатиназу выбирают из группы из ММП-2 и ММП-9.
Согласно другому аспекту настоящего изобретения предложен способ производства ингибитора металлопротеинов, причем этот способ содержит создание антител, направленных на вышеуказанное соединение, этим создавая ингибитор металлопротеинов.
Согласно другим признакам указанных предпочтительных вариантов осуществления антителами являются поликлональные антитела.
Согласно другим признакам указанных предпочтительных вариантов осуществления антителами являются моноклональные антитела.
Согласно другому аспекту настоящего изобретения предложена фармацевтическая композиция, содержащая упомянутое антитело и фармацевтически приемлемый носитель.
Согласно другому аспекту настоящего изобретения предложен способ лечения заболевания, связанного с несбалансированной или аномальной активностью металлопротеинов у пациента, причем этот способ включает назначение пациенту терапевтически эффективного количества любого одного из антител по пунктам 4-10, посредством чего лечат заболевание, связанное с несбалансированной или аномальной активностью металлопротеинов у пациента.
Согласно другим признакам указанных предпочтительных вариантов осуществления заболеванием является воспалительное заболевание внутреннего органа.
Согласно другому аспекту настоящего изобретения предложен способ ингибирования активности матриксной металлопротеазы в клетке, причем способ включает контакт клетки с любым одним из антител по пунктам 4-10, этим ингибируя активность матриксной металлопротеазы в клетке.
Настоящее изобретение успешно преодолевает недостатки известных конфигураций путем предложения новой гаптеновой композиции, которую можно использовать для генерации антител, которые распознают электронные и структурные детерминанты каталитического сайта металлопротеинов.
Если не указано иное, все технические и научные термины в настоящем описании имеют такое же значение, которое обычно понимается средним специалистом в области настоящего изобретения. Хотя способы и материалы, подобные или эквивалентные описанным здесь, могут быть использованы при практическом осуществлении или тестировании настоящего изобретения, подходящие способы и материалы описаны ниже. В случае противоречия, главным является описание изобретения, включая определения. Кроме того, материалы, способы и примеры являются только иллюстративными, но не ограничивающими.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Далее изобретение описано, причем только для примера, со ссылками на прилагаемые чертежи. Теперь с конкретной ссылкой на подробные чертежи подчеркивается, что показанные детали приведены только для примера и для целей иллюстративного описания предпочтительных вариантов осуществления настоящего изобретения и представлены для предложения того, что считается наиболее подходящим и легко понятным описанием принципов и концептуальных аспектов изобретения. В этом отношении не делается попытки показать структурные детали изобретения более подробно чем необходимо для его фундаментального понимания, причем описание, взятое вместе с чертежами, делает очевидным для специалистов в данной области, как несколько форм изобретения могут быть осуществлены на практике. На чертежах:
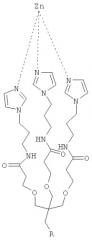
ФИГ.1A-D - схемы молекулярной структуры Co/ZnTCPP - [мезо-Тетракис (4-карбоксифенил)-порфиринато] кобальт/цинк (II) (ФИГ.1А-В, Imisdp - [2-(2-миноэтилкарбомоил)-этоксиметил]-трис-[2-(N-(3-имидазол-1-ил-пропил))этоксиметил]метан, и консервативное сшивание цинка-протеина в сайте каталитического цинка в ММП.
ФИГ.1Е-Н - три пространственные схемы структур, показанных на ФИГ.1A-D. Отметьте, что ZnTCPP остается планарной конформацией, а СоТСРР имеет искаженную конформацию микроцикла. Заметно, что структура Imisdp в высокой степени аналогична ближайшей среде иона каталитического цинка в ММП-9, как показано на ФИГ.1G.
ФИГ.2А - структурное наложение трех пространственных вычисленных структур Imisdp (зеленые атомы углерода) и три консервативных гистидина в активном сайте ММП-9 (PDB код 1GKC, серые атомы углерода). Ион каталитического цинка показан как оранжевый шар, молекула воды показана как синий шар, азот окрашен синим, кислород окрашен красным.
ФИГ.2В - структурное наложение порфиринового кольца ZnTCPP (CSD-код AKICOM) (зеленые атомы углерода) и трех консервативных гистидинов в активном сайте ММП-9 (зеленые атомы углерода PDB-код 1GKC), ион каталитического цинка показан как оранжевый шар, азот окрашен синим.
ФИГ.3А-С - изображения вестерн блоттинга, показывающие способность IgG мыши - иммобилизированных агарозой моноклональных антител вытягивать рекомбинантный каталитический домен ММП-2 (ММП-2cat) или Pro-ММП-2 и Pro-ММП-9 из раствора. В каждом эксперименте использовали антитела 6С6, 13Е11 и 13Е15. ФИГ.3А - ММП-2cat (2 мкг) инкубировали с IgG антимыши - агарозой (контроль, дорожка 1) или моноклональным антителом против СоТСРР, ZnTCPP и Imisdp (10 мкг) - IgG антимыши - агарозой в течение 2 часов при 20°C, иммунопреципитаты (дорожки 2, 3, 5) центрифугировали и промывали три раза, отделяли на геле SDS/PAGE и визуализировали окрашиванием кумасси. ФИГ.3В - Pro-ММП-2, Pro-ММП-9 инкубировали с моноклональным антителами антимыши IgG - агарозой таким же порядком, что и в А. Иммунопреципитаты (дорожки 2, 4, 6 слева и 1, 3, 5 справа) и несвязанную фракцию (дорожки 1, 3, 5 слева и 2, 4, 6 справа) отделяли на геле SDS/PAGE и визуализировали окрашиванием кумасси. ФИГ.3С - кондиционированная среда клеток НТ1080, которые или прошли активацию АРМА (слева) или не проходили (справа), была иммуноосаждена с помощью моноклонального антитела против СоТСРР и проанализирована вестерн блоттингом с помощью антител, специфических против ММП-2.
ФИГ.4А-В - графики Лайнвивера-Берка ингибирования ММП-2 (А) и ММП-9 (В) с помощью моноклонального антитела против СоТСРР. Единицей скорости является мкмоль/с-1, и единицей субстрата является мкмоль-1. ФИГ.4А - концентрации моноклонального антитела составили: 6 (черные треугольники), 18 (черные квадраты), 24 (белые круги), and 0 мкмоль (белые квадраты). Концентрация ММП-2cat составила 200 нмоль. ФИГ.4В - Ингибирование полной длины ММП-9, активированной АРМА, концентрации моноклонального антитела составили 6 (белые квадраты), 12 (черные треугольники), 24 (белые квадраты) и 0 мкмоль (черные квадраты). Концентрация ММП-9 составила 20 нмоль. Модель ингибирования показывает, что моноклональное антитело против СоТСРР ведет себя как конкурентный ингибитор ММП-2 и ММП-9.
ФИГ.5 - график, показывающий ингибирование ММП-2 и ММП-9 с помощью моноклонального антитела против Imisdp. Каталитический домен ММП-9 (20 нмоль) (черные круги) или полная длина ММП-2, активированной АРМА (черные треугольники, 5 нмоль), был добавлен в смеси флуорогенного субстрата OCAcPLGLA2pr(Dnp)-AR-NH2 (10 мкмоль) в буферном растворе R, содержащем увеличивающиеся концентрации моноклонального антитела. Линии представляют выравнивания по методу наименьших квадратов к уравнению:
vi/vo=(Km+[S])/(Km(1+[I]/Ki)+[S]), используя программу Origin.
На ФИГ.6А показаны спектры К-края активных и ингибированных моноклональным антителом против СоТСРР форм ММП-2cat для цинка. Показаны нормализованные необработанные данные XAS по области K-края цинка для активного (точки) и комплекса ММП-2cat - моноклональное антитело (сплошная линия).
На ФИГ.6В показано краевое положение, в котором комплекс (сплошная линия) ММП-2cat - моноклональное антитело сдвигается в сторону более высокой энергии по отношению к активной ММП-2cat (точки).
На ФИГ.6С показаны результаты EXAFS для активной (черный) и ингибированной (зеленый) форм ММП-2cat. Эти результаты представлены в R-пространстве и трансформированы обратно в k-пространство.
ФИГ.7А-В - фотографии, показывающие способность моноклонального антитела против СоТСРР ингибировать активность гелатиназы на поверхности клетки. Представительные флуоресцентные микрофотографии клеток НТ1080, нанесенных на покровные стекла, покрытые DQ-желатином в присутствии или отсутствии 1 мкмоль моноклонального антитела 13Е11. Гелатинолитическую активность поверхности клетки оценивали как меру флуоресценции, испускаемой разлагаемым желатином. Необработанные клетки проявляли значительную активность гелатиназы на поверхности клетки, которая была значительно ингибирована в присутствии 1 мкмоль моноклонального антитела против СоТСРР. Окрашивание 4'-6-диамидино-2-фенилиндолом (DAPI), синего цвета, указывает местонахождение ядер клеток.
ФИГ.8 - схема, показывающая конфигурацию различных активных сайтов ММП (SI-карман).
ФИГ.9 - схема синтеза Imisdp.
На ФИГ.10 показаны аминокислотные последовательности антител настоящего изобретения с выделенными участками CDR.
ФИГ.11A-D - фотографии и модели, показывающие, что 6С6 связывает только активную конформацию ММП9 и ММП2.
ФИГ.11А: Детектирование активной ММП9, которая очищена вместе с 6С6 от асцитной жидкости мышей. Моноклональное антитело (10 мкг), очищенное от асцитной жидкости мышей, содержащей ММП9, было подвергнуто вестерн блоттингу (ВБ) с использованием коммерческого антитела к ММП9. Несвязанное моноклональное антитело IgG, которое было очищено таким же образом, служило в качестве отрицательного контроля (контроль моноклонального антитела). Человеческая Про-ММП9, очищенная от трансформированных клеток Hilla, служила в качестве маркера молекулярной массы для распознания активных видов. Очистку выполнили аффинной хроматографией с использованием гранул белка G, которые связывали моноклональное антитело через его постоянный домен, оставляя сайт связывания антигена свободным для взаимодействия с антигеном.
ФИГ.11В,С: 6С6 моноклональное антитело, иммобилизированное к гранулам белка А, анализировали на его способность вытягивать каталитический фрагмент ProММП2, ProММП9 или ММП2 (в отсутствии гемопексина и продоменов) из раствора. MAbs 6С6 (10 мкг), иммобилизированное к гранулам сефарозы белка А, инкубировали с каталитическим фрагментом ММП2 (1 мкг) - ФИГ.11В, ProММП9 - ФИГ.11С верх или ProММП2 (2 мкг) ФИГ.11C низ, в течение 2 часов при 20°C. Связанный гранулами комплекс моноклонального антитела отделили центрифугированием и промыли три раза, отделили на геле SDS/PAGE и визуализировали окрашиванием кумасси. Иммунопреципитаты (6С6) и несвязанные фракции отделили на геле SDS/PAGE и визуализировали окрашиванием кумасси. В качестве отрицательного контроля для неспецифического поглощения фермент инкубировали с гранулами сефарозы белка А.
ФИГ.11D: Трехмерная структура ММП2 без домена гемопексина с про доменом (внизу) и без продомена (вверху) показана в поверхностном представлении (PDB ID: 1CK7). Каталитический и фибронектиновый домены показаны цианом, и пропептид показан красным. Ион каталитического цинка показан как оранжевая сфера; он связан с тремя консервативными гистидинами, показанными как желтые стержни. Как показано, пропептидный домен стерильно блокирует активный сайт.
ФИГ.12А-В - графики и данные, относящиеся к механизму ингибирования ММП-9 с помощью моноклонального антитела 6С6.
ФИГ.12А: рекомбинантный каталитический фрагмент ММП-9 (без гемопексина и продомена) инкубировали с разными количествами моноклонального антитела. Остаточную ферментную активность измеряли после добавления флуорогенного пептидного субстрата (10 мкмоль). Ki оценивали путем подбора к уравнению конкурентного ингибирования (vi/vo=Km+[S]/(Km(1+I/Ki)+[S]) Km=9,14±0,8) (Вставка). Активную ММП-9 (при фиксированной концентрации 2 нмоль) предварительно инкубировали в течение 60 минут при 37°C в отсутствии (•) или присутствии 0,7 (■) или 2 мкмоль (О) моноклонального антитела в 100 ммоль NaCl, 10 ммоль CaCl2, 100 ммоль Трис рН 7,5. Затем добавили флуорогенный пептидный субстрат (Mca-Pro-Leu-Gly-Leu-Dpa-Ala-Arg-NH2) для получения конечных концентраций (S) в диапазоне 0-30 мкмоль, и начальную скорость гидролиза субстрата определяли путем измерения возрастающей флуоресценции. Значения видимых Km и Vmax были получены путем подбора экспериментальных данных к уравнению Микаэлиса-Ментена. Полученные значения использовали для реконструирования двойной обратной кривой Линвивера-Берка, где точки пересечения показывают конкурентное ингибирование ММП-9 с помощью 6С6.
ФИГ.12В: Разные ММП были предварительно инкубированы с изменяющимися количествами моноклонального антитела. Остаточную ферментную активность измеряли после добавления флуорогенного пептидного субстрата (10 мкмоль). Ki оценивали путем подбора к уравнению конкурентного ингибирования (vi/vo=Km+[S]/(Km(1+I/Ki)+[S]) Km=2.46±0,34 для полной длины ММП2, очищенной от клеток Hila, Km=16±1 для каталитического домена МТ1-ММП). Эффективное ингибирование 6С6 также детектировали с использованием полной длины ММП-2 и ММП-9 (данные не показаны).
ФИГ.13 - структурное наложение разных ММП, показывающее общую консервативную топологию активного сайта с изменениями, главным образом, в периферийных петлях. ММП9 (PDB 1GKC) - циан, ММП2 (PDB 1QIB) - ярко-красный, МТ1-ММП (PDB 1BUV) - оранжевый, ММП7 (PDB 1MMQ) - красный, ТАСЕ (PDB 2147) - желтый. Консервативные гистидины показаны как стержни, ион каталитического цинка - как оранжевый шар. Заметно, что общая топография периферийных петель ММП-2 и ММП-9 сходна. Это может объяснить селективность 6С6 к ММП-2 и ММП-9 в испытанной группе ферментов.
ФИГ.14А-С - флуоресцентные микрофотографии, иллюстрирующие, что 6С6 ингибирует активность гелатиназы на поверхности клеток. Представительные флуоресцентные микрофотографии (генерируемые прямым зимографическим анализом) клеток НТ1080, помещенных на покровные стекла, покрытые DQ-желатином, в отсутствии (ФИГ.14А) или присутствии (ФИГ.14В) 5 мкмоль моноклинального антитела или 15 мкмоль SB-3CT основанным на механизме наномолярным ингибитором гелатиназ (ФИГ.14С). Активность гелатиназы на поверхности клеток анализировали как меру флуоресценции, испускаемой разлагающимся желатином. Необработанные клетки показывали значительную активность гелатиназы на поверхности (зеленый цвет), которая значительно ингибировалась в присутствии моноклонального антитела.
ФИГ.15А-С - графики, иллюстрирующие воздействие 6С6-обработки на различные проявления острого колита, вызванного DSS, у мышей C57BL/6. Заболевание индуцировали 2%-м DSS в течение 5 суток. Лечение 6С6 в количестве 1,5 мг/мышь, назначали в виде ежедневной внутрибрюшинной инъекции, начиная с дня 0. ФИГ.15А: Клинический показатель оценивали путем ежедневного мониторинга DAI (т.е., объединенного показателя массы тела, ректального кровотечения и консистенции стула, по шкале от 0 до 4). Данные выражены как распределение точек среднего значения для каждого животного по дням 6-10. ФИГ.15В: Длина ободочной кишки. ФИГ.15С: Смертность. Представленные данные являются объединенными результатами из двух экспериментов, при 15 мышах в группе.*, значительный эффект по сравнению с мышами с колитом, не получавшими лечения (p<0,05).
ФИГ.16 - график результатов рентгеновской абсорбционной спектроскопии на К-крае цинка для активной ММП9 (черный) и ингибированного комплекса ММП9-6С6 (красный). Результаты представлены в форме радиального распределения от иона цинка. Краевое положение комплекса (красный) каталитического домена ММП-9 - моноклональное антитело сдвигается в сторону более высокой энергии по отношению к активной ММП-9 (вставка), указывая на связывание с ионом каталитического цинка. Структурный анализ данных рентгеновской спектроскопии показывает, что 6С6 прямо связывает ион цинка и формирует пятикоординатный комплекс цинка-белка. Заметно, что этот режим связывания аналогичен связыванию ТИМП в активном сайте ММП.
ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Настоящее изобретение относится к антителам и их фрагментам, которые можно использовать для ингибирования активности металлопротеинов. Специфически, антитела настоящего изобретения можно использовать для лечения заболеваний, связанных с несбалансированной активностью матриксной металлопротеазы, таких как рассеянный склероз, аутоиммунных заболеваний и метастатических раков.
Принципы и действие настоящего изобретения могут быть лучше поняты со ссылками на чертежи и соответствующие описания.
Перед тем, как подробно объяснить по меньшей мере один вариант осуществления, необходимо сказать, что изобретение не ограничено в применении подробностями, изложенными в последующем описании или Примерах. Изобретение может быть осуществлено на практике в других вариантах. Также необходимо понимать, что примененная здесь фразеология и терминология предназначена для целей описания и не должна рассматриваться как ограничивающая.
Матриксные металлопротеазы участвуют в многих биологических процессах, от разрастания и дифференциации клеток и ремоделирования внеклеточного матрикса (ВКМ) до васкуляризации и миграции клеток. Эти процессы требуют точного баланса между функциями матриксных металлопротеаз (ММП) и их природными тканевыми ингибиторами (ТИМП). Утрата этого баланса является признаком многочисленных патологических состояний, включая метастатические опухоли, невродегенеративные заболевания и остеоартрит.
Известны многие ингибиторы ММП, включая малые пептидные ингибиторы, такие как гидроксомат, немикробные тетрациклины и моноклональные антитела. Хотя первый ограничен высокой стоимостью производства, высокой скоростью распада, низкой оральной доступностью и отсутствием специфичности, ни один из последних не продемонстрировал терапевтическую эффективность in vivo.
Авторы настоящего изобретения ранее выявили, что антитела, которые распознают электронные и структурные детерминанты каталитического сайта металлоферментов, могут быть использованы в качестве их мощных ингибиторов. Использование гаптенов, имитирующих связанный с металлом каталитический сайт металлоферментов, в качестве иммуногенов позволило создать высоко эффективные терапевтические антитела, которые можно использовать для лечения клинических состояний, характеризующихся повышенной активностью металлопротеинов (см. WO2004/087042 авторов настоящего изобретения).
При осуществлении настоящего изобретения на практике авторы разработали новое гаптеновое соединение, которое достаточно точно имитирует локальную структуру и конформацию реактивного сайта цинка в ММП. Это соединение, [2-(2-миноэтилкарбомоил)-этоксиметил]-трис-[2-(N-(3-имидазол-1-ил-пропил))этоксиметил]метан, сокращенно Imisdp (см. ФИГ.1), может имитировать 4-координатную геометрию и силовое поле, сходное с индуцируемым ионом цинка на скоординированной трехгистидинной матрице и воде. Почти четырехугольная конформация сформирована тремя имидазольными основаниями и молекулой воды в качестве четвертого лиганда. На ФИГ.2А показано наложение сконструированной трехмерной модели соединения Imisdp на каталитический сайт ММП-9 (PDB 1GKC), который был модифицирован для того, чтобы представлять четырехугольную геометрию лигандов цинка. Модификации включают замену лиганда, присутствующего в рентгеновской структуре (гидроксаматный ингибитор), молекулой воды и оптимизацию полного фермента до локального минимума многослойным подходом QM/MM (см. материалы и способы). Существует высокое подобие между вычисленным расположением гистидинного цинка в ММП-9 и Imisdp в смысле расстояний ε-азота гистидинов от иона цинка (2,04+0,06 и 2,02, соответственно) и относительной ориентацией трех гистидинов по отношению к металлу.
Как проиллюстрировано ниже в описании и Примерах, авторы настоящего изобретения иммунизировали мышей препаратом Imisdp и провели их скрининг на антитело к ММП, перекрестно реагирующее с ММП-2 и ММП-9. Это антитело было названо 6С6 (см. ФИГ.10 и Примеры 1-2). Было выявлено, что 6С6 связывает ММП-2/9 и конкурентно ингибирует активность ММП-9, ММП-2 (Ki-диапазон 1 мкмоль - 5 мкмоль) и МТ1-ММП (Ki 15 мкмоль, см. таблицу 4 ниже). Связывание и ингибирование ММП-9 и ММП-2 было продемонстрировано in vitro и in situ с помощью биохимических и биофизических средств (см. Примеры 4-7 и 9). Что важно, 6С6 связывает только активированную форму ММП-9 и ММП-2 (см. Пример 3 и Пример 8). В этой форме фермента отсутствует продомен, который защищает комплекс каталитического цинка, находящегося в части фермента. Авторы показали, что антитела, созданные по настоящему способу, способны соединяться in vivo с ММП-9 (ФИГ.11А). Кроме того, авторы показали, что антитела настоящего изобретения имеют терапевтический потенциал для лечения воспалительного заболевания кишечника (Пример 10).
Эти данные поддерживают использование Imisdp в качестве важного реагента (платформы) для производства ингибиторов металлопротеинов, а также 6С6 и производных пептидов и пептидоимитаторов в качестве ценного терапевтического средства.
Эти результаты демонстрируют потенциал использования этих антител как платформы для разработки селективных пептидных ингибиторов для отдельных ММП посредством отображения бактериофагов и точечных мутаций моноклональных антител или их фрагментов.
Так, согласно одному аспекту настоящего изобретения предложено соединение, имеющее общую формулу (I):
где:
m и n являются независимо целыми числами от 1 до 6;
X1-Х3 и Y1-Y3 являются независимо О или S;
R1-R3 независимо выбирают из группы, состоящей из водорода, алкила и циклоалкила; и R-(CH2)x-C(=O)NR'-(CH2)y-NR'R"
поскольку:
x и y являются независимо целыми числами от 1 до 6; и
R и R" независимо выбирают из группы состоящей из водорода, алкила и циклоалкила.
Согласно предпочтительному варианту осуществления этого аспекта настоящего изобретения, этим соединением является [2-(2-миноэтилкарбомоил)-этоксиметил]-трис-[2-(N-(3-имидазол-1-ил-пропил))-этоксиметил] метан, названное, Imisdp, которое имеет общую формулу (II):
где R=-CH2-C(=O)NH-CH2-CH2-NH2
Синтез Imisdp описан в Примере 7.
Поскольку Imisdp имитирует локальную структуру и переходную конформацию реактивного сайта цинка в ММП-9 и ММП-2, его можно использовать для производства ингибиторов металлопротеинов.
Так, согласно одному аспекту настоящего изобретения предложен способ производства ингибитора металлопротеинов.
Способ осуществляют путем создания антител или фрагментов антител, направленных на вышеописанное соединение (т.е., Imisdp). Смотрите Примеры 1-2, а также раздел "Материалы и способы" в разделе «Примеры».
Термин "металлопротеин" настоящего изобретения относится к метало-связанному белку, в котором сайт связи с металлом образует часть каталитического домена фермента, который электронно и структурно напоминает таковой у Imisdp.
Металлопротеин данного аспекта настоящего изобретения предпочтительно является металлопротеазой - ММП (например, гелатиназой, такой как ММП-2 и ММП-9).
Будет понятно, что все члены семейства ММП воспринимаются как латентные ферменты, которые после активации преобразуются в активные ферменты, у которых ион металла в активном сайте доступен для связи с субстратом. Например, для объяснения активации ММП in vitro ранее была предложена «модель перехода цистеина». Модель перехода цистеина предполагает, что после активации сайт образования связи с латентным цинком преобразуется в сайт образования связи с каталитическим цинком путем диссоциации тиолового пропептида с (Cys) от атома цинка. Расщепление этого пропептида приводит к разрушению продоменной структуры фермента, и утрате защиты ионом каталитического цинка. Следовательно, ион металла и карман активного сайта доступны для связи с субстратом и гидролиза [Ван Варт и Биркедаль-Хансен (1990) Proc. Natl. Acad. Sci. USA 87, 5578-5582].
Антитела и фрагменты антител, созданные по настоящему изобретению, служат в качестве мощных ингибиторов ММП из-за их способности связывать ион металла и координирующие аминокислоты в сай