Нонапептид с противоопухолевой активностью
Иллюстрации
Показать всеНастоящее изобретение относится к пептидам или пептидоподобным молекулам формулы: CCLLCCLLC (I) (SEQ ID NO:1) или CLLCCLLCC (III) (SEQ ID NO:3), где C представляет собой катионную аминокислоту и L представляет собой аминокислоту с липофильной группой R, в котором одна из аминокислот, имеющая липофильную группу R, представляет собой не кодируемую генетически аминокислоту, причем это соединение возможно находится в форме фармацевтически приемлемой соли, эфира или амида, и к их применениям в терапии, в частности, в качестве противоопухолевых агентов. 9 н. и 11 з.п. ф-лы, 7 ил., 12 табл., 9 пр.
Реферат
Настоящее изобретение относится к пептидам или пептидоподобным молекулам и к их применениям в терапии, в частности, в качестве противоопухолевых агентов, а также в качестве адъювантов для вакцин, включая противоопухолевые вакцины.
Пептиды и их производные давно признаны молекулами, представляющими терапевтический интерес. Широко разнообразные организмы используют пептиды как часть своего механизма иммунной защиты. Антимикробные пептиды выделены из столь различающихся видов, как бактерии и млекопитающие. Как правило, эти пептиды имеют суммарный положительный заряд и склонность к образованию амфифильных α-спиральных или β-складчатых структур при взаимодействии с наружным фосфолипидным бислоем в мембранах бактериальных клеток. В большинстве случаев детальные молекулярные механизмы антибиотического действия неизвестны, хотя считают, что некоторые пептиды, выделенные в категорию класса L (литические), взаимодействуют с мембранами бактериальных клеток, образуя ионные каналы, поры или другие структуры, способные к дестабилизации мембраны.
Показано, что среди общего класса литических антимикробных пептидов некоторые обладают противоопухолевой активностью. Эукариотические клеточные мембраны опухолевых клеток развивают свойства, подобные свойствам клеточных мембран прокариот, и установлено, что это может обеспечивать степень селективности этих литических пептидов для опухолевых клеток in vivo. Некоторая противоопухолевая активность пептидов, обладающих амфифильным характером и суммарным положительным зарядом, описана в WO 00/12542, WO 01/66147, WO 01/19852 и авторами Yang et al. в Journal of Peptide Science [2004], 10, pp 37-46 (PMID: 14959890). Как правило, противоопухолевая активность требует пептидов большего размера, чем может быть предназначено для антибактериальных применений. Уравновешивание необходимости в хорошей цитотоксичности для клеток-мишеней и селективности in vivo представляет конкретные проблемы в создании полезных противоопухолевых пептидов, отчасти в связи с тем, что сохраняется высокая степень подобия между клеточной мембраной опухолевых клеток и нетрансформированных клеток. Тем не менее, частота встречаемости рака в популяциях людей и животных и его роль в смертности означает, что продолжает существовать необходимость в новых лекарствах, которые эффективны против опухолей. Устранение опухоли, либо уменьшение ее в размерах, либо уменьшение числа раковых клеток, циркулирующих в кровеносной или лимфатической системе, может быть полезно при ряде путей: уменьшении боли или дискомфорта, предупреждении метастазов, облегчении оперативного вмешательства, продлении жизни.
В процессе исследований биологической активности пептидов авторы настоящего изобретения идентифицировали небольшую группу молекул, которые проявляют особенно хорошую активность против ряда типов рака и хорошую селективность в отношении раковых клеток по сравнению с нормальными клетками.
Как подробно описано ниже, одна молекула (LTX-315) особенно предпочтительна, и, следовательно, в соответствии с первым аспектом настоящего изобретения предложено соединение, имеющее формулу SEQ ID NO: 23, или его соль, эфир или амид.
В одном аспекте в настоящем изобретении предложено соединение, предпочтительно пептид, обладающий следующими характеристиками:
a) состоит из 9 аминокислот в линейном порядке;
b) из этих 9 аминокислот 5 являются катионными, и 4 имеют липофильную группу R;
c) по меньшей мере одна из этих 9 аминокислот представляет собой генетически некодируемую аминокислоту или модифицированное производное генетически кодируемой аминокислоты; и необязательно
d) липофильные и катионные остатки расположены таким образом, что не более чем два из любого типа остатков являются смежными друг с другом; и, кроме того, необязательно
e) молекула содержит две пары смежных катионных аминокислот и одну или две пары смежных липофильных остатков.
Катионные аминокислоты, которые могут быть одинаковыми или разными, предпочтительно представляют собой лизин или аргинин, но могут представлять собой гистидин или любую генетически некодируемую или модифицированную аминокислоту, несущую положительный заряд при pH 7,0.
Пригодные генетически некодируемые катионные аминокислоты и модифицированные катионные аминокислоты включают аналоги лизина, аргинина и гистидина, такие как гомолизин, орнитин, диаминомасляная кислота, диаминопимелиновая кислота, диаминопропионовая кислота и гомоаргинин, а также триметиллизин и триметилорнитин, 4-аминопиперидин-4-карбоновая кислота, 4-амино-1-карбамимидоилпеперидин-4-карбоновая кислота и 4-гуанидинофенилаланин.
Липофильные аминокислоты (то есть аминокислоты с липофильной группой R), которые могут быть одинаковыми или разными, все имеют группу R по меньшей мере с 7, предпочтительно по меньшей мере с 8 или 9, более предпочтительно по меньшей мере с 10 атомами не водорода. Аминокислота с липофильной группой R в данной заявке названа липофильной аминокислотой. Типично липофильная группа R имеет по меньшей мере одну, предпочтительно две циклические группы, которые могут быть конденсированы или соединены.
Липофильная группа R может содержать гетероатомы, такие как О, N или S, но типично имеется не более одного гетероатома, предпочтительно он представляет собой атом азота. Эта группа R предпочтительно будет иметь менее 2 полярных групп, более предпочтительно ни одной или одну, наиболее предпочтительно ни одной.
Триптофан является предпочтительной липофильной аминокислотой, и молекулы предпочтительно содержат от 1 до 3, более предпочтительно 2 или 3, наиболее предпочтительно 3 остатка триптофана. Дополнительными генетически кодируемыми аминокислотами, которые могут быть включены, являются фенилаланин и тирозин.
Предпочтительно одна из липофильных аминокислот представляет собой не кодируемую генетически аминокислоту. Наиболее предпочтительно молекула состоит из 3 генетически кодируемых липофильных аминокислот, 5 генетически кодируемых катионных аминокислот и 1 не кодируемой генетически липофильной аминокислоты. В данном контексте D аминокислоту, хотя она строго не кодируется генетически, не рассматривают как "не кодируемую генетически аминокислоту", которая должна структурно, не только стереоспецифично, отличаться от 20 генетически кодируемых L аминокислот. Молекулы по изобретению могут иметь некоторые или все аминокислоты, присутствующие в D форме, однако предпочтительно все аминокислоты находятся в L форме.
Когда молекулы включают генетически некодируемую липофильную аминокислоту (или производное аминокислоты), группа R этой аминокислоты предпочтительно содержит не более чем 35 не водородных атомов, более предпочтительно не более 30, наиболее предпочтительно не более 25 не водородных атомов.
Предпочтительно генетически некодируемые аминокислоты включают: 2-амино-3-(бифенил-4-ил)пропановую кислоту (бифенилаланин), 2-амино-3,3-дифенилпропановую кислоту (дифенилаланин), 2-амино-3-(антрацен-9-ил)пропановую кислоту, 2-амино-3-(нафталин-2-ил)пропановую кислоту, 2-амино-3-(нафталин-1 -ил)пропановую кислоту, 2-амино-3-[1,1':4',1''-терфенил-4-ил]-пропионовую кислоту, 2-амино-3-(2,5,7-три-трет-бутил-1Н-индол-3-ил)пропановую кислоту, 2-амино-3-[1,1':3',1''-терфенил-4-ил]-пропионовую кислоту, 2-амино-3-[1,1':2',1''-терфенил-4-ил]-пропионовую кислоту, 2-амино-3-(4-нафталин-2-илфенил)-пропионовую кислоту, 2-амино-3-(4'-бутилбифенил-4-ил)пропановую кислоту, 2-амино-3-[1,1':3',1''-терфенил-5'-ил]-пропионовую кислоту и 2-амино-3-(4-(2,2-дифенилэтил)фенил)пропановую кислоту.
В предпочтительной форме осуществления соединения по изобретению имеют одну из формул I-V, приведенных ниже, в которых С представляет собой катионную аминокислоту, как определено выше, и L представляет собой липофильную аминокислоту, как определено выше. Аминокислоты связаны ковалентной связью, предпочтительно пептидными связями с получением в результате настоящего пептида или другими связями с получением в результате пептидомиметика. Свободные амино- или карбокси-концы этих молекул могут быть модифицированы, карбокси-конец предпочтительно модифицирован для удаления отрицательного заряда, наиболее предпочтительно карбокси-конец амидирован, и эта амидная группа может быть замещенной.
Пептидомиметик типично характеризуется сохранением полярности, трехмерным размером и функциональностью (биологической активностью) его пептидного эквивалента, но где пептидные связи заменены, часто более стабильными связями. Под 'стабильным' подразумевают более устойчивый к ферментативному расщеплению гидролитическими ферментами. Как правило, связь, которая заменяет амидную связь (суррогат амидной связи), сохраняет многие из свойств амидной связи, например, конформацию, стерический объем, электростатический характер, возможность водородного связывания и т.д. В главе 14 книги "Drug Design and Development", Krogsgaard, Larsen, Liljefors и Madsen (Eds) 1996, Horwood Acad. Pub, приведено общее обсуждение методов дизайна и синтеза пептидомиметиков. В настоящем случае, где молекула вероятнее подвергается взаимодействию с мембраной, чем с активным центром специфичного фермента, некоторые из описанных проблем точной имитации сродства и эффективности или функции субстрата не являются релевантными, и пептидомиметик может быть легко получен на основании данной структуры пептида или мотива необходимых функциональных групп. Подходящие суррогаты амидной связи включают приведенные ниже группы: N-алкилирование (Schmidt, R. et al., Int. J. Peptide Protein Res., 1995, 46,47), ретро-инверсный амид (Chorev, M and Goodman, M., Асе. Chem. Res, 1993, 26, 266), тиоамид (Sherman D.B. and Spatola, A.F. J. Am. Chem. Soc., 1990, 112, 433), тиоэфир, фосфонат, кетометилен (Hoffman, R.V. and Kirn, H.O. J. Org. Chem., 1995, 60, 5107), гидроксиметилен, фторвинил (Allmendinger, Т. et al., Tetrahydron Lett., 1990, 31, 7297), винил, метиленамино (Sasaki, Y and Abe, J. Chem. Pharm. Bull. 1997 45, 13), метилентио (Spatola, A.F., Methods Neurosci, 1993, 13, 19), алкан (Lavielle, S. et. al., Int. J. Peptide Protein Res., 1993, 42, 270) и сульфонамидо (Luisi, G. et al. Tetrahedron Lett. 1993, 34, 2391).
Соединения-пептидомиметики по настоящему изобретению могут иметь 9 идентифицируемых субъединиц, которые примерно эквиваленты по размеру и функции 9 катионным и липофильным аминокислотам. Термин 'аминокислота' можно, следовательно, удобно использовать в данной заявке для отнесения к эквивалентным субъединицам соединения-пептидомиметика. Кроме того, пептидомиметики могут иметь группы, эквивалентные R группами аминокислот, и обсуждение в данной заявке подходящих R групп и N- и С-концевых модифицирующих групп применимо, с соответствующими поправками, к соединениям-пептидомиметикам.
Как обсуждено в "Drug Design and Development", Krogsgaard et al., 1996, наряду с заменой амидных связей пептидомиметики могут включать замену структурных группировок большего размера ди- или трипептидомиметическими структурами, и в этом случае миметические группировки, включающие пептидную связь, такие как миметики, образованные от азола, можно использовать как заменители дипептидов. Предпочтительны, однако, пептидомиметики и, следовательно, пептидомиметические каркасы, где только амидные связи заменены, как обсуждено выше.
Подходящие пептидомиметики включают восстановленные пептиды, где амидная связь восстановлена до метиленамина путем обработки восстанавливающим агентом, например, бораном или гидридным реагентом, таким как алюмогидрид лития. Такое восстановление имеет дополнительное преимущество повышения общей катионности молекулы.
Другие пептидомиметики включают пептоиды, образованные, например, путем ступенчатого синтеза полиглицинов с присоединенной амидной функциональной группой. Некоторые каркасы пептидомиметиков могут быть легко получены из их пептидов-предшественников, таких как пептиды, которые являются перметилированными, подходящие методы описаны Ostresh, J.M. et al. в Proc. Natl. Acad. Sci. USA (1994) 91, 11138-11142. Сильные основные условия способствуют преобладанию N-метилирования над O-метилированием и приводят в результате к метилированию некоторых или всех атомов азота в пептидных связях и N-концевого атома азота.
Предпочтительные каркасы пептидомиметиков включают полиэфиры, полиамины и их производные, а также замещенные алканы и алкены. Пептидомиметики будут предпочтительно иметь N- и С-концы, которые могут быть модифицированы, как описано в данной заявке.
Как β- и γ-аминокислоты, так и α-аминокислоты включены в термин 'аминокислоты', поскольку являются N-замещенными глицинами. Соединения по изобретению включают бета-пептиды и депсипептиды.
Как обсуждено выше, соединения по изобретению включают по меньшей мере одну, и предпочтительно одну, генетически некодируемую аминокислоту. Когда этот остаток обозначен как L', предпочтительные соединения представлены приведенными ниже формулами:
Особенно предпочтительны пептиды формулы I и II, и из этих пептидов особенно предпочтительна формула I''.
Предпочтительно пептид представляет собой не LTX-302 (SEQ ID NO:11) (ниже).
Приведенные ниже пептиды, которые представлены в таблице 1 (за исключением LTX-302), наиболее предпочтительны.
| Таблица 1 | ||
| Название | SEQ ID NO | Последовательность |
| LTX-301 | 10 | Dip-K-K-W-W-K-K-W-K-NH2 |
| LTX-302 | 11 | W-K-K-W-Dip-K-K-W-K-NH2 |
| LTX-303 | 12 | W-K-K-W-W-K-K-Dip-K-NH2 |
| LTX-304 | 13 | Bip-K-K-W-W-K-K-W-K-NH2 |
| LTX-305 | 14 | W-K-K-Bip-W-K-K-W-K-NH2 |
| LTX-306 | 15 | w-k-k-w-dip-k-k-w-k-NH2 |
| LTX-307 | 16 | K-K-W-Dip-K-K-W-W-K-NH2 |
| LTX-308 | 17 | k-k-W-Dip-k-k-W-W-k-NH2 |
| LTX-309 | 18 | K-K-W-Dip-K-K-W-Dip-K-NH2 |
| LTX-310 | 19 | K-K-W-Bip-K-K-W-W-K-NH2 |
| LTX-312 | 20 | K-Bip-K-K-W-W-K-K-W-NH2 |
| LTX-313 | 21 | K-K-Bip-W-K-K-W-W-K-NH2 |
| LTX-314 | 22 | K-K-W-W-K-K-Dip-W-K-NH2 |
| LTX-315 | 23 | K-K-W-W-K-K-W-Dip-K-NH2 |
| LTX-316 | 24 | K-W-Dip-K-K-W-W-K-K-NH2 |
| LTX-317 | 25 | K-K-W-W-K-W-Dip-K-K-NH2 |
| LTX-318 | 26 | Orn-Orn-W-Dip-Orn-Orn-W-W-Orn-NH2 |
| LTX-319 | 27 | Dap-Dap-W-Dip-Dap-Dap-W-W-Dap-NH2 |
| LTX-320 | 28 | R-R-W-Dip-R-R-W-W-R-NH2 |
| LTX-321 | 29 | K-W-W-K-K-Dip-W-K-K-NH2 |
| LTX-323 | 30 | K-Dip-K-K-W-W-K-K-W-NH2 |
| LTX-324 | 31 | K-K-Dip-W-K-K-W-W-K-NH2 |
| LTX-325 | 32 | k-w-w-k-k-dip-w-k-k-NH2 |
| LTX-326 | 33 | R-R-Bip-W-R-R-W-W-R-NH2 |
| LTX-327 | 34 | R-R-Dip-W-R-R-W-W-R-NH2 |
| LTX-329 | 35 | k-k-bip-w-k-k-w-w-k-NH2 |
| LTX-331 | 36 | k-k-Bip-w-k-k-w-w-k-NH2 |
| LTX-332 | 37 | K-K-bip-W-K-K-W-W-K-NH2 |
| LTX-333 | 38 | Dab-Dab-W-Dip-Dab-Dab-W-W-Dab-NH2 |
| LTX-334 | 39 | K-K-W-1-Nal-K-K-W-W-K-NH2 |
| LTX-335 | 40 | K-K-W-2-Nal-K-K-W-W-K-NH2 |
| LTX-336 | 41 | K-K-W-Ath-K-K-W-W-K-NH2 |
| LTX-338 | 42 | K-K-W-Phe(4-4'Bip)-K-K-W-W-K-NH2 |
В которой:
- стандартный однобуквенный код использован для генетически кодируемых аминокислот
- строчными буквами обозначены D аминокислоты
- Dip представляет собой дифенилаланин
- Bip представляет собой бифенилаланин
- От представляет собой орнитин
- Dap представляет собой 2,3-диаминопропионовую кислоту
- Dab представляет собой 2,4-диаминомасляную кислоту
- 1-Nal представляет собой 1-нафтилаланин
- 2-Nal представляет собой 2-нафтилаланин
- Ath представляет собой 2-амино-3-(антрацен-9-ил)пропановую кислоту
- Phe(4,4'Bip) представляет собой 2-амино-3-[1,1':4',1''-терфенил-4-ил]пропионовую кислоту
Все молекулы, описанные в данной заявке, могут находиться в форме соли, эфира или амида.
Таким образом, в соответствии с настоящим изобретением также предложено соединение, выбранное из группы, состоящей из: LTX-301, LTX-303-LTX-310, LTX-312-LTX-321, LTX-323-LTX-327, LTX-329, LTX-331-LTX-336 и LTX-338, или его соль, эфир или амид. Таким образом, в настоящем изобретении предложено соединение, имеющее формулу, выбранную из группы, состоящей из: SEQ ID NO: 10 и 12-42, или его соль, эфир или амид.
Молекулы предпочтительно представляют собой пептиды и предпочтительно имеют модифицированный, в частности, амидированный С-конец. Амидированные пептиды могут сами находиться в форме соли, и предпочтительны ацетатные формы. Подходящие физиологические приемлемые соли хорошо известны в данной области техники и включают соли неорганических или органических кислот, и включают как трифторацетат, так и ацетат и соли, образованные с HCl.
Молекулы, описанные в данной заявке, являются амфипатическими по природе, их 2° структура, которая может иметь или не иметь склонность к образованию α-спирали, дает амфипатическую молекулу в физиологических условиях.
В следующем аспекте предложены соединения по изобретению, в частности, соединения формул I-V, в частности, пептиды таблицы 1, для применения в терапии, в частности, для применения в качестве противоопухолевого или противоракового агента, где эти термины в данной заявке используют как синонимы.
Соединения проявляют противоопухолевую активность; в частности, они оказывают цитотоксический эффект посредством прямого механизма, влияющего на мембрану. Эти молекулы являются литическими, дестабилизирующими или даже перфорирующими клеточную мембрану. Это обеспечивает особое терапевтическое преимущество по сравнению с агентами, которые действуют на белковые компоненты клеток-мишеней или взаимодействуют с ними, например, с рецепторами клеточной поверхности. Если в результате мутаций могут образоваться новые формы белков-мишеней, что приводит к химиотерапевтической устойчивости, намного менее вероятно, что могут произойти радикальные изменения липидных мембран, которые предотвращают цитотоксический эффект.
Таким образом, в следующем аспекте предложены соединения по изобретению для применения при дестабилизации и/или пермеабилизации мембран опухолевых клеток. Под 'дестабилизацией' подразумевают нарушение нормальной трехмерной конфигурации липидного бислоя, включающее, но не ограниченное этим, утончение мембраны, повышенную мембранную проницаемость (типично без вовлеченности каналов) для воды, ионов или метаболитов и т.д.
В изобретении предложены способы лечения опухолей, как солидных, так и несолидных опухолей, путем введения различных соединений, описанных в данной заявке. Вводимое количество должно быть эффективным для уничтожения всех клеток или доли клеток-мишеней, либо для предотвращения или уменьшения скорости их размножения, либо для ингибирования метастазов, либо для иного уменьшения вредного эффекта опухоли на пациента. Врач или пациент должен наблюдать улучшение одного или более чем одного параметра или симптома, связанного с опухолью. Введение также может быть профилактическим. Пациент типично будет представлять собой пациента-человека, но можно также лечить животных, не являющихся человеком, таких как домашние животные или домашний скот.
В отличие от большинства агентов, которые имеют белковые мишени, молекулы по настоящему изобретению могут быть направлены на широкий ряд раков, как показано в Примерах, приведенных в данной заявке. Предпочтительные раковые мишени включают лимфомы, лейкозы, нейробластомы и глиобластомы (например, головного мозга), карциномы и аденокарциномы (в частности, молочной железы, ободочной кишки, почек, печени, легких, яичника, поджелудочной железы, простаты и кожи) и меланомы. Рак молочной железы является особенно предпочтительной мишенью.
Пептиды по изобретению можно синтезировать любым удобным путем. Как правило, присутствующие реакционные группы (например, амино, тиол и/или карбоксил) будут защищены на протяжении всего синтеза. Конечная стадия в синтезе, таким образом, будет состоять в удалении защиты защищенного производного по изобретению.
При построении пептида можно, в принципе, начать либо с С-конца, либо с N-конца, хотя метод С-концевого начала предпочтителен.
Способы пептидного синтеза хорошо известны в данной области техники, но для настоящего изобретения особенно удобным может быть осуществление синтеза на твердофазном носителе, где такие носители хорошо известны в данной области техники.
Известен широкий выбор защитных групп для аминокислот, и подходящие защитные группы амина могут включать карбобензилокси (также обозначенный Z) трет-бутоксикарбонил (также обозначенный Вос), 4-метокси-2,3,6-триметилбензолсульфонил (Mtr) и 9-флуоренилметоксикарбонил (также обозначенный Fmoc). Также понятно, что, когда пептид строят с С-конца, защитная группа амина будет находиться на α-аминогруппе каждого нового добавленного остатка, и ее будет необходимо селективно удалить перед следующей стадией сочетания.
Защитные группы карбоксила, которые можно, например, использовать, включают легко расщепляемые эфирные группы, такие как бензильная (Bzl), пара-нитробензильная (ONb) или трет-бутильная (OtBu) группы, а также сочетающие группы на твердых носителях, например, амид Ринка, связанный с полистиролом.
Защитные группы тиола включают пара-метоксибензил (Mob), тритил (Trt)и ацетамидометил (Acm).
Предпочтительные пептиды по изобретению могут быть удобно получены с использованием защитной группы трет-бутоксикарбонил (Boc) для аминных боковых цепей Lys, Orn, Dab и Dap, а также для защиты индольного атома азота остатков триптофана. Fmoc можно использовать для защиты альфа-аминогрупп. Для пептидов, содержащих Arg, можно использовать 2,2,4,6,7-пентаметилдигидробензофуран-5-сульфонил для защиты гуанидина боковой цепи.
Существует широкий ряд методов для удаления защитных групп амина и карбоксила. Они должны быть, однако, согласованы с используемой стратегией синтеза. Защитные группы боковой цепи должны быть стабильны по отношению к условиям, используемым для удаления временных защитных групп α-аминогруппы перед следующей стадией сочетания.
Защитные группы амина, такие как Вое, и защитные группы карбоксила, такие как tBu, можно удалять одновременно путем обработки кислотой, например, трифторуксусной кислотой. Защитные группы тиола, такие как Trt, можно удалять селективно, используя агент окисления, такой как йод.
Ссылки и методы синтеза пептидомиметических соединений и других биоактивных молекул по изобретению описаны в данной заявке и, таким образом, хорошо известны в данной области техники.
Препараты, содержащие одно или более чем одно соединение по изобретению в смеси с подходящим разбавителем, носителем или эксципиентом, составляют следующий аспект настоящего изобретения. Такие препараты могут быть предназначены среди прочего для фармацевтических (включая ветеринарные) целей. Подходящие разбавители, эксципиенты и носители известны специалисту в данной области техники.
Хотя для соединений по настоящему изобретению (или их солей, эфиров или амидов) возможно их введение в виде чистых соединений, предпочтительно представлять их в виде фармацевтических препаратов. Таким образом, препараты в соответствии с настоящим изобретением предпочтительно содержат по меньшей мере одно соединение, его соль, эфир или амид, как определено выше, вместе по меньшей мере с одним другим терапевтическим ингредиентом. Таким образом, настоящее изобретение распространяется на комбинированные препараты, включающие соединение по настоящему изобретению (или его соль, эфир или амид) и по меньшей мере один другой терапевтический ингредиент.
Способы лечения опухолей, которые включают введение пациенту-человеку или животному одного или более чем одного соединения, как описано в данной заявке, составляют следующий аспект настоящего изобретения.
Композиции в соответствии с изобретением могут быть представлены, например, в форме, пригодной для перорального, местного, назального, парентерального, внутривенного, внутриопухолевого, ректального или регионарного (например, изолированная перфузия конечностей) введения. Введение типично осуществляют парентеральным путем, предпочтительно путем инъекции подкожно, внутримышечно, интракапсулярно, интраспинально, интратуморально или внутривенно.
Активные соединения, определенные в данной заявке, могут быть представлены в общепринятых фармакологических формах введения, таких как таблетки, таблетки с покрытием, назальные спреи, растворы, эмульсии, липосомы, порошки, капсулы или формы пролонгированного высвобождения. Для приготовления этих форм можно использовать общепринятые фармацевтические эксципиенты, а также обычные способы получения.
Можно также использовать органоспецифические системы носителей.
Инъекционные растворы могут быть получены общепринятым способом, как, например, путем добавления консервирующих агентов, таких как пара-гид роксибензоаты, или стабилизаторов, таких как ЭДТА. Затем растворы заполняют во флаконы или ампулы для инъекций.
Предпочтительными препаратами являются те, в которых пептиды растворены в физиологическом растворе. Такие препараты пригодны для применения в предпочтительных способах введения, в частности, при локальном введении, то есть внутриопухолевом, например, путем инъекции или предпочтительно изолированной перфузии/инфузии (включая частичную изоляцию) конечности, области тела или органа.
Лекарственные формы, содержащие активные молекулы, предпочтительно содержат 0,1-10 мг, например, 1-5 мг противоопухолевого агента. Фармацевтические композиции могут дополнительно содержать дополнительные активные ингредиенты, включая другие цитотоксические агенты, такие как другие противоопухолевые пептиды. Другие активные ингредиенты могут включать различные типы цитокинов, например, IFN-γ, TNF, CSF, а также факторы роста, иммуномодуляторы, химиотерапевтические агенты, например, цисплатин, либо антитела или противораковые вакцины.
При применении таких композиций системно активная молекула присутствует в таком количестве, чтобы достичь сывороточного уровня биоактивной молекулы по меньшей мере примерно 5 мкг/мл. Как правило, сывороточный уровень не должен превышать 500 мкг/мл. Предпочтительный сывороточный уровень составляет примерно 100 мкг/мл. Такие сывороточные уровни могут быть достигнуты путем включения биоактивной молекулы в композицию, которую нужно вводить системно в дозе от 1 до примерно 10 мг/кг. Как правило, молекулу(ы) не следует вводить в дозе, превышающей 100 мг/кг.
В соответствии с настоящим изобретением также предложено соединение, его соль, эфир или амид в соответствии с настоящим изобретением в комбинации по меньшей мере с одной вакциной.
Как подробно описано ниже, эксперименты показали, что профилактическая вакцинация опухолевыми клетками, лизированными LTX-315, приводит в результате к ингибированию опухолевого роста, и показано, что соединения по настоящему изобретению высокоэффективны в качестве вакцинных адъювантов, и, следовательно, настоящее изобретение распространяется на применение соединений (или их солей, эфиров или амидов) в комбинации по меньшей мере с одной вакциной. Предпочтительные вакцины включают, но не ограничены ими, противораковые вакцины, содержащие по меньшей мере один белок и/или пептид с аминокислотными последовательностями, соответствующими иммуногенной последовательности (последовательностям) из опухолевого антигена(ов) (ТАА), где предпочтительными ТАА, но не ограниченными ими, являются теломераза, сурвивин, онкогенный р21, ras, abl, gip, gsp, ret, terk, и антивирусные вакцины, содержащие по меньшей мере один белок и/или пептид с аминокислотной последовательностью (последовательностями), соответствующей иммуногенным последовательностям из вирусного белка(ов). Кроме того, можно использовать лизат опухоли. Примеры предпочтительных вакцин включают вакцины, пептиды, пептидные фрагменты и иммуногены, заявленные WO 92/14756, WO 00/66153 (NO 309798), WO 00/02581, WO 02/051994, WO 02/070679, WO 02/094312, WO 99/58552 и WO 99/58564.
В соответствии с настоящим изобретением также предложено применение соединения, его соли, эфира или амида или комбинации в соответствии с настоящим изобретением при изготовлении лекарства, в частности, при изготовлении лекарства для лечения рака и/или при изготовлении вакцины.
Предпочтительно лекарство предназначено для лечения опухолей с множественной лекарственной устойчивостью (MDR, multidrug resistant tumours).
В соответствии с настоящим изобретением также предложена фармацевтическая упаковка, содержащая:
(i) по меньшей мере одну вакцину; и
(ii) соединение, соль, эфир или амид в соответствии с настоящим изобретением.
С помощью фармацевтических упаковок вакцину и соединение, соль, эфир или амид можно вводить отдельно (например, с задержкой по времени по меньшей мере примерно или не более чем 1, 2, 3, 4, 5, 10, 15, 20, 25, 30, 45, 60, 90 или 120 минут). Фармацевтическая упаковка может, конечно, также включать инструкции по введению.
В соответствии с настоящим изобретением также предложен способ лечения опухоли, включающий стадию введения фармацевтически эффективного количества соединения, соли, эфира или амида или комбинации в соответствии с настоящим изобретением пациенту, нуждающемуся в этом.
В соответствии с настоящим изобретением также предложен способ вакцинации, включающий стадию введения пациенту фармацевтически эффективного количества соединения, соли, эфира или амида или комбинации в соответствии с настоящим изобретением.
В соответствии с настоящим изобретением также предложен способ изготовления лекарства, включающий смешивание соединения, имеющего формулу SEQ ID NO: 23 (LTX-315), или его соли, эфира или амида с фармацевтически приемлемым носителем, разбавителем или эксципиентом.
В соответствии с настоящим изобретением также предложен способ изготовления лекарства, включающий смешивание соединения, имеющего формулу SEQ ID NO: 23 (LTX-315), или его соли, эфира или амида с опухолевыми клетками.
Теперь изобретение будет дополнительно описано в приведенных ниже Примерах и со ссылкой на графические материалы, в которых:
Фиг.1 представляет собой график, показывающий процент гибели эритроцитов в серии экспериментов по тестированию пептида LTX-315 при варьирующих концентрациях. На оси Х показана концентрация пептида (мкг/мл). На оси Y показан % гибели клеток;
На фиг.2 показан опухолевый рост у мышей, повторно инокулированных клетками А20 В-кпеточной лимфомы мыши по сравнению с ростом у контрольных животных из первоначального исследования. Ромбиками показаны контроли из первоначальных исследований. Сплошными квадратами показаны повторно инокулированные мыши;
На фиг.3 показан опухолевый рост у индивидуальных мышей, повторно инокулированных клетками В-клеточной лимфомы мыши А20, которые были первоначально обработаны LTX-315. Квадратами показана мышь 1. Треугольниками (основанием вниз) показана мышь 2. Треугольниками (основанием вверх) показана мышь 3. Ромбиками показана мышь 4;
На фиг.4 показан опухолевый рост у индивидуальных мышей, повторно инокулированных клетками карциномы ободочной кишки мыши CT26WT по сравнению с ростом у контрольных животных. Ромбиками показаны контроли из первоначальных исследований. Сплошными квадратами показаны неоднократно инокулированные мыши;
На фиг.5 показан опухолевый рост у индивидуальных мышей, повторно инокулированных клетками карциномы ободочной кишки мыши CT26WT, которые были первоначально обработаны LTX-315. Маленькими квадратиками показана мышь 1. Маленькими треугольниками (основанием вниз) показана мышь 2. Маленькими треугольниками (основанием вверх) показана мышь 3. Маленькими ромбиками показана мышь 4. Кружками показана мышь 5. Большими квадратами показана мышь 6. Большими треугольниками (основанием вниз) показана мышь 7. Большими треугольниками (основанием вверх) показана мышь 8. Большими ромбиками показана мышь 9;
На фиг.6 показан рост клеток В-клеточных лимфом А20 у облученных мышей, которые получили спленоциты от донорных мышей, проявляющих полную регрессию опухоли после обработки LTX-315 (группа 1), или контрольных мышей (группа 2), которые получили спленоциты от донорных мышей, ранее не подверженных экспериментам. Квадратами показана группа 1 (мыши, которые получили спленоциты от доноров, проявляющих полную регрессию). Ромбиками показана группа 2 (мыши, которые получили спленоциты от доноров, ранее не подверженных экспериментам);
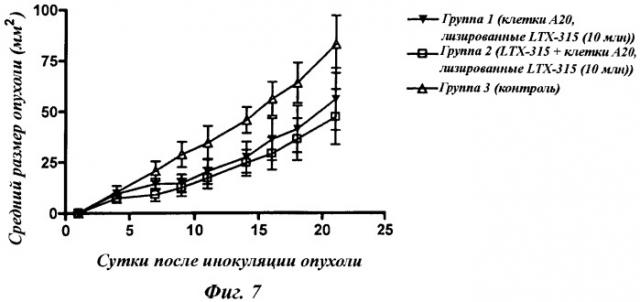
На фиг.7 показан противораковый эффект двух различных режимов обработки на солидных опухолях мышей А20 (группы 1 и 2) по сравнению с необработанными контролями (группа 3). Перевернутыми сплошными треугольниками (основанием вверх) показана группа 1 (обработка). Пустыми квадратами показана группа 2 (обработка + адъювант). Пустыми треугольниками (основанием вниз) показана группа 3 (контроль). Порядок по размеру опухоли (мм2) на сутки 21 является следующим (от наибольшего к наименьшему): группа 3, группа 1, группа 2.
В итоге, в приведенных ниже Примерах показано:
Пример 1 - что LTX-315 является самым эффективным из 5 протестированных соединений в исследовании цитотоксической активности in vitro против панели из 37 раковых клеточных линий человека.
Пример 2 - что LTX-315 является самым эффективным из 5 протестированных соединений в исследовании цитотоксической активности in vitro против панели из 10 клеточных линий лимфомы.
Пример 3 - что LTX 315 имеет среднее значение ЕС50 более чем 1200 мкг/мл (833 мкМ) против эритроцитов человека.
Пример 4 - что противоопухолевая активность LTX-315 приводила в результате к полному ответу опухоли у 3 из 7 обработанных мышей на группу, получающую оптимальную дозу (группа 1) в исследовании на эффект LTX-315 при различных уровнях дозы на клетках В-клеточной лимфомы мыши А20 у мышей.
Пример 5 - что четыре различных режима обработки LTX-315 продемонстрировали сильный противоопухолевый эффект против опухолей CT26WT мыши (с множественной лекарственной устойчивостью).
Пример 6 - что LTX-315 обладает широким спектром активности против различных раковых клеточных линий с множественной лекарственной устойчивостью и значимо намного более слабый цитотоксический эффект на нормальные клетки человека.
Пример 7 - что полная регрессия опухоли вследствие первоначальной обработки солидных опухолей мышей LTX-315 привела в результате к формированию долговременной эндогенной защиты против роста тех же опухолей после повторной инокуляции.
Пример 8 - что обработка LTX-315 может придавать долговременную защиту против специфичных опухолей путем вызова иммунного ответа.
Пример 9 - что иммунный ответ против клеток А20 индуцирован инъекцией смеси LTX-315 и лизированных клеток А20.
Пример 1
Исследование цитотоксической активности in vitro 5 тестируемых соединений против панели из 37 раковых клеточных линий человека
1. ЦЕЛЬ ИССЛЕДОВАНИЯ
- Определить концентрации пяти новых соединений для получения 50% ингибирования пролиферации (IC50) против панели из 37 раковых клеточных линий человека.
2. МАТЕРИАЛЫ И МЕТОДЫ
2.1. Тестируемые вещества
2.1.1. Тестируемые вещества
- Тестируемые вещества, LTX-302, LTX-313, LTX-315, LTX-320 и LTX-329 (см. таблицу 1) представлены в порошкообразной форме.
2.1.2. Положительный контроль
- В качестве положительного контроля использовали Тритон Х-100, поставляемый фирмой Oncodesing (Дижон, Франция) от Sigma (Сен-Кантен-Фалавье, Франция).
2.1.3. Растворитель лекарства и условия хранения
- Соединения хранили при 4°С. Сначала порошок растворяли в культуральной среде без сыворотки (RPMI 1640, Lonza, Вервье, Бельгия) и дополнительно разводили, используя культуральную среду без сыворотки, до достижения соответствующих разведении. Исходный раствор не хранили и готовили свежий на сутки эксперимента.
- 1% (конечная концентрация) Тритон Х-100 был получен путем разведения с использованием культуральной среды.
2.2. Опухолевые клеточные линии и условия культивирования
2.2.1. Опухолевые клеточные линии
Раковые клеточные линии и культуральные среды были приобретены и поставлены фирмой Oncodesign.
| Клеточные линии | Происхождение | Источник |
| КРОВЬ | ||
| CCRF-CEM | острый лимфобластный лейкоз, Т клетки | Pharmacella |
| CCRF-CEM/VLB | острый лимфобластн |