Слитый белок или пептид с увеличенным временем полужизни in vivo, поддерживаемый за счет замедленного высвобождения in vivo, и способ увеличения времени полужизни in vivo с его применением
Иллюстрации
Показать всеНастоящее изобретение относится к области биотехнологии, конкретно к созданию лекарственных препаратов с замедленным высвобождением белковых или пептидных лекарственных средств, и может быть использовано в медицине. Физиологически активный белок или полипептид сливают с вариантом альфа-1-антитрипсина, имеющим по меньшей мере один мутированный аминокислотный остаток. Мутации производят в следующих положениях: остаток аспарагина вместо остатка пролина в положении 357; или остаток аспарагина вместо остатка пролина в положении 357 и остаток треонина вместо серина в положении 359; или остаток аспарагина вместо остатка пролина в положении 357 и остаток серина вместо цистеина в положении 232; или остаток аспарагина вместо остатка пролина в положении 357, остаток треонина вместо серина в положении 359 и остаток серина вместо цистеина в положении 232. Изобретение позволяет увеличить время полужизни физиологически активного белка или полипептида in vivo путем поддержания его устойчивой циркуляции в крови. 2 н. и 5 з.п. ф-лы, 13 ил., 7 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к слитому белку или пептиду, который имеет увеличенное время полужизни in vivo, и к способу увеличения времени полужизни in vivo белка или пептида с его применением.
Уровень техники
Белковые и пептидные лекарственные средства обладают отличными терапевтическими эффектами в случае, когда нет возможности проводить лечение с помощью обычных синтетических химических лекарственных средств, и, следовательно, занимают важное положение в медицине и фармакологии. Например, рекомбинантный гормон роста человека (hGH) представляет собой единственное эффективное терапевтическое средство для лечения дефицита гормона роста, а рекомбинантный эритропоэтин человека (ЕРО) применяют при лечении анемии, возникающей в результате хронической болезни почек, благодаря его способности увеличивать уровень эритроцитов, и рекомбинантный гранулоцитарный колониестимулирующий гормон (G-CSF) применяют в качестве единственного лекарственного средства для увеличения уровня лейкоцитов в крови у пациентов с раком после химиотерапии. Кроме того, обнаруженные в организме различные типы цитокинов, гормонов и пептидов применяют в качестве единственной терапии для широкого спектра заболеваний, для которых не существует других доступных в настоящее время альтернатив.
Хотя белковые или пептидные лекарственные средства демонстрируют отличные терапевтические эффекты in vivo, они быстро теряют свою терапевтическую активность и, таким образом, они имеют короткие периоды полужизни in vivo, поскольку сразу же после инъекции происходит их деградация под действием протеиназ крови или они легко удаляются из крови почками или печенью. Следовательно, их недостаток в том, что они требуют частых инъекций с целью поддержания их постоянного уровня в крови или их постоянного титра. Пациенты менее охотно соглашаются на прием лекарственного средства, вводимого с помощью частых инъекций, из-за боязни инъекций и их болезненности или беспокойства, причиняемого повторными введениями, если их применяют в течение длительного периода.
Постоянно проводят множество исследований с целью увеличить стабильность белковых и пептидных лекарственных средств в крови и сохранить уровень лекарственных средств в крови в течение длительного промежутка времени.
Например, были разработаны лекарственные формы с замедленным высвобождением лекарственных средств путем создания композиций терапевтически активного белка или пептида с биологически разлагаемым полимером, который позволяет белкам или пептидам медленно высвобождаться из места инъекции. Если лекарственное средство с замедленным высвобождением вводят с помощью подкожной или внутримышечной инъекции, то лекарственное средство медленно высвобождается для поддержания постоянного уровня лекарственного средства в течение определенного периода времени (М. Chasin & R. Langer, et al., Biodegradable polymer as drug delivery system. Marcel Dekker (1990); J.Heller, et al., Adv. Drug Del Rev., 10, 163 (1993)). Среди биологически разлагаемых полимеров, широко применяют PLGA (сополимер молочной и гликолевой кислот). Например, была создана лекарственная форма с замедленным высвобождением пептидного агониста LHRH (лютеинизирующего гормона высвобождающий фактор), и было обнаружено, что это изделие высвобождает пептид in vivo в течение одного или трех месяцев. Применяют биологически разлагаемые полимеры и вместе с высокомолекулярными белками. Например, патент США №.6,500,448 раскрывает фармацевтическую композицию для замедленного высвобождения гормона роста человека, которая включает биологически совместимый полимер и частицы гормона роста человека в комплексе с катионами металла. В другом исследовании, в патенте Кореи №№.10-0236771 и 10-0329336, описано применение гиалуроновой кислоты для создания микрочастиц с замедленным высвобождением белковых лекарственных средств, в том числе рекомбинантного гормона роста человека.
Несмотря на то, что для замедленного высвобождения лекарственных средств, успешно применяют биологически разлагаемые полимеры для низкомолекулярных пептидов, существуют ограничения в отношении их применения для высокомолекулярных белков. Причина этого заключается в том, что белки легко денатурируют в ходе изготовления микрочастиц для замедленного высвобождения и денатурированные аминокислоты снижают активность белка, что может вызвать некоторые нежелательные иммунные ответы в организме человека. Кроме того, размер микрочастиц для замедленного высвобождения белков или пептидов бывает обычно большим, что требует применения толстых игл для шприца при введении с помощью инъекции в организм человека и вызывает болезненные ощущения в месте инъекции. Также, микрочастицы невыгодны с точки зрения экономики из-за низких выходов при производстве изделий для коммерческих целей.
С целью преодоления вышеуказанных проблем, были проведены исследования, направленные на замедление почечного клиренса белков или пептидов. В общем, белки с молекулярной массой, равной 60000 дальтон или менее, проходят через почки без задержки. Следовательно, были предприняты попытки увеличения низкой молекулярной массы пептидных или белковых терапевтических средств для того, чтобы продлить время циркуляции в крови т vivo, снижая, таким образом, частоту инъекций. В соответствии с этими методиками, физиологически активные белки и пептиды обеспечивают не в форме с замедленным высвобождением, а скорее в форме с длительным действием.
Одна из наиболее популярных стратегий, применяемых для снижения частоты инъекций, заключается в присоединении хорошо растворимого полимера, такого как полиэтиленгликоль (в дальнейшем в этой заявке обозначен как «ПЭГ») к поверхности фармацевтически активных белков или пептидов. ПЭГ может быть неспецифически присоединен к аминогруппе аминокислот белков или пептидов. ПЭГилирование может обеспечить растворимость в воде для гидрофобных лекарственных средств и белков и увеличивает гидродинамический размер средства для продления времени циркуляции в крови после введения с помощью инъекции в организм (Sada et al., J. Ferment Bioeng 71, 137-139, 1991).
Недавно, был налажен серийный выпуск ПЭГилированного интерферона-альфа с целью уменьшить частоту инъекций. Кроме того, Kinstler et al. показали, что одна инъекция ПЭГилированного гранулоцитарного колониестимулирующего фактора (G-CSF) в неделю (один цикл химиотерапии) имеет такое лечебное действие, какое производят инъекции G-CSF, проводимые три раза в неделю (Kinstler et al., Pharm Res 12, 1883-1888, 1995). ПЭГ-GCSF доступен для приобретения под торговым наименованием «Neulast».
Поскольку ПЭГилирование белка происходит в результате неспецифического ковалентного присоединения ПЭГ к поверхности белка, в ПЭГилированном участке может быть затруднено взаимодействие белка с его рецептором, что существенно снижает активность белка in vivo. Кроме того, ПЭГилирование представляет собой несколько трудоемкую процедуру, поскольку белки, ПЭГилированные по физиологически активному участку, должные быть удалены в процессе очистки, чтобы оставались только такие конъюгаты ПЭГ-белок, у которых активность была бы снижена минимально. Следовательно, в этом процессе выход желаемых конъюгатов ПЭГ-белок существенно снижен, что приводит к неблагоприятной с точки зрения экономики ситуации. Кроме того, что касается некоторых белков, которые нестабильны в водных растворах, то попытки конъюгировать их с ПЭГ потерпели неудачу.
Кроме того, частоту инъекций снижают с помощью гликоинженерной методики, применяемой в настоящее время в коммерческом производстве. Elliot et al. сообщили о дополнительном гликозилировании эритропоэтина (ЕРО) путем замещения аминокислот в определенных положениях {Nat Biotechnol 21, 414-421, 2003; патент США №.7,217,689). Эритропоэтин, модифицированный гликоинженерными способами, в настоящее время доступен для приобретения под торговым наименованием «Aranesp», и известно, что благодаря добавлению цепей Сахаров с сиаловой кислотой на конце и увеличению молекулярной массы замедляется циркуляция в кровотоке, метаболизм и экскреция модифицированного эритропоэтина. Однако гликоинженерию не используют широко для введения дополнительных участков гликозилирования белков, поскольку присоединение или добавление цепей Сахаров может привести к инактивации физиологически активного белка, и ее способность поддерживать стабильность т vivo не была подтверждена для многих белков. И набор участков физиологически активного белка, к которым могут быть дополнительно присоединены цепи Сахаров, очень невелик. Кроме того, гликоинженерию трудно применять в случае пептидов с низкой молекулярной массой.
Развитие генной инженерии позволило увеличить размер физиологически активного белка путем слияние его с высокомолекулярным белком (Curr Opin Drug Discov Devel 12, 284-295, 2009). Например, ген физиологически активного белка сливают с геном альбумина человека и затем экспрессируют в дрожжевых клетках для получения слитого белка (международные публикации патента №№WO 93/15199 и WO 93/15200). Примеры физиологически активных белков, слитых с альбумином, включают гранулоцитарный колониестимулирующий фактор (Halpem et al., Pharm Res 19, 1720-1729, 2002), гормон роста человека (Osborn et al., Eur J Pharmacol 456, 149-158, 2002), глюкагон-подобный пептид-1 (Baggio et al., Diabetes 53, 2492-2500, 2004), и интерферон-альфа (Osbom et al., J Pharmacol Exp Ther 303, 540-548, 2002).
Известны также слитые белки с трансферрином, полученные с помощью методики рекомбинантного слияния. Например, патент США №7,176,278 раскрывает слитую молекулу, в которой глюкагон-подобный пептид-1 слит с природным трансферрином или дегликозилированным трансферрином, и время его полужизни in vivo увеличивается.
При этом время полужизни белка in vivo может быть продлено путем слияния с Fc-фрагментом иммуноглобулина (Ig) (патенты США №5,116,964 и №5,605,690). Слитый ген фрагмента рецептора TNF-α и фрагмента IgG1 Fc экспрессируют в животных клетках (клетках яичника китайского хомячка, СНО), трансформированных геном, кодирующим слитый белок, и слитый белок в настоящее время доступен для приобретения (торговое наименование: Enbrel) после одобрения USFDA в качестве терапевтического средства для лечения ревматоидного артрита. Кроме того, Wang удалось (Qinghua Wang; WO 2007/012188) удлинить время полужизни in vivo GLP-1 (t1/2<2 мин) или эксендина-4 с коротким временем полужизни путем слияния с Fc-фрагментом Ig.
Несмотря на то, что Ig Fc широко применяют в качестве носителя для слитых белков с целью увеличения времени полужизни in vivo, IgG1 Fc сохраняет свою собственную антителозависимую клеточную цитотоксичность (ADCC) или комплементзависимую цитотоксичность (CDC). Таким образом, при введении в организм с помощью инъекции, слитый белок физиологически активного белка с IgG1 Fc может вызвать комплексные иммунные ответы. Кроме того, повторное введение Fc-слитых белков в течение длительного периода времени может привести к продукции нежелательных антител. Следовательно, применение белков, слитых с IgG1 Fc, имеет ограничение при применении в медицинской практике.
Патент Кореи №10-0725315 раскрывает белковый комплекс с применением фрагмента иммуноглобулина и способ его получения, в котором физиологически активный белок сливают с IgG Fc через ПЭГ. «Белковый комплекс», имеющий структуру физиологически активный белок-ПЭГ-Fc, обладает более продолжительным временем полужизни in vivo, по сравнению с физиологически активным белком, согласно данным фармакокинетических анализов. Однако похожие недостатки или проблемы, показанные для способа слияния с Fc, также можно наблюдать и для «белкового комплекса», поскольку физиологически активный белок и Fc-фрагмент химически связаны молекулой ПЭГ.
Другой пример применения иммуноглобулина для увеличения стабильности пептидного лекарственного средства in vivo представляет собой слияние целой молекулы антитела IgG и низкомолекулярного пептида (Rader et al, Proc. Natl. Acad. Sci. США 100, 5396-5400, 2003, Doppalapudi et al., Bioorg & Med Chew 17, 501-506, 2007). Однако эта методика, называемая «CovX-Body», не может быть применена к высокомолекулярным белкам, и ее применение ограничено из-за проблем, возникающих при получении Fc-слитых белков или ПЭГ-слитых белков.
Как описано выше, множество попыток было предпринято для слияния биополимера с физиологически активным белком или терапевтическим пептидом, но они могут быть применены только к ограниченному кругу белков или пептидов по следующим причинам: время существования in vivo не достаточно продолжительно для разработки слитого белка для медицинских целей; очень низкий выход при получении, делающий производство экономически невыгодным; нежелательные иммунные ответы, когда их используют в течение длительного времени; и нежелательное остаточное присутствие токсических химических производных, когда их используют для конъюгации с белками или пептидами. Следовательно, существует необходимость в новых слитых белках или пептидах, которые могут продлевать время полужизни in vivo физиологически активных белков или пептидов, с минимальной потерей активность in vivo.
Раскрытие изобретения
Техническая задача
Приведшее к настоящему изобретению интенсивное и тщательное исследование слитых белков или пептидов, которые имеют увеличенное время полужизни т vivo и минимальную потерю активности in vivo, проведенное авторами настоящего изобретения, привело к обнаружению того, что альфа-1-антитрипсин или его вариант позволяют слитому с ним физиологически активному белку или пептиду поддерживать устойчивую циркуляцию in vivo и, таким образом, увеличивают стабильность in vivo и время полужизни in vivo (Т1/2), по сравнению с собственными свойствами белка или пептида.
Техническое решение
Настоящее изобретение обеспечивает слитый белок или пептид с увеличенным временем полужизни in vivo с поддержанием его устойчивой циркуляции, и способ увеличения времени полужизни in vivo белка или пептида с применением того же.
Описание чертежей
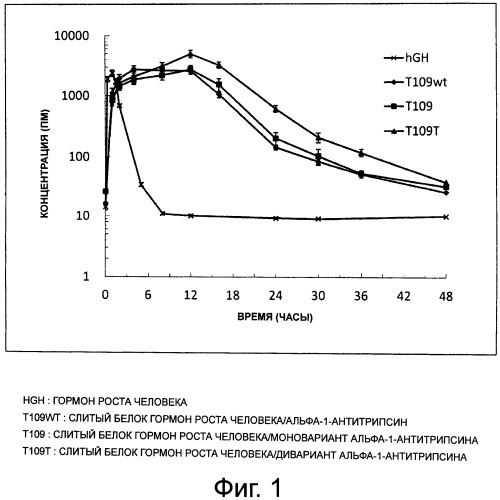
Фиг.1 представляет собой график, демонстрирующий фармакокинетическое поведение слитого белка гормон роста человека/альфа-1-антитрипсин [T109wt: α1AT/hGH], гормон роста человека/моновариант альфа-1-антитрипсина [Т109: α1AT(P357N)/hGH] и гормона роста человека/дивариант альфа-1-антитрипсина [Т109Т: α1AT(P357N, S359T)/hGH].
Фиг.2 представляет собой график, демонстрирующий фармакокинетическое поведение слитого белка интерферон-альфа человека/моновариант альфа-1-антитрипсина [Т502: α1AT(P357N)/IFN-α].
Фиг.3 представляет собой график, демонстрирующий фармакокинетическое поведение слитого белка гранулоцитарный колониестимулирующий фактор/дивариант альфа-1-антитрипсина [T602S: α1AT(P357N, C232S)/G-CSF] и слитого белка гранулоцитарный колониестимулирующий фактор/тривариант альфа-1-антитрипсина [T602ST: α1AT(P357N, C232S, S359T)/G-CSF].
Фиг.4 представляет собой график, демонстрирующий фармакокинетическое поведение слитого белка эксендин-4/моновариант альфа-1-антитрипсина [Т304: Эксендин-4/α1AT(P357N)].
Фиг.5 представляет собой график, демонстрирующий in vivo активность (изменение массы тела у крыс с удаленным гипофизом) слитого белка моновариант гормона роста человека/альфа-1-антитрипсин [Т109: α1AT(P357N)/hGH].
Фиг.6 представляет собой график, демонстрирующий in vivo активности (увеличение количества лейкоцитов) слитого белка гранулоцинарный колониестимулирующий фактор/дивариант альфа-1-антитрипсина [T602S: α1AT(P357N, C232S)/G-CSF] и слитого белка гранулоцитарный колониестимулирующий фактор/ тривариант альфа-1-антитрипсина [T602ST: α1AT(P357N, C232S, S359T)/G-CSF].
Фиг.7 представляет собой график, демонстрирующий результаты внутрибрюшинного теста на толерантность к глюкозе, проведенного с слитым белком эксендин-4/моновариант альфа-1-антитрипсина [Т304: Эксендин-4/α1AT(P357N)].
Фиг.8 представляет собой график, демонстрирующий влияние слитого белка эксендин-4/моновариант альфа-1-антитрипсина [Т304: Эксендин-4/α1AT(Р357Н)] на уровень сахара в крови в моделях диабета на мышах.
Фиг.9 представляет собой график, демонстрирующий внутриклеточную активность слитого белка гормон роста человека/альфа-1-антитрипсин [T109wt: α1AT/hGH], слитого белка гормона роста человека/моновариант альфа-1-антитрипсина [Т109: α1AT(P357N)/hGH] и слитого белка гормона роста человека/дивариант альфа-1-антитрипсина [Т109Т: α1AT(P357N, S359T)/hGH].
Фиг.10 представляет собой график, демонстрирующий внутриклеточную активность слитого белка гранулоцитарный колониестимулирующий фактор/дивариант альфа-1-антитрипсина [T602S: α1AT(P357N, C232S)/G-CSF] и слитого белка гранулоцитарный колониестимулирующий фактор/тривариант альфа-1-антитрипсина [T602ST: α1AT(P357N, C232S, S359T)/G-CSF].
Фиг.11 представляет собой график, демонстрирующий ингибирующую активность слитого белка гормон роста человека/альфа-1-антитрипсин [T109wt: α1AT/hGH] и слитого белка гормона роста человека/моновариант альфа-1-антитрипсина [Т109: α1AT(P357N)/hGH] в отношении трипсина.
Фиг.12 представляет собой график, демонстрирующий ингибирующую активность слитого белка гормон роста человека/альфа-1-антитрипсин [T109wt: α1AT/hGH] и слитого белка гормона роста человека/моновариант альфа-1-антитрипсина [Т109: α1AT(P357N)/hGH] в отношении эластазы нейтрофилов человека.
Фиг.13 представляет собой фотографии, демонстрирующие полосы слитого белка гормон роста человека/альфа-1-антитрипсина [T109wt: α1AT/hGH] и слитого белка гормона роста человека/моновариант альфа-1-антитрипсина [Т 109: α1AT(P357N)/hGH] и слитого белка гормон роста человека/дивариант альфа-1-антитрипсина [Т109Т: α1AT(P357N, S359T)/hGH] после электрофореза в SDS-полиакриламидном геле.
Лучший способ осуществления изобретения
В соответствии с аспектом настоящего изобретения обеспечивают слитый белок или пептид с увеличенным временем полужизни in vivo, в котором физиологически активный белок или пептид слит с альфа-1-антитрипсином, в результате чего физиологически активный белок или пептид может долговременно циркулировать in vivo.
В соответствии с другим аспектом настоящего изобретения обеспечивают слитый белок или пептид с увеличенным временем полужизни in vivo, в котором физиологически активный белок или пептид слит с вариантом альфа-1-антитрипсина, мутированным по одному или нескольким аминокислотным остаткам, в результате чего физиологически активный белок или пептид может долговременно циркулировать in vivo.
В соответствии с дальнейшим аспектом настоящего изобретения обеспечивают способ увеличения времени полужизни in vivo у физиологически активного белка или пептида, включающий слияние физиологически активного белка или пептида с альфа-1-антитрипсином или с вариантом альфа-1-антитрипсина, имеющим одну или несколько мутированных аминокислот, в результате чего физиологически активный белок или пептид может долговременно циркулировать in vivo.
Ниже приведено осуществление настоящего изобретения.
Слитый белок или пептид в соответствии с настоящим изобретением представляет собой пример применения альфа-1-антитрипсина или варианта альфа-1-антитрипсина для поддержания устойчивой циркуляции физиологически активного белка или пептида для увеличения времени полужизни in vivo путем слияния с ним физиологически активного белка или пептида.
Как применен в настоящей заявке, термин «слитый белок/слитый полипептид» означает новую белковую молекулу, в которой физиологически активный белок с большой молекулярной массой слит с N- или С-концом альфа-1-антитрипсина или варианта альфа-1-антитрипсина. Подобным образом, термин «слитый пептид», как применен в настоящей заявке, означает новую пептидную молекулу, в которой физиологически активный пептид с низкой молекулярной массой слит с N- или С-концом альфа-1-антитрипсина или варианта альфа-1-антитрипсина.
Физиологически активный белок или пептид могут быть слиты непосредственно или через линкер, состоящий из аминокислот, с альфа-1-антитрипсином или вариантом альфа-1-антитрипсина, мутированного по одной или нескольким аминокислотам.
Предпочтительно, для слияния физиологически активного белка или пептида с альфа-1-антитрипсином или вариантом альфа-1-антитрипсина, мутированного по одной или нескольким аминокислотам, применяют методику генетической рекомбинации. Альтернативно, для слияния физиологически активного белка или пептида с N- или С-концом или свободной группой альфа-1-антитрипсина или варианта альфа-1-антитрипсина, мутированного по одной или нескольким аминокислотам, может быть применен линкер, хорошо известный в этой области техники.
Среди физиологически активных белков есть гормоны и их рецепторы, модификаторы биологического ответа и их рецепторы, цитокины и их рецепторы, ферменты, антитела и фрагменты антител. Конкретные примеры физиологически активных белков включают гормон роста человека (hGH), инсулин, фолликулостимулирующий гормон (FSH), хорионический гонадотропин человека, паратиреоидный гормон (РТН), эритропоэтин (ЕРО), тромбопоэтин (ТРО), гранулоцитарный колониестимулирующий фактор(О-CSF), гранулоцитарно-макрофаговый колониестимулирующий фактор (GM-CSF), интерферон-альфа, интерферон-бета, интерферон-гамма, интерлейкины, макрофаг активирующий фактор, фактор некроза опухолей, тканевой активатор плазминогена, фактор коагуляции VII, VIIa, VIII и IX, костный морфогенетический белок человека 2 (hBMP2), фактор роста кератиноцитов (KGF), фактор роста тромбоцитов (PDGF), глюкоцереброзидазу, α-галактозидазу А, α-L-идуронидазу, идуронат-2-сульфатазу, лактазу, аденозиндеаминазу, бутирилхолинэстеразу, хитиназу, глутаматдекарбоксилазу, имиглюцеразу, липазу, уриказу, ацетилгидролазу фактора активации тромбоцитов, нейтральную эндопептидазу, урокиназу, стрептокиназу, миелопероксидазау, супероксиддисмутазу, ботулотоксин, коллагеназу, гиалуронидазу, L-аспарагиназу, моноклональные антитела, поликлональные антитела, scFv, Fab, Fab', F(ab')2 и Fd, но не ограничиваясь этим.
Примеры физиологически активного пептида включают глюкагон-подобный пептид-1 (GLP-1) и его аналоги, эксендин и его аналоги, соматостатин и его аналоги, агонист и антагонист гормона, высвобождающего лютеинизирующий гормон (LHRH), адренокортикотропный гормон, гормон, высвобождающий гормон роста, окситоцин, тимозин альфа-1, кортикотропин-рилизинг фактор, кальцитонин, бивалирудин, аналоги вазопрессина и фрагменты физиологически активных белков, но, не ограничиваясь этим.
Альфа-1-антитрипсин представляет собой сывороточный белок млекопитающих, размером примерно 50000 дальтон, который присутствует в крови в высоких концентрациях, примерно 2 мг/мл (Robin W.C. et al., Nature 298, 329-334, 1982). Альфа-1-антитрипсин также называют ингибитором альфа-1-протеаз, поскольку он ингибирует широкий круг протеаз. Однако, в отношении известных заболеваний, его основная функция заключается в защите тканей легкого от эластазы нейтрофилов (Beatty et al., J Biol Chem 255, 3931-3934, 1980). В отсутствии альфа-1-антитрипсина, эластаза нейтрофилов свободно разрушает эластин, который вносит вклад в эластичность легких, что приводит к затруднению дыхания, такому как эмфизема. Расстройства, связанные с этим белком, включают такое наследственное заболевание как недостаточность альфа-1-антитрипсина. Альфа-1-антитрипсин, экстрагированный из сыворотки, доступен для приобретения в качестве терапевтического средства для лечения эмфиземы под торговым наименованием «Prolastin», поскольку он был одобрен FDA. Стабильность и безопасность Prolastin была подтверждена, и его вводят в виде внутривенной инъекции в дозе, равной 60 мг/кг в неделю. Кроме того, известно, что альфа-1-антитрипсин сам по себе имеет время полужизни in vivo, равное примерно 5-6 дням (Weweres, MD, et al., N. Engl J Med 316, 1055-1062, 1987). Это обеспечивает теоретическую основу, согласно которой альфа-1-антитрипсин, который безопасен для организма, даже если его вводят в большом количестве, может служить для увеличения времени полужизни in vivo физиологически активного белка или пептида путем слияния его и альфа-1-антитрипсина между собой. Структура альфа-1-антитрипсина и его роль в качестве ингибитора протеазы хорошо известны (Elliott, P. et al., JMB 275, 419-425, 1998). PI аминокислотный остаток (положение 358 от N-конца) в альфа-1-антитрипсине представляет собой метионин, остаток, важный для связывания эластазы. Известно также, что белок ингибирует широкий круг протеаз, включая трипсин, химотрипсин, тромбин и эластазу. Ген альфа-1-антитрипсина высоко плеоморфный, со свыше, чем 100 идентифицированными к настоящему времени аллелями, их фенотипы установлены с помощью IEF (изоэлектрическое фокусирование) и им присвоен буквенный код (от А до Z) (Stoller et al., The Lancet, 365, 2225-2236, 2005). Семейство М-аллелей, наиболее распространенное среди аллелей, обозначаемое как М, дополнительно подразделяется на подтипы, такие как M1 (Val213), M1 (Ala213), M2 и М3, в соответствии с мутациями аминокислот в последовательности. Следовательно, альфа-1-антитрипсин, применяемый в настоящем изобретении, представляет собой специфический подтип, принадлежащий к семейству М-аллелей, применяют также и другие подтипы с тем же эффектом.
Вариант альфа-1-антитрипсина может быть получен с помощью сайт-направленного мутагенеза одной или нескольких аминокислот. Например, вариант альфа-1-антитрипсина может иметь аспарагин в положении 357 в Р2 вместо пролина. В дополнении к замещению в Р2 пролина на аспарагин в положении 357, вариант альфа-1-антитрипсина может иметь одну или несколько иных мутантных аминокислот в других положениях. Подробно, вариант альфа-1-антитрипсина может иметь аспарагин вместо пролина в положении 357 и, необязательно, треонин вместо серина в положении 359 и/или серин вместо цистеина в положении 232. Вариант альфа-1-антитрипсина, применяемый в настоящем изобретении, может быть выбран из моноварианта альфа-1-антитрипсина [α1AT(P357N)], диварианта альфа-1-антитрипсина [α1AT(P357N, S359T)], диварианта альфа-1-антитрипсина 2 [α1AT(P357N, C232S)] и триварианта альфа-1-антитрипсина [α1AT(P357N, C232S, S359T)].
Моновариант альфа-1-антитрипсина [α1AT(P357N)] получают при замещении пролина (Pro) аспарагином (Asn) в положении 357 в Р2 с N-конца. Этот вариант альфа-1-антитрипсина характеризуется образованием нового участка N-гликозилирования Asn-X-Ser, который вносит вклад в нейтрализацию ингибирующей активности альфа-1-антитрипсина как ингибитора протеаз, а также минимизирует иммуногенность, возникающую после инъекции из-за замены аминокислоты.
Дивариант альфа-1-антитрипсина [α1AT(P357N, S359T)] возникает в результате замещения пролина аспарагином в положении 357 в Р2 и серина треонином в положении 359. Этот вариант альфа-1-антитрипсина характеризуется образованием нового участка N-гликозилирования Asn-X-Thr, который вносит вклад в нейтрализацию ингибирующей активности альфа-1-антитрипсина как ингибитора протеаз и минимизирует иммуногенность, возникающую после инъекции из-за замены аминокислоты
Дивариант альфа-1-антитрипсина 2 [α1AT(P357N, C232S)] возникает в результате замещения пролина аспарагином в положении 357 в Р2 и цистеина серином в положении 232. Этот дивариант альфа-1-антитрипсина 2 характеризуется образованием нового участка N-гликозилирования Asn-X-Ser, который вносит вклад в нейтрализацию ингибирующей активности альфа-1-антитрипсина как ингибитора протеаз, минимизирует иммуногенность, возникающую после инъекции из-за замены аминокислоты, и дополнительно предупреждает образование димера, опосредуемое свободным цистеином.
Образующийся в результате замещения пролина аспарагином в положении 357 в Р2, цистеина серином в положении 232 и серина треонином в положении 359, тривариант альфа-1-антитрипсина [α1AT(P357N, C232S, S359T)] характеризуется образованием нового участка N-гликозилирования Asn-X-Thr, вносит вклад в нейтрализацию ингибирующей активности альфа-1-антитрипсина как ингибитора протеаз, минимизирует иммуногенность, возникающую после инъекции из-за замены аминокислоты, и дополнительно предупреждает образование димера, опосредуемое свободным цистеином.
Среди слитых белков или пептидов настоящего изобретения можно назвать гормон роста человека/альфа-1-антитрипсин [T109wt: α1AT/hGH] (SEQ ID NO:1), гормон роста человека/моновариант альфа-1-антитрипсина [Т109: α1AT(P357N)/hGH] (SEQ ID NO:2), гормон роста человека/дивариант альфа-1-антитрипсина [Т109Т: α1AT(P357N, S359T)/hGH] (SEQ ID NO:3), интерферон-альфа человека/моновариант альфа-1-антитрипсина [Т502: α1AT(P357N)/IFN-α] (SEQ ID NO:4), гранулоцитарный колониестимулирующий фактор/дивариант альфа-1-антитрипсина [T602S: α1AT(P357N, C232S)/G-CSF] (SEQ ID NO:5), гранулоцитарный колониестимулирующий фактор/тривариант альфа-1-антитрипсина [T602ST: α1AT(P357N, C232S, S359T)/G-CSF] (SEQ ID NO:6) и эксендин-4/моновариант альфа-1-антитрипсина [Т304: эксендин-4/α1AT(P357N)] (SEQ ID NO:7).
У всех слитых белков или пептидов, описанных в этой заявке, гормон роста человека/альфа-1-антитрипсин [T109wt: α1AT/hGH], гормон роста человека/моновариант альфа-1-антитрипсина [Т109: α1AT(P357N)/hGH], гормон роста человека/дивариант альфа-1-антитрипсина [Т109Т: α1AT(P357N, S359T)/hGH], интерферон-альфа человека/моновариант альфа-1-антитрипсина [Т502: α1AT(P357N)/IFN-α], гранулоцитарный колониестимулирующий фактор/дивариант альфа-1-антитрипсина [T602S: α1AT(P357N, C232S)/G-CSF], гранулоцитарный колониестимулирующий фактор/тривариант альфа-1-антитрипсина [T602ST: α1AT(P357N, C232S, S359T)/G-CSF] и эксендин-4/моновариант альфа-1-антитрипсина [Т304: у эксендин-4/α1AT(P357N], значительно вырастает время полужизни в сыворотке крови (t1/2), и он демонстрирует отличную стабильность in vivo, по сравнению с физиологически активным белком или пептидом самим по себе.
При введении с помощью инъекции крысам с удаленным гипофизом, было обнаружено, что слитый белок гормон роста человека/моновариант альфа-1-антитрипсина [Т109: α1AT(P357N)/hGH] индуцирует прирост веса у животных. После инъекции слитого белка гранулоцитарный колониестимулирующий фактор/дивариант альфа-1-антитрипсина [T602S: α1AT(P357N, C232S)/G-CSF] или слитого белка гранулоцитарный колониестимулирующий фактор/тривариант альфа-1-антитрипсина [T602ST: α1AT(P357N, C232S, S359T)/G-CSF] у крыс возрастает уровень лейкоцитов. Группа, которой вводят слитый белок эксендин-4/моновариант альфа-1-антитрипсина [Т304: эксендин-4/α1AT(P357N)], продемонстрировала большее снижение уровня сахара в крови, по сравнению с группами, которым вводят экссндин-4, и этот низкий уровень сахара в крови сохранялся, по меньшей мере, в течение 24-х часов после введения. Следовательно, слитые белки или пептиды в соответствии с настоящим изобретением сохраняют активность in vivo в течение длительного периода времени.
Кроме того, слитые белки или пептиды, гормон роста человека/альфа-1-антитрипсин [T109wt: α1AT/hGH], гормон роста человека/моновариант альфа-1-антитрипсина [Т 109: α1AT(P357N)/hGH], гормон роста человека/дивариант альфа-1-антитрипсина [Т109Т: α1AT(P357N, S359T)/hGH], гранулоцинарный колониестимулирующий фактор/дивариант альфа-1-антитрипсина [T602S: α1AT(P357N, C232S)/G-CSF] и гранулоцинарный колониестимулирующий фактор/тривариант альфа-1-антитрипсина [T602ST: α1AT(P357N, C232S, S359T)/G-CSF], обладают сходной внутриклеточной активностью (ЕС50) и, следовательно, их активности незначительно различаются в зависимости от типа носителя, т.е., альфа-1-антитрипсина и вариантов альфа-1 -антитрипсина.
Кроме того, слитый белок настоящего изобретения гормон роста человека/альфа-1-антитрипсин [T109wt: α1AT/hGH], демонстрирует отличную ингибирующую активность в отношении трипсина и эластазы нейтрофилов человека, тогда как слитый белок гормон роста человека/моновариант альфа-1-антитрипсина [Т 109: α1AT(P357N)/hGH], обладает очень низкой ингибирующей активностью в отношении трипсина и эластазы нейтрофилов человека. Следовательно, тот факт, что слитый белок гормон роста человека/альфа-1-антитрипсин [T109wt: α1AT/hGH] и слитый белок гормон роста человека/моновариант альфа-1-антитрипсина [Т109: α1AT(P357N)/hGH] увеличивают время полужизни in vivo путем устойчивой циркуляции, не зависит от собственных свойств альфа-1-антитрипсина.
Как описано выше, слитые белки или пептиды в соответствии с настоящим изобретением увеличивают время полужизни в сыворотке крови (T1/2) посредством устойчивой циркуляции, и, таким образом, обладают повышенной стабильностью in vivo, по сравнению с собственно физиологически активными белками или пептидами. Следовательно, слитые белки или пептиды настоящего изобретения могут быть применены для разработки лекарственных форм белковых или пептидных лекарственных средств с устойчивой циркуляцией.
Осуществление изобретения
Лучшее понимание настоящего изобретения может быть достигнуто с помощью следующих примеров, которые приведены для иллюстрации, но не должны рассматриваться, как ограничивающие настоящее изобретение.
Пример 1. Получение слитого белка гормон роста человека/альфа-1-антитрипсин [T109wt: α1AT/hGH]
1. Конструирование вектора экспрессии, pSNAT
Для экспрессии гормона роста человека, слитого с С-концом альфа-1-антитрипсина, конструируют вектор экспрессии pSNAT, несущий альфа-1-антитрипсин. Подробно, ген альфа-1-антитрипсина получают из вектора hMU001448 (KRIBB) с помощью PCR, применяя пару праймеров ALT21 (SEQ ID NO:8) и ALT30 (SEQ ID NO:9), которые были разработаны для слияния гормона роста человека с С-концом альфа-1-антитрипсина. При разработке в праймер ALT30 также был включен линкер, который может создавать подвижность, необходимую для стабилизации слитых белков. Амплифицированные нуклеотиды расщепляют в присутствии двух рестриктаз XhoI и BamHI и клонируют в pSGHVO (код доступа в Банке генов AF285183), получая в результате рекомбинантный вектор, названный pSNAT.
2. Конструирование вектора гормон роста человека/альфа-1-антитрипсин [T109wt, α1AT/hGH]
Ген гормона роста человека (hGH) амплифицируют из вектора IOH45734 («Invitrogen») с помощью PCR, применяя пару праймеров DH22 (SEQ ID NO:10) и ALT12 (SEQ ID NO:11). PCR-продукт, полученный таким образом, расщепляют в присутствии двух рестриктаз BamHI и NotI, и клонируют в pSNAT по тому же сайту рестрикции BamHI/NotI для создания рекомбинантного вектора экспрессии, названного T109wt (SEQ ID NO:1).
3. Экспрессия слитого белка гормон роста человека/альфа-1-антитрипсин (T109wt) Слитый белок гормон роста человека/альфа-1-антитрипсин (T109wt), полученный как описано выше в пунктах 1-2, экспрессируют в клетках яичника китайского хомячка (СНО-K1). СНО-K1 поддерживают в DMEM (среда Игла в модификации Дульбекко), дополненной 10% FBS (эмбриональная бычья сыворотка) и антибиотиками при 37°С под 5%-ным CO2. За один день до введения в них гена гормон роста человека/альфа-1-антитрипсин (T109wt), клетки инокулируют в количестве 1×106 клеток на 100 мм чашку для культивирования. К 800 мкл среды DMEM, свободной от FBS и антибиотиков, добавляют 5 мкг слитого белка гормона роста человека/альфа-1-антитрипсин (T109wt), и смесь инкубируют при комнатной температуре в течение 1 мин, смешивают с 20 мкг PEI (полиэтиленимин, линейный, «Polysciences Inc» (№ по каталогу: 23966, MW ~25000)) и оставляют при комнатной температуре в течение 10~15 мин. В это время клетки, инкубировавшиеся в течение одного дня, промывают PBS и к ним добавляют 6 мл свежей DMEM. Слитый белок гормона роста человека/альфа-1-антитрипсин (T109wt), оставленный на 10~15 мин при комнатной температуре, добавляют в чашку для культивирования. На следующий день, клетки промывают PBS и к ним добавляют свободную от FBS среду IMDM (№ по каталогу 12200-028, «Gibco». среда Дульбекко, модифицированная по способу Исков) для идентификации экспрессии белка.
4. Очистка слитого белка гормон роста человека/альфа-1-антитрипсин (T109wt)
После того как в клетках яичника китайского хомячка (СНООК1) была проведена экспрессия, как описано выше в пунктах 1-3, белок T109wt очищают следующим образом. Подробно, поскольку слитый белок гормон роста человека/альфа-1-антитрипсин (T109wt), секретируется в среду, культуру клеток центрифугируют, так чтобы можно было собрать супернатант. Этот супернатант уравновешивают буферным раствором (20 мМ фосфат натрия, рН 8,0), наносят на колонку с Q-сефарозой («GE Healthcare», США), предварительно уравновешенную раствором буфера уравновешивания, и основательно промывают раствором буфера уравновешивания, затем элюируют в возрастающем градиенте концентрации NaCl (0~400 мМ NaCl, 20 мМ фосфат натрия, рН 8,0). Белковый элюат смешивают с солью, наносят на уравновешенную колонку с фенил-сефарозой («GE Healthcare», U.S.A), и промывают достаточным количеством раствора буфера уравновешивания, затем элюируют в понижающем градиенте концентрации NaCl (2~0 М NaCl, 20 мМ фосфат натрия, рН 6,8). Белковую фракцию концентрируют с помощью устройства «Vivaspin20» («GE Healthcare», США) и получают высокоочищенный T109wt.
Пример 2. Получение слитого белка гормон роста человека/моновариант альфа-1-антитрипсина [Т109: α1AT(P357N)/hGH]
1. Получение моноварианта альфа-1-антитрипсина (вектор