Способ препаративного выделения вирусов растений
Иллюстрации
Показать всеИзобретение относится к области биохимии. Проводят гомогенизацию тканей зараженного растения в нейтральном буферном растворе на основе 2-[4-(2-гидроксиэтил)пиперазин-1-ил]этансульфоновой кислоты (HEPES) в концентрации 0,02-0,03 М с добавлением ингибиторов растительных ферментов иодайетата натрия и фенилметилсульфонилфторида. Добавляют сахарозу. Осветляют полученный экстракт. Обрабатывают осветленный экстракт 4-6% Тритоном Х-100 для отделения вирусных частиц от клеточных компонентов. Выделяют вирусные частицы из осветленного экстракта посредством дифференциального центрифугирования или ультрацентрифугирования. Способ позволяет увеличить выход вирусных частиц, очищенных от растительных примесей, из 100 г навески свежих листьев в 2-3 раза. 4 ил., 4 пр.
Реферат
Область применения изобретения
Изобретение относится к области биотехнологии, физико-химической биологии, вирусологии, молекулярной биологии и направлено на разработку способа препаративного выделения нуклеопротеидов, в частности вирусных частиц, из растительных экстрактов. Высокоочищенные вирусные препараты, получаемые в соответствии с настоящим изобретением, могут быть использованы в био- и нанотехнологиях для получения моноспецифических антисывороток к вирусам или моноклональных антител с целью их последующего применения для диагностики вирусов, изучения структуры вирусных частиц и их отдельных компонентов (белка оболочки и нуклеиновой кислоты).
Терминология
Все технические и научные термины, использованные в описании изобретения, имеют те же смысл и значение, в которых они обычно применяются в соответствующих областях науки и техники.
Термин «препаративное выделение» означает выделение вирусного препарата, очищенного от клеточных компонентов, в количестве несколько миллиграммов или больше. Термин «растение-хозяин» означает растение, которое может быть заражено данным вирусом. Термин «растение-накопитель» означает растение-хозяин, в котором вирус накапливается в большом количестве.
Уровень техники
Частицы вирусов растений в большинстве случаев состоят из молекулы (молекул) геномной РНК, покрытой субъединицами белка оболочки (БО). В процессе инфекции они накапливаются в клетках растения. Для получения вирусного препарата вирусные частицы необходимо экстрагировать из растительных тканей и отделить от клеточных компонентов, многие из которых обладают сходной структурой и физико-химическими свойствами.
Общие принципы препаративного выделения вирусов растений хорошо разработаны (Гиббс А., Харрисон Б. Основы вирусологии растений. - М.: Мир, 1978; Kurstack E., Ed. Handbook of Plant Virus Infections and Comparative Diagnosis. Amsterdam: Elsevier/North Holland Biomedical Press, 1981; Халл Р. Очистка, биофизическая и биохимическая характеристика вирусов (преимущественно вирусов растений). Вирусология. Методы. Под ред Б.Мейхи. - М.: Мир, 1988; Loebenstein et al., Eds. Virus and Virus-like Diseases of Potatoes and Production of Seed-Potatoes. - Dordrecht, Boston, London: Kluwer Acad. Publ., 2001; Hull R. Matthew's Plant Virology. San Diego, San Fransisco, New York, Boston, London, Sydney, Tokyo: Acad. Press, 2002; Атабеков И.Г., ред. Практикум по общей вирусологии. - М.: МГУ, 2002).
Процесс препаративного выделения вируса состоит из нескольких этапов и включает: накопление вируса в специально подобранных для этого растениях-хозяевах; экстракцию вируса из тканей зараженного растения и удаление из экстракта большей части компонентов растения-хозяина; концентрирование вирусного препарата с дальнейшим удалением растительных веществ и, наконец, окончательную очистку вирусных частиц от примесей растительного происхождения.
Основные требования, предъявляемые к растениям - накопителям вируса, состоят в следующем. Вирус должен накапливаться в них в высокой концентрации, что происходит при системной инфекции. Ткани растения должны содержать минимальное количество веществ, способных разрушать или инактивировать вирус (фенолов, танинов, органических кислот, рибонуклеаз и протеаз). Важным условием является легкость выращивания растений. Большинству этих требований удовлетворяют травянистые растения из родов Chenopodium, Cucumis, Nicotiana, Petunia и Phaseolus, которые в подавляющем большинстве случаев и используются для накопления вирусов с целью их последующего препаративного выделения.
Экстракцию вирусов из растения (главным образом, из листьев) проводят, разрушая клеточные стенки и клетки с помощью гомогенизатора с вращающимися ножами в буферном растворе для поддержания определенного значения кислотности среды и в присутствии соединений, предотвращающих разрушение и инактивацию вирусных частиц. При выделении палочковидных и нитевидных вирусов использование гомогенизатора может приводить к ломке вирусных частиц. В таких случаях зараженные ткани часто растирают вручную с помощью ступки и пестика. Эффективность разрушения растительных тканей и клеточных стенок можно повысить путем предварительного замораживания растительного материала, однако в ряде случаев замораживание приводит к снижению выхода вируса и появлению в экстракте трудноустранимых примесей растительных веществ. При выделении флоэмно-ограниченных вирусов для разрушения волокон сосудистых тканей применяют ферментные препараты (целлюлазы и пектиназы), обладающие мацерирующим действием.
Состав экстрагирующего буферного раствора и его ионная сила существенно влияют на эффективность выделения вируса. В большинстве случаев используют фосфатные буферы умеренной ионной силы (0,05-0,1 М) с нейтральными значениями рН. Вирусы, склонные к агрегации (например, потивирусы), обычно экстрагируют слабощелочными буферами. Для экстракции многих вирусов применяют кислые буферные растворы с рН около 5, при котором денатурируют и осаждаются многие клеточные белки. Поскольку вирусы инактивируются промежуточными продуктами окисления фенольных соединений, обязательным компонентом экстрагирующего буфера являются восстановители, препятствующие действию полифенолоксидаз: меркаптоэтанол, тиогликоляты, сульфит натрия, а также диэтилдитиокарбамат натрия (ДИЕКА), который хелатирует ионы меди - кофактора полифенолоксидаз. Для инактивации танинов часто применяют поливинилпирролидон.
Для очистки вирусных частиц их следует отделить от других компонентов клетки: рибосом, мембран, органелл и таких превалирующих в экстракте белков хлоропластов, как фитоферритин и рибулозобисфосфаткарбоксилаза. Для диссоциации рибосом используют хелатирующий агент натриевую соль этилендиаминтетрауксусной кислоты (ЭДТА); добавление ЭДТА также ингибирует некоторые ферменты. Для отделения вирусных частиц от мембран и для удаления мембран из экстракта обычно применяют органические растворители: бутанол, хлороформ и четыреххлористый углерод или смесь этих соединений. При эмульгировании с органическими растворителями удаляются, кроме того, пигменты и часть клеточных белков, которые денатурируют на границе раздела фаз.
Заключительной стадией процедуры экстракции является осветление экстракта путем низкоскоростного центрифугирования, при котором удаляют оставшиеся фрагменты растительных тканей, выпавшие в осадок примеси и происходит разделение фаз при экстракции органическими растворителями. Вирусные частицы остаются в супернатанте или в водной фазе.
Вирус в осветленном экстракте находится в низкой концентрации и сильно загрязнен растительными примесями. Концентрирование вирусного препарата, которое сопровождается его дальнейшей очисткой, осуществляют ультрацентрифугированием или с помощью осаждения полиэтиленгликолем. Ультрацентрифугирование на 20-30% сахарозной подушке, затрудняющей седиментацию белков, мембран и пигментов растения и препятствующей их соосаждению с вирусом, является весьма эффективной процедурой концентрирования вируса и, одновременно, его очистки.
Окончательную очистку вируса осуществляют несколькими циклами дифференциального центрифугирования или более эффективными методами ультрацентрифугирования вирусного препарата в градиенте концентрации сахарозы или градиенте плотности хлорида или сульфата цезия. Сочетание обоих типов градиентов позволяет получать вирусные препараты очень высокой степени очистки.
Несмотря на то что общие принципы препаративного выделения вирусов хорошо разработаны, универсальной процедуры получения очищенного вирусного препарата не существует. Выбор оптимального способа препаративного выделения зависит от структуры и физико-химических свойств вирионов, механизма репликации вируса, вида растения-накопителя и от концентрации вируса в зараженном растении, которая варьирует от нескольких миллиграммов (вирус табачной мозаики) до долей микрограмма (лютеовирусы) на 1 г свежей листовой массы. Поэтому для каждого вируса или группы родственных вирусов обычно разрабатывают оригинальные методики выделения, основанные на изложенных выше принципах, но существенно отличающиеся в деталях. Большей части таких методик присущи следующие основные недостатки: а) недостаточная степень очистки вирусов от клеточных компонентов; б) низкий выход очищенного вирусного препарата; в) ломка палочковидных и нитевидных вирусных частиц в процессе выделения; г) деградация БО в результате воздействия клеточных протеаз.
Недостаточная эффективность методик препаративного выделения вынуждает наращивать и использовать для выделения большие массы листового материала и/или проводить несколько выделений для получения необходимого количества вирусного препарата. Низкое качество получаемых препаратов затрудняет их анализ и ограничивает последующее применение.
Описание изобретения
Задача настоящего изобретения состояла в разработке эффективного способа препаративного выделения вирусов растений, характеризующегося высоким выходом интактных вирусных частиц, отсутствием контаминации клеточными компонентами и применимым для выделения вирусов различных таксономических групп.
Экспериментальные растения выращивали в теплице при естественном освещении, дополняемом в зависимости от сезона искусственным освещением натриевыми лампами высокого давления ДНа/Reflux Н 350 (ООО «Рефлах», Россия), и при контролируемой температуре 20-30°С. Растения заражали посредством механической инокуляции листьев, как описано в примерах 1-4. Листья с симптомами инфекции собирали через 3-6 недель после инокуляции. Свежие листья гомогенизировали в 0,02 М буфере на основе 2-[4-(2-гидроксиэтил)пиперазин-1-ил]этансульфоновой кислоты (HEPES-буфере), рН 6,8, содержащем 0,2 М сахарозу, 20 мМ иодацетат натрия, 10 мМ ДИЕКА, 1 мМ фенилметилсульфонилфторид (PMSF) и 2 мМ ЭДТА, при соотношении навески и буфера 1:4 (г/мл). Для разрушения растительных тканей использовали лабораторный блендер MSE Ato-Mix («MSE Scientific Instruments», Англия) или керамические ступку с пестиком. Гомогенат осветляли низкоскоростным центрифугированием на центрифуге J2-21 («Beckman», США) в роторе JA-20 13000 об/мин 15 мин при температуре 4°С и фильтровали через нетканый материал Miracloth («Calbiochem», США). Затем к осветленному экстракту по каплям, при непрерывном перемешивании экстракта на магнитной мешалке, добавляли неионный детергент Тритон Х-100 до конечной концентрации 5% и перемешивали еще 40 мин при 4°С. Смесь наслаивали на 20% (вес/вес) сахарозную подушку в 0,02 М HEPES-буфере рН 6,8, приготовленную в поликарбонатных центрифужных пробирках (Beckman, Cat No 355618). Вирус осаждали центрифугированием на ультрацентрифуге L5-50 («Beckman») в угловом роторе 50.2 Ti при 28000 об/мин 210 мин. Осадок ресуспендировали в 0,1 М натрий-боратном буфере рН 8,2, содержащем 5 мМ ЭДТА. Вирусный препарат осветляли центрифугированием при 10000 об/мин 5 мин на настольной центрифуге MiniSpin («Eppendorf», Германия) и очищали посредством ультрацентрифугирования в градиенте концентрации сахарозы. С этой целью вирусную суспензию наслаивали на преформированный сахарозный градиент (10%-40%, вес/вес), приготовленный на 0,1 М натрий-боратном буфере рН 8,2 в Beckman Ultra-Clear Centrifuge Tubes, Cat No 344058, и центрифугировали в роторе SW 27 при 25000 об/мин 120 мин. Содержимое пробирок фракционировали с помощью Auto Densi-Flow IIC («Haakebuchler», США) и Uvicord S («LKB», Швеция), собирая фракции объемом 2 мл. Фракции, содержащие вирус, объединяли и диализовали против 0,05 М боратного буфера рН 8,2 в течение ночи. Вирус осаждали ультрацентрифугированием в роторе 50.2 Ti при 30000 об/мин 150 мин. Осадок вируса ресуспендировали в соответствующем буферном растворе, как описано в примерах 1-4.
Концентрацию вирусов в листьях, в экстрактах на различных стадиях очистки и во фракциях сахарозного градиента определяли методом иммуноферментного анализа (ИФА) с помощью диагностических реагентов соответствующей специфичности, как описано в примерах 1-4.
Спектральные характеристики очищенных вирусных препаратов и концентрацию вирусов определяли с помощью спектрофотометра Ultrospec 1100 pro («Biochrom Ltd.», Англия).
Чистоту вирусных препаратов изучали методом электрофореза в полиакриламидном геле с додецилсульфатом натрия (Laemmli U.K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature, 1970, 227: 680-685). Использовали набор белков-маркеров фирмы «Хеликон» (Россия). Гели окрашивали Кумасси бриллиантовым синим, отмывали от избытка красителя смесью этанола, уксусной кислоты и воды в объемном соотношении 5:1:5 и фотографировали с помощью цифровой фотокамеры на трансиллюминаторе TFP-M/WL (Vilber Lourmat, Франция).
Электронно-микроскопические исследования вирусных препаратов проводили на электронном микроскопе JEM 100СХ («Jeol», Япония) при инструментальном увеличении 20000. Препараты негативно контрастировали 2% водным раствором фосфовольфрамовой кислоты рН 6,5.
Разработанный в данной заявке способ был использован для препаративного выделения потивируса оспы сливы (ВОС), потивируса А картофеля (АВК), тобамовируса табачной мозаики (ВТМ), тобравируса погремковости табака (ВПТ).
Полученные результаты показывают, что разработанный способ препаративного выделения вирусов из растительных экстрактов, основанный на применении низкомолярного нейтрального HEPES-буфера с добавлением 0,2 М сахарозы и ингибиторов растительных ферментов для экстракции и очистки вируса, и 5% неионного детергента Тритона Х-100 для отделения вирусных частиц от компонентов растения-хозяина, преимущественно от внутриклеточных мембран, обеспечивает высокий выход интактных вирусных частиц, практически полностью очищенных от клеточных компонентов. Применение указанного экстрагирующего буфера способствует разрушению агрегатов вируса, препятствует ломке палочковидных и нитевидных вирусных частиц при разрушении клеток и деградации БО вирусов под воздействием растительных протеаз, высвобождающихся при разрушении клеток. Использование 5% Тритона Х-100 вместо обычно применяемых хлороформа или бутанола позволяет эффективно отделять вирус от клеточных мембран и обеспечивает высокую чистоту вирусных препаратов. В результате, разработанный способ позволяет получать большое количество высокоочищенного вирусного препарата из небольшой навески листьев, что упрощает работу по очистке вируса.
Краткое описание чертежей (рисунков)
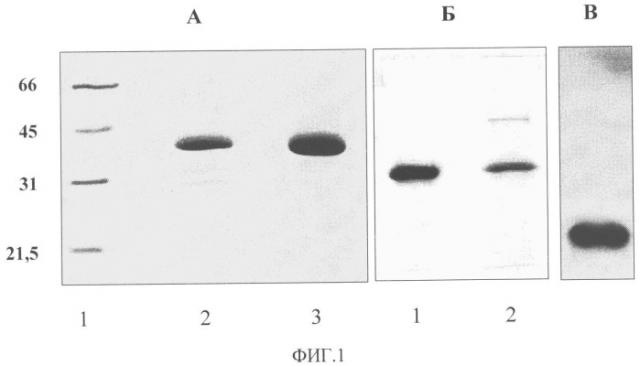
Фиг.1. Электрофорез в 10% полиакриламидном геле очищенных препаратов ВОС (А), АВК (Б) и ВПТ (В). А: 1 - положение маркеров с молекулярной массой (кДа), указанной слева от рисунка; 2 - препарат, выделенный по общепринятому методу. Видны продукты деградации БО; 3 - препарат, выделенный способом, разработанным в заявке. Б: 1 - препарат АВК, выделенный способом, разработанным в заявке; 2 - обычно применяемым способом. Видна контаминация препарата белками клеточного происхождения.
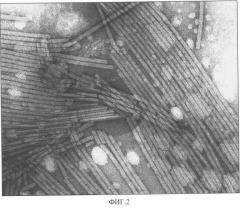
Фиг.2. Электронно-микроскопическая фотография препарата ВТМ, выделенного способом, описанным в настоящей заявке. Увеличение 160000 х.
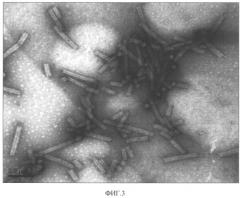
Фиг.3. Электронно-микроскопическая фотография препарата ВПТ, выделенного способом, описанным в настоящей заявке. Масштабная черта 200 нм.
Фиг.4. Симптомы на листьях растений табака N. clevelandii, зараженных очищенным препаратом ВПТ.
Примеры
Пример 1. Препаративное выделение вируса оспы сливы (ВОС).
Вирус оспы сливы (Plum pox virus, род Potyvirus, сем. Potyviridae) представляет собой нитевидные частицы длиной 750 нм и диаметром 15-18 нм. Они состоят из 1 молекулы РНК длиной около 10 тыс. нуклеотидов, покрытой субъединицами БО с молекулярной массой (мол. м.) 36,5 кДа (Glasa & Candresse, 2005. Plum pox virus. CMI/AAB Descriptions of plant viruses, №410). ВОС накапливается в растениях в небольших количествах. В зараженных клетках вирус аккумулируется в виде агрегатов, тесно связанных с внутриклеточными мембранами. При выделении ВОС общепринятым способом (Lain et al., 1988. Nucleotide sequence of the 3' terminal region of plum pox potyvirus RNA. Virus Res., 10, 325-342) он экстрагируется в основном в виде этих агрегатов, которые соосаждаются вместе с клеточными компонентами. Это влечет за собой большие потери вируса уже на первых стадиях очистки и приводит к низкому выходу вирусного препарата, загрязненному клеточным содержимым. Другая проблема препаративного выделения ВОС заключается в деградации БО клеточными протеазами, что приводит к выделению вирусных частиц, содержащих дефектный БО.
Вирус накапливали в растениях табака N. benthamiana, заражая их путем механической инокуляции с целитом в 0,02 М HEPES-буфере рН 7,5. Препаративное выделение вируса проводили согласно описанию данного изобретения. Содержание вируса во фракциях градиента определяли методом ИФА с помощью наборов ELISA Reagent Set SRA 31505 (Agdia, США) в соответствии с инструкцией производителя. Осадок вируса ресуспендировали в 0,05 М боратном буфере рН 8,2. Концентрацию вируса определяли, используя коэффициент экстинкции А260=2,5.
Анализ содержания ВОС на каждой стадии процесса очистки показал отсутствие потерь вируса после осветления экстракта и после обработки осветленного экстракта 5% Тритоном Х-100. Не обнаружено следов вируса в сахарозной подушке и в зеленом экстракте поверх нее, что свидетельствовало об оптимальных условиях ультрацентрифугирования на сахарозной подушке и об отсутствии деградации вирусных частиц на этой стадии очистки.
Препарат ВОС имел спектр, типичный для нуклеопротеинов, с А260/А280=1,3 и А260/А243=1,1. Электрофоретические и спектральные характеристики вируса указывали на чистоту полученного препарата, который содержал один вирусный белок с мол. м. 36 кДа. Других белковых зон, в частности продуктов протеолиза БО, в геле, окрашенном Кумасси бриллиантовым синим, обнаружено не было (Фиг.1А). Разработанный способ препаративного выделения позволял получать до 10 мг высокоочищенного ВОС из 100 г свежих листьев N. benthamiana, что в 2-3 раза выше выхода, известного по литературным источникам (Lain et al., 1988).
Пример 2. Препаративное выделение вируса А картофеля (АВК).
Вирус А картофеля (Potato virus А, род Potyvirus, сем. Potyviridae) представляет собой нитевидные частицы длиной 730 нм и диаметром 11 нм. Они состоят из 1 молекулы РНК длиной около 9,5 тыс. нуклеотидов, покрытой субъединицами БО с мол. м. 32-33 кДа. При выделении АВК общепринятым способом с применением для экстракции вируса калий-фосфатного буфера с 0,8 М мочевиной для разрушения агрегатов вируса (Loebenstein et al., Eds. Vims and Virus-like Diseases of Potatoes and Production of Seed-Potatoes. Dordrecht, Boston, London: Kluwer Acad. PubL, 2001) происходит ломка значительной части вирусных частиц. Обломки соосаждаются вместе с клеточными компонентами, что влечет за собой большие потери вируса и приводит к низкому выходу вирусного препарата, загрязненному клеточным содержимым.
Вирус накапливали в растениях табака N. tabacum, заражая их путем механической инокуляции. Препаративное выделение вируса проводили согласно описанию данного изобретения. Содержание вируса во фракциях градиента определяли методом ИФА с помощью наборов ELISA Reagent Set SRA 60000 (Agdia, США) в соответствии с инструкцией производителя. Осадок вируса ресуспендировали в 0,1 М глицине, доведенным до рН 7.5 1N КОН. Концентрацию вируса определяли, используя коэффициент экстинкции А260=2,4.
Анализ содержания АВК на каждой стадии процесса очистки показал отсутствие потерь вируса после осветления экстракта и после обработки осветленного экстракта 5% Тритоном Х-100. Не обнаружено следов вируса в сахарозной подушке и в зеленом экстракте поверх нее, что свидетельствовало об оптимальных условиях ультрацентрифугирования на сахарозной подушке и об отсутствии деградации вирусных частиц на этой стадии очистки.
Препарат АВК имел спектр, типичный для нуклеопротеинов, с А260/А280=1,21 и А260/А243=1,1. Электрофоретические и спектральные характеристики вируса указывали на чистоту полученного препарата, который содержал один вирусный белок с мол. м. 32 кДа. Других белковых зон в геле, окрашенном Кумасси бриллиантовым синим, обнаружено не было (Фиг.1Б). Разработанный способ препаративного выделения позволял получать до 5-6 мг высокоочищенного препарата АВК из 100 г свежих листьев N. tabacum, что в 2-3 раза выше выхода, известного по литературным источникам (Loebenstein et al., Eds. Virus and Virus-like Diseases of Potatoes and Production of Seed-Potatoes. Dordrecht, Boston, London: Kluwer Acad. PubL, 2001). Важно отметить, что способ позволяет получать большое количество вирусного препарата из небольшой навески листьев, что упрощает работу по очистке вируса.
Пример 3. Препаративное выделение вируса табачной мозаики (ВТМ).
Вирус табачной мозаики (Tobacco mosaic virus, род Tobamovirus, сем. Virgaviridae) представляет собой палочковидные частицы длиной 300 и диаметром 18 нм, которые состоят из 1 молекулы РНК длиной 6 тыс. нуклеотидов, покрытой субъединицами БО с мол. м. 17.5 кДа (Zaitlin, 2000. Tobacco mosaic virus. CMI/AAB Descriptions of plant viruses, №370). Вирус накапливается в системно зараженных растениях табака в количествах до нескольких миллиграмм на 1 г листьев. Поэтому получить большое количество высокоочищенного вирусного препарата не вызывает затруднений. Однако качество препарата, получаемого известными методами, не всегда бывает высоким, потому что частицы ВТМ отличаются высокой ломкостью.
Вирус поддерживали и накапливали в растениях N. tabacum, заражая их путем механической инокуляции. Через 2-3 недели листья с симптомами мозаики использовали для выделения вируса. Препаративное выделение вируса проводили согласно описанию данного изобретения. Концентрация Тритона Х-100 составляла 4%. Были использованы следующие режимы ультрацентрифугирования: на сахарозной подушке 30000 об/мин 210 мин в роторе 50.2 Ti; в градиенте концентрации сахарозы 32000 об/мин 120 мин в роторе SW41; для осаждения вируса 30000 об/мин 150 мин в роторе 50.2 Ti. Содержание вируса во фракциях градиента определяли с помощью наборов ELISA Reagent Set SRA57400 (Agdia, США) в соответствии с инструкцией производителя. Осадок вируса ресуспендировали в 0,1 М фосфатном буфере рН 7,5. Концентрацию вируса определяли, используя коэффициент экстинкции А260=2,7.
Препарат ВТМ имел спектр, типичный для нуклеопротеинов, с А260/А280=1,2. Электрофоретические и спектральные характеристики вируса указывали на чистоту полученного препарата, который содержал один вирусный белок с мол. м. 17-18 кДа. Никаких других белковых зон в геле, окрашенном Кумасси бриллиантовым синим, обнаружено не было. Электронно-микроскопическое исследование вирусного препарата показало, что ломаные частицы в нем практически отсутствуют (Фиг.2).
Пример 4. Препаративное выделение вируса погремковости табака (ВПТ).
Вирус погремковости табака (Tobacco rattle virus, род Tobravirus, сем. Virgaviridae) представлен 2 типами палочковидных частиц длиной 180-200 нм и 50-115 (в зависимости от штамма) нм и диаметром около 25 нм. Каждый тип частиц состоит из 1 молекулы РНК (6,7 и 1,9-3,9 тыс. нуклеотидов соответственно), инкапсидированной БО с мол. м. 22 кДа (Robinson D.J. 2003. Tobacco rattle virus. CMI/AAB Descriptions of plant viruses, №398). Для получения инфекционного препарата вируса необходимо выделение обоих типов частиц. Однако большая часть коротких частиц, в силу их небольшого размера, соосаждается вместе с клеточными компонентами и, таким образом, утрачивается в процессе выделения. Смягчение режима препаративного выделения позволяет выделять короткие частицы, но приводит к получению вирусного препарата, загрязненного компонентами растения-хозяина.
Вирус накапливали в растениях табака N. clevelandii, заражая их путем механической инокуляции с целитом в 0,1 М калий-фосфатном буфере, рН 7,2, содержащим 0,01 М ЭДТА и 0,25% сульфит натрия. Препаративное выделение вируса проводили согласно описанию данного изобретения. Концентрация Тритона Х-100 составляла 6%. Были использованы следующие режимы ультрацентрифугирования: на сахарозной подушке 30000 об/мин 210 мин в роторе 50.2 Ti; в градиенте концентрации сахарозы 32000 об/мин 120 мин в роторе SW41; для осаждения вируса 30000 об/мин 150 мин в роторе 50.2 Ti. Осадок вируса ресуспендировали в 0,1 М глициновом буфере рН 7,5. Концентрацию вируса определяли, используя коэффициент экстинкции А260=3,0.
Препарат ВПТ имел спектр, типичный для нуклеопротеинов, с А260/А280=1,15. Электрофоретические, электронно-микроскопические (Фиг.3) и спектральные характеристики вируса указывали на чистоту полученного препарата, который содержал один вирусный белок с мол. м. 22,6 кДа. Других белковых зон в геле, окрашенном Кумасси бриллиантовым синим, обнаружено не было (Фиг.1В). Разработанный способ препаративного выделения позволял получать до 20 мг высокоочищенного ВПТ из 100 г свежих листьев N. clevelandii, что вдвое превышает максимальный выход, известный по литературным источникам (Robinson, 2003).
Полученный вирусный препарат обладал высокой инфекционностью. Типичные симптомы инфекции развивались через 10-14 дней после инокуляции (Фиг.4). Этот результат также свидетельствует о высоком качестве вирусного препарата, получаемого по разработанному способу.
Существенно, что разработанный способ препаративного выделения позволяет получить большое количество препарата ВПТ из небольшой (100 г) навески листьев, что значительно упрощает работу по очистке вируса. При выделении по общепринятому методу для получения 10-100 мг вирусного препарата требуется переработать не менее 1 кг листьев.
Способ препаративного выделения вирусов растений, включающий гомогенизацию тканей замороженного растения в буферном растворе, осветление полученного экстракта и выделение вирусных частиц из осветленного экстракта посредством дифференциального центрифугирования или ультрацентрифугирования, отличающийся тем, что в качестве буферного раствора используют нейтральный буферный раствор на основе 2-[4-(2-гидроксиэтил)пиперазин-1-ил]этансульфоновой кислоты (HEPES) в концентрации 0,02-0,03 М с добавлением сахарозы и ингибиторов растительных ферментов иодацетата натрия и фенилметилсульфонилфторида, и перед стадией выделения вирусных частиц дополнительно осуществляют обработку осветленного экстракта 4-6% Тритоном Х-100.