Способ оценки состояния гиперпролиферативных заболеваний шейки матки
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности к применению молекулярных маркеров ВПЧ ВКР и их качественных и количественных характеристик для прогнозирования течения гиперпролиферативных заболеваний ШМ. Способ осуществляется поэтапно: 1) из соскобов из цервикального канала и биоптатов ШМ выделяют ДНК ВПЧ; 2) определяют генотип вируса; 3) отбирают пациенток с ВПЧ16-позитивной CIN; 4) методом ПНР в реальном времени определяют число копий ДНК вируса и степень интеграции ее в хозяйский геном (физический статус); 5) устанавливают пороговый уровень вирусной нагрузки с учетом физического статуса вируса (6,5 lg копий ДНК ВПЧ 16 на клетку); 6) классифицируют пациенток в зависимости от установленного порогового уровня вирусной нагрузки и физического статуса вируса (эписомальная или интегрированная форма); 7) выявляют пациенток с неблагоприятным прогнозом, имеющих высокую вирусную нагрузку (>6.5 lg копий ДНК на клетку) при эписомальной форме вируса или низкую нагрузку (<6.5 lg копий ДНК на клетку) при интегрированной форме вируса. Способ позволяет провести раннее прогнозирование неблагоприятного течения цервикальных интраэпителиальных неоплазий и возможного перехода их в рак ШМ. 2 з.п. ф-лы, 2 ил., 1 табл., 4 пр.
Реферат
Изобретение относится к области медицины, точнее к области молекулярной диагностики цервикальных интраэпителиальных неоплазий (cervical intraepithelial neoplasia - CIN) с потенциальным риском развития рака шейки матки (РШМ).
Рак шейки матки занимает второе место среди заболеваний злокачественными опухолями органов женской половой системы. В настоящее время убедительно доказана этиологическая роль вируса папилломы человека (ВПЧ) высокого канцерогенного риска (ВКР) в развитии гиперпролиферативных изменений эпителиоцитов шейки матки от дисплазий разной степени тяжести до злокачественных новообразований [1, 2]. Из всех известных в настоящее время ВПЧ ВКР 16 тип является наиболее распространенным и относится к числу вирусов, обладающих наиболее высоким канцерогенным потенциалом [3-5]. Персистирующая инфекция канцерогенными типами ВПЧ может привести к развитию CIN [3, 4, 6-8]. При этом, изменения низкой степени тяжести (CIN I) спонтанно регрессируют у 60% женщин, и только у 1% пациенток указанная патология переходит в инвазивный рак. Изменения умеренной и тяжелой степени (CIN II, CIN III) регрессируют лишь у 40% и 33% женщин соответственно и практически у 5% и 12% больных прогрессируют в инвазивный рак [9-11]. Поэтому крайне актуальной задачей является разработка способов прогнозирования течения CIN на индивидуальном уровне.
Известно достаточно большое количество зарубежных и российских изобретений по использованию разнообразных молекулярно-генетических и других методов выявления и оценки ВПЧ-инфекции с целью диагностики, прогнозирования течения и мониторинга лечения предраковых заболеваний шейки матки, а также оценки риска возникновения и диагностики РШМ, в том числе на ранней стадии.
Известен комплексный способ диагностики ВПЧ-инфекции и прогнозирования ее течения (персистирующее или транзиторное) (RU 2379690). Он включает сбор анамнеза и комплексное клинико-лабораторное обследование. К анамнестическим признакам относят отягощенную онкологическую наследственность, раннее начало половой жизни, возраст до 20 лет и промискуитет. Клинические признаки - это аногенитальные бородавки, эрозии и эктопии шейки матки, контактная кровоточивость, Ovuli nabotti, воспалительные заболевания органов малого таза и наличие внутриматочной спирали. В качестве лабораторных признаков принимают инфекции, передаваемые половым путем, микстинфицирование, дефицит лактобактерий, дисбиоз влагалища, вызванный условно-патогенной флорой, бактериальный вагиноз, вирус-вирусные ассоциации, урогенитальный герпес и др., а также инфицирование ВПЧ различных генотипов. Каждый признак оценивают по балльной системе и в зависимости от количества баллов диагностируют персистирующее или транзиторное течение папилломавирусной инфекции или подвергают дополнительному обследованию. Способ позволяет определить тактику дальнейшего ведения пациента, сформировать группы потенциального риска развития очаговых диспластических и злокачественных трансформаций эпителия урогенитального тракта.
Описанный способ не учитывает физический статус вируса, это - эписомальная форма, когда ДНК вируса не интегрирована в клеточный геном или интегрированная форма, когда ДНК вируса интегрирована в геном клетки-хозяина, и количественные показатели ВПЧ-инфекции (вируса).
Известен способ прогнозирования предраковых заболеваний шейки матки у женщин с папилломавирусной инфекцией (патент RU 2310197). Серийные срезы слизистой оболочки шейки матки женщин с папилломавирусной инфекцией исследуют иммуногистохимическим методом: обрабатывают по стрептавидин-биотиновому пероксидазному методу и инкубируют с антителами к антигену ядер пролиферирующих клеток - PCNA и к ингибитору апоптоза BCL-2. Определяют митотический индекс, апоптозный индекс (АИ), индекс метки PCNA (ИМ PCNA) и индекс метки BCL-2 (ИМ BCL-2), после чего рассчитывают коррелятивный индекс пролиферации (КИП) по формуле: КИП=Митотический индекс (ИМ PCNA (ИМ BCL - 2/АИ. Если у больных с цервикальной интраэпителиальнй неоплазией I степени значение КИП превышает 114,0, то предполагают высокую вероятность перехода заболевания в стадию цервикальной интраэпителиальной неоплазии П степени, а если значение КИП превышает 208,0, предполагают высокую вероятность перехода заболевания в стадию цервикальной интраэпителиальной неоплазии III степени или развития онкологической патологии шейки матки. Использование способа позволяет осуществить раннюю диагностику продолжения опухолевого роста и скорректировать индивидуальное лечение.
Способ не учитывает количественные показатели ВПЧ-инфекции и физический статус вируса.
Изобретение по заявке CN 1570646 (А) раскрывает способ ранней диагностики рака матки, связанного с ВПЧ 16/18 на основе выявления антител к ранним и поздним белкам ВПЧ 16/18 с помощью специальных полипептидов.
Изложенный способ не учитывает количественные показатели ВПЧ-инфекции и физический статус вируса.
Известно изобретение по патенту LT5228 (В), в котором на основании методов генной инженерии осуществляют раннее выявление неблагоприятного течения папилломавирусной инфекции. Способ ранней in vitro диагностики дисплазии шейки матки и рака включает количественное определение онкобелка Е7 ВПЧ 16 и ВПЧ 18 с использованием меченных моноклональных антител (716-281 и 716-332), которые распознают различные антигенные детерминанты онкобелка Е7. Количество Е7 ВПЧ 16 и ВПЧ 18 коррелирует со злокачественной трансформацией эпителиальных клеток: уровень Е7 онкобелка вируса, соответствующий 40 пг/мл - 50 нг/мл, свидетельствует о дисплазии и раке шейки матки.
Способ прогнозирования течения папилломавирусной инфекции (или ранней диагностики патологии шейки матки (дисплазии и рака)) не учитывает такой количественный показатель ВПЧ-инфекции как число копий ДНК, и физический статус вируса.
Известно изобретение (US 2010330550 (А1)), относящееся к in vitro методам скрининга персистирующей ВПЧ инфекции 5 типов (ВПЧ 16, 18, 31, 33 и 45) и оценке экспрессии мРНК вирусных онкогенов Е6 и/или Е7. Наличие транскриптов Е6 и/или Е7 может быть использовано в качестве молекулярного маркера клеточных изменений, ассоциированных с персистирующей ВПЧ-инфекцией, для того, чтобы различить цервикальные поражения высокой и низкой степени. В частности, для различения гистологически верифицированной CIN III без анэуплоидных клеток и CIN III с анэуплоидными клетками. Отмечается, что РНК-тест имеет сходную с гистологическим исследованием специфичность, но более высокую чувствительность. Методы применимы в контексте скрининга рака шейки матки.
В рассматриваемом изобретении не учитываются такой количественный показатель ВПЧ-инфекции как число копий ДНК и физический статус вируса.
Известны биомаркеры, которые коррелируют с прогрессией ВПЧ-индуцированной неоплазии шейки матки в рак, предложено использовать их с целью диагностики ВПЧ-ассоциированного РШМ и предраковых заболеваний (US 2010316990 (А1)). К числу таких биомаркеров относятся корнулин, РА28 [beta], DJ-1, актин, транстиретин, HSPB1, CV внутриклеточного канала 1, цитокератин 8, трансферрин, HSP20, афлатоксина редуктаза, (alpha)2 коллаген 1 типа, креатинкиназа В, цитокератин 13, GSTP, РА28 (alpha), марганец-зависимая СОД, ламин А/С, В1 серпин (ингибитор эластазы), серпин ВЗ (SCAA1), цитокератин 10, цитокератин 6А, и trp-тРНК синтетаза. Популярные биомаркеры для ВПЧ-индуцированного рака включают корнулин, DJ-1, РА28 (alpha), и РА28 [бета], trp-тРНК синтетазу, HSP[beta]6, креатинкиназу В, афлатоксин редуктазу, GSTP, транстиретин, трансферрин, (alpha)2-тип коллагена 1, а также их комбинации.
Изложенный подход не учитывает количественные показатели ВПЧ-инфекции и физический статус вируса.
Прототипом предлагаемого изобретения является международная заявка WO 2010129941 (А1), в которой представлены наборы и способы диагностики цервикальных заболеваний. Способы включают измерение уровня экспрессии онкогенов Е6 и/или Е7 ВПЧ ВКР в биологических образцах. Уровень Е6 и/или Е7 мРНК положительно коррелирует с прогрессированием заболеваний шейки матки. Порог уровня экспрессии Е6 и Е7 мРНК обеспечивает разграничение нормальных цервикальных образцов от патологических клеток или тканей; а также образцов с цервикальными поражениями высокой степени (с тяжелыми дисплазиями) от образцов с низкой степенью поражения (легкими дисплазиями).
К недостаткам данного способа можно отнести технические сложности работы с РНК-материалом и необходимость использования дорогостоящих реактивов, что, несомненно, ограничивает возможность использования его в обычных клинических лабораториях. Кроме того, изложенный способ не учитывает такой количественный показатель ВПЧ-инфекции как число копий ДНК и физический статус вируса.
Таким образом, известно достаточно много способов, связанных с прогнозированием течения гиперпролиферативных заболеваний шейки матки (в том числе CIN) и их прогрессии в РШМ, основанные на качественном и количественном определении различных биомаркеров, которыми, как правило, являются продукты вирусных или клеточных генов, инфицированных больных. Вместе с тем не обнаружено комплексного молекулярно-генетического подхода, одновременно учитывающего различные качественные и количественные характеристики самого генетического материала ВПЧ, такие как генотип вируса, физический статус вирусной ДНК (эписомальная или интегрированная форма) и ее количественная нагрузка.
Технический результат предлагаемого изобретения заключается в возможности раннего выявления пациентов с неблагоприятным прогнозом течения CIN и высоким риском развития РШМ за счет интегральной оценки качественных и количественных показателей ДНК ВПЧ: генотипа, физического статуса и количественной нагрузки - числа копий ДНК вируса в клетке.
Сущность изобретения заключается в способе раннего выявления пациенток с CIN, имеющих неблагоприятное течение и высокую вероятность перехода в рак, на основе нового подхода, учитывающего одновременно генотип ВПЧ, количество копий ДНК вируса, присутствующего в клетке-хозяина в эписомальной или интегрированной форме. При этом из биологических образцов - соскобы из цервикального канала или соответствующие биоптаты UIM больных, выделяют ДНК вируса и выявляют в ней наличие 12 наиболее распространенных генотипов высокого канцерогенного риска. Затем отбирают пациенток с ВПЧ16-позитивной CIN и методом ПЦР в режиме реального времени определяют количество геномных эквивалентов Е7, Е2 вируса и клеточного гена b-глобина. По их соотношению оценивают количественную нагрузку вируса, а также наличие интеграции его ДНК в геном клетки-хозяина. Далее устанавливают критерий неблагоприятного прогноза в соответствии с физическим статусом вируса и его количественной нагрузкой: ≥6.5 lg копий ДНК ВПЧ16 на 100 тыс.клеток при эписомальной форме или <6.5 lg копий ДНК ВПЧ16 на 100 тыс.клеток при интегрированной форме вируса. В соответствии с этими критериями прогнозируют неблагоприятное течение CIN и возможный переход этого заболевания в РШМ.
Перечень фигур;
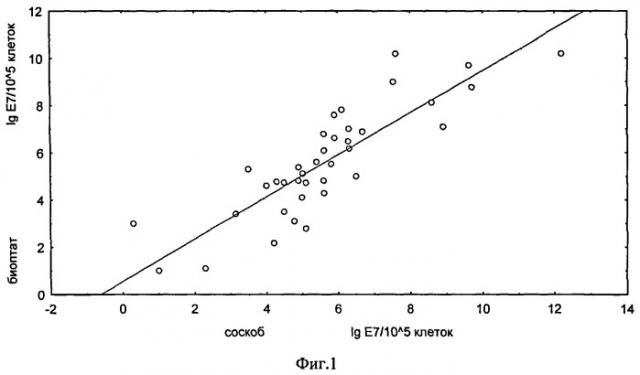
Фиг.1 - Корреляция количественной нагрузки ВПЧ 16 в соскобах из цервикального канала и соответствующих биоптатах ШМ больных CIN и РШМ.
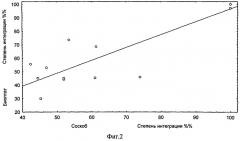
Фиг.2 - Корреляция степени интеграции ДНК ВПЧ 16 в соскобах из цервикального канала и соответствующих биоптатах ШМ больных CIN и РШМ.
Способ осуществляют следующим образом:
1) получение биологического материала: у больных CIN цитощеткой берут соскобы эпителиальных клеток из цервикального канала и наружной поверхности шейки матки (ШМ), а при отсутствии противопоказаний к инвазивному вмешательству - соответствующие биоптаты ШМ (фрагменты ткани ШМ);
2) из полученного биологического материала выделяют ДНК сорбентным методом с применением наборов «ДНК-сорб AM» - для соскобов и «ДНК-сорб С» - для биоптатов (ФГУН ЦНИИ Эпидемиологии Роспотребнадзора (ФГУН ЦНИИЭ), Россия) или аналогичных наборов других фирм;
3) полученные образцы исследуют на наличие вируса и определяют его генотип методом полимеразной цепной реакции (ПЦР) с использованием комплекта реагентов «АмплиСенс ВПЧ ВКР генотип-FL» ФГУН ЦНИИЭ или аналогичных реагентов других фирм;
4) отбирают образцы с ВПЧ 1 6-положительными результатами;
5) методом мультиплексной ПЦР в режиме реального времени определяют количество ДНК вирусных генов Е7 и Е2 (известно, что ген Е7 присутствует в обеих формах вируса - эписомальной и интегрированной, а ген Е2 присутствует только в эписомальной форме вируса), параллельно оценивают количество ДНК b-глобина человека, что соответствует 1/2 количества клеток в анализируемом образце (1 клетка содержит 2 молекулы b-глобина). Все три мишени - Е7, Е2 и b-глобин амплифицируют в одной пробирке. Одновременно в каждом опыте амплифицируют стандартные образцы с известной концентрацией ДНК ВПЧ и ДНК b-глобина человека;
6) анализ образцов проводят на амплификаторах "iCycler iQ" (BioRad, Германия) и "Rotor Gene" ("Corbett Research", Австралия) или аналогичных приборах других фирм. Каждый клинический образец и стандартные образцы исследуют в нескольких повторах;
7) количество геномных эквивалентов Е7, Е2 и b-глобина определяют по калибровочным кривым. Калибровочные кривые получают на стандартных образцах (п.5) в соответствии с программой амплификаторов "iCycler iQ", "Rotor Gene" или аналогичных приборов других фирм;
8) наличие интеграции ДНК вируса в геном клетки-хозяина оценивают по величине среднего значения соотношения геномных эквивалентов Е7/Е2 для нескольких повторов;
9) количество ДНК вируса оценивают по величине среднего значения соотношения геномных эквивалентов Е7/b-глобин в логарифмах, нормализованных на 100 тыс.клеток (1 клетка содержит 2 b-глобина);
10) экспериментальным путем устанавливают пороговый уровень вирусной нагрузки: высокая нагрузка соответствует количеству копий ДНК ВПЧ на 100 тысяч клеток ≥6,5 lg, а низкая<6,5 lg копий ДНК ВПЧ на 100 тысяч клеток;
11) классифицируют пациенток в зависимости от физического статуса ВПЧ на подгруппы с эписомальной или интегрированной формой вируса (п.5). В этих подгруппах определяют вирусную нагрузку - количество копий ДНК вируса на 100 тыс.клеток (п.10);
12) выявляют пациенток с неблагоприятным прогнозом, имеющих высокую вирусную нагрузку при эписомальной форме ВПЧ или низкую вирусную нагрузку при интегрированной форме.
Примеры реализации способа
Пример 1. Выявление пациенток с ВПЧ16-позитивными РШМ и CIN
У первичных больных отделения лучевых и комбинированных методов лечения гинекологических заболеваний ФГБУ МРНЦ Минздравсоцразвития и России, г.Обнинск и женской консультации №4, г.Калуга) с гистологически верифицированными РШМ I-IV стадий (137 человек) и CIN различной степени тяжести (49 человек) до лечения брали соскобы из цервикального канала и наружной поверхности ШМ, а у части больных также брали соответствующий биопсийный материал.
Из полученных образцов выделяли ДНК с использованием коммерческих тест-наборов, описанных выше.
Методом ПЦР в режиме реального времени на "iCycler iQ" ("BioRad", Германия) и "Rotor Gene" ("Corbet Research", Австралия) проводили генотипирование ДНК вируса с использованием коммерческих тест-наборов в соответствии с заявляемой методикой, подробно описанной выше.
Отбирали образцы, инфицированные либо одним ВПЧ 16, либо несколькими ВПЧ ВКР одновременно (множественная инфекция), среди которых ВПЧ 16 являлся ведущим генотипом. В группе РШМ обнаружено 85 таких образцов (62,0%) в группе CIN - 25 образца (51,0%), при этом на долю множественной инфекции приходилось лишь 7 и 4 случая соответственно.
Пример 2. Анализ количественной нагрузки и физического статуса вируса в биологических образцах - соскобах из цервикального канала и биоптатах ШМ
У 85 больных РШМ и 25 больных CIN с выявленной ВПЧ16 инфекцией проведено исследование количественной нагрузки и физического статуса ДНК вируса в соскобах из цервикального канала из них у 40 больных РШМ, не имеющих противопоказаний к инвазивному вмешательству - в биоптатах шейки матки. В соответствии с заявляемым способом число копий ДНК ВПЧ в клетке оценивали по соотношению геномных эквивалентов Е7 вируса и b-глобина клетки (Е7/b-глобин) и нормировали эту величину на 100 тыс.клеток. Наличие интеграции ДНК вируса в геном клетки-хозяина в соответствии с заявляемым способом оценивали по соотношению геномных эквивалентов Е7/Е2 с учетом коэффициента вариации (CV%) для трех повторов согласно разработанным критериям: если при CV% ≤10% Е7/Е2≥1,2-2,0 - интеграция обнаружена, если Е7/Е2<1,2-2,0 - интеграция не обнаружена.
Интегрированная форма ДНК вируса обнаружена у 33 больных РШМ и 7 больных CIN, эписомальная форма - у 52 и 18 больных соответственно; количество больных CIN с эписомальной формой ДНК вируса и высокой вирусной нагрузкой составляет 2, с интегрированной формой ДНК вируса и высокой вирусной нагрузкой - 5; количество больных РШМ с эписомальной формой ДНК вируса и высокой вирусной нагрузкой составляет 20, с интегрированной формой ДНК вируса и высокой вирусной нагрузкой - 3.
Пример 3. Сравнительное исследование количественной нагрузки и физического статуса вируса в соскобах из цервикального канала и соответствующих биоптатах ШМ
Проведено сравнение данных по количественной нагрузке вируса, полученных в соответствии с заявляемым способом, для биоптатов шейки матки 40 больных РШМ с соответствующими данными для соскобов из цервикального канала этих же больных, и выявлен высокий уровень корреляции их между собой. Коэффициент корреляции R=0,889 при уровне значимости р<0,000001 (фиг.1).
Из этих 40 больных наличие интеграции ДНК вируса в геном клетки-хозяина обнаружено у 15 человек. Показатели корреляции данных по интеграции ДНК ВПЧ, полученных для соскобов из цервикального канала и биоптатов ШМ соответствуют: R=0,78; р=0,0006; n=15 (фиг.2).
Корреляционный анализ проведен с использованием пакета программ "Statistica-6".
Высокая корреляция результатов, полученных при исследовании разных биологических образцов - соскобов из цервикального канала и биоптатов ШМ, свидетельствует о пригодности того и другого материала для осуществления заявляемого способа прогнозирования. Полученные данные являются основанием для использования в заявляемом способе щадящей неинвазивной техники получения биологического материала.
Пример 4. Относительный шанс (odds ratio - OR) возникновения РШМ в группе больных CIN с неблагоприятным прогнозом
25 первичных больных с гистологически верифицированными ВПЧ16-позитивными CIN были условно разделены на группы с благоприятным и неблагоприятным сочетанием факторов в зависимости от физического статуса ВПЧ 16 (эписомальная или интегрованная форма ДНК вируса) и выявленного количества копий ДНК вируса в соответствии с заявляемым способом. На такие же группы соответственно были разделены 85 больных с гистологически верифицированными ВПЧ16-позитивными РШМ. Далее проводили сравнение количества лиц с неблагоприятным и благоприятным сочетаниями факторов в группах больных РШМ и CIN по критерию Фишера (пакет программ "Statistica-6"), а также рассчитывали величину и доверительный интервал OR (относительный шанс возникновения РШМ у больных CIN) по формулам, приведенным в книге О.Ю.Ребровой, 2006 [12]. Указанное сравнение выполнено как для каждого из неблагоприятных сочетаний (группы №2 и №3), так и для их объединенной группы (№1) против группы №4 (таблица 1).
| Таблица 1 | ||||
| Распределение больных РШМ и CIN на группы в зависимости от количественной нагрузки и физического статуса ВПЧ 16 | ||||
| Сочетание факторов, характеризующих ВПЧ-инфекцию | № группы сравнения | Показатели количественной нагрузки и физического статуса вируса | Количество больных | |
| РШМ | CIN | |||
| Неблагоприятное сочетание | 1 | Сумма неблагоприятных факторов, в том числе: | 50 | 4 |
| 2 | Высокая нагрузка (≥6,5 lg копий ДНК ВПЧ на 100 тысяч клеток) при эписомальной форме (Е7/Е2<1,2-2,0;) | 20 | 2 | |
| 3 | Низкая нагрузка (<6,5 lg копий ДНК ВПЧ на 100 тысяч клеток) при интегрированной форме (Е7/Е2>1,2-2,0;) | 30 | 2 | |
| Благоприятное сочетание | 4 | Низкая нагрузка (<6,5 lg копий ДНК ВПЧ на 100 тысяч клеток) при эписомальной форме; | 35 | 21 |
| высокая нагрузка (≥6,5 lg копий ДНК ВПЧ на 100 тысяч клеток) при интегрированной форме. |
Полученные результаты свидетельствуют о том, что неблагоприятное сочетание факторов, характеризующих ВПЧ-инфекцию, встречается статистически значимо чаще у больных РШМ, чем у больных CIN: уровень значимости р по двустороннему критерию Фишера составляет 0,0002 для группы №1; 0,001 - для группы №2 и 0,01 - для группы №3.
Расчеты также показывают, что при неблагоприятном сочетании факторов риск возникновения рака у больных CIN с эписомальной формой и высокой нагрузкой вируса в 6,0 раз выше, чем у остальных больных (доверительный интервал - ДИ для OR - [2,3; 24,2]), а у больных CIN с интегрированной формой и низкой нагрузкой вируса в 9,0 раз выше соответственно (ДИ для OR - [1,9; 42,3]). Больные с неблагоприятным прогнозом течения заболевания в соответствии с данными критериями составляют 16% среди всех представленных ВПЧ16-позитивных случаев CIN.
Подтверждение достижения технического результата.
Пример 1 демонстрирует долю больных CIN, к которым применяется заявляемый способ прогнозирования течения заболевания.
Пример 2 демонстрирует долю больных с интегрированной и эписомальной формой ДНК вируса и высокой вирусной нагрузкой среди пациентов с СЕМ и РШМ, к которым применяется заявляемый способ прогнозирования течения заболевания.
Пример 3 доказывает возможность использования в заявляемом способе как биоптатов ШМ, так и соскобов эпителиальных клеток из цервикального канала, тем самым обосновывая применение менее инвазивного способа получения материала для исследования.
Пример 4 ретроспективно доказывает эффективность заявляемого способа раннего выявления пациентов с неблагоприятным течением CIN. Установлены критерии, соответствующие неблагоприятному сочетанию факторов, характеризующих ВПЧ-инфекцию: высокая вирусная нагрузка (≥6,5 lg копий ДНК ВПЧ на 100 тысяч клеток) при эписомальной форме (Е7/Е2<1,2-2,0) или низкая нагрузка (<6,5 lg копий ДНК ВПЧ на 100 тысяч клеток) при частично или полностью интегрированной форме вируса (Е7/Е2≥1,2-2,0).
Использование способа позволяет сформировать среди больных CIN группы повышенного риска развития злокачественной трансформации эпителия ШМ и, соответственно, может позволить управлять средствами лечения и профилактики во времени, предотвращая таким образом развитие онкологического заболевания.
Заявляемый способ - относительно несложный в исполнении и относительно не дорогостоящий (по сравнению с прототипом), что делает его применение доступным в лабораториях обычных клиник.
ЛИТЕРАТУРА
1. Lowy D. Human Papillomavirus: What They are and What They Do // AACR Education Book. 2006. P.275-278.
2. Little RD, Kinney W, Fetter-man В et al. Risk of cervical precancer and cancer in women aged 30 years older with an HPV-negative low-grade squamous intraepithelial lesion screening result // J Low Genit Tract Dis. 2011. V.15. P.54-59.
3. Clifford GM, Rana RK, Franceschi S. Human Papillomavirus Genotype Distribution in Low-Grade Cervical Lesions: Comparison by Geographic Region and with Cervical Cancer. // Cancer Epidemiol Biomarkers (Prevention. - 2005. - V.14. - p.1157-1164.
4. Cattani P, Siddu A, D'Onghia S et al. RNA (E6 and E7) Assay versus DNA (E6 and E7) Assay for Risk Evaluation for Women Infected with Human Papillomavirus. // J Clin Microbiol. - 2009. - V.47. - P.2136-2141.
5. Vinokurova S, Wentzensen N, Kraus I et al. Type-dependent Integration Frequency of Human Papillomavirus Genomes in Cervical Lesions. // Cancer Res. - 2008. - V.68. - P.307-313.
6. Koshiol J, Lindsay L, Pimenta J et al. Persistent Human Papillomavirus Infection and Cervical Neoplasia: A Systematic Review and Meta-Analysis. // Amer J Epidemiol. - 2008. - V.168. - P.123-137.
7. Kulmala S-M A, Shabalova IP, Petrovitchev N et al. // Type-Specific Persistence of High-Risk Human papillomavirus Infection in the New Independent States of the former Soviet Cohort Study. // Cancer Epidemiol Biomarkers (Prevention. - 2007. - V.16. - P. 17-22.
8. Louvanto К, Syrjanen KJ, Rintala MA et al. Human papillomavirus and predictors of cervical intraepithelial neoplasia among young mothers in prospective foolow-up study. // Acta Obstet Gynecol Scand. - 2011. - V.90. - P.167-173.
9. Dalstein V, Riethmuller D, Pretet JL, et al. Persistence and load of high-risk HPV are predictors for development of high-grade cervical lesion: longitudinal French cohort study. // IntJ.Cancer. - 2003, V.I Об.- Р.396-403.
10. Castle PE, Fetterman B, Poitras N et al. Variable risk of cervical precancer and cancer after a human papillomavirus-positive test. // Obstet Gynecol. - 2011. - V.117. - P650-656.
11. Gage JC, Schiffman M, Solomon D et al. Comparison of measurements of human papillomavirus persistence for postcolposcopic surveillance for cervical precancerous lesions. // Cancer Epidemiol Biomarkers Prev. - 2010. - V.19. - P.1668-1674.
12. О.Ю.Реброва «Статистический анализ данных. Применение пакета прикладных программ Statistika. «Медиа Сфера», Москва, 2006 г.
1. Способ оценки состояния гиперпролиферативных заболеваний шейки матки, включающий подготовку биологического материала - соскобы эпителиальных клеток из цервикального канала и биоптаты шейки матки у больных с цервикальными интраэпителиальными неоплазиями, выявление и генотипирование ДНК вируса папилломы человека, отличающийся тем, что отбирают биологические образцы с ВПЧ16-позитивной цервикальной интраэпителиальной неоплазией, проводят полимеразную цепную реакцию, затем определяют количество ДНК вирусных генов Е7, Е2 и клеточного гена b-глобина, по их соотношению устанавливают наличие интеграции вируса в геном клетки и его количественную нагрузку, в соответствии с которыми прогнозируют состояние неблагоприятного течения цервикальной интраэпителиальной неоплазии с прогрессией заболевания в рак шейки матки.
2. Способ по п.1, отличающийся тем, что при эписомальной форме ДНК вируса Е7/Е2<1,2-2,0 и высокой вирусной нагрузке ≥6,5 lg прогнозируют неблагоприятное течение заболевания с прогрессией в рак шейки матки.
3. Способ по п.1, отличающийся тем, что при интегрированной форме ДНК вируса Е7/Е2≥1,2-2,0 и низкой вирусной нагрузке <6,5 lg прогнозируют неблагоприятное течение заболевания с прогрессией в рак шейки матки.