Способ получения водорастворимых фракций маннопротеинов и β-глюкана
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности, а именно к способу получения водорастворимых фракций маннопротеинов и β-глюкана. Способ получения водорастворимых фракций маннопротеинов и β-глюкана, заключающийся в том, что биомассу дрожжей предварительно подвергают механической активации в активаторах или мельницах, к полученному механокомпозиту добавляют раствор ферментного комплекса, проявляющий β-глюканазную или протеазную активность, проводят гидролиз, полученный гидролизат разделяют на маннопротеиновую и β-глюкановую фракции, которые подвергают последующей очистке, при определенных условиях. Вышеописанный способ позволяет повысить эффективность гидролиза и увеличить выход конечного продукта. 1 з.п. ф-лы, 4 ил., 10 пр.
Реферат
Изобретение позволяет получать из дрожжевой биомассы Saccharomyces cerevisiae препараты на основе водорастворимых маннопротеинов и β-глюкана, которые без дополнительной очистки могут быть использованы в косметике, пищевой промышленности, в животноводстве для профилактики инфекций, а также в иммунологии.
Клеточная стенка дрожжей S. cerevisiae является супрамолекулярным комплексом, состоящим преимущественно из β-глюкана и маннопротеинов. Маннопротеины, в свою очередь, состоят из белковой и маннанолигосахаридной части.
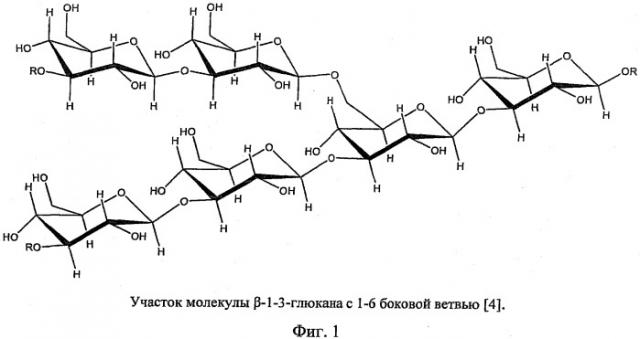
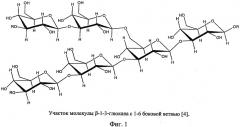
β-Глюкан - полимер из последовательно соединенных β-1,3-связью мономеров глюкозы (фиг.1). Полимерные цепочки β-1,3-глюкана соединяются между собой посредством β-1,6-связей в сложную сетчатую структуру. Во многом благодаря этой структуре β-1,3-глюкан обеспечивает жесткость и прочность клеточной стенки, устойчивость ее к воздействиям окружающей среды. β-1,3-Глюкан можно селективно гидролизовать ферментами, проявляющими 1,3-глюканазную активность.
Благодаря своим физико-химическим свойствам β-глюкан находит широкое применение в косметике и пищевой промышленности, например, в качестве компонентов кремов и диет, обогащенных слабоусваеваемыми пищевыми волокнами, а также как вещество, стимулирующее неспецифический иммунный ответ организма.
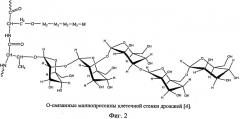
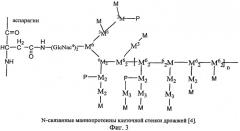
Маннопротеины (реже употребляемый термин - маннаны) различают по виду химической связи маннанолигосахаридной части с белковой частью. Наиболее распространены в клеточной стенке Saccharomyces cerevisiae два типа маннопротеинов: O-связанные, в которых присоединение маннанолигосахаридной части к белку происходит посредством O-гликозидной связи между остатком маннанолигосахарида и гидроксильной группой серина или треонина (фиг.2), и N-связанные Маннопротеины с N-гликозидной связью между остатком N-ацетилглюкозамина и β-амидным азотом аспарагина (фиг.3).
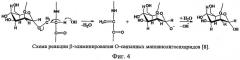
Из литературы известно, что O-гликозидная связь маннопротеинов легко разрушается при действии разбавленных растворов щелочей (β-элиминирование) фиг.4). Достаточно обработки 0,1-0,5 М гидроксидом натрия в течение 12 часов, чтобы отщепить олигосахаридный компонент от белка. N-связанный маннанолигосарид, напротив, может быть отщеплен от белковой молекулы только под действием специфических ферментов - EndoH-EndoF-гликозидаз. Однако под действием растворов щелочей N-маннанолигосахариды экстрагируются из клеточной стенки вместе с белковым компонентом. Необходимым условием для экстракции является разупорядочение клеточной стенки дрожжей, вызванное механической обработкой в энергонапряженных активаторах или гидролизом структурообразующего β-глюкана.
Известно, что маннопротеины посредством маннанолигосахаридных фрагментов взаимодействуют со специфическими белками (пектинами) на поверхности болезнетворных бактерий и препятствуют их закреплению на слизистых оболочках организма, например в пищеварительном тракте или ротовой полости. Неприкрепленные бактерии не способны вызвать заболевания, не размножаются и быстро выводятся из организма или гибнут.
Супрамолекулярная структура клеточной стенки дрожжей S. cerevisiae построена таким образом, что маннопротеины в значительной степени интегрированы в β-глюкановый слой и для переведения их в биологически доступную водорастворимую форму необходимо разрушить связь маннопротеинов с β-глюканом. Для этого используют различные методы, например индуцированный автолиз, ферментативный или кислотный гидролиз.
Известно изобретение RU 2406516 C1 от 20.12.2010 в котором из дрожжевой биомассы получают антибактериальный препарат, содержащий маннанопротеины, интегрированные в клеточную стенку. Для этого проводится механическая активация дрожжевой биомассы совместно с ферментным комплексом, обладающим деполимеразной активностью к β-глюкану и последующий твердофазный ферментативный гидролиз.
В результате механической активации получается механокомпозит, представляющий собой дрожжевые клетки с равномерно распределенным среди них ферментным комплексом. В ходе последующего ферментативного гидролиза клектчные стенки лишь частично гидролизуются, переводя маннанопротеины, интегрированные в стенки, в биодоступное, но не в водорастворимое состояние.
Недостатком данного технического решения является нерациональное использование механической активации. Из-за необходимости проводить обработку в низкоэнергетичных условиях, чтобы не денатурировали ферменты, разупорядочения структуры клеточных стенок практически не происходит и последующий ферментативный гидролиз не облегчается. Также, гидролиз стенок проходит не полностью, что сказывается на биологической активности маннанов.
Наиболее близким техническим решением,, выбранным за прототип, является способ получения β-глюканов и маннанов описанный в Pat. USA №7.048.937 В2 (от 23.05.2006). Способ по прототипу включает 3 стадии:
1. Подготовка биомассы к ферментативному гидролизу: автолиз микробной (в т.ч. дрожжевой) биомассы при 35-55°C для разрушения клеток и получения клеточных стенок. Проводится в течение 24-36 часов при pH от 4 до 8. Полученные клеточные стенки отделяются центрифугированием и подвергаются ферментативному гидролизу.
2. Ферментативный гидролиз: проводится добавленными к реакционной смеси, содержащей подготовленные клеточные стенки, ферментами (щелочными протеазами, глюкоамилазой, амилазой, амилоглюкозидазой, липазой). В процессе гидролиза часть белков и β-глюкана клеточных стенок гидролизуется и становится доступной для разделения на две фракции. Гидролизат центрифугируют, при этом β-глюкан выпадает в осадок и сушится распылительной сушкой, а маннопротеины остаются в надосадочной жидкости, которую используют для ультрафильтрации и выделения маннопротеинов.
3. Разделение на фракции: ультрафильтрация экстракта на молекулярных ситах позволяет выделить маннопротеины с молекулярной массой выше 10 кDа. Полученные маннопротеины сушат распылительной сушкой.
Таким образом получают препарат маннанов, который содержит не менее 85 мас.% маннопротеинов с молекулярной массой выше 10 кDа и препарат β-глюкана, который содержит около 65 мас.% β-глюкана.
Способ получения маннопротеинов и β-глюкана по прототипу имеет существенные недостатки. Для подготовки биомассы методом автолиза в жидкой фазе и получения полупродукта разрушенных клеточных стенок необходимо большое количество воды. Проведение процесса автолиза в жидкой фазе экономически не эффективно, так как необходимо длительное время (более суток) поддерживать высокую температуру (около 50°C) реакционной смеси, затем отделять осадок клеточных стенок от жидкой фазы. Также известно, что для увеличения скорости автолиза к реакционной смеси добавляют пожароопасные и токсичные органические растворители.
Использование щелочных протеаз на стадии ферментативного гидролиза клеточных стенок обуславливает необходимость в щелочном (от 9 до 10) pH реакционной среды. В этих условиях низкомолекулярные 0-маннанолигосахариды отщепляются от белковых молекул и переходят в раствор. При ультрафильтрации на молекулярных ситах этот тип маннанолигосахаридов не извлекается и отбрасывается вместе с балластными веществами. Таким образом, в состав препарата маннопротеинов, полученного по прототипу, входят лишь высокомолекулярные N-маннанолигосахариды, что снижает биологическую активность полученного препарата. Кроме того, полученные препараты содержат 85 и 65% маннопротеинов и β-глюкана соответственно, что обуславливает необходимость их дальнейшей очистки с целью получения очищенных препаратов для применения в косметике и иммунологии.
Задача, решаемая заявляемым техническим решением, заключается в разработке экологически чистого, простого способа получения очищенных препаратов на основе водорастворимых маннопротеинов и β-глюкана.
Способ получения должен позволять использовать доступное сырье, такое как биомасса кормовых дрожжей, отработанная дрожжевая биомасса, послеспиртовая барда и т.д. Для улучшения способа получения препаратов по прототипу необходимо, чтобы подготовка дрожжевой биомассы, а именно разрушение клеточных стенок дрожжей проводилось без проведения автолиза в жидкой фазе, а на стадии ферментативного гидролиза использовались ферменты, проявляющие наибольшую активность при значениях pH<7. Для использования в косметике и иммунологии маннопротеины и β-глюкан должны быть дополнительно очищены от примесей балластных веществ, потенциально способных вызывать аллергические реакции.
Поставленная задача решается благодаря заявляемому способу, включающему подготовку биомассы дрожжей к ферментативному гидролизу, ферментативный гидролиз, разделение на фракции, очистку, отличающийся тем, что, биомассу дрожжей предварительно подвергают механической активации в активаторах или мельницах, обеспечивающих ускорение мелющих тел 60-600 м/с2 при времени пребывания в зоне обработки 0,5-15 мин., к полученному механокомпозиту добавляют раствор ферментного комплекса, проявляющий β-глюканазную или протеазную активность, ферментативный гидролиз проводят при pH 4-7, концентрации ферментного комплекса 0,5-10 мас.%, концентрации полученного механокомпозита 5-20 мас.%, при температуре 50-65°C в течение 10-30 часов, полученный гидролизат разделяют на маннопротеиновую и β-глюкановую фракции, которые подвергают последующей очистке.
Предпочтительно, механическую активацию биомассы проводят в активаторах планетарного, центробежного или виброцентробежного типов, или в роликовых мельницах.
При механической активации дрожжевой биомассы в указанных высокоэнергетичных условиях происходит механическое разрушение клеток и значительное разупорядочение надмолекулярной структуры клеточных стенок, повышение их реакционной способности по отношению к ферментативному гидролизу. Также, в полученном механокомпозите - продукте механической активации - реализуются уменьшенные диффузионные пути, структурные слои клеточной стенки носят диффузный характер.
Подбор оборудования для механической активации не случаен и направлен на достижение заданной структуры механокомпозита. Условия механической активации и состав оборудования не очевиден и не может быть подобран простым перебором режимов без проведения всестороннего изучения структуры и разупорядочения стенок дрожжевой биомассы.
Механический способ подготовки дрожжевой биомассы к ферментативному гидролизу, а именно получение разрушенных клеточных стенок более экономически эффективен, чем автолиз в жидкой фазе так как не требует больших количеств воды, длительного поддержания повышенной температуры, а также стадии выделения клеточных стенок из автолизата. Полупродукт разрушенных клеточных стенок получаемый после механической активации представляет собой воздушно сухой порошок от бежевого до светло-коричневого цвета, который может непосредственно использоваться для дальнейшего ферментативного гидролиза.
Ферментативный гидролиз полупродукта, полученного в результате механической активации, при помощи препаратов, проявляющих β-глюканазную и протеазную активность позволяет разрушать химические связи между маннопротеиновой частью и структурообразующей β-глюкановой частью. Следствием разрушения химических связей между перечисленными компонентами является возможность их разделения на две фракции. Кроме того, проведение гидролиза ферментными препаратами, проявляющими активность в диапазоне pH 4-7 позволяет сохранить низкомолекулярные O-маннанолигосахариды в составе маннопротеиновой фракции, что, безусловно, повышает биологическую активность полученных веществ по сравнению с препаратами по прототипу.
Проведение очистки водорастворимых маннопротеинов и β-глюкана в описанных режимах позволяет получать препараты с более высоким, нежели в прототипе, содержанием маннопротеинов и β-глюкана. Более концентрированные и очищенные препараты обладают большей биологической активностью и содержат меньше балластных веществ, которые потенциально могут вызывать аллергические реакции. Так, очищенный маннопротеиновый препарат имеет следующий состав: водорастворимые маннопротеины - 85-90 масс.%, β-глюкан - 2-4 масс.%, зола - 3-6 масс.%, вода - остальное. Очищенный β-глюкановый препарат имеет следующий состав: β-глюкан - 75-80, белки - 10-13, зола - 5-7 масс.%, вода - остальное.
Совокупность существенных признаков заявляемого способа среди известных прототипов не выявлена, что позволяет сделать вывод о соответствии заявляемого способа критерию «изобретательский уровень» и «новизна».
Достигаемый технический результат заключается в получении биологически активных препаратов на основе водорастворимых маннопротеинов и β-глюкана, обладающих повышенной чистотой, с помощью заявляемого экологически чистого и простого способа.
Изобретение поясняется следующими примерами.
Пример 1.
Высушенные до влажности 10 мас.% прессованные хлебопекарные дрожжи ГОСТ 171-81 механически активируют в проточном активаторе центробежного типа ЦЭМ, или виброцентробежного типа ВЦМ, или роликовой мельнице обеспечивающих ускорение мелющих тел 60 м/с2 и время пребывания в зоне обработки 0,5 минут. Полученный полупродукт смешивают с ферментативным комплексом «ЦеллоЛюкс-А» (производство ПО «СИББИОФАРМ» г.Бердск), обладающим β-глюканазной активностью, в соотношении 99,5/0,5. К смеси добавляют буферный раствор с pH 4-6 до концентрации твердой фазы 5 мас.% и проводят ферментативный гидролиз в течение 10 часов при температуре 50°C.
При ускорении мелющих тел менее 60 м/с2 не обеспечивается достаточная разупорядоченность супрамолекулярной структуры клеточных стенок дрожжевой биомассы, что снижает эффективность последующего ферментативного гидролиза.
Применение обработки менее 0,5 минут не обеспечивает необходимой степени разрушения дрожжевых клеток, накопления механической энергии и практически не приводит к образованию механокомпозита. Понижение температуры ферментативного гидролиза ниже 50°C отрицательно сказывается на скорости протекания гидролиза, а проведение прогрева менее, чем за 10 часов, не обеспечивает оптимальной степени превращения. Понижение концентрации твердой фазы менее 5 мас.% не целесообразно из экономических соображений, так как связано с дальнейшей необходимостью удаление лишнего объема воды.
Пример 2.
Высушенные до влажности 10 мас.% прессованные хлебопекарные дрожжи ГОСТ 171-81 механически активируют в проточном активаторе центробежного типа ЦЭМ, или виброцентробежного типа ВЦМ, или роликовой мельнице обеспечивающих ускорение мелющих тел 600 м/с2 и время пребывания в зоне обработки 15 минут. Полученный полупродукт смешивают с ферментативным комплексом «ЦеллоЛюкс-А» (производство ПО «СИББИОФАРМ» г.Бердск), обладающим β-глюканазной активностью, в соотношении 9/1. К смеси добавляют буферный раствор с pH 4-6 до концентрации твердой фазы 20 мас.% и проводят ферментативный гидролиз в течение 20 часов при температуре 65°C.
При ускорении более 600 м/с2 происходит разогрев обрабатываемой биомассы, что может привести к разрушению биологически активных маннопротеинов. Применение обработки свыше 15 минут также может приводить к механодеструкции целевых компонентов. Повышение температуры ферментативного гидролиза выше 65°C приводит к денатурации ферментативного комплекса. Увеличение времени прогрева свыше 20 часов несущественно сказывается на степень превращения ввиду постепенного уменьшения скорости реакции от времени. Повышение концентрации твердой фазы более 20 мас.% не целесообразно ввиду высокой вязкости реакционной смеси.
Пример 3.
Осуществляется в условиях примера 2. В качестве ферментативного комплекса используется смесь ферментативного комплекса «ЦеллоЛюкс А», обладающего β-глюканазной активностью, и ферментативного комплекса «Протосубтилин г3х» (производство ПО «СИББИОФАРМ» г.Бердск), обладающего протеазной активностью по отношению к белкам клеточной стенки. Оптимальная температура проведения ферментативного гидролиза для данного ферментативного комплекса 60°C, оптимальный pH 6-7. Продолжительность реакции 15 часов.
Использование смеси ферментативных комплексов, обладающих β-глюканазной и протеазной активностью, позволяет увеличить скорость ферментативной реакции гидролиза клеточной стенки за счет комплексного воздействия на все ее структурные компоненты.
Пример 4.
Осуществляется в условиях примера 1-2. В качестве механического активатора используют активатор планетарного типа АГО-2, позволяющий получать в лабораторных условиях небольшие партии продукта для научных исследований и отработки технологических стадий.
Пример 5.
Осуществляется в условиях примера 2. В качестве сырья используется дрожжевая биомасса послеспиртовой барды высушенная до влажности 10 мас.%. Ввиду наличия в дрожжевой биомассе послеспиртовой барды соединений, способных инактивировать ферментативный комплекс, затрудняя протекание ферментативного гидролиза, целесообразно использовать дрожжевую биомассу и ферментативный комплекс, обладающий β-глюканазной активностью, в соотношении 90/10. Продолжительность реакции составляет в данном случае 30 часов. Вовлечение в производство дешевого и некондиционного сырья позволяет рационально утилизировать перечисленные отходы, а также сократить расходы на получение препарата.
Пример 6.
Осуществляется в условиях примера 2-3. В качестве сырья используется биомасса кормовых дрожжей, высушенная до влажности 10 мас.%. Ввиду наличия у кормовых дрожжей упрочненной клеточной стенки, целесообразно использовать интенсивные режимы механической активации и смесь ферментативных комплексов, обладающих β-глюканазной и протеазной активностью. Соотношение интенсивно активированной биомассы кормовых дрожжей и смеси ферментативных комплексов составляет 98/2. Продолжительность реакции составляет 20 часов. Вовлечение в производство дешевого кормового сырья позволяет сократить расходы на получение препарата.
Пример 7
Осуществляется в условиях примера 1-3. Продукт, полученный в результате ферментативного гидролиза центрифугируют в течение 10 минут при 5000 об./мин. Осадок, содержащий β-глюкан, промывают раствором 0,005-0,01 М гидроксида натрия с постепенным понижением концентрации, а затем дистиллированной водой. Очищенный препарат β-глюкана сушат распылительной сушкой или в вакуумных сушильных шкафах при температуре не выше 50°C.
Полученный продукт содержит, мас.%:
β-глюкан - 80%,
белки - 10%,
зола - 5%,
вода - остальное.
Пример 8.
Осуществляется в условиях примеров 1-3. Продукт, полученный в результате ферментативного гидролиза центрифугируют в течение 10 минут при 5000 об./мин. Надосадочную жидкость, содержащую маннопротеины, фильтруют на молекулярных ситах, удерживающих молекулы с молекулярной массой более 10 kDa и многократно промывают раствором «25 мас.% дистиллированной воды / 75 мас.% этилового спирта» до достижения прозрачных промывных вод. Очищенный препарат, содержащий маннопротеины, сушат распылительной сушкой или в вакуумных сушильных шкафах при температуре не выше 50°C.
Полученный продукт содержит, мас.%:
водорастворимые маннопротеины - 90%,
β-глюкан - 2%,
зола - 3%,
вода - остальное.
Пример 9.
Осуществляется в условиях примера 5-6. Продукт, полученный в результате ферментативного гидролиза, центрифугируют в течение 10 минут при 5000 об./мин. Осадок, содержащий β-глюкан, промывают раствором 0,005-0,01 М гидроксида натрия с постепенным понижением концентрации, а затем дистиллированной водой. Очищенный препарат β-глюкана сушат распылительной сушкой или в вакуумных сушильных шкафах при температуре не выше 50°C.
Полученный продукт содержит, мас.%:
β-глюкан - 75%,
белки - 13%,
зола - 7%,
вода - остальное.
Пример 10.
Осуществляется в условиях примера 5-6. Продукт, полученный в результате ферментативного гидролиза, центрифугируют в течение 10 минут при 5000 об./мин. Надосадочную жидкость, содержащую маннопротеины, фильтруют на молекулярных ситах, удерживающих молекулы с молекулярной массой более 10 kDa и многократно промывают раствором «25 мас.% дистиллированной воды / 75 мас.% этилового спирта» до достижения прозрачных промывных вод. Очищенный препарат, содержащий маннопротеины, сушат распылительной сушкой или в вакуумных сушильных шкафах при температуре не выше 50°C.
Полученный продукт содержит, мас.%:
водорастворимые маннопротеины - 85%,
β-глюкан - 4%,
зола - 6%,
вода - остальное.
Источники информации
1. Biorndal H., Lindberg В. The Structure of a β-(1-6)-D-glucan from yeast cell walls // Biochem. J. - 1973. - №.135. - P.31-36.
2. Manners D.J., Masson A.J., Patterson J.C. The structure of a β-(1-3)-D-glucan from yeast cell walls // Biochem. J. - 1973. - №135. - С.19-30.
3. Бирюзова В.И. Ультраструктурная организация дрожжевой клетки / М.: Наука, 1993. - 224 с.
4. Калебина Т.С., Кулаев И.С. Роль белков в формировании молекулярной структуры клеточной стенки дрожжей // Успехи биологической химии. - 2001. - №.41. - С.105-130.
5. Kitamura К., Matsuki S., Tanabe K. Physiologically active polysaccharides, production ad use thereof// Pat. USA. - №4.313.934.-2.02.1982.
6. Nakakuki Т. Present status and future prospects of functional oligosaccharide development in Japan // J. Appl. Glycosci. - 2005. - №52. - P.267-271.
7. Warrand J. Healthy polysaccharides. The next chapter in food products // Food technol. Biotechnol. - 2006. - №44. - P.355-370.
8. Гликопротеины, под ред. А. Готтшалка, Т1./М.: Мир, 1969. - 304 с.
9. Fairchild A.S., Grimes J.L., Jones F.T., Winel M.J., Edens F.W., Sefton A.E. Effects of hen age, Bio-Mos, and Flavomycin on poult susceptibility to oral Escherichia coli challenge // J. Poultry Sci. - 2001. - №80. - P.562-571.
10. Firon N., Oftek I., Sharon N. Carbohydrate specificity of the surface lectins of Escherichia coli, Klebsiella pneumoniae, and Salmonella typhimurium II Carbohydrate research - 1983. - №120. - P.235-249.
11. Smith S., Elbein A.D., Pan Y.T. Inhibition of bacterial binding by high-mannose oligosaccharides // Pat. USA. - №5.939.279. - 17.08.1999.
12. Tzipori S. The relative importance of enteric pathogen affecting neonates of domestic animals // Adv. in vet. sc. compare, med. - 1985. - №29. - P.103-206.
13. Dawson K.A., Sefton A.E. Methods and composition for control of coccidiosis // Pat. USA. - №7.048.937.B2. - 23.05.2006.
14. Sedmak J.J. Production of beta-glucans and mannans // Pat. USA. - №2006/0263415.A1. - 23.11.2006.
15. Белоусова Н.И., Гордиенко С. В., Ерошин В.К., Ильченко В.Я. Получение смесей аминокислот на основе автолизатов дрожжей Saccharomyces, выращенных на этаноле или сахарах // Биотехнология. - 1990. - №3. - С.6-9.
1. Способ получения водорастворимых фракций маннопротеинов и β-глюкана, включающий подготовку биомассы дрожжей к ферментативному гидролизу, ферментативный гидролиз, разделение на фракции, очистку, отличающийся тем, что биомассу дрожжей предварительно подвергают механической активации в активаторах или мельницах, обеспечивающих ускорение мелющих тел 60-600 м/с2 при времени пребывания в зоне обработки 0,5-15 мин, к полученному механокомпозиту добавляют раствор ферментного комплекса, проявляющий β-глюканазную или протеазную активность, до концентрации комплекса 0,5-10 мас.%, и буферный раствор с pH 4-7, до концентрации твердой фазы 5-20 мас.%, гидролиз проводят при температуре 50-65°C в течение 10-30 ч, полученный гидролизат разделяют на маннопротеиновую и β-глюкановую фракции, которые подвергают последующей очистке.
2. Способ по п.1, отличающийся тем, что механическую активацию биомассы дрожжей проводят в активаторах планетарного, центробежного или виброцентробежного типов или в роликовых мельницах.