3- или 4-замещенные пиперидиновые соединения
Иллюстрации
Показать всеОписываются рацемически или энантиомерно обогащенные соединения 3-замещенного пиперидина общей формулы (I)
или их фармацевтически приемлемые соли, где A означает фенил, нафтил, возможно замещенные, или бензотиофенил; B - азол, выбранный из группы, состоящей из триазола, бензотриазола, 5-метил- или 5-фенилтетразола;
Y - CH2 и X - N-R, где R - водород или C1-4алкил, фармацевтические композиции, содержащие данные соединения, и способы лечения депрессии, тревожности и болевого расстройства у млекопитающего. 7 н. и 4 з.п. ф-лы, 4 табл., 126 прим.
Реферат
Область техники
Настоящее изобретение относится, в целом, к рацемически или энантиомерно обогащенным новым 3- или 4-замещенным пиперидиновым производным и к их фармацевтически полезным солям, фармацевтической композиции, содержащей эффективное количество рацемически или энантиомерно обогащенных новых 3- или 4-замещенных пиперидиновых производных в качестве ингибиторов обратного захвата нейротрансмиттерных моноаминов для лечения заболеваний центральной нервной системы, к способу лечения заболеваний центральной нервной системы у млекопитающего. Более конкретно, настоящее изобретение относится к рацемически или энантиомерно обогащенным новым 3- или 4-замещенным пиперидиновым производным, имеющим различные азольные остатки и к их фармацевтически полезным солям, применимым для лечения заболеваний центральной нервной системы, таким как депрессия, тревожность и болевое расстройство.
УРОВЕНЬ ТЕХНИКИ
Три биогенных амина, серотонин, норадреналин и дофамин, наиболее тесно связаны с расстройствами ЦНС, такими как депрессия. Большинство антидепрессантов, применяемых в настоящее время, ингибируют обратный захват серотонина и/или норадреналина. Хотя выраженную активность, ингибирующую обратный захват дофамина, связывают с риском нежелательных эффектов центральной стимуляции, многие сообщения указывают, что тройные моноаминные нейротрансмиттеры, т.е. ингибиторы обратного захвата серотонина, норадреналина и дофамина применимы для лечения расстройств ЦНС, таких как депрессия, тревожность, расстройство дефицита внимания с гиперактивностью, ожирение, лекарственная зависимость и расстройства боли. Например, международная патентная заявка WO 2004/072071 раскрывает новые 8-аза-бицикло[3,2,1]октановые производные, применимые в качестве ингибиторов обратного захвата моноаминных нейротрансмиттеров.
3-замещенные пиперидиновые соединения эффективно применяют для лечения различных расстройств центральной нервной системы (ЦНС). Например, Международная патентная заявка WO 02/51837 раскрывает 3-замещенные пиперидиновые производные, которые являются подходящими для лечения тревожности, депрессии, расстройства сна. Продолжаются активные усилия в исследованиях и разработках, направленные на применение 3-замещенных пиперидиновых соединений для лечения расстройств ЦНС.
Сущность изобретения
Объектом настоящего изобретения является обеспечение 3- или 4-замещенных пиперидиновых производных, представленных следующей структурной формулой (I):
или любыми их изомерами или их фармацевтически приемлемыми солями,
где
A выбран из группы, состоящей из фенила, нафтила, бензотиофенила, пиридила, хинолила и изохинолила, которые могут быть замещены одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из водорода, галогена, прямой- или разветвленной - цепи C1-4алкила, прямой- или разветвленной - цепи C1-3алкокси, нитро, циано, трифторметила, трифторметокси, метансульфонила, фенилокси, фенила и тиенила;
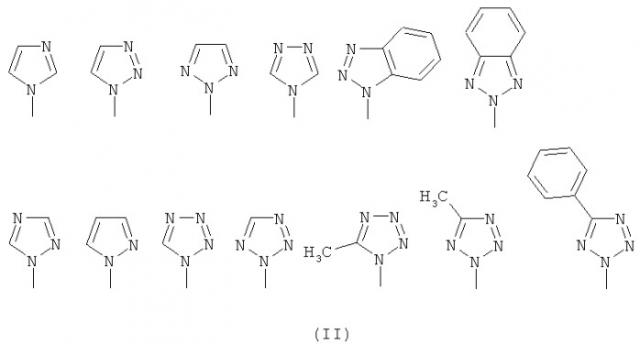
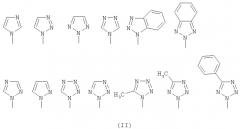
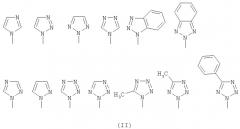
В представляет собой азол, выбранный из группы, состоящей из имидазола, пиразола, триазола, бензотриазола, тетразола, 5-метилтетразола и 5-фенилтетразола, которые связываются с помощью атома азота, как представлено на следующей структурной формуле (II): и
один из X и Y представляет собой углерод и другой представляет собой N-R, где R представляет собой водород или C1-4алкильную группу.
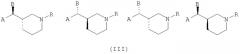
Более конкретно, настоящие 3- или 4-замещенные пиперидиновые соединения, представленные приведенной выше формулой (I), содержат любой из их изомеров или любую смесь их изомеров, представленных следующими структурными формулами (III) и (IV):
где значения A, B и R определены выше.
Еще более конкретно 3-замещенные пиперидиновые соединения выбраны из группы, представленной следующими структурными формулами (XXII):
где R1, R2, R3 являются одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из галогена, алкила с прямой или разветвленной цепью, содержащей от 1 до 4 атомов углерода, и алкокси с прямой или разветвленной цепью, содержащей от 1 до 3 атомов углерода; B и R имеют указанные значения, или их фармацевтически приемлемые соли.
Другой объект настоящего изобретения обеспечивает фармацевтическую композицию, содержащую эффективное количество рацемических или энантиомерно обогащенных 3- или 4-замещенных пиперидиновых соединений, представленных приведенной выше структурной формулой (I), в частности, соединений, представленных приведенными выше структурными формулами (III) и (IV) для лечения заболеваний центральной нервной системы, такими как депрессия, страх и боль.
Еще один объект настоящего изобретения обеспечивает способ лечения заболеваний центральной нервной системы, таких как депрессия, страх и боль у млегопитающего, который нуждается в таком лечении, путем введения эффективного количества рацемических или энантиомерно обогащенных 3- или 4-замещенных пиперидиновых соединений, представленных приведенной выше структурной формулой (I), в частности, соединений, представленных приведенными выше структурными формулами (III), (IV) и фармацевтически приемлемого носителя.
Описание предпочтительного воплощения изобретения
Согласно настоящему изобретению, соединение, представленное приведенной выше структурной формулой (I) и его фармацевтически приемлемые соли, могут быть получены с помощью методик и процессов, доступных среднему специалисту, например, следуя способам, которые раскрыты на последующих схемах. Эти схемы не должны быть расценены как ограничение объема изобретения. Все заместители, за исключением тех, которые специально оговорены, определены ранее. Реагенты и исходный продукт доступны среднему специалисту.
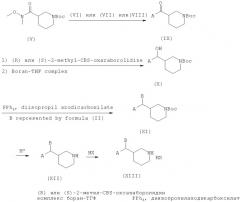
Согласно настоящему изобретению, соединение, представленное структурной формулой (III) и его фармацевтически приемлемые соли могут быть получены с помощью следующих шагов, исходя из трет-бутил-3-[метокси(метил)карбамоил]пиперидин-1-карбоксилата, представленного следующей общей структурной формулой (V):
Должно быть отмечено, что стереохимия третьего положения пиперидина общей структурной формулы (III) в значительной степени зависит от исходного продукта (V); исходный продукт (V) в виде (S)-энантиомера приводит только к продукту в виде (3S)-энантиомерна и исходный продукт (V) в виде (R)-энантиомера приводит только к продукту в виде (3R)-энантиомера.
Пример способа получения соединения общей формулы (III), в которой R представляет собой водород, будет описан в деталях далее.
Вначале, трет-бутил-3-[метокси(метил)карбамоил]пиперидин-1-карбоксилат взаимодействует с замещенным фенил или нафтилмагнийбромидом, представленым следующими структурными формулами (VI), (VII) или (VIII):
где R1, R2, R3 является одним или более, одинаковыми или различными заместителями, выбранными из группы, состоящей из водорода, галогена, прямой или разветвленной цепи алкила, содержащей от 1 до 4 атомов углерода, прямой или разветвленной цепи алкокси, содержащей от 1 до 3 атомов углерода, нитро, циано, трифторметила, трифторметокси, метансульфонила, фенилокси, фенила и тиенила;
чтобы синтезировать Boc-защищенные аминокетоны структурной формулы (IX).
где A выбран из группы, состоящей из фенила, нафтила, бензотиофенила, пиридила, хинолила, изохинолила, которые могут быть замещенными одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из водорода, галогена, прямой или разветвленной цепи алкила, содержащей от 1 до 4 атомов углерода, прямой или разветвленной цепи алкокси, содержащей от 1 до 3 атомов углерода, нитро, циано, трифторметила, трифторметокси, метансульфонила, фенилокси, фенила и тиенила.
Считатется, что Boc-защищенные аминокетоны, представленные структурной формулой (IX), где A представляет собой бензотиофенил; пиридил; хинолил или изохинолил могут быть получены с помощью аналогичных способов.
Соединение формулы (IX) обрабатывают (R)-2-метил-CBS-оксазаборолидином или (S)-2-метил-CBS-оксазаборолидином, а затем комплексом боран-ТГФ, чтобы синтезировать энантиомерно обогащенные спиртовые соединения, представленные структурной формулой (X).
Соединение формулы (X) взаимодействует с трифенилфосфином, диизопропил азодикарбоксилатом и азольными соединениями, такими как имидазол, пиразол, триазол, тетразол, 5-метилтетразол, 5-фенилтетразол, бензотриазол, представленными структурной формулой (II), чтобы синтезировать Boc-защищенные аминоазольные соединения, представленные структурной формулой (XI)
где A выбран из группы, состоящей из фенила, нафтила, бензотиофенила, пиридила, хинолила, изохинолила, которые могут быть замещенными одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из водорода, галогена, прямой или разветвленной цепи алкила, состоящей из от 1 до 4 атомов углерода, прямой или разветвленной цепи алкокси, состоящей из от 1 до 3 атомов углерода, нитро, циано, трифторметила, трифторметокси, метансульфонила, фенилокси, фенила и тиенила;
В выбран из азольной группы, такой как имидазол, пиразол, триазол, бензотриазол, тетразол, 5-метилтетразол и 5-фенилтетразол, которые связываются азотом и представлены следующими структурными формулами (II):
С полученного промежуточного соединения удаляют защиту с помощью метанольного раствора соляной кислоты, что приводит к 3-замещенным пиперидиновым производным, представленным общей формулой (XII).
Соединение формулы (XII) может быть превращено в фармацевтически приемлемые соли (XIII) обработкой кислотой, способной образовывать фармакологически полезную соль.
Указанный процесс в целом представлен далее на реакционной схеме I ниже.
Реакционная Схема I
Условия проведения процесса в деталях, раскрытого на схеме I, следующие. Для превращения соединения (V) в соединение (IX), предпочтительно, чтобы концентрация исходного продукта (V) составляла примерно от 0.005 до 0.1 моль с фенил или нафтилмагнийбромидом, находящемся в интервале примерно от 2.0 до 3.0 эквивалентов. Данную реакцию предпочтительно проводить при температуре от 10 до 30°C. Полученное соединение кетона обрабатывают от 0.5 до 1.0 эквивалентами (R) или (S)-2-метил-CBS-оксазаборолидином при температуре -78°C, с последующим добавлением комплекса боран-ТГФ в количестве от 1.0 до 3.0 эквивалентов, что дает энантиомерно обогащенное спиртовое соединение формулы (X). Полученный спирт обрабатывают трифенилфосфином, диизопропилазодикарбоксилатом и азольными соединениями в количестве, находящемся в интервале от 1.0 до 2.5 эквивалента, предпочтительно при температуре примерно от 0 до 30°C. Для этой реакции могут быть использованы в качестве растворителя эфирный растворитель, такой как диэтиловый эфир и тетрагидрофуран или ароматические углеводороды, такие как бензол, толуол и ксилол. Соединение (XI) обрабатывают 6% метанольном раствором соляной кислотой при температуре примерно от -10 до 30°C, с последующей нейтрализацией, чтобы получить соединение формулы (XII).
На реакционной Схеме I, HX представляет собой кислоту, способную образовать фармакологически пригодную соль с основным атомом азота. Конкретные примеры безводной кислоты, используемой для получения соединения (XIII) из соединения (XII), включают соляную кислоту, бромистоводородную кислоту, серную кислоту, фосфорную кислоту, уксусную кислоту, бензойную кислоту, угольную кислоту, лимонную кислоту, малоновую кислоту, салициловую кислоту, яблочную кислоту, фумаровую кислоту, оксалиновую кислоту, сукциновую кислоту, винную кислоту, молочную кислоту, глюконовую кислоту, аскорбиновую кислоту, малеиновую кислоту, аспарагиновую кислоту, камфоросульфоновую кислоту, п-толуолсульфоновую кислоту, бензолсульфоновую кислоту, метансульфоновую кислоту, этансульфоновую кислоту, гидроксиметансульфоновую кислоту и гидроксиэтансульфоновую кислоту и тому подобное. Дополнительные кислоты могут быть найдены в "Pharmaceutical Salts " J. Pharm. Sci., 1977; 66 (1): 1-19. Данное превращение осуществляют в реакционной среде, которая представлена простым эфиром, таким как тетрагидрофуран, спиртовым растворителем, таким как метанол, сложноэфирным растворителем, таким как этилацетат, галогенированным углеводородом, и их смесью. Эфирный растворитель рекомендован как дополнительный растворитель, включая этиловый эфир, пропиловый эфир, изопропиловый эфир, бутиловый эфир, изобутиловый эфир. Концентрация соединения (XII) находится в области примерно от 0.01 до 5 молей.
Способ получения соединения общей формулы (III), в которой R не является водородом, будет описан в деталях ниже.
Вначале, полученные аминовые соединения (XII) взаимодействуют с триэтиламином и подходящим алкилагалоидом в дихлорметане при 0°C, что приводит к алкилированному аминовому соединению, представленному общей формулой (III), в которой R не является водородом.
Соединение формулы (III), в котором R не является водородом, может быть превращено в фармацевтически приемлемые соли (XIV), как раскрыто выше.
Указанный процесс суммирован на схеме II ниже в целом, как представлено далее.
Реакционная Схема II
Реакционные условия процесса, представленного на схеме II, в деталях являются следующими. Для превращения соединения (XII) в соединение (III), концентрация исходного продукта (XII) составляет примерно от 0.005 до 0.1 моль с триэтиламином, взятым в количестве от примерно 2.0 до 3.0 эквивалентов и алкилагалоидом от примерно от 1.5 до 3 эквивалентов. Указанную реакцию предпочтительно проводить при температуре от 0 до 30°C. Для указанного алкилирования могут быть использованы эфирный растворитель, такой как диэтиловый эфир и тетрагидрофуран, галогенированный углеводород, такой как дихлорметан и хлороформ, спиртовый растворитель, такой как метанол, этанол и пропанол, или их смесь.
На реакционной Схеме II, HX представляет собой кислоту, способную формировать фармакологически применимую соль с основным атомом азота, как описано выше.
В соответствии с настоящим изобретением соединение, представленное структурной формулой (IV) и его фармацевтически приемлемые соли, могут быть получены с помощью следующих шагов, исходя из трет-бутил-4-[метокси(метил)карбамоил]пиперидин-1-карбоксилата, представленного следующей общей структурной формулой (XV):
Пример способа получения соединения формулы (IV), в котором R не является водородом, описан в деталях ниже.
Вначале, трет-бутил-4-[метокси(метил)карбамоил]пиперидин-1-карбоксилат взаимодействует с замещенным фенил или нафтилмагнийбромидом, представленными следующими структурными формулами (VI), (VII) или (VIII):
где
R1, R2 или R3 является одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей водорода, галогена, прямой- или разветвленной - цепи алкила, состоящего из от 1 до 4 атомов углерода, прямой или разветвленной цепи алкокси, состоящей из от 1 до 3 атомов углерода, нитро, циано, трифторметила, трифторметокси, метансульфонила, фенилокси, фенила и тиенила;
чтобы синтезировать Boc-защищенные аминокетоновые соединения, представленные структурной формулой (XVI).
где
A выбран из группы, состоящей из фенила, нафтила, бензотиофенила, пиридила, хинолила и изохинолила, которые могут быть замещенными одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из водорода, галогена, прямой или разветвленной цепи алкила, состоящей из от 1 до 4 атомов углерода, прямой или разветвленной цепи алкокси, состоящей из от 1 до 3 атомов углерода, нитро, циано, трифторметила, трифторметокси, метансульфонила, фенилокси, фенила и тиенила.
Считается, что Boc-защищенные аминокетонные соединения, представленные структурной формулой (IX), где A представляет собой бензотиофенил, пиридил, хинолил или изохинолил могут быть получены аналогичным путем.
Соединение формулы (XVI) обрабатывают (R)-2-метил-CBS-оксазаборолидином или (S)-2-метил-CBS-оксазаборолидином, с последующей обработкой комплексом боран-ТГФ, чтобы синтезировать энантиомерно обогащенные спиртовые соединения, представленные структурной формулой (XVII).
Соединение формулы (XVII) взаимодействует с трифенилфосфином, диизопропил азодикарбоксилатом и азольными соединениями, таким как имидазол, пиразол, триазол, тетразол, 5-метилтетразол, 5-фенилтетразол, бензотриазол, представленными структурной формулой (II), чтобы синтезировать Boc-защищенные аминоазольные соединения, представленные структурной формулой (XVIII)
где
A выбран из группы, состоящей из фенила, нафтила, бензотиофенила, пиридила, хинолила и изохинолила, которые могут быть замещенными одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из водорода, галогена, прямой или разветвленной цепи алкила, состоящей из от 1 до 4 атомов углерода, прямой или разветвленной цепи алкокси, состоящей из от 1 до 3 атомов углерода, нитро, циано, трифторметила, трифторметокси, метансульфонила, фенилокси, фенила и тиенила;
В выбран из азольной группы, такой как имидазол, пиразол, триазол, бензотриазол, тетразол, 5-метилтетразол или 5-фенилтетразол, которые связываются атомом азота и представлены следующими структурными формулами (II):
С указанного промежуточного соединения удаляют защиту с помощью метанольного раствора соляной кислоты, что приводит к 4-замещенным пиперидиновым производным, представленным общей формулой (XIX).
Энантиомерную смесь (XIX) растворяют в небольшом количестве изопропилового спирта и разделяют с помощью хиральной препаративной жидкостной хроматографии. Разделение осуществляют, используя CHIRALPACK OD-H колонку (производство Daicel Chemical Industries, Ltd.), также как Prep-LC колонку, при температуре колонки 25°C, со смесью н-гексан / изопропиловый спирт, включая 0.1% триэтиламина (90:10), в качестве элюента, чтобы получить чистые энантиомеры.
Энантиомерно чистое соединение формулы (XIX) может быть превращено в фармацевтически приемлемые соли (XX), как описано выше.
Указанный процесс суммирован, как представлено далее, на реакционной Схеме III, ниже.
Реакционная Схема III
В деталях условия реакции, раскрытые на реакционной Схеме III, являются следующими. Для превращения соединения (XV) в соединение (XVI), предпочтительно, чтобы концентрация исходного продукта (XV) составляла примерно от 0.005 до 0.1 моль с фенил или нафтилмагнийбромидом в количестве от примерно 2.0 до 3.0 эквивалентов. Указанную реакцию предпочтительно проводить при температуре от 10 до 30°C. Полученное соединение кетона обрабатывают от 0.5 до 1.0 эквивалентами (R) или (S)-2-метил-CBS-оксазаборолидина при температуре -78°C, с последующим добавлением комплекса боран-ТГФ в количестве от 1.0 до 3.0 эквивалентов, что дает энантиомерно обогащенное спиртовое соединение формулы (XVII). Полученное спиртовое соединение обрабатывают трифенилфосфином, диизопропилазодикарбоксилатом и азольными соединениями в количестве интервала от 1.0 до 2.5 эквивалентов, предпочтительно при температуре от около 0 до 30°C. Для этой реакции могут быть использованы эфирный растворитель, такой как диэтиловый эфир и тетрагидрофуран или ароматические углеводороды, такие как бензол, толуол и ксилол. Соединение (XVIII) обрабатывают метанольным раствором 6% соляной кислоты при температуре от около -10 до 30°C, с последующей нейтрализацией, чтобы получить соединение формулы (XIX).
На реакционной Схеме III, HX представляет собой кислоту, способную формировать фармакологически полезную соль с основным атомом азота, как описано выше.
Способ получения соединения общей формулы (IV), в котором R не является водородом, описано в деталях ниже.
Вначале, полученное аминовое соединение (XIX) взаимодействует с триэтиламином и пригодным алкилагалоидом в дихлорметане при 0°C, чтобы получить алкилированное аминовое соединение, представленное общей формулой (IV), в котором R не являтся водородом.
Соединение формулы (IV), в котором R не является водородом, может быть превращено в фармацевтически приемлемые соли (XXI), как описано выше.
Указанный процесс суммирован, как представлено далее, на реакционной Схеме IV, ниже.
Реакционная Схема IV
В деталях условия реакции, раскрытой на реакционной Схеме IV, являются следующими. Для превращения соединения (XIX) в соединение (IV), концентрация исходного продукта (XIX) составляет примерно от 0.005 до 0.1 моль с триэтиламином от примерно 2.0 до 3.0 эквивалентов и алкилагалоида от примерно 1.5 до 3 эквивалентов. Указанную реакцию предпочтительно проводят при температуре от 0 до 30°C. Для указанного алкилирования могут быть использованы эфирный растворитель, такой как диэтиловый эфир и тетрагидрофуран, галогенированный углеводород, такой как дихлорметан и хлороформ, спиртовой растворитель, такой как метанол, этанол и пропанол, или их смесь.
На реакционной Схеме IV, HX представляет собой кислоту, способную к образованию фармакологически полезной соли с основным атомом азота, как описано выше.
Конкретные примеры соединений (I), (III) и (IV) со Схем I, II, III и IV включают следующие соединения:
(3R)-3-[(R)-нафталин-2-ил(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(S)-нафталин-2-ил(2H-тетразол-2-ил)метил]пиперидин
(3R)-3-[(S)-нафталин-2-ил(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(R)-нафталин-2-ил(2H-тетразол-2-ил)метил]пиперидин
(3R)-3-[(R)-нафталин-2-ил(1H-тетразол-1-ил)метил]пиперидин
(3S)-3-[(S)-нафталин-2-ил(1H-тетразол-1-ил)метил]пиперидин
(3R)-3-[(S)-нафталин-2-ил(1H-тетразол-1-ил)метил]пиперидин
(3S)-3-[(R)-нафталин-2-ил(1H-тетразол-1-ил)метил]пиперидин
(3S)-3-[(R)-(5-метил-2H-тетразол-2-ил)(нафталин-2-ил)метил]пиперидин
(3S)-3-[(S)-(5-метил-2H-тетразол-2-ил)(нафталин-2-ил)метил]пиперидин
(3R)-3-[(S)-(5-метил-2H-тетразол-2-ил)(нафталин-2-ил)метил]пиперидин
(3R)-3-[(R)-(5-метил-2H-тетразол-2-ил)(нафталин-2-ил)метил]пиперидин
(3R)-3-[(R)-нафталин-2-ил(2H-1,2,3-триазол-2-ил)метил]пиперидин
(3S)-3-[(S)-нафталин-2-ил(2H-1,2,3-триазол-2-ил)метил]пиперидин
(3R)-3-[(R)-(3,4-дихлорфенил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(S)-(3,4-дихлорфенил)(2H-тетразол-2-ил)метил]пиперидин
(3R)-3-[(R)-(4-хлорфенил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(S)-(4-хлорфенил)(2H-тетразол-2-ил)метил]пиперидин
(3R)-3-[(S)-(4-хлорфенил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(R)-(4-хлорфенил)(2H-тетразол-2-ил)метил]пиперидин
(3R)-3-[(R)-нафталин-1-ил(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(S)-нафталин-1-ил(2H-тетразол-2-ил)метил]пиперидин
(3R)-3-[(R)-(4-изопропилфенил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(S)-(4-изопропилфенил)(2H-тетразол-2-ил)метил]пиперидин
(3R)-3-[(S)-(4-изопропилфенил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(R)-(4-изопропилфенил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(S)-(3,4-диметоксифенил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(R)-(3,4-диметоксифенил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(S)-(3,4-диметоксифенил)(1H-тетразол-1-ил)метил]пиперидин
(3S)-3-[(R)-(3,4-диметоксифенил)(1H-тетразол-1-ил)метил]пиперидин
(3S)-3-[(S)-фенил(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(R)-фенил(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-{(S)-2H-тетразол-2-ил[4-(трифторметил)фенил]метил}пиперидин
(3S)-3-{(R)-2H-тетразол-2-ил[4-(трифторметил)фенил]метил}пиперидин
(3S)-3-[(S)-(6-метоксинафталин-2-ил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(R)-(6-метоксинафталин-2-ил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(S)-(4-метилфенил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(R)-(4-метилфенил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(S)-(3-хлорфенил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(R)-(3-хлорфенил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(S)-(2,4-дифторфенил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(R)-(2,4-дифторфенил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(S)-(4-метоксифенил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(R)-(4-метоксифенил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(S)-(4-метоксифенил)(1H-тетразол-1-ил)метил]пиперидин
(3S)-3-[(R)-(4-метоксифенил)(1H-тетразол-1-ил)метил]пиперидин
(3S)-3-[(S)-(4-феноксифенил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(R)-(4-феноксифенил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(S)-(4-феноксифенил)(1Н-тетразол-1-ил)метил]пиперидин
(3S)-3-[(R)-(4-феноксифенил)(1H-тетразол-1-ил)метил]пиперидин
(3S)-3-[(S)-(4-фторфенил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(R)-(4-фторфенил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(S)-бифенил-4-ил(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(R)-бифенил-4-ил(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-{(S)-2H-тетразол-2-ил[3-(трифторметил)фенил]метил}пиперидин
(3S)-3-{(R)-2H-тетразол-2-ил[3-(трифторметил)фенил]метил}пиперидин
(3S)-3-[(S)-(4-пропилфенил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(R)-(4-пропилфенил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(S)-(4-метилнафталин-1-ил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(R)-(4-метилнафталин-1-ил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(S)-(3-метилфенил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(R)-(3-метилфенил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(S)-(3-метоксифенил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(R)-(3-метоксифенил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(S)-1-бензотиофен-5-ил(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(R)-1-бензотиофен-5-ил(2H-тетразол-2-ил)метил]пиперидин
(3R)-3-[(R)-(6-хлорнафталин-2-ил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(S)-(6-хлорнафталин-2-ил)(2H-тетразол-2-ил)метил]пиперидин
(3R)-3-[(S)-(6-хлорнафталин-2-ил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(R)-(6-хлорнафталин-2-ил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(S)-(6-фторнафталин-2-ил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(R)-(6-фторнафталин-2-ил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-1-этил-3-[(S)-нафталин-2-ил(2H-тетразол-2-ил)метил]пиперидин
(3R)-3-[(R)-нафталин-2-ил(5-фенил-тетразол-2-ил)метил]пиперидин
(3S)-3-[(S)-нафталин-2-ил(5-фенил-тетразол-2-ил)метил]пиперидин
(3R)-3-[(S)-нафталин-2-ил(5-фенил-тетразол-2-ил)метил]пиперидин
(3S)-3-[(R)-нафталин-2-ил(5-фенил-тетразол-2-ил)метил]пиперидин
1-{(S)-нафталин-2-ил[(3S)-пиперидин-3-ил]метил}-1H-бензотриазол
1-{(R)-нафталин-2-ил[(3S)-пиперидин-3-ил]метил}-1H-бензотриазол
2-{(S)-нафталин-2-ил[(3S)-пиперидин-3-ил]метил}-2H-бензотриазол
2-{(R)-нафталин-2-ил[(3S)-пиперидин-3-ил]метил}-2H-бензотриазол
(3S)-3-[(R)-1-бензотиофен-3-ил(2H-тетразол-2-ил)метил]пиперидин
(3R)-3-[(R)-(6-фторнафталин-2-ил)(2H-тетразол-2-ил)метил]пиперидин
(3R)-3-[(S)-(6-фторнафталин-2-ил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(S)-(6-метилнафталин-2-ил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(R)-(6-метилнафталин-2-ил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(S)-(4-фторнафталин-1-ил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(R)-(4-фторнафталин-1-ил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(R)-нафталин-2-ил(4H-1,2,4-триазол-4-ил)метил]пиперидин
(3S)-3-[(S)-нафталин-2-ил(1H-1,2,4-триазол-1-ил)метил]пиперидин
(3S)-3-[(R)-нафталин-2-ил(1Н-1,2,4-триазол-1-ил)метил]пиперидин
(3S)-3-[(R)-нафталин-2-ил(1H-пиразол-1-ил)метил]пиперидин
(3S)-3-[(S)-1-бензотиофен-2-ил(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(R)-1-бензотиофен-2-ил(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(S)-(3,4-дифторфенил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(R)-(3,4-дифторфенил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(S)-(2,3-дихлорфенил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(R)-(2,3-дихлорфенил)(2H-тетразол-2-ил)метил]пиперидин
(3R)-3-[(R)-(1-фторнафталин-2-ил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(S)-(1-фторнафталин-2-ил)(2H-тетразол-2-ил)метил]пиперидин
(3R)-3-[(S)-(1-фторнафталин-2-ил)(2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(R)-(1-фторнафталин-2-ил)(2H-тетразол-2-ил)метил]пиперидин
(3R)-3-[(R)-(1-фторнафталин-2-ил)(5-метил-2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(S)-(1-фторнафталин-2-ил)(5-метил-2H-тетразол-2-ил)метил]пиперидин
(3R)-3-[(S)-(1-фторнафталин-2-ил)(5-метил-2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(R)-(1-фторнафталин-2-ил)(5-метил-2H-тетразол-2-ил)метил]пиперидин
(3R)-3-[(R)-(1-фторнафталин-2-ил)(5-фенил-2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(S)-(1-фторнафталин-2-ил)(5-фенил-2H-тетразол-2-ил)метил]пиперидин
(3R)-3-[(S)-(1-фторнафталин-2-ил)(5-фенил-2H-тетразол-2-ил)метил]пиперидин
(3S)-3-[(R)-(1-фторнафталин-2-ил)(5-фенил-2H-тетразол-2-ил)метил]пиперидин
(3R)-3-[(R)-(6-фторнафталин-2-ил)(5-метил-2H-тетразол-2-ил)метил]пиперидин
(3S)-1-бутил-3-[(S)-нафталин-2-ил(2H-тетразол-2-ил)метил]пиперидин
4-[(S)-нафталин-2-ил(2H-тетразол-2-ил)метил]пиперидин
4-[(R)-нафталин-2-ил(2H-тетразол-2-ил)метил]пиперидин
4-[(S)-нафталин-2-ил(1H-тетразол-2-ил)метил]пиперидин
4-[(R)-нафталин-2-ил(1H-тетразол-2-ил)метил]пиперидин
4-[(S)-(4-метилфенил)(2H-тетразол-2-ил)метил]пиперидин
4-[(R)-(4-метилфенил)(2H-тетразол-2-ил)метил]пиперидин
4-[(S)-(4-метилфенил)(1H-тетразол-2-ил)метил]пиперидин
4-[(R)-(4-метилфенил)(1H-тетразол-2-ил)метил]пиперидин
4-[(S)-нафталин-2-ил(2H-1,2,3-триазол-2-ил)метил]пиперидин
4-[(R)-нафталин-2-ил(2H-1,2,3-триазол-2-ил)метил]пиперидин
4-[(S)-нафталин-2-ил(1H-1,2,3-триазол-2-ил)метил]пиперидин
4-[(R)-нафталин-2-ил(1H-1,2,3-триазол-2-ил)метил]пиперидин
4-[(S)-(3,4-дихлорфенил)(2H-тетразол-2-ил)метил]пиперидин
[4-[(R)-(3,4-дихлорфенил)(2H-тетразол-2-ил)метил]пиперидин
Лучшее понимание настоящего изобретения может быть достигнуто с учетом следующих примеров, которые изложены для иллюстрации, но не ограничивают данное изобретение.
Пример 1
(3R)-3-[(R)-нафталин-2-ил(2H-тетразол-2-ил)метил]пиперидин
Смесь 2-бромнафталина (4.59 ммоль) и магния (5.508 ммоль) энергично перемешивают в безводном ТГФ (10 мл) в атмосфере азота 1 час, чтобы приготовить раствор нафталин-2-илмагнийбромида. К полученному раствору медленно добавляют трет-бутил-(3R)-3-[метокси(метил)карбамоил]пиперидин-1-карбоксилат (1.836 ммоль) при 0°C. Через 10 минут, реакционную смесь медленно нагревают до комнатной температуры и перемешивают 2 часа. Полученный раствор затем гасят водным раствором NH4Cl (10 мл) и добавляют этилацетат (15 мл). Органический слой отделяют от водного слоя, промывают рассолом. Объединенный органический слой сушат над безводным MgSO4 и концентрируют в вакууме.
Сырой продукт растворяют в безводном ТГФ. К полученному раствору медленно добавляют (S)-2-метил-CBS-оксазаборолидин (1.0 М в толуоле, 0.5 эквив) при -78°C. Через 5 минут, медленно добавляют комплекс боран-ТГФ (3 эквив.). Реакционную смесь затем перемещают в морозильную камеру и оставляют на ночь. Хиральная LC показала соотношение S к R изомеру равное 9:1. Смесь охлаждают до 0°C и по каплям добавляют воду, чтобы загасить реакцию. Реакционную смесь разбавляют этилацетатом, промывают 5% водным раствором NaOH, водой, рассолом, и сушат над MgSO4. После концентрирования, сырой продукт очищают колоночной флеш-хроматографией с градиентом 4-35% этилацетата в гексане, чтобы получить (R)-трет-бутил-3-((S)-гидрокси(нафтил)метил)пиперидин-1-карбоксилат.
К перемешиваемому раствору трифенилфосфина (2.754 ммоль) и 1H-тетразола (2.754 ммоль) в ТГФ (6 мл) добавляют ранее полученный продукт (1.836 ммоль) в ТГФ (2 мл) при комнатной температуре. Реакционную смесь перемешивают 15 минут, с последующим прибавлением по каплям диизопропилазодикарбоксилата (3.672 ммоль) при 0°C. Раствор затем перемешивают в течение 1 часа при комнатной температуре. Когда реакция завершена, сырую смесь очищают хроматографией на силикагеле (этилацетат : гексан = 1:6).
Конечный продукт растворяют в 6% растворе HCl-MeOH и дают перемешаться в течение 6 часов. Растворитель удаляют при пониженном давлении и подщелачивают 1N водным раствором NaOH, чтобы получить (3R)-3-[(R)-нафталин-2-ил(2H-тетразол-2-ил)метил]пиперидин.
1H-ЯМР (CDCl3 200 МГц), δ 8.5 (с, 1H), 8.0 (с, 1H), 7.8 (м, 4H), 7.5 (м, 2H), 6.0 (д, 1H), 3.0 (ушир., 2H), 2.5 (ушир., 3H), 1.5 (ушир., 3H), 1.2 (м, 2H)
Пример 2
(3S)-3-[(S)-нафталин-2-ил(2H-тетразол-2-ил)метил]пиперидин
Процесс получения приведенный в Примере 1, протекал с использованием в качестве реагента трет-бутил-(3S)-3-[метокси(метил)карбамоил]пиперидин-1-карбоксилата вместо трет-бутил-(3R)-3-[метокси(метил)карбамоил]пиперидин-1-карбоксилата. В качестве восстановителя, (R)-2-метил-CBS-оксазаборолидин используют вместо (S)-2-метил-CBS-оксазаборолидина, что дает (3S)-3-[(S)-нафталин-2-ил(2H-тетразол-2-ил)метил]пиперидин.
1H-ЯМР (CDCl3, 200 МГц), δ 8.5 (с, 1H), 8.0 (с, 1H), 7.8 (м, 3H), 7.7 (м, 1H), 7.5 (м, 2H), 6.0 (д, 1Н), 3.0 (ушир., 2H), 2.5 (ушир., 3H), 1.5 (ушир., 3H), 1.2 (м, 2H)
Пример 3
(3R)-3-[(S)-нафталин-2-ил(2H-тетразол-2-ил)метил]пиперидин
Процесс получения, приведенный в Примере 1, протекал с использованием (R)-2-метил-CBS-оксазаборолидина в качестве восстановителя, вместо (S)-2-метил-CBS-оксазаборолидина, что дает (3R)-3-[(S)-нафталин-2-ил(2H-тетразол-2-ил)метил]пиперидин гидрохлорид.
1H-ЯМР (DMSO, 200 МГц), δ 9.1 (ушир., 1H), 8.2 (с, 1H), 8.0 (м, 3H), 7.7 (д, 1H), 7.6 (м, 2H), 6.2 (д, 1H), 2.8 (ушир., 2H), 2.5 (ушир., 3H), 1.6 (ушир., 2H), 1.3 (ушир., 3H)
Пример 4
(3S)-3-[(R)-нафталин-2-ил(2H-тетразол-2-ил)метил]пиперидин
Процесс получения, приведенный в Примере 1, протекал с использованием в качестве реагента трет-бутил-(3S)-3-[метокси(метил)карбамоил]пиперидин-1-карбоксилата, вместо трет-бутил-(3R)-3-[метокси(метил)карбамоил]пиперидин-1-карбоксилата, что дает (3S)-3-[(R)-нафталин-2-ил(2H-тетразол-2-ил)метил]пиперидин гидрохлорид.
1H-ЯМР (DMSO, 200 МГц), δ 9.1 (ушир., 1H), 8.2 (с, 1H), 8.0 (м, 3H), 7.7 (д, 1H), 7.6 (м, 2H), 6.2 (д, 1H), 2.8 (ушир., 2H), 2.5 (ушир., 3H), 1.6 (ушир., 2H), 1.3 (ушир., 3H)
Пример 5
(3R)-3-[(R)-нафталин-2-ил(1H-тетразол-1-ил)метил]пиперидин
Методика получения, приведенная в Примере 1, дает (3R)-3-[(R)-нафталин-2-ил(1H-тетразол-1-ил)метил]пиперидин.
1H-ЯМР (CDCl3, 200 МГц), δ 9.0 (с, 1H), 7.8 (м, 4H), 7.5 (м, 3H), 5.8 (д, 1H), 4.8 (ушир., 1H), 3.0 (ушир., 4H), 2.5 (ушир., 1H), 1.6 (ушир., 3H)
Пример 6
(3S)-3-[(S)-нафталин-2-ил(1H-тетразол-1-ил)метил]пиперидин
Методика получения, приведенная в Примере 2, дает (3S)-3-[(S)-нафталин-2-ил(1H-тетразол-1-ил)метил]пиперидин.
1H-ЯМР (CDCl3, 200 МГц), δ 9.0 (с, 1H), 7.8 (м, 4H), 7.5 (м, 3H), 5.8 (д, 1H), 4.8 (ушир., 1H), 3.0 (ушир., 4H), 2.5 (ушир., 1H), 1.6 (ушир., 3H)
Пример 7
(3R)-3-[(S)-нафталин-2-ил(1H-тетразол-1-ил)метил]пиперидин
Методика получения, приведенная в Примере 3, дает (3R)-3-[(S)-нафталин-2-ил(1H-тетразол-1-ил)метил]пиперидин гидрохлорид.
1H-ЯМР (DMSO, 200 МГц), δ 9.8 (с, 1H), 8.0 (м, 4H), 7.6 (м, 3H), 6.0 (д, 1H), 2.8 (ушир., 2H), 2.5 (ушир., 2H), 2.3 (м, 1H), 1.6 (ушир., 2H), 1.3 (ушир., 3H)
Пример 8
(3S)-3-[(R)-нафталин-2-ил(1H-тетразол-1-ил)метил]пиперидин
Методика получения, приведенная в Примере 4, дает (3S)-3-[(R)-нафталин-2-ил(1H-тетразол-1-ил)метил]пиперидин гидрохлорид.
1H-ЯМР (DMSO, 200 МГц), δ 9.8 (с, 1H), 8.0 (м, 4H), 7.6 (м, 3H), 6.0 (д, 1H), 2.8 (ушир., 2H), 2.5 (ушир., 2H), 2.3 (м, 1H), 1.6 (ушир., 2H), 1.3 (ушир., 3H)
Пример 9
(3S)-3-[(R)-(5-метил-2H-тетразол-2-ил)(нафталин-2-ил)метил]пиперидин
Методику получения, приведенную в Примере 1, осуществляют с использованием в качестве реагента 5-метил-1H-тетразола, вместо 1H-тетразола. Также, в качестве реагента, трет-бутил-(3S)-3-[метокси(метил)карбамоил]пиперидин-1-карбоксилат используют вместо трет-бутил-(3R)-3-[метокси(метил)карбамоил]пиперидин-1-карбоксилата, что дает (3S)-3-[(R)-(5-метил-2H-тетразол-2-ил)(нафталин-2-ил)метил]пиперидин.
1H-ЯМР (CDCl3, 200 МГц), δ 8.0 (м, 1H), 7.8 (ушир., 3H), 7.7 (