Моноклональные антитела против il-21 человека
Иллюстрации
Показать всеИзобретение относится к области иммунологии. Представлены два антитела против IL-21 человека. Первое антитело содержит вариабельную область тяжелой цепи, включающую SEQ ID NO: 31, 33 и 35, и вариабельную область легкой цепи, включающую SEQ ID NO: 39, 41 и 43. Второе антитело содержит вариабельную область тяжелой цепи, включающую SEQ ID NO: 47, 49 и 51, и вариабельную область легкой цепи, включающую SEQ ID NO: 55, 57 и 59. Кроме того, описаны гибридомы, продуцирующие первое и второе антитело против IL-21 человека и депонированные в коллекции культур «American Type Culture Collection» под номерами «АТСС Patent Deposit Designation РТА-8790» и «АТСС Patent Deposit Designation РТА-8786» соответственно. Изобретение позволяет получить антитела к IL-21 человека. 6 н. и 42 з.п. ф-лы, 4 ил., 16 табл., 23 пр.
Реферат
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[1] Иммунная система является первичной защитой организма от заболеваний, вызываемых патогенами, а именно бактериями, вирусами, грибами и т.д., а также от заболеваний, вызываемых аномальным ростом собственных клеток и тканей организма (т.е. злокачественных опухолей). Обычно иммунная система обладает способностью различать нормальные клетки организма или "свои" и чужеродные патогены или аномальные клетки или "не свои, чужие". Процессы, посредством которых иммунная система воздерживается от реагирования на собственное тело, называют толерантностью. Иногда иммунная система теряет способность узнавать "свое" как нормальное и последующий ответ, направленный против ткани или клеток, приводит к потере толерантности, состояние аутоиммунитета. Патологии, возникающие вследствие аутоиммунитета, часто имеют серьезные клинические последствия и являются одной из основных проблем со здоровьем в мире, особенно в промышленно развитых странах.
[2] IL-21 представляет собой мощный иммуномодулирующий цитокин I типа из четырех α-спиральных тяжей, который связывается с гетеродимерным рецептором, состоящим из IL-21 R и общей гамма-цепи (обзор, Spolski and Leonard, Annu Rev Immunol. Nov 8; 2007). IL-21 продуцируется NK-T-клетками и CD4+Т-клетками (в том числе провоспалительными клетками Th17 и фолликулярными Т-клетками-хелперами, TFN, которые являются важными для ответов герминального центра) и обладает плейотропными эффектами как на врожденные, так и на адаптивные иммунные ответы, в том числе усиленную пролиферацию В-клеток и Т-клеток, повышенную цитотоксичность CD8+Т-клеток и натуральных (естественных) киллерных (NK) клеток, дифференцировку В-клеток в иммуноглобулин-секретирующие плазматические клетки, и регуляцию клеточной линии Th17 (см. ниже). IL-21 также может ингибировать антигенпрезентирующую функцию дендритных клеток и при определенных условиях может индуцировать апоптоз в В-клетках и NK-клетках. IL-21 обладает мощной противоопухолевой активностью, но также был ассоциирован с развитием различных аутоиммунных заболеваний, в том числе системной красной волчанкой (SLE), ревматоидным артритом (RA), воспалительным заболеванием кишечника (IBD) и псориазом (обзор, Spolski and Leonard, Anna Rev Immunol. Nov. 8. 2007).
[3] Было показано, что IL-21 модулировал ответы антител прямым действием на В-клетки (Mehta et al., J. Immunol., 170:4111-4118, 2003; Ozaki et al., Science, 298:1630-1634, 2002; Suto et al., Blood. 100:4565-4573, 2002). IL-21 может индуцировать дифференцировку наивных В-клеток в антителосекретирующие плазматические клетки (Ozaki et al., J. Immunol. 173:5361, 2004; Ettinger et al., J. Immunol. 175:7867-79, 2005; Ettinger et al., J. Immunol. 128:2872-82, 2007; Kuchen et al., J. Immunol. 179:5886-96, 2007) и стимулировать продуцирование IgE в В-клетках человека (Kobayashi et al., Human Immunol, doi: 10:1016/j.humimm.2008.10.). У животных, лишенных IL-21 или IL-21 R, меньше антителосекретирующих клеток образуется в результате реакции герминального центра и снижается созревание аффинности (Zotos et al., представлено к публикации). Экстрафолликулярные антителообразующие клетки, которые вовлечены в аутоиммунитет, требуют когнатной помощи от субпопуляции специализированных CD4 Т-клеток, которые секретируют IL-21 (Odegard, et al., JEM 205(12): 2873-2886. 2008).
[4] Образование антител против аллогенного МНС является основным феноменом в отторжении трансплантата. Реципиенты с трансплантатом, у которых нарастают титры анти-МНС антител (высокочувствительные пациенты с трансплантацией), находятся во временном риске t в отношении хронического отторжения и являются плохими кандидатами для новых трансплантатов вследствие вероятности опосредованного антителами отторжения нового трансплантата (Smith, et al., Am J Transplantation 8: 1-11, 2008). В модели на крысах острого отторжения почечного аллотрансплантата IL-21 и IL-21 R были однозначно повышены в интраваскулярных мононуклеарных клетках почечных аллотрансплантатов, но не изотрансплантатов (Hecker, et al., Immunobiology: doi: 10.1016/i.imbio.2008.04.004. (2008)). У пациентов с трансплантатами сердца, подвергающихся отторжению, уровни экспрессии IL-21 и IL-21 R коррелируют со степенью отторжения согласно ISHLT (пер., ISHLT - Международное Общество трансплантации сердца и легких) и наивысшая экспрессия находится в степенях 1R и 2R (Baan, et al., Transplantation 83 (11): 1485-1492, 2007).
[5] В реакции "трансплантат против хозяина" (GVHD), ответ анти-алло опосредуется неконтролируемой активацией Т-лимфоцитов от трансплантата, которые контролируют воспалительный ответ против тканей хозяина. Регуляторные Т-клетки (Treg) могут модулировать данный ответ в моделях на животных. Было показано, что IL-21 нейтрализовал регуляторные функции Treg (Clough et al., J. Immunol. 180: 5395-5401, 2008). В мышиных моделях GVHD перенос Т-клеток, лишенных IL-21, приводила к существенно сниженным клиническим симптомам и гистологическим показателям и повышенной выживаемости по сравнению с Т-клетками WT. Пониженную частоту Т-клеток, секретирующих IFN-гамма, и повышенную Tregs наблюдали в слизистой оболочке ободочной кишки. Блокада IL-21 с использованием анти-mIL-21 mAb и перенос Т-клеток WT продуцировали подобные результаты (Bucher et al., Blood (ASH Annual Meeting Abstracts) 2008 112: Abstract #2342).
[6] Также недавно было показано, что IL-21 и продуцируется провоспалительными Th17-клетками мыши, и требуется для дифференцировки провоспалительных Th17-клеток мыши (Korn et al., Nature, 448:484-487, 2007; Nurieva et al., Nature, 448:480-483, 2007; Zhou et al., Nat. Immunol., 8:967-974, 2007; Wei et al., J. Biol. Chem. 282:34605-34610, 2007). Человеческие Th17-клетки также продуцируют IL-21 и исследования продолжаются для определения, действует ли IL-21 как аутокринный фактор для человеческих Th17-клеток, так же как и IL-21 действует для Th17-клеток мыши. Ozaki et al. (J. Immunol. 173:5361, 2004) показали, что экспрессия IL-21 является повышенной у предрасположенных к волчанке мышей BXSB-Yaa, модель системной красной волчанки (SLE), в возрасте, при котором начальные признаки аутоиммунных процессов в первую очередь становятся выраженными. Лечение данных мышей BXSB-Yaa с помощью растворимого рецептора IL-21 мыши (mIL-21R-Fc) частично ингибирует различные параметры заболевания, в том числе гломерулонефрит (Bubier et al., Ann N Y Acad. Sci. 1110:590-601. 2007). Также было показано, что лечение с помощью mIL-21R-Fc являлось эффективным в другой доклинической мышиной модели заболевания SLE, MRL/lpr (Herber et al., J. Immunol. 178: 3822-3830, 2007), а также в модели коллаген-индуцированного артрита (CIA) ревматоидного артрита (Young et al., Arthr. Rheum. 56: 1152-1163, 2007). Предварительные данные в отношении человека также наводят на мысль о дисрегуляции IL-21 и IL-21 R в SLE (Mitoma et al., Int. J. Mol. Med. 16: 609-615. 2005; Wang et al., Chinese J. Cell. Mol. Immunol. 23(11):1041-1042. 2007; Sawalha et al., Ann Rheum. Dis. 67: 458-461, 2008). Совсем недавно, данные Rus et al., полученные от 24 SLE пациентов и 15 здоровых контролей (Nguyen et al., ACR/ARHP Scientific Meeting, 1760/482, 2008 Oct 24-29 San Francisco, CA). Rus et al. показали, что 1) экспрессия мРНК IL-21 является существенно повышенной в CD4+Т-клетках пациентов с волчанкой по сравнению с контролями, 2) уровни IL-21 являются существенно повышенными в сыворотках пациентов с активными SLE по сравнению с неактивными SLE или контролями, 3) IL-21 повышает пролиферацию CD4+Т-кпеток и CD19+В-клеток у пациентов и контролей дозозависимым образом, 4) IL-21 усиливает дифференцировку плазматических клеток, индуцированную анти-CD40, у обычных контрольных пациентов и SLE пациентов, и 5) повышенные уровни IL-21 могут вносить вклад в пролиферацию аутореактивных CD4+Т-клеток и дифференцировку плазматических клеток у SLE.
[7] Monteleone et al. показали, что экспрессия РНК и белка IL-21 является повышенной в воспаленной, но не в невоспаленной ткани пациентов с болезнью Крона (CD) (и, в меньшей степени, с язвенным колитом) и что продуцирование IL-21 CD3+-клетками монононуклеарных клеток собственной пластинки пациентов с CD также является повышенным (Monteleone et al. Gastroenterology 128:687-694, 2005; Monteleone et al. Gut 55: 1774-1780, 2006; Peluso et al., J. Immunol. 178:732-739, 2007). Эти авторы предположили, что IL-21 регулирует экспериментальный колит модуляцией баланса между регуляторными Т-клетками (Tregs) и Th17-клетками (Fantini et al., Eur. J. Immunol. 37:3155-3163, 2007). Ингибирование IL-21 in vivo с использованием растворимого рецептора IL-21 как в мышиной, так и в крысиной моделях колита приводит к существенным снижениям клинических симптомов колита (Young et al. US 2006/0039902).
[8] Рецептор IL-21 экспрессируется NK-клетками, и было показано, что NK-клетки являются ответственными за лечение с помощью IL-21 как in vivo, так и in vitro. У онкологических пациентов, леченных с помощью рекомбинантного человеческого IL-21, наблюдали измененные распределения субпопуляций лимфоцитов, в том числе NK-клеток, и повышенную экспрессию маркеров активации NK-клеток и активность цитолитических эффекторов (Frederiksen, et al., Cancer Immunol Immunother 57(10); 1439-1449, 2008). При аутоиммунных заболеваниях активность NK-клеток может играть роль в активации воспаления и сопутствующего повреждения ткани. Хоуминг NK-клеток в ткани управляется хемоаттрактантами, высвобождаемыми в месте воспаления (Morris and Ley, Curr Mol Med.; 4(4):431-8. 2004). NK-клетки собственной пластинки пациентов с болезнью Крона высвобождали более значительные количества IFN-γ и TNF-α при стимуляции in vitro с помощью IL-21 и IgG по сравнению с клетками LPNK контролей (Liu and Jiu, Chronic Inflammation of Liver and Gut. Falk Symposium abst. No.163. 2008 Mar 14-15). Также сообщают, что NK-клетки регулируют аутоиммунитет и отторжение трансплантата посредством их взаимодействий с дендритными клетками (DC), путем уничтожения незрелых или активированных DC и путем высвобождения цитокинов, которые нарушают состояние активации и функции презентации антигена DC (Vivier et al., Nat. Immunol. 9(5):503-510. 2008; Laffont et al., Blood 112:661-671. 2008). Сравнение мононуклеарных клеток периферической крови толерантных и нетолерантных реципиентов с аллотрансплантатом печени показало изменения в транскрипционной программе NK-клеток (Martinez-Llordella et al., J. Clin. Invest. 118(8):2845-2857. 2008). Таким образом, блокада IL-21 может модулировать активационный статус NK-клеток, снижать их вклад в воспаление ткани в аутоиммунных заболеваниях и изменять течение болезни отторжения трансплантата. Также сообщается, что NK-клетки регулируют аутоиммунитет и отторжение трансплантата путем их взаимодействий с дендритными клетками (DC), путем уничтожения (пер., киллинга) незрелых или активированных DC и путем высвобождения цитокинов, которые нарушают состояние активации и изменяют функции презентации антигена DC. Таким образом, блокада IL-21 может модулировать активационный статус NK-клеток и снижать их вклад в воспаление ткани в аутоиммунных заболеваниях.
[9] Данное изобретение обеспечивает моноклональные антитела против IL-21 человека и способы применения данных антител, которые ингибируют симптомы и биологические активности, которые обнаруживают в виде аутоиммунных и воспалительных нарушений и являются ассоциированными с взаимодействиями IL 21/IL-21 рецептор.
КРАТКОЕ ОПИСАНИЕ ФИГУР
[10] Фигура 1 представляет собой выравнивание аминокислотных остатков, содержащих вариабельные области тяжелых цепей антител, обозначенных номерами клонов 362.78.1.44 (78), 362.597.3 (597), 362.75.1.1 (75), 366.552.11 (552), 366.328.10 (328).
[11] Фигура 2 представляет собой выравнивание аминокислотных остатков, содержащих вариабельную область легких цепей антител, описанных выше.
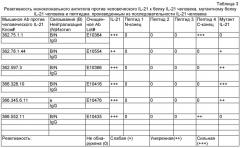
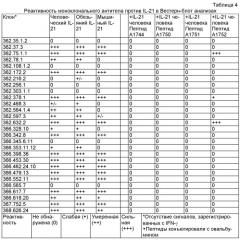
[12] Фигура 3 иллюстрирует масс-спектры MALDI/TOF областей пептидных последовательностей IL-21, полученных из IL-21 в чистом виде и иммунного комплекса IL-21. Пептидные последовательности IL-21, EKKPPKEF (SEQ ID NO: 2 от остатка 129 до 136) (m/z (пер., масса/заряд), 1002.5619 Да) и LERFKSLL (SEQ ID NO: 2 от остатка 137 до 144) (m/z, 1005.6091 Да) свободного состояния IL-21 (А). Сдвиг масс пептидов, обусловленный удерживанием дейтерирования амидов в присутствии IL-21 mAb (В). Другая область пептидной последовательности IL-21, KSLLQKMIHQHLSSRTHGSEDS (SEQ ID NO: 2 от остатка 141 до 162) (m/z, 2519.2451) свободного состояния IL-21 (С). Частичный сдвиг масс пептидов, обусловленный удерживанием дейтерирования амидов в присутствии IL-21 mAb (D).
[13] Фигура 4 иллюстрирует выбранные ионные хроматограммы ацетилированных и неацетилированных пептидов. Выбранная одна ионная хроматограмма ацетилированного TCPSCDSYEKKPPKEF (SEQ ID NO: 2 от остатка 119 до 136) (m/z, 1986 Да), выделенного из IL-21 в чистом виде (А) и аналогичная хроматографическая кривая иммунного комплекса IL-21 (В). Вложенный масс-спектр представляет собой трехзарядное состояние массы пептида (m/z, 662.9). Третья кривая демонстрирует выбранную ионную хроматограмму иона пептида при m/z 1018 Да, который представляет собой ацетилированный KSLLQKMI (SEQ ID NO: 2 от остатка 141 до 148), выделенного из IL-21 в чистом виде (С) и аналогичная хроматографическая кривая иммунного комплекса IL-21 (D). Вложенный масс-спектр представляет собой двухзарядное состояние массы пептида (m/z, 509.1).
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
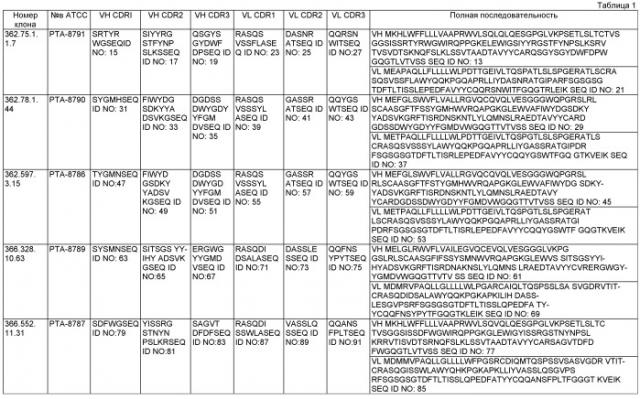
[14] В одном аспекте данное изобретение обеспечивает моноклональное антитело против IL-21 человека, содержащее по меньшей мере 80% идентичность с аминокислотными остатками 20-145 SEQ ID NO: 29 и по меньшей мере 80% идентичность с аминокислотными остатками 21-126 SEQ ID NO: 37. В некоторых вариантах антитела содержат изменения по меньшей мере 80% идентичности, которые существуют в вариабельной области тяжелой цепи CDRI SEQ ID NO: 31.
[15] В другом аспекте данное изобретение обеспечивает моноклональное антитело против IL-21 человека, содержащее: (а) область тяжелой цепи, содержащую: (i) вариабельную область тяжелой цепи CDR1, содержащую SEQ ID NO: 31; (ii) вариабельную область тяжелой цепи CDR2, содержащую SEQ ID NO: 33; и (iii) вариабельную область тяжелой цепи CDR3, содержащую SEQ ID NO: 35; и (b) область легкой цепи, содержащую: (i) вариабельную область легкой цепи CDRI, содержащую SEQ ID NO: 39; (ii) вариабельную область легкой цепи CDR2, содержащую SEQ ID NO: 41; и (iii) вариабельную область легкой цепи CDR3, содержащую SEQ ID NO: 43. В конкретных вариантах изобретение обеспечивает моноклональное антитело против IL-21 человека, содержащее аминокислотные остатки 20-145 SEQ ID NO: 29 и аминокислотные остатки 21-126 SEQ ID NO: 37. В других вариантах антитело является дополнительно содержащим аминокислотные остатки 1-145 SEQ ID NO: 29 и аминокислотные остатки 1-126 SEQ ID NO: 37. Другой вариант данного изобретения обеспечивает гибридому, обозначенную 362.78.1.44, где гибридому депонируют в Американской коллекции типовых культур, имеющую патентное депонированное обозначение в АТСС РТА-8790, и изобретение включает в себя антитело, продуцируемое гибридомой.
[16] Другой аспект данного изобретения обеспечивает моноклональное антитело против IL-21 человека, содержащее: (а) область тяжелой цепи, содержащую: (i) вариабельную область тяжелой цепи CDR1, содержащую SEQ ID NO: 47; (ii) вариабельную область тяжелой цепи CDR2, содержащую SEQ ID NO: 49; и (iii) вариабельную область тяжелой цепи CDR3, содержащую SEQ ID NO: 51; и (b) область легкой цепи, содержащую: (i) вариабельную область легкой цепи CDR1, содержащую SEQ ID NO: 55; (ii) вариабельную область легкой цепи CDR2, содержащую SEQ ID NO: 57; и (iii) вариабельную область легкой цепи CDR3, содержащую SEQ ID NO: 59. В некоторых вариантах изобретение обеспечивает моноклональное антитело против IL-21 человека, содержащее аминокислотные остатки 20-145 SEQ ID NO: 45 и аминокислотные остатки 21-126 SEQ ID NO: 53. В других вариантах изобретение является дополнительно содержащим аминокислотные остатки 1-145 SEQ ID NO: 45 и аминокислотные остатки 21-126 SEQ ID NO: 53. Другой вариант данного изобретения обеспечивает гибридому, обозначенную 362.597.3, где гибридому депонируют в Американской коллекции типовых культур, имеющую патентное депонированное обозначение в АТСС РТА-8786, и изобретение включает в себя антитело, продуцируемое гибридомой.
[17] В другом аспекте данное изобретение обеспечивает моноклональное антитело против IL-21 человека, содержащее по меньшей мере 80% идентичность с аминокислотными остатками 20-141 SEQ ID NO: 13 и по меньшей мере 80% идентичность с аминокислотными остатками 21-126 SEQ ID NO: 21. В одном варианте изобретение включает в себя моноклональное антитело, где аминокислотные замены представляют собой консервативные аминокислотные замены.
[18] В другом аспекте данное изобретение обеспечивает моноклональное антитело против IL-21 человека, содержащее: (а) область тяжелой цепи, содержащую: (i) вариабельную область тяжелой цепи CDR1, содержащую SEQ ID NO: 15; (ii) вариабельную область тяжелой цепи CDR2, содержащую SEQ ID NO: 17; и (iii) вариабельную область тяжелой цепи CDR3, содержащую SEQ ID NO: 19; и (b) область легкой цепи, содержащую: (i) вариабельную область легкой цепи CDR1, содержащую SEQ ID NO: 23; (ii) вариабельную область легкой цепи CDR2, содержащую SEQ ID NO: 25; и (iii) вариабельную область легкой цепи CDR3, содержащую SEQ ID NO: 27. В некоторых вариантах данное изобретение включает в себя моноклональное антитело против IL-21 человека, содержащее аминокислотные остатки 20-141 SEQ ID NO: 13 и аминокислотные остатки 21-126 SEQ ID NO: 21. В другом варианте изобретение является дополнительно содержащим аминокислотные остатки 1-141 SEQ ID NO: 13 и аминокислотные остатки 1 -126 SEQ ID NO: 21. Другой вариант данного изобретения обеспечивает гибридому, обозначенную 362.75.1.1, где гибридому депонируют в Американской коллекции типовых культур, имеющую патентное депонированное обозначение в АТСС РТА-8791, и антитело продуцируется гибридомой.
[19] В другом аспекте данное изобретение обеспечивает моноклональное антитело против IL-21 человека, содержащее: (а) область тяжелой цепи, содержащую: (i) вариабельную область тяжелой цепи CDR1, содержащую SEQ ID NO: 79; (ii) вариабельную область тяжелой цепи CDR2, содержащую SEQ ID NO: 81; и (iii) вариабельную область тяжелой цепи CDR3, содержащую SEQ ID NO: 83; и (b) область легкой цепи, содержащую: (i) вариабельную область легкой цепи CDR1, содержащую SEQ ID NO: 87; (ii) вариабельную область легкой цепи CDR2, содержащую SEQ ID NO: 89; и (iii) вариабельную область легкой цепи CDR3, содержащую SEQ ID NO: 91. В одном варианте данное изобретение обеспечивает моноклональное антитело против IL-21 человека, содержащее аминокислотные остатки 20-136 SEQ ID NO: 77 и аминокислотные остатки 23-129 SEQ ID NO: 85. В другом варианте изобретение является дополнительно содержащим аминокислотные остатки 1-136 SEQ ID NO: 77 и аминокислотные остатки 1-129 SEQ ID NO: 85. Другой вариант данного изобретения обеспечивает гибридому, обозначенную 366.552.11, где гибридому депонируют в Американской коллекции типовых культур, имеющую патентное депонированное обозначение в АТСС РТА-8787, и антитело продуцируется гибридомой.
[20] В другом аспекте данное изобретение обеспечивает моноклональное антитело против IL-21, содержащее: (а) область тяжелой цепи, содержащую: (i) вариабельную область тяжелой цепи CDR1, содержащую SEQ ID NO: 63; (ii) вариабельную область тяжелой цепи CDR2, содержащую SEQ ID NO: 65; и (iii) вариабельную область тяжелой цепи CDR3, содержащую SEQ ID NO: 67; и (b) область легкой цепи, содержащую: (i) вариабельную область легкой цепи CDR1, содержащую SEQ ID NO: 71; (ii) вариабельную область легкой цепи CDR2, содержащую SEQ ID NO: 73; и (iii) вариабельную область легкой цепи CDR3, содержащую SEQ ID NO: 75. В некоторых вариантах данное изобретение обеспечивает моноклональное антитело против IL-21 человека, содержащее аминокислотные остатки 20-139 SEQ ID NO: 61 и аминокислотные остатки 23-129 SEQ ID NO: 69. В других вариантах данное изобретение является дополнительно содержащим аминокислотные остатки 1-139 SEQ ID NO: 61 и аминокислотные остатки 1-129 SEQ ID NO: 69. Другой вариант данного изобретения обеспечивает гибридому, обозначенную 366.328.10, где гибридому депонируют в Американской коллекции типовых культур, имеющую патентное депонированное обозначение в АТСС РТА-8789, и антитело продуцируется гибридомой.
[21] В другом аспекте данное изобретение обеспечивает гибридому, обозначенную 366.345.6.11, где гибридома является депонированной в Американской коллекции типовых культур, имеющей патентное депонированное обозначение в АТСС РТА-8788, и включает в себя антитело, продуцируемое гибридомой.
[22] В другом аспекте данного изобретения данное изобретение обеспечивает выделенное моноклональное антитело, которое связывается с прерывистым эпитопом, содержащим по меньшей мере две области в белке IL-21, где первая область состоит из по меньшей мере одной аминокислоты от остатка Ile45 до остатка Leu56 SEQ ID NO: 2 и вторая область состоит по меньшей мере из одного аминокислотного остатка Glul29 до остатка Leul44 SEQ ID NO: 2. В одном варианте изобретение обеспечивает, что первая область состоит из от 1 до 12 аминокислот от остатка Ile45 до остатка Leu56 SEQ ID NO: 2, и вторая область состоит из от 1 до 16 аминокислот от остатка Glul29 до остатка Leul44 SEQ ID NO: 2.
[23] В каждом аспекте включенных изобретений, описанных выше, находится вариант, в котором моноклональное антитело дополнительно содержит Fc-часть, и другой вариант, в котором Fc-часть выбрана из группы, состоящей из IgG1, IgG2 и IgG4, и другой вариант, в котором Fc-часть имеет сниженную эффекторную функцию.
[24] В другом аспекте данное изобретение обеспечивает способ лечения заболеваний, опосредованных фолликулярными Т-клетками-хелперами или опосредованных В-клетками у субъекта, путем введения терапевтического количества заявляемых моноклональных антител против IL-21 человека, описанных здесь, где заболевания, опосредованные фолликулярными Т-клетками-хелперами и опосредованные В-клетками, выбраны из группы, состоящей из системной красной волчанки, аутоиммунной потери слуха, болезни Грейвса, обыкновенной пузырчатки, миастении гравис, нейромиелита зрительного нерва, синдрома Гудпасчера, аутоиммунного нефрита, криоглобулинемии, синдрома Гийена - Барре, хронической воспалительной демиелинизирующей полинейропатии (CIDP), аутоиммунной гемолитической анемии и идиопатической тромбоцитопенической пурпуры (IТР).
[25] В другом аспекте данное изобретение обеспечивает способ лечения заболеваний, опосредованных ТН1-клетками или опосредованных ТН17-клетками у субъекта, путем введения терапевтического количества заявляемых моноклональных антител против IL-21 человека, описанных здесь, где заболевания, опосредованные THI-клетками или опосредованные ТН17-клетками, выбраны из группы, состоящей из псориаза, спондилоартропатии, реактивного артрита, энтеропатического артрита, аутоиммунного миокардита, синдрома Кавасаки, глютеновой энтеропатии, увеита, болезни Бехчета, болезни коронарных артерий, хронического обструктивного легочного заболевания (COPD) и интерстициального заболевания легких.
[26] В другом аспекте данное изобретение обеспечивает способ лечения воспалительного заболевания кишечника (IBD) у субъекта путем введения терапевтического количества заявляемых моноклональных антител против IL-21 человека, описанных здесь, где воспалительное заболевание кишечника выбрано из группы, состоящей из болезни Крона, язвенного колита и синдрома раздраженной толстой кишки.
[27] В другом аспекте данное изобретение обеспечивает способ лечения ревматоидного артрита у субъекта путем введения терапевтического количества заявляемых моноклональных антител против IL-21 человека, описанных здесь.
[28] В другом аспекте данное изобретение обеспечивает способ лечения рассеянного склероза у субъекта путем введения терапевтического количества заявляемых моноклональных антител против IL-21 человека, описанных здесь.
[29] В другом аспекте данное изобретение обеспечивает способ лечения сахарного диабета I типа (IDDM) у субъекта путем введения терапевтического количества заявляемых моноклональных антител против IL-21 человека.
[30] В другом аспекте данное изобретение обеспечивает способ лечения синдрома Шегрена у субъекта путем введения терапевтического количества заявляемых моноклональных антител против IL-21 человека, описанных здесь.
[31] В другом аспекте данное изобретение обеспечивает способ лечения субъекта с трансплантацией путем введения терапевтического количества заявляемых моноклональных антител против IL-21 человека, описанных здесь, где подавляют отторжение трансплантата, устанавливают толерантность в схеме лечения перед трансплантацией или снижают титры аллоантител у субъекта.
[32] В другом аспекте данное изобретение обеспечивает способ лечения аутоиммунного заболевания у субъекта путем введения терапевтического количества заявляемых моноклональных антител против IL-21 человека, описанных здесь, где аутоиммунное заболевание выбрано из группы, состоящей из панкреатита, воспалительного заболевания мышц (полимиозита, дерматомиозита), микроскопического полиангиита, аутоиммунной апластической анемии, аутоиммунного тиреоидита, аутоиммунного гепатита, синдрома Вегенера, дивертикулеза, анкилозирующего спондилоартрита, склеродермии, системного склероза, псориатического артрита, остеоартрита, атопического дерматита, витилиго, реакции трансплантат против хозяина (GVHD), кожной Т-клеточной лимфомы (CTCL), гломерулонефрита, нефропатии IgA-типа, высокосенсибилизированных пациентов с трансплантацией, антифосфолипидного синдрома и астмы и других аутоиммунных заболеваний или других заболеваний, опосредованных антагонистами IL-21 и рецептора IL-21.
[33] В другом аспекте данное изобретение обеспечивает способ лечения системной эритематозной волчанки (SLE) у субъекта путем введения терапевтического количества заявляемых моноклональных антител против IL-21 человека, описанных здесь.
[34] В другом аспекте данное изобретение обеспечивает способ лечения псориаза у субъекта путем введения терапевтического количества заявляемых моноклональных антител против IL-21 человека, описанных здесь.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[35] Нижеследующие определения обеспечивают для облегчения понимания изобретений, описанных здесь.
[36] Термины "амино-концевой" и "карбокси-концевой" используются здесь для обозначения положений внутри полипептидов. Там, где позволяет контекст, эти термины используются со ссылкой на конкретную последовательность или часть полипептида для обозначения близости или относительного положения. Например, некоторая последовательность, расположенная карбоксил-терминально относительно ссылочной последовательности в полипептиде, расположена проксимально относительно карбоксил-конца ссылочной последовательности, но не обязательно находится при карбоксил-конце полного полипептида.
[37] Термин "антагонист" относится к любому соединению, в том числе белку, полипептиду, пептиду, антителу, фрагменту антитела, крупной молекуле или небольшой молекуле (менее чем 10 кДа), которая снижает активность, активирование или функцию другой молекулы. Антагонисты IL-21 вызывают по меньшей мере одно из нижеуказанных: сниженную иммунную функцию NK-клеток, дендритных клеток, субпопуляций Т-клеток и субпопуляций В-клеток; связывание IL-21, при котором взаимодействие белка IL-21 со своим рецептором блокируется, ингибируется, снижается или нейтрализуется.
[38] "Антитела" (Abs) и "иммунноглобулины" (Igs) представляют собой гликопротеины, обладающие одинаковыми структурными характеристиками. Тогда как антитела проявляют специфичность связывания с конкретным антигеном, иммуноглобулины включают в себя как антитела, так и другие подобные антителам молекулы, у которых отсутствует антигенная специфичность. Полипептиды последнего типа, например, продуцируются на низких уровнях лимфатической системой и на повышенных уровнях миеломами. Таким образом, как используют здесь, термин "антитело" или "пептид (пептиды) антитела" относится к интактному антителу или его связывающему фрагменту, который конкурирует с интактным антителом при специфическом связывании и включает в себя химерные, гуманизированные, полностью человеческие и биспецифические антитела. В некоторых вариантах связывающие фрагменты получают технологиями рекомбинантных ДНК. В дополнительных вариантах связывающие фрагменты получают ферментативным или химическим расщеплением интактных антител. Связывающие фрагменты включают в себя, но без ограничения, Fab, Fab', F(ab')2, Fv и одноцепочечные антитела, ScFv. Как правило, "природные антитела и иммуноглобулины" представляют собой гетеротетрамерные гликопротеины приблизительно 150000 дальтон, состоящие из двух одинаковых легких (L) цепей и двух одинаковых тяжелых (Н) цепей. Каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, тогда как между тяжелыми цепями различных изотипов иммуноглобулинов количество дисульфидных связей различается. Также каждая тяжелая и легкая цепь имеет равномерно расположенные внутрицепочечные дисульфидные мостики. Каждая тяжелая цепь на одном конце имеет вариабельный домен (VH) с последующим некоторым количеством константных доменов. Каждая легкая цепь имеет на одном конце вариабельный домен (VL) и константный домен на другом ее конце; константный домен легкой цепи ориентирован к первому константному домену тяжелой цепи, а вариабельный домен легкой цепи ориентирован к вариабельному домену тяжелой цепи. Предполагают, что поверхность раздела между вариабельными доменами легкой и тяжелой цепей образуют конкретные аминокислотные остатки. (Chothia et al., J. Mol. Biol. 186:651 (1985); Novotny and Haber, Proc. Natl. Acad. Sci. U.S.A. 82:4592 (1985)).
[39] Термин "химерное антитело" или "химерные антитела" относится к антителам, гены легкой и тяжелой цепи которых были сконструированы, обычно генной инженерией, из генов константной и вариабельной области иммуноглобулина, принадлежащих к различным видам. Например, вариабельные сегменты генов мышиного моноклонального антитела могут быть присоединены к человеческим константным сегментам, таким как гамма 1 и гамма 3. Таким образом, типичное терапевтическое химерное антитело является гибридным белком, состоящим из вариабельного или антигенсвязывающего домена мышиного антитела и константного домена человеческого антитела, хотя другие виды млекопитающих могут быть использованы. Конкретно, химерное антитело получают методами на основе рекомбинантной ДНК, в которой все или часть шарнирных и константных областей легкой цепи, тяжелой цепи или обеих цепей иммуноглобулина были замещены на соответствующие области другой легкой цепи или тяжелой цепи иммуноглобулина животного. Таким образом, антигенсвязывающую часть родительского моноклонального антитела пересаживают в остов антитела другого вида.
[40] Термин "эпитоп" относится к любой белковой детерминанте, способной к специфическому связыванию с иммуноглобулином или Т-клеточным рецептором. Эпитопные детерминанты обычно состоят из химически активных поверхностных групп молекул, таких как боковые цепи аминокислот или сахаров, и обычно имеют специфические трехмерные структурные характеристики, а также специфические характеристики заряда. Более конкретно, термин "эпитоп IL-21", в применении здесь, относится к части полипептида IL-21, имеющей антигенную или иммуногенную активность в животном, предпочтительно в млекопитающем, и наиболее предпочтительно в мыши или в человеке. Эпитоп, имеющий иммуногенную активность, представляет собой часть полипептида IL-21, которая вызывает образование антител в животном. Эпитоп, имеющий антигенную активность, представляет собой часть полипептида IL-21, с которой антитело иммуноспецифически связывается, что установлено любым методом, хорошо известным в данной области, например иммунологическими анализами. Антигенные эпитопы необязательно должны быть иммуногенными. "Прерывистые эпитопы" представляют собой конформационные эпитопы, образованные из по меньшей мере двух раздельных областей первичной последовательности белка IL-21. Конформационные эпитопы теряют способность специфически связывать в присутствии денатурирующих растворителей (например, в Вестерн-блот анализе).
[41] Данное изобретение обеспечивает моноклональные антитела и фрагменты антител, которые специфически связываются с белками и полипептидами IL-21. Полипептиды IL-21 человека и мыши, белки и полинуклеотиды, кодирующие полипептиды, описывают в Parrish-Novak et al., Nature 408:57- 63, 2003; патенты США №№6307024 и 6686178; и 7250274. Описанные здесь представляют собой структурные и функциональные характеристики, определяющие области (эпитопы) белка IL-21 человека, которые были идентифицированы в виде мишеней для терапевтического моноклонального антитела. Представляют приводимые в качестве примера моноклональные антитела против IL-21 человека. Некоторые из этих антител имеют способность связывать природный IL-21 человека, рекомбинантный дикого типа IL-21 человека, рекомбинантный мутантный белок IL-21 и/или пептидные области IL-21 человека.
[42] Данное изобретение обеспечивает анти-IL-21 антитела, которые применимы для терапевтического лечения аутоиммунных и воспалительных заболеваний. Например, анти-IL-21 антитела применимы для лечения псориаза, панкреатита, сахарного диабета I типа (IDDM), болезни Грейвса, воспалительного заболевания кишечника (IBD), болезни Крона, язвенного колита, синдрома раздраженной толстой кишки, рассеянного склероза, ревматоидного артрита, реактивного артрита, энтеропатического артрита, спондилоартропатии, аутоиммунного миокардита, синдрома Кавасаки, целиакии, увеита, болезни Бехчета, болезни коронарных артерий, хронического обструктивного легочного заболевания (COPD), интерстициального заболевания легких, воспалительного заболевания мышц (полимиозита, дерматомиозита), микроскопического полиангиита, аутоиммунной апластической анемии, аутоиммунного тиреоидита, аутоиммунного гепатита, синдрома Вегенера, дивертикулеза, системной красной волчанки, анкилозирующего спондилита, склеродермии, системного склероза, псориатического артрита, остеоартрита, атопического дерматита, витилиго, реакции "трансплантат против хозяина" (GVHD), кожной Т-клеточной лимфомы (CTCL), синдрома Шегрена, гломерулонефрита, нефропатии IgA-типа, аутоиммунного нефрита, обыкновенной пузырчатки, миастении гравис, аутоиммунной потери слуха, нейромиелита зрительного нерва, синдрома Гудпасчера, криоглобулинемии, синдрома Гийена - Барре, хронической воспалительной демиелинизирующей полинейропатии (CIDP), аутоиммунной гемолитической анемии, идиопатической тромбоцитопенической пурпуры (ITP), отторжения трансплантата, высокосенсибилизированных пациентов с трансплантацией, антифосфолипидного синдрома, аллергии и астмы и других аутоиммунных заболеваний или других заболеваний, опосредованных IL-21 и агонистами рецептора IL-21.
[43] Пять классов иммуноглобулина, IgG, IgA, IgM, IgD и IgE, были идентифицированы у высших позвоночных. Белки IgG, IgD и IgE обычно являются сшитыми дисульфидными связями гетеротетрамерами, состоящими из двух одинаковых тяжелых цепей и двух одинаковых легких цепей. Обычно IgM обнаруживается в виде пяти тетрамеров, тогда как IgA встречается в виде двух тетрамеров. Модификации могут быть введены в молекулу иммуноглобулина.
[44] IgG охватывает основной класс, который обычно существует в виде второго наиболее распространенного белка, обнаруженного в плазме. У людей IgG состоит из четырех подклассов, обозначенных IgG1, IgG2, IgG3 и IgG4. Каждая тяжелая цепь иммуноглобулинов содержит константную область, которая состоит из доменов константной области белка (CH1, шарнира, CH2 и CH3), которые являются неизменными для данного подкласса. Константные области тяжелой цепи класса IgG идентифицируют с использованием греческого символа γ. Например, иммуноглобулины подкласса IgG1 содержат константную область тяжелой цепи γI.
[45] Fc-фрагмент или Fc-домен состоит из сшитых дисульфидными связями шарнирных участков тяжелой цепи, CH2, и CH3 доменов. В слитых белках иммуноглобулинов Fc-домены подкласса IgG1 часто используют в виде части молекулы иммуноглобулина, поскольку IgG1 имеют наиболее продолжительное время полужизни в сыворотке любого из сывороточных белков. Протяженное время полужизни в сыворотке может быть желаемой характеристикой белка при исследованиях на животных и потенциальном терапевтическом применении для человека. Кроме того, подкласс IgG1 обладает наиболее сильной способностью реализации эффекторных функций, опосредованных антителом. Первичная эффекторная функция, которая может быть наиболее пригодной в слитом белке иммуноглобулина, представляет собой способность для IgG1 антитела опосредовать антителозависимую клеточную цитотоксичность. С другой стороны, это могло быть нежелательной функцией для слитого белка, который функционирует в первую очередь в виде антагониста. Было идентифицировано несколько из аминокислотных остатков, которые являются важными для активности в подклассе IgG1, опосредованной константной областью антитела. Таким образом, введение или удаление этих специфических аминокислот обеспечивает включение или выключение специфической активности, опосредованной константной областью иммуноглобулина (см. патенты США №№5648260; 5624821).
[46] Модифицированный IgG1 Fc человека был сконструирован для создания слитых белков с Fc. Например, мутации Fc4, Fc5 и Fc6 для снижения эффекторных функций, опосредованных Fc путем уменьшения связывания FcγRI и связывания комплемента C1q, описывают в патентной заявке США 2006-0034852, включенной в качестве ссылки в ее полном виде. Конкретно, три аминокислотные замены вводили для уменьшения связывания FcγRI. Данные замены являются заменами в положениях 234, 235 и 237