Плазмида 40gal, определяющая синтез α-галактозидазы α-psgal, штамм e.coli rosetta(de3)/40gal - продуцент химерного белка, включающего аминокислотную последовательность α-psgal, и способ ее получения
Иллюстрации
Показать всеИзобретение относится к области биохимии и представляет собой плазмиду, определяющую синтез α-галактозидазы α-PsGal, включающую NcoI/SalI - фрагмент плазмиды pET-40b(+) (Novagen) и фрагмент ДНК, размером 2142 пар оснований, содержащий химерный ген, состоящий из структурной части гена α-PsGal, адаптированной по N-концу для экспрессии в клетках E. coli, и нуклеотид, кодирующий специфическую последовательность для энтеропептидазы. Изобретение относится также к штамму E. coli Rosetta (DE3), трансформированному указанной плазмидой, - продуценту химерного белка, содержащего аминокислотную последовательность рекомбинантной α-галактозидазы α-PsGal и последовательность, специфичную для энтеропептидазы. Предложен также способ получения рекомбинантной α-галактозидазы α-PsGal, включающий стадии: инкубирования указанного штамма-продуцента в жидкой питательной среде LB в течение 12 ч при 16°С, осаждения бактериальных клеток центрифугированием, дезинтеграции суспензии клеток в буфере, центрифугирования экстракта, хроматографии надосадочной жидкости на колонке с металлоафинной смолой, элюции белка, концентрирования активных фракций с помощью ионообменной смолы, инкубирования с энтеропептидазой и выделения целевого продукта гель-фильтрацией. Изобретение позволяет получать более активную и стабильную рекомбинантную альфа-галактозидазу с высокой степенью эффективности. 3 н.п. ф-лы, 1 ил., 3 пр.
Реферат
Изобретение относится к биотехнологии, в частности к генетической инженерии, и касается способа получения рекомбинантного белка α-галактозидазы морской бактерии Pseudoalteromonas sp. штамма КММ 701 ВКМ В-2135Д (α-PsGal), а также плазмиды для его получения и рекомбинантного штамма Escherichia coli. Изобретение позволяет производить высокоактивную рекомбинантную α-галактозидазу для использования в трансфузионной и клинической медицине, генной инженерии и молекулярной биологии.
α-D-галактозидаза (Е.С.3.2.1.22) катализирует гидролиз α-галактозидной связи в таких олигосахаридах, как раффиноза, мелибиоза, стахиоза, и в таких полисахаридах, как галактоманнаны, а также в гликоконъюгатах, включая гликопротеины и гликолипиды. α-PsGal рекомендована для использования в трансфузионной медицине как фермент, способный удалять α-1,3-связанные остатки галактозы из гликопротеинов групповых веществ В-крови с превращением последних в вещества группы Н (О); в клинической медицине как профилактический и лечебный антибактериальный препарат для обработки слизистых и раневых поверхностей; в молекулярной биологии как инструмент для исследования структуры олиго- и полисахаридных матриксов; в генной инженерии для получения реперных белков и т.д.
Разработка эффективного способа получения универсальных по групповым свойствам эритроцитов для неотложной трансфузиологической помощи пострадавшим продолжает быть весьма актуальной. α-Галактозидазы, инактивирующие серологическую активность эритроцитов человека группы В (ЭЧ-В), - относительно редкие ферменты. Клинические испытания конвертированных эритроцитов на добровольцах продемонстрировали, что ферментативное преобразование ЭЧ-В выполнимо, что конвертированные ферментом ЭЧ-В в ЭЧ-O жизнеспособны и могут функционировать так же, как необработанные ЭЧ, которые подобраны по группе крови в соответствии с правилами, принятыми в клинической медицине переливания. Однако количество фермента (мг), в этих исследованиях, даже с современной эффективной рекомбинантной технологией экспрессии составляет экономическое препятствие для использования их в медицине переливания, так как на одну упаковку (200 мл) эритроцитов требуется 1-2 г фермента [Zhang Y.P, Gong F., Bao G.Q., Gao H.W, Ji S.P, Tan Y.P., Li S.B., Li L.L, Wang Y.L., Xu Н., Xu L.J., Tian S.G., Zhang Z.X., Lu Q.S., Qiu Y., Bai J.S. Chen J.T. В to O 2 erythrocyte conversion by the recombinant α-galactosidase // Chin. Med. J. - 2007. - Vol.120, N 13. - P.1145-1150]. Кроме того, огромное значение имеет рН-оптимум фермента и узкая субстратная специфичность. Так, все описанные в литературе ферменты, эффективно действующие на эритроциты, имеют оптимум в кислой области рН, что крайне нежелательно для эритроцитов.
Анализ многочисленных литературных данных показал, что именно бактерии содержат ферменты, одно из свойств которых удовлетворяет технологическим требованиям (оптимум действия при рН 7,0), предъявляемым к модификации эритроцитов в физиологических условиях.
Морские бактерии как источники ферментов с уникальной специфичностью привлекают все большее внимание исследователей. Так было установлено, что α-галактозидаза из морской бактерии Pseudoalteromonas sp. KMM 701 помимо инактивирующего действия на серологическую активность В-эритроцитов обладает антибактериальным свойством разрушать микробиологические пленки патогенных штаммов, образующихся на слизистых человека. Обработка эпителиальных клеток гортани человека препаратом такого фермента значительно снижала адгезию возбудителя дифтерии С.diphtheriae [L.A.Balabanova, I.Y.Bakunina, O.I.Nedashkovskaya, I.D.Makarenkova, T.S. Zaporozhets, N.N.Besednova, T.N.Zvyagintseva and V.A.Rasskazov. Molecular Characterization and Therapeutic Potential of a Marine Bacterium Pseudoalteromonas sp.KMM 701 α-Galactosidase // Mar Biotechnol. - 2010. - Vol.12. P.111-120].
Известен способ получения природного белка α-галактозидазы из дикого штамма-продуцента Pseudoalteromonas sp. ВКМ В-2135Д [RU 2113479 C1, 20.06.1998]. Основным недостатком этого способа являются высокие технологические затраты при хранении и выращивании дикого штамма.
Недавно была установлена нуклеотидная последовательность зрелого белка α-галактозидазы Pseudoalteromonas sp. KMM 701 (код GenBank DQ530422.1). Однако способы получения активного рекомбинантного аналога α-галактозидазы Pseudoalteromonas sp.ВКМ В-2135Д (α-PsGal) пока еще не известны. Получение растворимой высокоактивной α-PsGal в гетерологичных бактериальных системах сопряжено с рядом трудностей, так как функциональный белок является психрофильным и состоит из двух субъединиц.
Задача изобретения - конструирование рекомбинантного штамма E. coli, плазмиды, кодирующей синтез рекомбинантного белка α-PsGal, и разработка способа его получения.
Поставленная задача решена созданием генетической конструкции в виде рекомбинантной плазмиды 40Gal и штамма Е. coli Rosetta(DE3)/40Gal, обеспечивающих индуцируемый синтез с высоким и стабильным выходом активной растворимой рекомбинантной α-галактозидазы в периплазму клетки кишечной палочки.
Технический результат заявленного изобретения - получение активной рекомбинантной α-галактозидазы α-PsGal с высоким выходом и уровнем очистки.
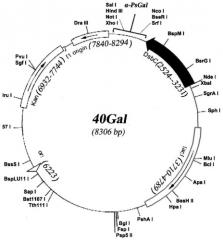
Плазмида 40Gal имеет 8306 пар оснований (п.о.) и характеризуется наличием NcoI/SalI-фрагмента плазмиды pET-40b(+) (Novagen) и последовательности фрагмента ДНК размером 2142 п.о., адаптированной по N-концу для экспрессии в клетках E. coli, содержащего химерный ген, состоящий из структурной части гена α-PsGal, и специфической последовательности для энтеропептидазы с целью удаления дополнительных аминокислотных остатков с N-концевой части молекулы рекомбинантного белка.
На чертеже представлена физическая карта плазмиды 40Gal и область плазмиды, ответственная за экспрессию рекомбинантного белка α-PsGal.
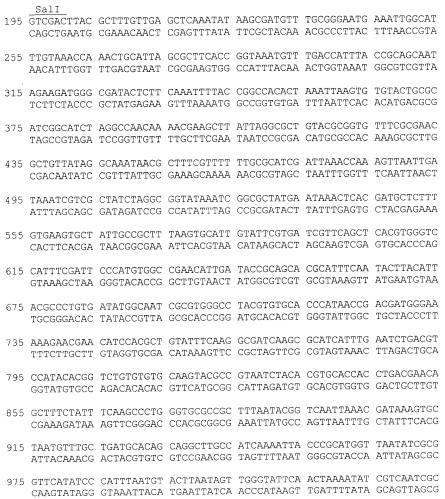
Нуклеотидная последовательность фрагмента плазмиды 40Gal, фланкированная сайтами Ncol и Sail, содержит последовательность структурного гена α-PsGal с адаптированным N-концом для экпрессии в E. coli, соответствующую открытой рамке считывания для белка α-PsGal, и последовательность, специфичную для энтеропептидазы (SEQ ID N 1).
Штамм E. coli Rosetta(DE3)/40Gal получен трансформацией клеток E. coli Rosetta (DE3) (Novagen) плазмидой 40Gal с использованием традиционной генно-инженерной технологии [Sambrook J., Fritsch E.F., Maniatis T. // Molecular Cloning. A. Laboratory Manual. 2bd ed. Cold Spring Harbor, NY, 1989.].
Рекомбинантный штамм E. coli Rosetta(DE3)/40Gal характеризуется следующими признаками.
Культурально-морфологические признаки
Клетки штамма образуют крупные круглые с ровными краями, выпуклые колонии до 5 мм в диаметре, поверхность колоний гладкая, консистенция слизистая. Пигмент не накапливается. Грамотрицательны, спор не образуют, капсулы не имеют. Колонии хорошо растут на простых питательных средах (LB). При росте в жидких средах образуют интенсивную ровную муть.
Физико-биологические признаки
Штамм E. coli Rosetta(DE3)/40Gal видотипичен по своим биохимическим свойствам. Штамм не обладает желатиназной активностью, не ферментирует лизин; расщепляет глюкозу, лактозу, маннит, сахарозу до кислоты и газа. Имеет мутацию в гене lac, обеспечивающую контроль уровня экспрессии, а также трансляцию редких кодонов. Оптимальной для роста является температура 37°С, а для продукции психрофильной α-PsGal 16°С.
Устойчивость к антибиотикам
Клетки штамма характеризуются устойчивостью к хлорамфениколу (34 мкг/мл) и канамицину (25 мкг/мл).
Патогенность и токсичность
Рекомбинантный штамм E. coli Rosetta(DE3)/40Gal не патогенен и не токсичен для теплокровных животных.
Штамм хранится обычным способом в суспензии с глицерином (30%) при -20°С. Заявляемый способ получения рекомбинантной α-галактозидазы α-PsGal заключается в культивировании клеток штамма E. coli Rosetta (DE3)/40Gal в питательной среде LB, содержащей канамицин, отделении биомассы от культуральной жидкости, разрушении микробных клеток с последующим выделением целевого продукта водной экстракцией и хроматографической очисткой ферментного препарата. Очистку целевого продукта осуществляют хроматографией на металлоафинной смоле и гель-фильтрацией.
Выход рекомбинантной α-PsGal в результате применения описанного способа составляет не менее 10 мг рекомбинантного белка с 1 л культуры с удельной активностью более 500 ед./мг белка, что превышает удельную активность природного аналога в 5 раз.
Рекомбинантный белок α-PsGal является гомодимером с молекулярной массой 160 кДа, имеет оптимальную температуру реакции 20-22°С и оптимум рН=7,0-7,5, и его активность не зависит от присутствия ионов двухвалентных металлов в инкубационной среде. Рекомбинантная α-PsGal может быть успешно использована для удаления групповой специфичности эритроцитов человека группы крови B(III) и получения универсальной донорской крови группы O(I), так как после окончания реакции легко инактивируется уже после 25°С. α-PsGal также может быть использована для обработки слизистого эпителия человека в целях профилактики и лечения инфекционных заболеваний.
Существенными преимуществами заявляемого способа являются:
- использование штамма-продуцента E. coli Rosetta (DE3)/40Gal, что позволяет получать при биосинтезе большое количество полноразмерной, двухсубъединичной и высокоактивной рекомбинантной α-PsGal;
- использование двухстадийной хроматографической очистки фермента, что позволяет получить чистый рекомбинантный белок за короткое время и с малыми потерями.
Способ получения функционально активного белка на основе использования гена, кодирующего α-галактозидазу морской бактерии α-PsGal, иллюстрируется следующими примерами.
Пример 1. Конструирование плазмиды 40Gal.
Рекомбинантную плазмиду 40Gal, содержащую структурный ген α-PsGal, кодирующий зрелую форму α-галактозидазы Pseudoalteromonas sp. KMM 701, и последовательность, специфичную для этеропептидазы, фланкированные сайтами рестрикции NcoI и SaiI, конструируют на основе коммерческой плазмиды рЕТ-40b(+) (Novagen).
Фрагмент ДНК, содержащий полноразмерный ген α-PsGal, получают при помощи полимеразной цепной реакции с использованием геномной ДНК штамма морской бактерии Pseudoalteromonas sp.KMM 701, ВКМ В-2135Д, в качестве матрицы и праймеров G2-NcoI-for40 и G3-SalI-rev40, где G2-NcoI-for40 - праймер, специфичный по отношению к N-концевой последовательности α-PsGal, включающий последовательность для энтеропетидазы, G3-SalI-rev40 - обратный праймер, специфичный по отношению к С-концевой последовательности α-PsGal:
G2-NcoI-for40: 5'-
ATTACCATGGATGACGACGACAAGGCCGACACTAAATCATTTTATCGATTAGACA-3'
G3-SalI-rev40: 5'-ACACGTCGACTTACGCTTTGTTGAGCTCAAATATAAGC-3'
Данную реакцию проводят в следующих условиях: 10х Encycio буфер, 50х смесь полимераз Encycio ("Encycio PCR kit", Евроген, Москва), 50х смесь dNTP (10 mM каждого), смесь праймеров (5 µМ каждого), 50 нг ДНК. Процесс амплификации состоит из следующих стадий: прогревание при 95°С 2,5 мин, 35 циклов ПЦР (15 сек 95°С, 2 мин 72°С) и инкубация 10 мин при 72°С. После амплификации фрагмент ДНК очищают электрофоретически в 1% агарозном геле. Фрагмент (1 мкг) обрабатывают рестриктазами NcoI и SaiI в оптимальном буфере (Fermentas) в течение 3 часов, затем ферменты удаляют из реакционной среды по стандартной методике фенолом (1:1). В водную фракцию, содержащую фрагмент, добавляют 1/10 объема 0,3 М ацетата Na, pH 5,2, и 1/2 объема изопропанолового спирта и оставляют на -20°С в течение 30 мин. Затем центрифугируют при 14000 об/мин в течение 20 мин, осадок промывают 75% этанолом и высушивают при комнатной температуре. Осадок растворяют в 20 мкл.
5 мкг плазмидной ДНК рЕТ-40b(+) обрабатывают рестриктазами NcoI и Sail в соответствии с методикой, описанной выше, и из полученного гидролизата выделяют векторную часть плазмиды в 1% геле легкоплавкой агарозы.
Полученный фрагмент и векторную часть плазмиды рЕТ-40b(+) сшивают при помощи лигазной реакции в 50 мкл буфера для лигирования согласно инструкции (Fermentas). 10 мкл реакционной смеси используют для трансформации компетентных клеток E. coli Rosetta(DE3). Трансформанты высевают на LB-агар, содержащий 25 мкг/мл канамицина. После инкубирования в течение 16 час при 37°С клоны отсевают, выделяют плазмидную ДНК и анализируют на наличие мутаций при помощи автоматического секвенирования. Отбирают ДНК, содержащую необходимую последовательность, представляющую собой плазмиду 40Gal размером 8306 п.о.
Пример 2. Получение штамма E. coli Rosetta (DE3)/40Gal, трансформированного плазмидой 40Gal - продуцента химерного белка, содержащего аминокислотную последовательность рекомбинантной α-галактозидазы α-PsGal и последовательность, специфичную для энтеропептидазы.
Штамм-продуцент получают путем трансформации клеток штамма E. coli Rosetta(DE3) рекомбинантной плазмидой 40Gal. Ночную культуру (0,5 мл LB) штамма-продуцента рекомбинантной α-PsGal выращивают в литровой колбе в жидкой среде LB, содержащей на литр 10 г бакто-триптона, 5 г бакто-дрожжевого экстракта и 10 г NaCl, 25 мг/мл канамицина, рН 7,7, на шейкере при 200 об/мин при температуре 37°С в течение 2 часов до оптической плотности 0,6-0,8 (OD600), затем добавляют индуктор экспрессии IPTG до конечной концентрации 0,2 мМ и инкубируют далее при 16°С в течение 12 часов. Для определения продуктивности штамма клеточные водные экстракты анализируют электрофорезом в 12% полиакриламидном геле с додецилсульфатом натрия. Гель окрашивают Кумасси R-250 по стандартной методике и определяют относительное количество белка в полосе целевого продукта. Содержание рекомбинантного белка в растворимой клеточной фракции составляет не менее 30% от всех белков этой фракции.
Пример 3. Выделение и характеристика рекомбинантной α-галактозидазы α-PsGal.
Штамм-продуцент рекомбинантной α-галактозидазы α-PsGal E. coli Rosetta (DE3)/40Gal инкубируют в литровой колбе в жидкой среде LB, содержащей на литр 10 г бакто-триптона, 5 г бакто-дрожжевого экстракта и 10 г NaCl, 0,2 мМ IPTG, 25 мг/мл канамицина, рН 7,7, на шейкере при 250 об/мин в течение 12 часов при 16°С. Бактериальные клетки осаждают на проточной центрифуге при 5000 об/мин в течение 10 мин. Суспензию клеток дезинтегрируют в 100 мл буфера А (0,01 М NaH2PO4, рН 7,7, 0.01% NaN3) в течение 5×30 сек, охлаждая во льду. Затем центрифугируют при 5000 об/мин в течение 10 мин. Надосадочную жидкость собирают и помещают на колонку с металлоафинной смолой (Qiagen), предварительно уравновешенную буфером А. Элюцию белка проводят буфером А, содержащим 50 мМ ЭДТА. Активные фракции собирают и концентрируют до 3 мл в буфере А, содержащем 0,4 мМ NaCl, на ионообменной смоле ДЕАЕ-toyoperl 650М (TOYA SODA) и инкубируют с энтеропептидазой (Invitrogen) при 21°С в течение 15 часов. Раствор белка наносят на колонку для гель-фильтрации с Sephacryl S-200 HR (Sigma). Выход рекомбинантного белка составляет около 10 мг с 1 литра культуры. Полученный рекомбинантный полипептид определяют по первым 10 аминокислотам на автоматическом секвенаторе. Проведенное секвенирование препарата рекомбинантной α-галактозидазы α-PsGal, выделенной из клеток штамма E. coli Rosetta (DE3)/40Gal, показало, что N-концевая аминокислотная последовательность А1а-Asp-Thr-Lys-Ser-Phe-Tyr-Arg-Leu-Asp соответствует первым 10 аминокислотам полноразмерного природного белка α-галактозидазы Pseudoalteromonas sp. KMM 701, ВКМВ-2135Д,-аналога α-PsGal.
Активность α-галактозидазы определяют по расщеплению п-нитрофенилгалактопиранозида (п-НФГП). Реакционная смесь в объеме 400 мкл содержит 10 мМ NaH2PO4 (рН 7,2), 3 мМ субстрата и фермент. После 20 мин инкубации при 20°С реакцию останавливают добавлением 0,6 мл 1 М Na2CO3. Количество образовавшегося в процессе ферментативной реакции продукта определяют спектрофотометрически при 400 нм. За единицу активности принимают количество фермента, катализирующего освобождение 1 мкМ п-НФГ (E400 нм=18600) в течение 1 мин инкубации. Удельную активность выражают в единицах активности фермента на 1 мг белка. Концентрацию белка в растворе определяют по методу Брэдфорд.
Полученные данные по физико-химическим характеристикам и ферментативной активности продукта экспрессии искусственного химерного гена α-PsGal в клетках штамма E. coli Rosetta (DE3)/40Gal свидетельствуют о соответствии исследуемого полипептида его природному аналогу.
Как следует из приведенных примеров, заявляемая группа изобретений позволяет получать активную рекомбинантную α-галактозидазу α-PsGal с высоким выходом при относительно простой и надежной технологии.
Заявленное изобретение позволяет:
- с помощью использования штамма-продуцента E. coli Rosetta(DE3)/40Gal получать активную рекомбинантную α-галактозидазу α-PsGal;
- использование штамма-продуцента E. coli Rosetta(DE3)/40Gal позволяет получать при биосинтезе большое количество полноразмерной рекомбинантной α-галактозидазы α-PsGal;
- использование металлоафинной и гель-фильтрационной хроматографий при очистке фермента из водного экстракта клеток штамма-продуцента позволяет получать фермент с чистотой более 98%.
Перечень нуклеотидных и аминокислотных последовательностей
<110> Балабанова Л.А., Голотин В.А., Бакунина И.Ю., Рассказов В.А.
<120> Плазмида 40Gal, определяющая синтез α-галактозидазы α-PsGal, штамм E.coli Rosetta(DE3)/40Gal - штамм-продуцент рекомбинантной α-галактозидазы α-PsGal и способ ее получения.
<160> 1
<210> 1
<211> 2156
<212> ДНК
<213> Pseudoalteromonas sp. KMM 701 ВКМ В-2135Д
<223> Нуклеотидная последовательность фрагмента плазмиды 40Gal, содержащая сайты рестрикции NcoI и SalI, последовательность, специфичную для энтеропептидазы, и последовательность структурного гена α-PsGal, соответствующую открытой рамке считывания для белка α-PsGal, включающую стоп-кодон.
1. Плазмида 40Gal размером 8306 пар оснований (п.о.), определяющая синтез рекомбинантной α-галактозидазы морской бактерии Pseudoalteromonas sp. BKM В-2135Д (α-PsGal) и характеризующаяся наличием следующих фрагментов: NcoI/SalI-фрагмента плазмиды pET-40b(+) (Novagen) и фрагмента ДНК размером 2142 п.о., содержащего химерный ген, состоящий из структурной части гена α-PsGal, адаптированной по N-концу для экспрессии в клетках E.coli, и нуклеотида, кодирующего специфическую последовательность для энтеропептидазы (SEQ ID N 1).
2. Штамм E.coli Rosetta(DE3), трансформированный плазмидой 40Gal по п.1, - продуцент химерного белка, содержащего аминокислотную последовательность рекомбинантной α-галактозидазы α-PsGal и последовательность, специфичную для энтеропептидазы.
3. Способ получения рекомбинантной α-галактозидазы α-PsGal, характеризующийся тем, что штамм-продуцент по п.2 инкубируют в жидкой питательной среде LB в течение 12 ч при 16°С, затем бактериальные клетки осаждают центрифугированием, суспензию клеток дезинтегрируют в буфере, далее экстракт центрифугируют, затем надосадочную жидкость помещают на колонку с металлоафинной смолой, далее элюируют белок, затем активные фракции концентрируют на ионообменной смоле, инкубируют с энтеропептидазой и выделяют целевой продукт гель-фильтрацией.