Набор олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченного зонда для идентификации рнк коронавируса человека, ассоциированного с тяжелым острым респираторным синдромом
Иллюстрации
Показать всеИзобретение относится к биотехнологии, в частности к генетической инженерии, и может быть использовано для выявления генетического материала (РНК) коронавируса человека, ассоциированного с тяжелым острым респираторным синдромом (ТОРС). Набор олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченного ДНК-зонда для идентификации коронавируса человека, ассоциированного с тяжелым острым респираторным синдромом, содержит пару внутренних и один внешний олигонуклеотиды, обладающие активностью прямого и обратного праймеров в полимеразной цепной реакции, а также флуоресцентно-меченный ДНК-зонд, имеющие следующую структуру: внешний обратный праймер
NR: 5`-CTTTTGGCAATGTTGTK(G/T)CCTT-3`; внутренние прямой (F) и обратный (R) праймеры 5`→3` F: 5`-AAAATGTCTGATAATGGACCCC-3` и R: 5`-ACCACCACGAR(A/G)CTCGTCG-3`; флуоресцентно-меченный ДНК-зонд
Z: 5`-TY(C/T)CACCAAATGTAATGCGGGG-3`. Набор праймеров и зонд позволяют идентифицировать коронавирус человека, ассоциированный с ТОРС, а также коронавирусы, подобные ТОРС-коронавирусу человека, выделенные от пальмовых циветт, енотовых собак и плодоядных летучих мышей методом ПЦР в реальном времени с получением более продолжительного амплифицированного фрагмента NP-гена коронавируса (513 п.н.). 2 ил., 5 табл., 2 пр.
Реферат
Изобретение относится к биотехнологии, в частности к генетической инженерии, и может быть использовано для выявления генетического материала (РНК) коронавируса человека, ассоциированного с тяжелым острым респираторным синдромом (ТОРС), в клинических образцах, секционных пробах, образцах окружающей среды, культуральных вируссодержащих жидкостях и прочих биопрепаратах с целью постановки диагноза, коррекции лечения, эпидемиологического расследования, а также для решения научно-исследовательских задач по мониторингу и изучению свойств коронавируса, созданию диагностических, профилактических и лечебных препаратов и может быть использовано в медицине, биотехнологии и эпидемиологии.
При помощи разработанных диагностических праймеров и флуоресцентно-меченного зонда возможно выявление генетического материала (РНК) коронавируса, ассоциированного с ТОРС.
Метод обратно-транскриптазной полимеразной цепной реакции (ОТ-ПЦР) с детекцией продуктов амплификации в режиме реального времени обладает высокой чувствительностью и является основным методом выявления вирусной РНК. Метод ОТ-ПЦР основан на получении комплементарной ДНК (кДНК) на матрице вирусной РНК с последующим многократным избирательным удвоением участка кДНК. Амплифицируемый участок кДНК, являясь маркерным, позволяет выявить вирусный агент в исследуемом образце. Для эффективного проведения ОТ-ПЦР в режиме реального времени необходимы флуоресцентно-меченный ДНК-зонд и ДНК-затравки - праймеры (синтетические олигонуклеотиды), строго специфичные к кДНК вирусного генома. Сложность выбора праймеров и зонда обусловлена требованием их строгой видоспецифичности. Праймеры должны быть комплементарны нуклеотидным последовательностям кДНК, ограничивая амлифицируемый участок справа и слева таким образом, чтобы синтез ДНК ДНК-полимеразой проходил строго в выбранном регионе. Флуоресцентно-меченный ДНК-зонд, в свою очередь, должен лежать внутри участка кДНК, ограниченного праймерами. Правильный выбор праймеров позволяет осуществить экспоненциальное увеличение количества копий целевого участка кДНК. Правильный выбор сочетания пары праймеров и ДНК-зонда позволяет осуществлять детекцию накопления продуктов амплификации в режиме реального времени. В целом от правильности выбора олигодезоксирибонуклеотидных праймеров и ДНК-зонда зависит специфичность проводимой ОТ-ПЦР, а значит и точность диагностики вирусного заболевания.
Ниже приведены зарубежные аналоги, представляющие собой наборы праймеров и наборы реагентов, обеспечивающие детекцию кДНК коронавируса, ассоциированного с ТОРС.
Известный патент Китая №CN101603096 (опубл. 2009 г.) получен на набор реагентов и готовый ПЦР-набор для детекции вируса гриппа типа А субтипов Н5 и Н7, ТОРС ассоциированного коронавируса, хантавируса, чумной палочки (Yersinia pestis), возбудителя сибирской язвы (Bacillus anthracis).
Известная заявка США №US2009117537 (опубл. 2009 г.) касается набора праймеров и набора реагентов, позволяющего детектировать ТОРС, ассоциированный коронавирус, причем, праймеры локализуются в гене РНК-полимеразы коронавируса.
Известная Международная заявка №WO2006022459 (опубл. 2006 г.) касается детекции ТОРС ассоциированного коронавируса методом ПЦР в реальном времени.
Известный патент Сингапура № SG161740 (опубл. 2010 г.) касается выявления одного и более неизвестных коронавирусов, в том числе и ТОРС, ассоциированный коронавирус, причем праймеры фланкируют участок гена РНК-полимеразы и ген Nspl.
Известный патент Китая № CN1597984 (опубл. 2005 г.) касается биочипа, в основе которого лежит видоспецифическая ПЦР с последующей детекцией продуктов амплификации на твердой фазе ДНК-биочипа.
Известная заявка США № US2004265796 (опубл. 2004 г.) касается набора праймеров, фланкирующих участок N-гена и 3`-нетранслируемую область ТОРС ассоциированного коронавируса.
Известный патент Германии №DE20315159 (опубл. 2004 г.) касается набора реагентов, позволяющего детектировать ТОРС, ассоциированный коронавирус, методом ОТ-ПЦР в режиме реального времени.
Известный патент Китая №CN1570139 (опубл. 2005 г.) касается набора реагентов для выявления ТОРС ассоциированнго коронавируса методом ОТ-ПЦР с электрофоретической и гибридизационно-флуоресцентной детекцией накопления продуктов амплификации.
Известный патент Китая №CN1514010 (опубл. 2005 г.) касается набора реагентов, позволяющего выявлять ТОРС, ассоциированный коронавирус, методом ОТ-ПЦР. Праймеры, использующиеся в этом наборе реагентов, фланкируют ген РНК-полимеразы.
Известный патент Китая №CN1548550 (опубл. 2005 г.) касается набора реагентов, позволяющего выявлять ТОРС, ассоциированный коронавирус, методом ОТ-ПЦР. Заявка США №20040265796 (опубл. 2004 г.) касается набора реагентов, включающего праймеры, фланкирующие участок N-гена коронавируса, ассоциированного с ТОРС.
Известные патенты Китая № CN1609230 (опубл. 2005 г.), № 20080194422(А1) (опубл. 2008 г.), №20090117537 (опубл. 2009 г.), заявка США № US2008194422 (опубл. 2008 г.) также касаются наборов праймеров и наборов реагентов для выявления ТОРС ассоциированного коронавируса в исследуемых образцах.
Известен набор праймеров (внешнего и внутреннего) для детекции ТОРС ассоциированного коронавируса с электрофоретической детекцией продуктов амплификации (патент Респ. Корея № KR20100094968, опубл. 2010 г.).
Однако праймеры, используемые в вышеприведенных аналогах, имеют недостаточную гомологию к последовательностям генома ТОРС подобных коронавирусов, циркулирующих в настоящее время в дикой природе. Кроме того, указанные наборы праймеров не позволяют получить продолжительный амплифицированный фрагмент NP-гена (нуклеопротеид), нуклеотидную последовательность которого можно проанализировать и спрогнозировать патогенность и контагеозность выявленного коронавируса. Указанные наборы не могут быть использованы в количественной ПЦР.
Наиболее близким аналогом (прототипом) является http://www.interlabservice.ru/catalog/reagents/index.php?sid=1450&id=6187 (ЦНИИ Эпидемиологии, г. Москва) - набор реагентов, включающий праймеры для амплификации кДНК коронавируса человека, ассоциированного с тяжёлым острым респираторным синдромом, из клинического материала методом ПЦР с электрофоретической детекцией продуктов амплификации в агарозном геле (http://www.pcr.ru/sem_who/shipulin1.pdf).
Однако указанный набор реагентов был разработан в период вспышки заболеваемости тяжелым острым респираторным синдромом, вызванным коронавирусом, в 2003 году. За прошедшие 9 лет в ходе эпидемиологических исследований учеными были выделены вирусы, идентичные вирусу ТОРС человека, от пальмовых циветт (Paguma larvata), енотовых собак (Nyctereutes procyonoides), плодоядных летучих мышей (Rousettus, Cynopterus и т.д.). Это говорит о широком распространении в природе коронавирусов, подобных ТОРС-коронавирусу человека, а следовательно, возможности перехода геновариантов коронавирусов, подобных ТОРС-коронавирусу человека, из популяций животных в человеческую. Для этих геновариантов вышеназванные наборы праймеров не будет обладать достаточной специфичностью, чтобы обеспечить надежный синтез целевых фрагментов ДНК. Таким образом, праймеры, используемые в вышеприведенном прототипе, имеют недостаточную гомологию к последовательностям генома ТОРС подобных коронавирусов, циркулирующих в настоящее время в дикой природе. Кроме того, указанный набор праймеров не позволяет получить продолжительный амплифицированный фрагмент NP-гена (нуклеопротеид), нуклеотидную последовательность которого можно проанализировать и спрогнозировать патогенность и контагеозность выявленного коронавируса. Указанные наборы не могут быть использованы в количественной ПЦР.
Техническим результатом заявленного изобретения является разработка такого набора олигонуклеотидных праймеров и флуоресцентно-меченного зонда, который обеспечивал бы более надежную детекцию коронавируса человека, ассоциированного с ТОРС-инфекцией, в клинических образцах.
Указанный технический результат достигается разработкой набора олигодезоксирибонуклеотидных праймеров для детекции РНК коронавируса человека, ассоциированного с ТОРС, содержащего пару внутренних и один внешний олигонуклеотиды, обладающие активностью прямого и обратного праймеров в полимеразной цепной реакции, а также флуоресцентно-меченный ДНК-зонд. Указанные олигонуклеотиды имеют следующую структуру:
| внешний обратный праймер (NR) 5`→3` | |
| NR: 5`-CTTTTGGCAATGTTGTK(G/T)CCTT-3` | (21 н.) |
| внутренние прямой (F) и обратный (R) праймеры 5`→3` | |
| F: 5`-AAAATGTCTGATAATGGACCCC-3` | (22 н.) |
| R: 5`-ACCACCACGAR(A/G)CTCGTCG-3` | (18 н.) |
| флуоресцентно-меченный ДНК-зонд (Z) 5`→3` | |
| Z: 5`-TY(C/T)CACCAAATGTAATGCGGGG-3` | (21 н.) |
В рамках заявляемого технического решения разработанные праймеры и ДНК-зонд обладают высокой степенью гомологии ко всем известным нуклеотидным последовательностям NP-гена изолятов коронавируса человека, ассоциированного с ТОРС, а также к коронавирусам, обнаруженным у пальмовых циветт, енотовых собак и плодоядных летучих мышей, подобным ТОРС-коронавирусу человека, доступным в международной базе данных биотехнологической информации GenBank.
Апробация праймеров была осуществлена с использованием культуры клеток Vero, зараженной коронавирусом, ассоциированным с ТОРС, штамм Frankfurt 1, полученный из Американской типовой коллекции клеточных культур (ATCC). Экспериментально было показано, что выбранные праймеры и ДНК-зонд обеспечивают надежный синтез целевых ДНК-фрагментов. Специфичность амплификации дополнительно подтверждали секвенированием.
Созданный набор олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченного зонда позволяет идентифицировать коронавирус человека, ассоциированный с ТОРС, а также коронавирусы, подобные ТОРС-коронавирусу человека, выделенные от пальмовых циветт, енотовых собак и плодоядных летучих мышей методом ПЦР в реальном времени с получением более продолжительного амплифицированного фрагмента NP-гена коронавируса (513 п.н.), что позволяет провести секвенирование выявленного в образце коронавируса и провести более точный эпидемиологический анализ.
Характеристика набора праймеров и участка амплифицируемой геномной РНК. Предлагаемые к патентованию праймеры фланкируют участок гена, кодирующего нуклеопротеид (NP-ген). В первом раунде ПЦР амплифицируется фрагмент генома с 28117 по 28630 нуклеотид (513 п.н.), во втором раунде амплифицируется фрагмент с 28117 по 28413 нуклеотид (296 п.н.). Использование в комплекте с диагностическими праймерами флуоресцентно-меченного ДНК-зонда позволяет производить детекцию накопления продуктов амплификации в режиме реального времени.
Важно отметить, что оптимизация условий проведения ПЦР осуществлялась с использованием наборов коммерчески доступных реагентов, приборов и ферментов, предназначенных для массового использования в лабораторной практике, что позволяет быстрое и надежное применение данного изобретения в медицинских и научно-исследовательских лабораториях.
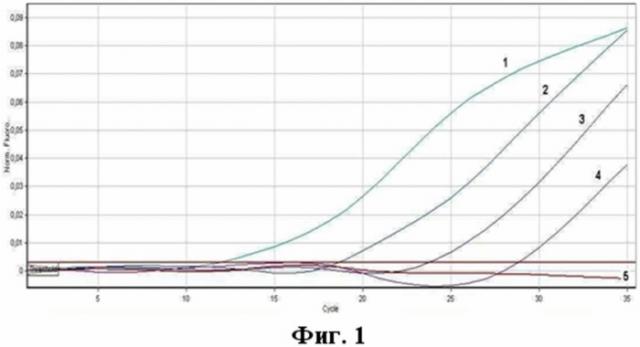
Перечень графических материалов. На фиг.1 представлены результаты анализа образцов методом ПЦР в реальном времени. В эксперименте методом ПЦР в реальном времени были проанализированы три последовательных десятикратных разведения кДНК коронавируса, ассоциированного с ТОРС, штамм Frankfurt 1.
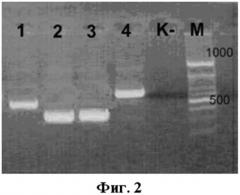
На фиг.2 приведена типичная электрофореграмма разделения в 2% агарозном геле продуктов ПЦР, полученных с использованием патентуемых олигонуклеотидов.
Пример 1. Методика конструирования набора диагностических праймеров и флуоресцентно-меченного зонда
На основе теоретического изучения структуры генома коронавируса, ассоциированного с ТОРС, на консервативную область гена нуклеопротеина (NP-ген) были рассчитаны и синтезированы праймеры и флуоресцентно-меченный ДНК-зонд для проведения полимеразной цепной реакции (таблица 1). В ходе работы было проанализировано 329 имеющихся в базе данных нуклеотидных последовательностей NP-гена коронавируса, ассоциированного с ТОРС, а также коронавирусов, обнаруженных у пальмовых циветт, енотовых собак и плодоядных летучих мышей, подобных ТОРС-коронавирусу человека.
| Таблица 1 | ||||
| Праймеры и зонд для детекции коронавируса человека, ассоциированного с ТОРС-инфекцией | ||||
| Вирус | Праймеры и зонды | Структура олигонуклеотидной последовательности5' → 3' | Т отжига,°С | Размер ампликона, п.н. |
| ТОРС КоВ | 28117-28138 | AAAATGTCTGATAATGGACCCC | 51.4 | 296 |
| 28181-28159 | FAM-TYCACCAAATGTAATGCGGGG-BHQ1 | 58.0 | ||
| 28413-28396 | ACCACCACGARCTCGTCG | 51.2 | ||
| 28630-28610 | CTTTTGGCAATGTTGTKCCTT | 51.2 | 513 |
Референс-последовательности базы данных Национального центра биотехнологической информации США (Blast NCBI): SARS coronavirus, complete genome (NC_004718.3)
Методика получения положительных контрольных образцов. Положительные контрольные образцы были получены методом ТОРО-Т/А клонирования. После чего компетентные клетки E. coli линии TOP 10 (Invitrogen, США) были трансформированы полученными плазмидами pCR2.1 (Invitrogen, США), несущими вирусспецифическую вставку синтезированных фрагментов ДНК. В ходе проделанной работы была сконструирована рекомбинантная плазмида: pHCoV-SARS. Наличие специфической к вирусному геному ДНК-вставки подтверждали секвенированием.
Анализ эффективности проведенной трансформации осуществляли проведением ПЦР в режиме реального времени в соответствии с протоколом, описанным ниже, где в реакционную смесь в качестве положительного образца добавляли 1×ТЕ-буфер, содержащий рекомбинантную плазмиду pHCoV-SARS, со встройкой вирусспецифического синтезированного ДНК-дуплекса. В качестве отрицательного контрольного образца в реакционную смесь добавляли 1×ТЕ-буфер.
Экстракция вирусной РНК. Вирусную РНК выделяли из 100 мкл культуральной вируссодержащей жидкости с использованием набора РИБО-преп» (ФБУН ЦНИИ эпидемиологии Роспотребнадзора, г. Москва) согласно инструкции производителя.
Реакция обратной транскрипции. Синтез комплементарной ДНК (кДНК) проводили на матрице суммарной РНК с использованием набора реагентов «Реверта-L» (ФБУН ЦНИИ эпидемиологии Роспотребнадзора, г. Москва) согласно инструкции производителя.
Пример 2. Проведение полимеразной цепной реакции
Условия проведения амплификации оптимизировали по концентрации ионов магния, концентрации праймеров и зондов в реакционной смеси, температуре отжига праймеров.
| Таблица 2 | |
| ПЦР-смесь для первого раунда (из расчета на одну пробирку) | |
| Компонент | Объем, мкл |
| ПЦР-буфер×10 | 3 |
| дНТФ (5 мМ) | 1 |
| MgCl2 (50 мМ) | 1.5 |
| Hot Start Taq ДНК-полимераза | 0.3 |
| Прямой праймер - F (10 нМ) | 2 |
| Обратный праймер - NR (10 нМ) | 2 |
| Образец | 3 |
| diH2O | 17.2 |
Реакцию амплификации проводили в 30 мкл смеси для ПЦР (табл. 2 и табл. 3), содержащей 1×Taq буфер для амплификации, 2.5 мМ MgCl2, 0.17 мМ каждого из нуклеозид-трифосфатов, 1.5 активных единиц Smart Taq ДНК-полимеразы (все компоненты ООО «Лаборатория МЕДИГЕН»), 20 пМ прямого и обратного праймеров и 8 пМ флуоресцентно-меченного ДНК-зонда.
Реакцию амплификации с электрофоретической детекцией продукта амплификации проводили на приборе Mastercycler gradient (Eppendorf, Германия) согласно программе табл. 4.
| Таблица 3 | |
| ПЦР-смесь для второго раунда (из расчета на одну пробирку) | |
| Компонент | Объем, мкл |
| ПЦР-буфер×10 | 3 |
| дНТФ (5 мМ) | 1 |
| MgCl2 (50 мМ) | 1.5 |
| Hot Start Taq ДНК-полимераза | 0.3 |
| Прямой праймер - F (10 нМ) | 2 |
| Обратный праймер - R (10 нМ) | 2 |
| ДНК-зонд - Z (15 нМ) | 0.5 |
| Продукт первого раунда ПЦР | 1 |
| diH2O | 18.7 |
| Таблица 4 | |||
| Программа амплификатора для ПЦР | |||
| № | Операция | T, °C | T, мин:с |
| 1 | Hold/Активация Smart-Taq-ДНК-полимеразы | 95 | 05:00 |
| 2 | Cycling/Циклирование (40 циклов) | 95 | 00:10 |
| 50 | 00:30 | ||
| 72 | 00:20 | ||
| 3 | Hold/Финальная элонгация | 72 | 10:00 |
Продукты ПЦР разделяли методом электрофореза в 2 % агарозном геле в присутствии бромистого этидия. Результаты оценивали по наличию флуоресцирующих полос, соответствующих фрагментам ДНК в 513 п.н. (первый раунд ПЦР), 296 п.н. (второй раунд ПЦР) и 720 п.н. (положительный контрольный образец). На фиг.2 представлена электрофореграмма разделения в 2% агарозном геле продуктов ПЦР, полученных с использованием патентуемых олигонуклеотидов.
Примечание:
1) кДНК коронавируса, ассоциированного с ТОРС, штамм Frankfurt 1, первый раунд ПЦР (513 п.н.);
2) кДНК коронавируса, ассоциированного с ТОРС, штамм Frankfurt 1, второй раунд ПЦР (разведение 1:100) (296 п.н.);
3) кДНК коронавируса, ассоциированного с ТОРС, штамм Frankfurt 1, второй раунд ПЦР (разведение 1:1000) (296 п.н.);
4) положительный контрольный образец (плазмидная конструкция pHCoV-SARS) (720 п.н.);
К - отрицательный контрольный образец (однократный ТЕ-буфер);
М - маркер молекулярного веса.
Полосы флуоресценции в геле соответствовали полученным в реакции амплификации участкам плазмидной ДНК и кДНК коронавируса.
ПЦР в режиме реального времени проводили согласно программе амплификации, таблица 5.
| Таблица 5 | |||
| Программа амплификатора для ПЦР-РВ | |||
| № | Операция | T, °C | T, мин:с |
| 1 | Hold/Активация Smart-Taq-ДНК-полимеразы | 95 | 05:00 |
| 2 | Cycling 1/Циклирование 1 (10 циклов) | 95 | 00:10 |
| 50 | 00:30 | ||
| 72 | 00:20 | ||
| 3 | Cycling 2/Циклирование 2 (30 циклов) | 95 | 00:10 |
| 50 | 00:30 детекция | ||
| 72 | 00:20 |
Детекцию интенсивности флуоресценции проводили по каналу - Green 470/510 нм (краситель FAM). Измерение флуоресценции проводили на приборах “Rotor Gene 6000” (Corbet Research, Австралия) и iQ5 (BioRad, США). Результаты оценивали по наличию флюоресценции до 30 цикла. На фиг.1 представлены результаты анализа образцов методом ПЦР в реальном времени с использованием патентуемых олигонуклеотидов.
Примечание:
1) положительный контрольный образец (плазмидная конструкция pHCoV-SARS);
2) кДНК коронавируса, ассоциированного с ТОРС, штамм Frankfurt 1 (разведение 1:100);
3) кДНК коронавируса, ассоциированного с ТОРС, штамм Frankfurt 1 (разведение 1:1000);
4) кДНК коронавируса, ассоциированного с ТОРС, штамм Frankfurt 1 (разведение 1:10000);
5) отрицательный контрольный образец (однократный ТЕ-буфер).
Таким образом, предлагаемый к патентованию набор олигонуклеотидов обладает высокой степенью гомологии не только к коронавирусу человека, ассоциированному с ТОРС, но и к коронавирусам, обнаруженным у пальмовых циветт, енотовых собак и плодоядных летучих мышей, подобным ТОРС-коронавирусу человека. Кроме того, предлагаемая к патентованию разработка сочетает в себе, помимо олигонуклеотидных праймеров, также флуоресцентно-меченный ДНК-зонд, что позволяет детектировать накопление продуктов амплификации в режиме реального времени, к тому же известно, что ПЦР в реальном времени обладает большей чувствительностью, чем ПЦР с электрофоретической детекцией продуктов амплификации. Наличие в наборе внешнего обратного праймера позволяет увеличить чувствительность ПЦР за счет проведения реакции в два раунда, а также получить продолжительный фрагмент ДНК (513 п.н.), что позволяет провести секвенирование выявленного в образце коронавируса, и провести более точный эпидемиологический анализ. Помимо этого, использование в качестве положительного контроля плазмидной конструкции несущей вирусспецифическую вставку (как описано ниже), позволяет разработать количественную ПЦР, что в свою очередь дает возможность оценить вирусную нагрузку в исследуемом образце.
Приложение
<110> Федеральное бюджетное учреждение науки «Государственный научный центр вирусологии и биотехнологии "Вектор"» (ФБУН ГНЦ ВБ "Вектор").
<120> Набор олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченного зонда для идентификации РНК коронавируса человека, ассоциированного с тяжелым острым респираторным синдромом.
<210> 4
<223> Последовательности олигонуклеотидов видоспецифические к коронавирусу человека, ассоциированному с тяжелым острым респираторным синдромом.
<400> 1
| внешний обратный праймер 5`→3` | |
| 5`-CTTTTGGCAATGTTGTK(G/T)CCTT-3` | 21 |
<400> 2
| внутренний прямой праймер 5`→3` | |
| 5`-AAAATGTCTGATAATGGACCCC-3` | 22 |
<400> 3
| внутренний обратный праймер 5`→3` | |
| 5`-ACCACCACGAR(A/G)CTCGTCG-3` | 18 |
<400> 4
| флуоресцентно-меченный ДНК-зонд 5`→3` | |
| 5`-FAM-TY(C/T)CACCAAATGTAATGCGGGG-BHQ1-3` | 21 |
Набор олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченного ДНК-зонда для идентификации коронавируса человека, ассоциированного с тяжелым острым респираторным синдромом, содержащий пару внутренних и один внешний олигонуклеотиды, обладающие активностью прямого и обратного праймеров в полимеразной цепной реакции, а также флуоресцентно-меченный ДНК-зонд, имеющие следующую структуру:● внешний обратный праймер (NR) 5`→3`NR: 5`-CTTTTGGCAATGTTGTK(G/T)CCTT-3`● внутренние прямой (F) и обратный (R) праймеры 5`→3`F: 5`-AAAATGTCTGATAATGGACCCC-3`R: 5`-ACCACCACGAR(A/G)CTCGTCG-3`● флуоресцентно-меченный ДНК-зонд (Z) 5`→3`Z: 5`-TY(C/T)CACCAAATGTAATGCGGGG-3`