Способ диагностики вторичной иммунологической недостаточности при туберкулезе легких
Иллюстрации
Показать всеИзобретение относится к области медицины и предназначено для диагностики вторичной иммунологической недостаточности при туберкулезе легких. До назначения специфической химиотерапии проводят иммунологическое исследование периферической крови больных туберкулезом легких и определяют клеточные, гуморальные и молекулярно-генетические параметры иммунного статуса пациента. При содержании в периферической крови CD4+CD25+Foxp3+ регуляторных Т-клеток более чем 2,6%, CD4+CD25-Foxp3+ регуляторных Т-клеток более чем 5,1%, CD3+CD4-CD25+ регуляторных Т-клеток более чем 0,2%, CD4+CD25+Foxp3- регуляторных Т-клеток/Т-хелперов активированных менее чем 25,5%, CD3+CD4+CD25- Т-хелперов менее чем 35,4%, γδТ-лимфоцитов менее чем 4,9%, CD45R0+ Т-клеток памяти менее чем 8,9%; IL-2 менее чем 22,3 пг/мл, IL-4 более чем 40,0 пг/мл, IL-10 более чем 25,3 пг/мл, TGFβ более чем 1109,0 пг/мл одновременно с носительством аллеля G и генотипа GG T-330G гена IL2 и аллеля А и генотипа АА С-592А гена IL10, аллеля Т и генотипа ТТ С-509Т гена TGFB и аллеля Т и генотипа ТТ С-590Т гена IL4 диагностируют вторичную иммунологическую недостаточность. Изобретение позволяет своевременно диагностировать дефекты иммунной системы у больных туберкулезом легких и применять меры коррекции лечебного воздействия с использованием современных методов иммуномодулирующей терапии. 6 ил., 4 табл., 1 пр.
Реферат
Изобретение относится к области медицины, а именно к фтизиатрии и пульмонологии, клинической иммунологии, аллергологии и патологической физиологии и может быть использовано для диагностики вторичной иммунологической недостаточности (ВИН) у впервые выявленных больных с распространенным деструктивным туберкулезом легких (ТБ) до назначения специфической химиотерапии.
В основе патогенеза распространенного деструктивного ТБ лежит дисрегуляция антигенспецифического Th1-зависимого иммунного ответа [1, 2]. Однако, по-прежнему, остается открытым вопрос о том, включение каких механизмов иммунного ответа на Mycobacterium tuberculosis (МВТ) и на каком его этапе способствует возникновению «иммунной девиации», патологическому прогрессирующему течению туберкулезной инфекции и формированию многокомпонентной вторичной иммунологической недостаточности у больных ТБ. С другой стороны, развитие ТБ практически всегда происходит на фоне функциональной несостоятельности иммунного ответа. Таким образом, ВИН может быть как причиной, так и следствием клинической манифестации туберкулеза.
В течение последнего десятилетия при исследовании особенностей иммунопатогенеза ТБ особое внимание уделяется регуляторным Т-клеткам, которые обладают супрессорной активностью и способствуют снижению интенсивности протективного антигенспецифического иммунного ответа, направленного на эрадикацию возбудителя [3, 4, 5]. Предполагается, что опосредованное регуляторными Т-клетками угнетение антигензависимой дифференцировки Th0-лимфоцитов и клональной экспансии Th-активированных и Th1-лимфоцитов лежит в основе формирования Т-клеточной и туберкулиновой анергии и, как следствие, ВИН у больных ТБ [6, 7]. «Репертуар» регуляторных Т-клеток весьма разнообразен, однако конкретные механизмы, с помощью которых они реализуют свои иммуносупрессорные потенции, остаются неустановленными. Между тем известно, что Т-лимфоциты с иммунофенотипом CD4+CD25+, содержащие внутриклеточный транскрипционный фактор Foxp3 (Treg), отличаются от Th1-, Th2-, Th17-, Th9-, Th22-, TFH-, Th-активированных клеток по спектру секретируемых цитокинов и способны супрессировать функции всех перечисленных клонов Т-хелперов [3, 8]. Конверсия, индукция Treg и реализация ими супрессорных свойств опосредуются преимущественно иммунорегуляторными цитокинами - интерлейкином (IL) 2, IL-4, IL-10, трансформирующим фактором роста (TGF) β. Допускается также возможность прямого контактного взаимодействия Treg с клеткой-мишенью, влияние Treg на апоптоз и пролиферацию лимфоцитов [9, 10].
В иммунопатогенезе ТБ тесно взаимосвязаны механизмы врожденного и адаптивного иммунитета, посредниками которых считаются, в том числе, γδТ-клетки [11, 12]. Они играют решающую роль не только в реализации ответа «первой линии защиты» на патоген, но и выполняют регуляторные функции. В структуре цитокинов, секретируемых регуляторными Т-клетками, наиболее широким спектром супрессорного воздействия обладают TGFβ, IL-10 и IL-4 [13]. Кроме того, высказывается предположение о связи генетически детерминированной гипер- или гипопродукции цитокинов-супрессоров с качеством иммунного ответа, тяжестью и продолжительностью инфекционных заболеваний [14, 15].
В связи с изложенным, комплексное изучение этиопатогенетических факторов иммунопатологических изменений и анализ причинно-следственных взаимосвязей между ними при туберкулезной инфекции является актуальным и может служить основой для разработки новых подходов к диагностике и персонифицированной коррекции ВИН у впервые выявленных больных с распространенными деструктивными формами ТБ.
Известен способ прогнозирования течения ТБ. Данный вариант прогнозирования течения ТБ основан на выделении L-форм микобактерий из мокроты пациентов, страдающих ТБ, и определении у возбудителей заболевания антилизоцимной активности [16]. В том случае, если параметр антилизоцимной активности оказывался равным или больше 4 мкг/мл, можно с полной уверенностью прогнозировать обострение течения ТБ. Одним из важнейших недостатков этого метода является сложность исполнения и опасность заражения сотрудников лаборатории, т.к. для данного метода необходимо выделять L-формы микобактерий. Кроме того, в данной модели анализируется прогноз течения основного заболевания, а не формирования сопутствующей ВИН.
Известен способ прогнозирования возможных вариантов иммунокорригирующей терапии вторичных иммунодефицитных состояний, который имеет достаточно широкое применение во многих областях медицины, таких как терапия, педиатрия, фтизиатрия, хирургия и иммунология. Изобретение основывается на контроле параметров иммунного статуса и отличается от остальных патентов тем, что на каждом этапе иммунокорригирующей терапии происходит восстановление наиболее поврежденного звена иммунной системы, после чего вновь производят исследование параметров иммунного статуса с последовательным подбором препаратов иммунокорригирующей терапии, направленных на восстановление вновь обнаруженных нарушений в соответствующих звеньях иммунной системы [17]. Несмотря на свою информативность, данное изобретение достаточно сложно в исполнении и не позволяет выявлять нарушения иммунного ответа на молекулярно-генетическом уровне.
Известен способ диагностики вторичного иммунодефицита, который включает в себя исследование периферической крови, в которой определяют формулу дисбаланса в иммунной системе путем выбора трех наиболее отличающихся от нормы показателей. Отбор осуществляют с помощью критерия диагностической значимости из количества Т-, В-лимфоцитов и иммуноглобулинов (Ig) классов A, G, М по направлению динамики их изменений. При разработке данного метода диагностики ВИН было обследовано 1304 человека с 33 различными патологиями, у которых выявляли три параметра, наиболее значимо отличающихся от контрольных значений и указывающих на то, в какую сторону изменялись иммунологические показатели, имеющие характерную особенность для каждой из патологий. Диагностику осуществляют для конкретной патологии по таблице. Способ обеспечивает повышение точности и сокращение времени диагностики вторичного иммунодефицита [18]. Однако данный способ диагностики ВИН не является специфичным по отношению к ТБ и дает весьма схематичное представление об особенностях дефектов иммунной системы.
Был проводен патентный поиск в зарубежной патентной базе данных Worldwide (www.espacenet.com), который позволил выявить следующие изобретения. В 2009 г. в Калифорнийском университете зарегистрирован способ серологической экспресс-диагностики у млекопитающих активного туберкулезного воспаления легочной и внелегочной локализации, основанный на определении активности микобактериальной глутамин-синтетазы. Глутамин-синтетаза - ферментативный белок с молекулярной массой 53 кДа. Он играет центральную роль в метаболизме азота, катализирует синтез L-глутамина в L-глутамат, аммиак и АТФ. Установлено, что только патогенные микобактерии, такие как М.tuberculosis и М.bovis, высвобождают большие количества глутамин-синтетазы в отличие от непатогенных микобактерий (М.smegmatis и М.phlei). Таким образом, высокий уровень активности в культуральном фильтрате глутамин-синтетазы коррелирует с патогенностью микобактерии. Способ, предложенный авторами изобретения, заключается в определении активности фермента в сыворотке крови пациентов с целью диагностики активного туберкулеза, перехода латентной инфекции в активный процесс, а также для контроля эффективности специфической противотуберкулезной химиотерапии. Высокая активность бактериальной глутамин-синтетазы в сыворотке крови больного через 15 дней после начала лечения свидетельствует о неэффективности используемых препаратов, а значит - о наличии лекарственной устойчивости у инфицирующего штамма М.tuberculosis [19]. В этой модели продемонстрирована оценка эффективности специфической химиотерапии ТБ, в то время как наличие/отсутствие у больных ВИН не анализируется.
Различия в геноме (и, как следствие, в антигенной структуре) между эпидемически значимым штаммом М.tuberculosis и вакцинным штаммом М.bovis были положены в основу способа иммунологической диагностики туберкулеза, предложенного в 2004 г. коллективом авторов из STATENS SERUM INSTITUTE. Установлено, что белковые компоненты, входящие в состав инфицирующих штаммов микобактерий, отличаются от таковых для вакцинного штамма. Использование «коктейля» протеинов микобактериального происхождения (состав и иммуногенная активность компонентов белковой смеси предложены авторами изобретения) значительно (до 93%) повышает чувствительность и специфичность иммунологического метода диагностики туберкулезной инфекции. В частности показано, что добавление в культуральную среду мононуклеаров периферической крови смеси антигенов микобактериального происхождения (ESAT6+CFP10+Rv3 873poolA+Rv2654 14/15) вызывает усиление продукции IFN-γ у больных с активным туберкулезом, и напротив, не оказывает активирующего влияния на цитокин-продуцирующую активность клеток у BCG-вакцинированных лиц [20]. В данной модели исследован генотип возбудителя, который, безусловно, может модулировать течение иммунного ответа на МБТ, но не установлена роль конкретных дефектов иммунной системы.
В ходе проведения патентного поиска не было выявлено источника информации, в котором был описан способа эффективного и информативный способ диагностики ВИН у впервые выявленных больных с распространенным деструктивным ТБ до назначения специфической химиотерапии.
Новая техническая задача - создание точного и информативного способа диагностики ВИН у больных ТБ.
Для решения поставленной задачи в способе диагностики вторичной иммунологической недостаточности у впервые выявленных больных с ТБ до назначения специфической химиотерапии, проводят иммунологическое исследование периферической крови больных ТБ и определяют клеточные, гуморальные и молекулярно-генетические параметры иммунного статуса пациента, определяют количество γδТ-лимфоцитов, CD3+CD4+CD25- Т-хелперов, CD4+CD25+Foxp3- регуляторных Т-клеток/Т-хелперов активированных, CD45R0+ Т-клеток памяти, CD4+CD25+Foxp3+, CD4+CD25-Foxp3+ и CD3+CD4-CD25+ регуляторных Т-клеток, секреция in vitro IL-2, IL-4, IL-10, TGFβ и аллельные варианты генов иммунорегуляторных цитокинов IL2, IL4, IL10, TGFB и при относительном содержании в периферической крови CD4+CD25+Foxp3+ регуляторных Т-клеток более чем 2,6%, CD4+CD25-Foxp3+ регуляторных Т-клеток более чем 5,1%, CD3+CD4-CD25+ регуляторных Т-клеток более чем 0,2%, CD4+CD25+Foxp3- регуляторных Т-клеток/Т-хелперов активированных менее чем 25,5%, CD3+CD4+CD25- Т-хелперов менее чем 35,4%, γδТ-лимфоцитов менее чем 4,9%, CD45R0+ Т-клеток памяти менее чем 8,9%; содержании IL-2 в супернатантах культуральных суспензий мононуклеарных лейкоцитов периферической крови менее чем 22,3 пг/мл, IL-4 - более чем 40,0 пг/мл, IL-10 - более чем 25,3 пг/мл, TGFβ - более чем 1109,0 пг/мл одновременно с носительством «низко продуцирующего» аллеля G и генотипа GG (T-330G) гена IL2 и «высоко продуцирующих» аллеля А и генотипа АА (С-592А) гена IL10, аллеля Т и генотипа ТТ (С-509Т) гена TGFB и аллеля Т и генотипа ТТ (С-590Т) гена IL4 диагностируют вторичную иммунологическую недостаточность.
Способ осуществляют следующим образом:
Производят забор периферической крови из вены, утром, натощак. Материалом исследования служат лимфоциты крови и супернатанты культуральных суспензий мононуклеаров периферической крови больных туберкулезом легких.
До назначения специфической химиотерапии, проводят иммунологическое исследование периферической крови больных ТБ и определяют клеточные, гуморальные и молекулярно-генетические параметры иммунного статуса пациента, определяют количество γδТ-лимфоцитов, CD3+CD4+CD25- Т-хелперов, CD4+CD25+Foxp3- регуляторных Т-клеток/Т-хелперов активированных, CD45R0+ Т-клеток памяти, CD4+CD25+Foxp3+, CD4+CD25-Foxp3+ и CD3+CD4-CD25+ регуляторных Т-клеток, секреция in vitro IL-2, IL-4, IL-10, TGFβ и аллельные варианты генов иммунорегуляторных цитокинов IL2, IL4, IL10, TGFB и при относительном содержании в периферической крови CD4+CD25+Foxp3+ регуляторных Т-клеток более чем 2,6%, CD4+CD25-Foxp3+ регуляторных Т-клеток более чем 5,1%, CD3+CD4-CD25+ регуляторных Т-клеток более чем 0,2%, CD4+CD25+Foxp3- регуляторных Т-клеток/Т-хелперов активированных менее чем 25,5%, CD3+CD4+CD25- Т-хелперов менее чем 35,4%, γδТ-лимфоцитов менее чем 4,9%, CD45R0+ Т-клеток памяти менее чем 8,9%; содержании IL-2 в супернатантах культуральных суспензий мононуклеарных лейкоцитов периферической крови менее чем 22,3 пг/мл, IL-4 - более чем 40,0 пг/мл, IL-10 - более чем 25,3 пг/мл, TGFβ - более чем 1109,0 пг/мл одновременно с носительством «низко продуцирующего» аллеля G и генотипа GG (T-330G) гена IL2 и «высоко продуцирующих» аллеля А и генотипа АА (С-592А) гена IL10, аллеля Т и генотипа ТТ (С-509Т) гена TGFB и аллеля Т и генотипа ТТ (С-590Т) гена IL4 диагностируют вторичную иммунологическую недостаточность.
Для определения поверхностных молекул CD3, CD4, CD25, CD45R0, γδTCR и внутриклеточного маркера иммуносупрессорной активности Foxp3 в лимфоцитах периферической крови применяют метод проточной лазерной трехцветной цитометрии с использованием моноклональных антител (МКАТ), меченных флуоресцентными метками. Процедуру окрашивания поверхностных (CD3, CD4, CD25, CD45R0, γδTCR) и внутриклеточного (Foxp3) маркеров проводили согласно протоколам фирмы производителя («Becton Dickinson (BD)», США).
Порядок выполнения исследования:
Определение количества CD4+CD25+Foxp3- регуляторных Т-клеток/Т-хелперов активированных, CD4+CD25+Foxp3+ и CD4+CD25-Foxp3+ регуляторных Т-клеток в периферической крови
После выделения мононуклеарные лейкоциты дважды отмывали фосфатно-солевым буфером (РН=7,4) и стандартизировали количество клеток в суспензии до 10×106 клеток/мл. Для окрашивания поверхностных маркеров (CD4, CD25) лимфоцитов периферической крови к суспензии мононуклеарных лейкоцитов добавляли по 20 мкл соответствующих специфических МКАТ, меченных флуоресцентными метками: МКАТ к CD4, меченные FITC (кат. №345768), и МКАТ к CD25, меченные РЕ-Су5 (кат. №555433) («Becton Dickinson (BD)», США). Пробы инкубировали 20 мин при комнатной температуре, защищая от света. Для окрашивания внутриклеточного маркера Foxp3 проводили процесс пермеабилизации лимфоцитов. Для этого в каждую пробирку поочередно вносили рабочие растворы стандартных буферов: Human Foxp3 Buffer А и Human FoxP3 Buffer С из набора BD Pharmingen Human Foxp3 Buffer Set (кат. №560098). Буферы разводили согласно прилагаемой инструкции. Лейкоциты инкубировали в течение 30 мин при комнатной температуре в темном месте. Затем клетки дважды отмывали 2 мл фосфатно-солевого буфера (РН=7,4). В ресуспендированный осадок вносили антитела к внутриклеточному маркеру Foxp3, меченные РЕ (кат. №560046), в количестве 20 мкл и инкубировали 30 мин в темноте при комнатной температуре. Затем клетки дважды отмывали 2 мл фосфатно-солевого буфера (РН=7,4), к осадку добавляли 400 мкл фосфатно-солевого буфера, после чего пробы были готовы к измерению. Измерение производили на цитометре FACSCalibur (Becton Dickinson, США), укомплектованном аргоновым лазером с длиной волны 488 нм и стандартными фильтрами. Анализ полученных данных осуществляли при помощи программного приложения BD CellQuest for Mac OS® X.
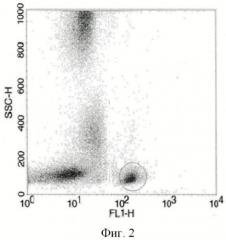
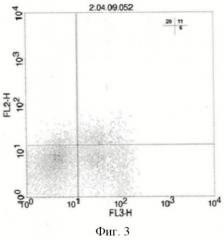
Анализ образцов клеточных суспензий проводили по пяти параметрам: прямому светорассеянию (FSC), характеризующему размер клетки, боковому светорассеянию (SSC), характеризующему цитоплазматические, а также мембранные особенности клетки, и трем показателям флуоресценции - зеленой (FITC - 530 нм), оранжевой (РЕ - 585 нм) и малиновой (Ре-Су5 - 610 нм), выявляемой на FL1-, FL2- и FL3-каналах (Фиг.1-3).
На Фиг.3 в нижнем правом квадранте находятся клетки, экспрессирующие одновременно CD4-, CD25- и не содержащие внутриклеточный маркер Foxp3 (CD4+CD25+Foxp3- регуляторные Т-лимфоциты/Т-хелперы активированные), в верхнем правом квадранте находятся CD4+CD25+Foxp3+ регуляторные Т-клетки, в верхнем левом квадранте - CD4+CD25-Foxp3+ регуляторные Т-клетки.
На графике FSC против SSC выделяли гейт 1 - лимфоциты (Фиг.1). Гейт 1 прикладывали к событиям на графике SSC против FL-1 (CD4-FITC), гейтом 2 очерчивали популяцию клеток, несущих CD4 (Фиг.2). Гейт 2 прикладывали к графику FL-2 (Foxp3-РЕ) против FL-3 (CD25- РЕ-Су5) (Фиг.3). Результаты выражали в процентах.
Определение количества CD3+CD4+CD25- Т-хелперов и CD3+CD4-CD25+ регуляторных Т-клеток в периферической крови
Для определения поверхностных антигенов CD3, CD4 и CD25 на лимфоцитах периферической крови применяли метод лазерной проточной трехцветной цитометрии с использованием МКАТ, меченных флуоресцентными метками. Процедуру окрашивания маркеров CD3, CD4 и CD25 проводили согласно протоколу фирмы производителя («Becton Dickinson (BD)», США).
Ход работы. После выделения моцонуклеарные лейкоциты дважды отмывали фосфатно-солевым буфером (рН=7,4), каждый раз при этом ресуспендируя и центрифугируя в течение 10 мин при 1500 об/мин. Затем надосадочную жидкость сливали, а оставшийся осадок ресуспендировали в фосфатно-солевом буфере и стандартизировали количество клеток в суспензии до 10×106 клеток/мл. Для окрашивания лимфоцитов в цитометрические пробирки вносили по 50 мкл суспензии мононуклеарных лейкоцитов и по 20 мкл конъюгированных МКАТ - CD3 (PerCP-Cy5,5)/CD4 (FITC)/CD25 (РЕ) («Becton Dickinson (BD)», США, кат. №333170), перемешивали на вортексе и инкубировали в течение 15 мин при комнатной температуре в темноте.
Измерение производили на цитометре FACSCalibur (Becton Dickinson, США), укомплектованном аргоновым лазером с длиной волны 488 нм и стандартными фильтрами. Анализ полученных данных осуществляли при помощи программного приложения BD CellQuest for Mac OS® X.
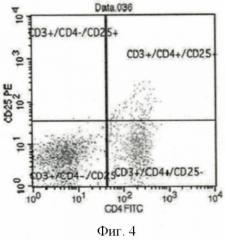
Анализ образцов клеточных суспензий проводили по пяти параметрам: прямому светорассеянию (FSC), характеризующему размер клетки, боковому светорассеянию (SSC), характеризующему цитоплазматические, а также мембранные особенности клетки, и трем показателям флуоресценции - зеленой (FITC - 530 нм), оранжевой (РЕ - 585 нм) и малиновой (PerCP-Су5,5 - 610 нм), выявляемой на FL1-, FL2-, FLS-каналах (Фиг.4).
Для анализа строили два промежуточных графика: FSC против SSC на котором выделяли гейт 1 - лимфоциты. Гейт 1 прикладывали к событиям на втором графике SSC против FL-3 (CD3-PerCP-Су5,5), гейтом 2 очерчивали популяцию лимфоцитов, несущих CD3. Затем гейт 2 прикладывали к графику FL-1 (CD4-FITC) против FL-2 (CD25-PE) (Фиг.4). Результаты выражали в процентах.
На Фиг.4 в левом верхнем квадранте находятся лимфоциты, презентирующие одновременно CD3- и CD25-молекулы и не презентирующие CD4-молекулу. В правом нижнем квадранте находятся лимфоциты с иммунофенотипом CD3+CD4+CD25- (Т-хелперы).
Определение количества CD45R+ лимфоцитов (Т-клетки памяти) и γδTCR+ Т-клеток (γδТ-лимфоцитов) в периферической крови
Для определения в периферической крови лимфоцитов, презентирующих маркеры CD45R0 и γδTCR, применяли метод лазерной проточной трехцветной цитометрии с использованием МКАТ к лимфоцитарным рецепторам Anti-CD45R0, меченных РЕ (кат. №347967) («Becton Dickinson (BD)», США) и МКАТ к лимфоцитарным рецепторам Anti-TCR-γ/δ-1, меченных РЕ (кат. №333141) («Becton Dickinson (BD)», США). Процедуру окрашивания лимфоцитов, несущих CD45R0-молекулу, и лимфоцитов, презентирующих γδTCR, проводили согласно протоколу фирмы производителя («Becton Dickinson (BD)», США).
Ход работы. Процедуры пробоподготовки, окрашивания и измерения проводились аналогично охарактеризованным выше. Анализ образцов клеточных суспензий проводили по трем параметрам: прямому светорассеянию (FSC), характеризующему размер клетки, боковому светорассеянию (SSC), характеризующему цитоплазматические, а также мембранные особенности клетки, и одному показателю флуоресценции - оранжевой (РЕ - 585 нм), выявляемой на FL2-канале (Фиг.5, Фиг.6). Для анализа строили промежуточный график: FSC против SSC, на котором выделяли гейт 1 - лимфоциты. Гейт 1 прикладывали к событиям на графике SSC против FL-2 (Anti-CD45R0-PE) (Фиг.5, Фиг.6). На Фиг.5 и Фиг.6 в нижних правых квадрантах находятся лимфоциты, презентирующие CD45R0-молекулу (Т-клетки памяти) и γδTCR (γδT-лимфоциты). Результаты выражали в процентах.
Определение содержания иммунорегуляторных цитокинов в супернатантах культуральных суспензий мононуклеарных лейкоцитов периферической крови in vitro
Выделение мононуклеарных лейкоцитов из цельной крови. Венозную гепаринизированную кровь (25 ЕД/мл) выдерживали при 37°С в течение 30 мин для отделения плазмы от эритроцитов. Полученную плазму наслаивали на градиент плотности фиколл-урографин (ρ=1077 г/см3) («МР Biomedical, LLC», США) в соотношении 1:2 и центрифугировали при 1500 об/мин в течение 20 мин. Образовавшееся интерфазное кольцо из смеси мононуклеарных клеток собирали пипеткой, трижды отмывали средой RPMI-1640 (ФГУН ГНЦ ВБ «Вектор», Россия), дополненной 100 мкг/мл гентамицина и 5%-й инактивированной эмбриональной телячьей сывороткой (ООО «БиолоТ», Россия), последовательно ресуспендируя и центрифугируя каждый раз в течение 10 мин при 1500 об/мин. При использовании градиента указанной плотности 90-95% от всех выделенных мононуклеаров составляли лимфоциты.
Приготовление супернатантов. Для получения супернатантов выделенные мононуклеарные лейкоциты ресуспендировали в полной питательной среде, состоящей из 90% RPMI-1640 (ФГУН ГНЦ ВБ «Вектор», Россия), 10% инактивированной эмбриональной телячьей сыворотки (ООО «БиолоТ», Россия), 0,3 мг/мл L-глутамина, 100 мкг/мл гентамицина. Стандартизировали количество клеток в суспензии до 2,5×106/мл. Для индукции секреторной функции мононуклеарных лейкоцитов в пробы вносили вакцинный штамм BCG в дозе 50 мкг/мл. В контрольные пробы вносили полную питательную среду. Клеточные суспензии в количестве 1 мл инкубировали при 37°С и 5% СО2 в течение 24 ч. После инкубации пробирки встряхивали, центрифугировали 10 мин при 1500 об/мин. Супернатанты собирали и использовали для количественного определения цитокинов. Клетки осадка исследовали на жизнеспособность. Для этого 0,1 мл суспензии смешивали с равным объемом 0,5% трипанового синего («Serva» США) и заполняли счетную камеру Горяева. Жизнеспособность мононуклеарных лейкоцитов оценивали, вычитая число «мертвых» клеток, окрашенных в синий цвет.
Иммуноферментный анализ для количественного определения содержания цитокинов. Для определения содержания IL-2, IL-4, IL-10 и TGFβ в супернатантах культуральных суспензий использовали твердофазный иммуноферментный «сэндвичевый» метод (ELISA). Процедуру ИФА проводили по инструкциям, предлагаемым отечественными (ЗАО «Вектор-Бест», ООО «Протеиновый контур») и зарубежными («Bender Medsystems» (США), «ВСМ Diagnostics» (США)) производителями тест-систем. Оптическую плотность содержимого ячеек планшета регистрировали на фотометре Multiscan EX (Финляндия) при длине волны 450 нм. Концентрацию цитокинов вычисляли по калибровочной кривой. Результаты выражали в пг/мл.
Исследование полиморфизма генов цитокинов
Выделение ДНК. Выделение ДНК из периферической крови проводили согласно инструкции, прилагаемой к набору «ДНК-сорб-В» («ИнтерЛабСервис», Россия).
Принцип метода. ДНК сорбируется на сорбент, затем отмывается буферным раствором и сорбент удаляется. Полученная ДНК используется для дальнейших определений.
Ход работы. Перед началом работы лизирующий раствор и раствор для отмывки 1 прогревали при 65°С до полного растворения кристаллов. Отбирали необходимое количество одноразовых пробирок. Вносили в каждую пробирку по 300 мкл лизирующего раствора и по 100 мкл венозной крови. Пробы тщательно перемешивали на вортексе. Тщательно ресуспендировали сорбент на вортексе и добавляли в каждую пробирку отдельным наконечником по 25 мкл ресуспендированного сорбента. Пробы перемешивали на вортексе, ставили в штатив на 2 мин, затем еще раз перемешивали и оставляли в штативе на 5 мин. Осаждали сорбент в пробирках центрифугированием при 5000 об/мин в течение 30 с. Удаляли супернатант в колбу-ловушку, используя вакуумный отсасыватель и отдельный наконечник для каждой пробы.
Добавляли в пробы по 300 мкл раствора для отмывки 1 и перемешивали на вортексе до полного ресуспендирования сорбента. Осаждали сорбент центрифугированием при 5000 об/мин на микроцентрифуге в течение 30 с. Удаляли супернатант вакуумным отсасывателем и отдельным наконечником для каждой пробы. Далее в пробы вносили по 500 мкл раствора для отмывки 2, перемешивали до полного ресуспендирования сорбента, центрифугировали 30 с при 10000 об/мин, отбирали супернатант вакуумным отсасывателем и отдельным наконечником для каждой пробы (процедуру отмывки повторяли дважды). Пробирки с открытыми крышками помещали в термостат 65°С на 5-10 мин для подсушивания сорбента. После этого в пробирки добавляли по 50 мкл ТЕ-буфера для элюции ДНК, перемешивали на вортексе и ставили в термостат 65°С на 5 мин, периодически встряхивая на вортексе. Центрифугировали пробирки на микроцентрифуге при 12 (100 об/мин в течение 1 мин. Полученный супернатант содержал очищенную ДНК.
Исследование полиморфизма генов цитокинов
Исследование полиморфных участков генов цитокинов проводили с использованием аллельспецифичной амплификации специфических участков генома [21].
Принцип метода. Исследуемые аллельные варианты генов относятся к SNP-полиморфизмам, т.е. характеризуются заменой одного нуклеотида. Для детекции используется аллельспецифичная полимеразная цепная реакция (ПЦР). По наличию или отсутствию продукта амплификации делают заключение о характере полиморфизма.
Ход работы. Амплификацию осуществляли согласно инструкции, прилагаемой к набору «АмплиСенс-200-1» («ИнтерЛабСервис», Россия), в пробирках типа «Эппендорф» путем ПЦР, используя структуру праймеров и параметры температурных циклов, описанных в литературе, с применением амплификатора «Терцик МС2» («ДНК-технология», Россия).
Было исследовано четыре полиморфных варианта генов четырех цитокинов: T-330G гена IL2 (rs2069762), C-590T гена IL4 (rs2243250), C-592A гена IL10 (rs1800872), C-509T гена TGFB (rs1800469). Все изученные полиморфизмы локализованы в промоторных участках соответствующих генов.
Общая реакционная смесь для амплификации объемом 25 мкл содержала: «нижнюю» смесь, состоящую из смеси праймеров («Синтол», Россия) и смеси дезоксинуклеотидтрифосфатов, 2 мМ (dNTP-mix) в равных частях в отдельных пробирках на каждую пару праймеров; «верхнюю» смесь в конечной концентрации Mg2+ 2, 5, 10 мкл ПЦР-буфера, 2,5 мкл 50 мМ MgSO4, 6,5 мкл Н2О и 1,0 мкл Tag-полимеразы (из расчета на одну пробирку). Раскапывали в микропробирки для ПЦР по 5 мкл «нижней» смеси и по 10 мкл «верхней» смеси. Сверху капали по 1 капле масла для ПЦР. Вносили сверху на масло по 10 мкл исследуемой ДНК. Программа амплификации включала в себя предварительную денатурацию при 96°С в течение 1 мин, с последующими 10 циклами, каждый из которых состоял из денатурации при 96°С (15 с), отжига при специфической для каждой пары праймеров при температуре 92°С (50 с), элонгации цепи при 72°С (40 с). Затем следовали 20 циклов, состоящих из денатурации при 96°С (10 с), отжига при 60°С (50 с) и элонгации при 72°С (40 с). Программу завершала финальная элонгация при 72°С в течение 1 мин. Анализ продуктов амплификации проводили разделением фрагментов ДНК в 2% агарозном геле: 2 г агарозы смешивали с 2 мл 50×трис-ацетатного (ТАЕ) буфера (242 г трисаминометана, 37,2 г ЭДТА, 57,1 мл ледяной уксусной кислоты довести до 1 л H2O, рН 8,0) и нагревали в микроволновой печи до полного расплавления агарозы. Охлаждали раствор до 50-60°С и заливали в камеру для электрофореза, в которой предварительно устанавливали гребенку для формирования лунок. Для формирования геля оставляли его на 20-30 мин, затем камеру заполняли 1×TAE буфером (10 мл 50×ТАЕ буфера, 490 мл H2O) так, чтобы он слегка покрывал гель, и убирали гребенку. После проведения ПЦР 5 мкл амплификата разделяли в агарозном геле, содержащем 0,5 мг/мл этидиум бромида, при напряжении 150 B в течение нескольких минут для последующей визуализации в УФ-свете, подтверждающей наличие продукта амплификации. В качестве маркера размера ДНК использовали плазмиду pUC19, расщепленную рестриктазой MspI («Сибэнзим», Россия).
Критерии предлагаемого способа диагностики ВИН у больных ТБ подобраны на основании анализа данных углубленного клинико-иммунологического обследования 338 больных с впервые выявленным распространенным деструктивным ТБ до назначения специфической химиотерапии и 118 условно здоровых добровольцев, соответствующих следующим критериям. Критерием включения в исследование было наличие у впервые выявленных больных инфильтративного, диссеминированного и фиброзно-кавернозного ТБ. В исследование не включались: больные, не желающие принимать участие в исследовании, больные, получавшие на момент исследования терапию противотуберкулезными, нестероидными противовоспалительными препаратами и глюкокортикостероидами; больные с тяжелыми сопутствующими заболеваниями (онкопатология, сахарный диабет, бронхиальная астма); больные с иммунозависимыми, в том числе аутоиммунными и аллергическими заболеваниями, инфицированные вирусами гепатита и ВИЧ; больные, которым применялась иммунотерапия. Включенные в исследование здоровые добровольцы были сопоставимы с больными ТБ по полу и возрасту, не имели в анамнезе хронических соматических (в том числе аутоиммунных) заболеваний и аллергических реакций.
После применения вышеуказанных критериев были сформированы три клинические группы больных с различными клиническими формами ТБ. Клиническую форму заболевания устанавливали на основании данных рентгенологического исследования легких. У всех обследованных пациентов отмечался распространенный (более 4 сегментов) деструктивный характер поражения легочной ткани с вовлечением в патологический процесс преимущественно обоих легких.
Инфильтративный туберкулез легких (ИТБ) был диагностирован у 209 пациентов и характеризовался на рентгенограмме наличием одной или нескольких неоднородных теней туберкулезного инфильтрата диаметром от 5 до 7 см с очагами распада и обсеменения.
Диссеминированный туберкулез (ДТБ) был выявлен у 89 больных, рентгенологическим признаком которого являлось наличие в одном или обоих легких мелких и средне очаговых изменений неоднородной структуры за счет инфильтрации и распада.
Диагноз фиброзно-кавернозного туберкулеза легких (ФКТБ) был выставлен 40 больным и характеризовался на рентгенограмме наличием нескольких кольцевидных теней более 2 см в диаметре чаще в субплевральных отделах, а также выраженным пневмофиброзом.
Возбудитель туберкулеза выявляли методом прямой световой микроскопии мазка мокроты, окрашенного по Цилю-Нильсену, а также методом люминесцентной микроскопии с использованием флуорохромов (аурамина). Бактериовыделение регистрировалось в 100% случаев заболевания. Для видовой идентификации микобактерий туберкулеза (МБТ) производили посев мокроты на плотные питательные среды Левенштейна-Йенсена и Финн-2.
Всем больным для установления наличия/отсутствия ВИН проводилось комплексное исследование параметров клеточного и гуморального иммунитета, а также иммуногенетического исследование.
Анализ первичных данных проводили с применением методов статистического описания и проверки статистических гипотез. Все количественные показатели проверяли на нормальность распределения с использованием критерия Шапиро-Уилка. Для нормально распределенных выборок вычисляли средневыборочные характеристики: среднее арифметическое (X), среднее квадратичное отклонение (σ), ошибку среднего (m). Для выборок, распределение которых отличалось от нормального, рассчитывали медиану (М), первый и третий квартили (Q1, Q3). Для показателей, характеризующих качественные признаки, указывалось абсолютное число (n) и относительная частота встречаемости (%). При соответствии признака в исследуемых выборках нормальному закону распределения проверку гипотезы о равенстве средних выборочных величин проводили с использованием однофакторного дисперсионного анализа.
Для оценки достоверности различий числовых характеристик выборок, не подчиняющихся нормальному распределению, использовали критерий Краскала-Уоллиса.
Для попарного сравнения показателей в исследуемых группах применяли критерий Манна-Уитни (для независимых групп) и критерий Вилкоксона (для зависимых групп). Различие показателей в сравниваемых группах считали статистически значимым при уровне значимости р≤0,05. Распределение генотипов по исследуемым полиморфным локусам проверяли на соответствие равновесию Харди-Вайнберга с помощью точного теста Фишера. Для сравнения частот аллелей между различными группами использовали критерий χ2 Пирсона с поправкой Йетса.
Показатели клеточного иммунитета у больных ТБ и здоровых добровольцев, установленные в ходе проведенного исследования, суммированы в таблице 1. Представленные результаты свидетельствуют о выраженном дисбалансе в структуре субпопуляций регуляторных и эффекторных Т-лимфоцитов у больных ТБ. Продемонстрировано увеличение численности Foxp3-позитивных регуляторных Т-клеток с супрессорной активностью и CD3+CD4-CD25+ регуляторных Т-лимфоцитов на фоне снижения числа CD4+CD25+Foxp3- регуляторных Т-клеток/Т-хелперов активированных, CD3+CD4+CD25- Т-хелперов, γδТ-лимфоцитов и CD45R0+ Т-клеток памяти у больных ТБ по сравнению с аналогичными показателями у здоровых добровольцев. Отметим, что указанные изменения наиболее выражены и случаях ДТБ и ФКТБ, которые всегда менее благоприятны с точки зрения как клинического течения заболевания, так и эффективности протективного иммунного ответа. Таким образом, у больных ТБ отмечается дисрегуляция клеточного звена иммунной системы с преобладанием числа субпопуляций Т-лимфоцитов, выполняющих супрессорные функции, что свидетельствует о неэффективности клеточных реакций и иммунологической недостаточности.
В таблице 2 представлены данные, характеризующие особенности цитокинопродукции in vitro у больных ТБ. В целом, полученные результаты позволяют сделать вывод, что при туберкулезной инфекции дисбаланс цитокинопродукции связан с дефицитом секреции IL-2 («фактора роста» Т-клеток) на фоне гиперсекреции противовоспалительных цитокинов с иммуносупрессорной активностью: IL-4, IL-10 и TGFβ. При этом данные изменения являются однонаправленными, как в случае базальной секреции цитокинов, так и при индукции клеточных культур вакцинным штаммом BCG. Это позволяет сделать вывод, что помимо увеличения количества клеток-супрессоров иммунного ответа у больных ТБ значительно повышена и их функциональная активность, поскольку регуляторные Т-клетки реализуют свои иммуносупрессорные эффекты преимущественно за счет продукции цитокинов-ингибиторов и, возможно, секвестрации IL-2 путем его связывания посредством рецептора к IL-2 (молекулы CD25) на поверхности клеток [3].
В ходе исследований нас интересовал также вопрос о предрасположенности обследованных нами больных ТБ к формированию иммунологической недостаточности осложняющей течение туберкулезной инфекции. Для решения этой задачи было проведено исследование полиморфных скитов генов цитокинов (T-330G гена IL2 (rs2069762), С-590Т гена IL4 (rs2243250), C-592A гена IL10 (rs1800872), С-509Т гена TGFB (rs1800469)) и проанализировали взаимосвязь аллельного полиморфизма иммунорегуляторных генов с цитокинопродукцией in vitro. В таблицах 3 и 4 суммированы данные, полученные в ходе исследования особенностей функционального полиморфизма генов цитокинов. Установлено, что у больных ТБ как базальная, так и BCG-индуцированная гипосекреция IL-2 и гиперсекреция IL-4, IL-10 и TGFβ обусловлены носительством «низко продуцирующего» аллеля G и генотипа GG (T-330G) гена IL2 и «высоко продуцирующих» аллеля A и генотипа AA (С-592А) гена IL10, аллеля Т и генотипа ТТ (С-509Т) гена TGFB и аллеля Т и генотипа ТТ (С-590Т) гена IL4. Таким образом, у пациентов с ТБ иммунологическая недостаточность является в том числе детерминированной носительством полиморфных вариантов иммунорегуляторных генов IL2, IL4, IL10 и TGFB, так как избыток цитокинов с супрессорной активностью, несомненно, приводит к индукции, конверсии и генерации на периферии регуляторных Т-клеток, а недостаток IL-2 способствует угнетению клональной экспансии эффекторных Т-хелперов.