Способ диагностики уролитиаза
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к урологии и нефрологии, и может быть использовано для диагностики мочекаменной болезни (уролитиаза). Сущность способа: исходную пробу мочи разделяют на два одинаковых образца, получают гистограммы распределения частиц по размерам, по которой определяют процентное содержание олигомерной формы Т&НЕ(7) белка Тамма-Хорсфалла и сравнивают гистограммы образцов. В качестве реагента для идентификации белка Тамма-Хорсфалла используют моноклональные антитела, вступающие с белком Тамма-Хорсфалла в имунно-афинную реакцию. Из второго образца извлекают белок Тамма-Хорсфалла Т&НЕ(28) и в обоих образцах мочи определяют содержание олигомерной формы Т&НЕ(28) белка Тамма-Хорсфалла в свободном состоянии и в агрегатах с микрокристаллами оксалатов (в %). Затем рассчитывают соотношение выявленных олигомерных форм по формулам: С1=Т&НЕ(28)А/Т&НЕ(7) и C2=T&HE(28)F/T&HE(7). При соотношении С1>1.5 и любом значении соотношения С2 диагностируют уролитиаз, при соотношениях С1<0.1 и С2<1.81 диагностируют отсутствие заболевания, а при соотношениях С<1,5 и С2>1.81 пациента относят к группе риска развития уролитиаза. Способ позволяет проводить разграничение обследуемых не только на группы больных уролитиазом и здоровых, но и выделить группу риска развития уролитиаза. Способ обладает высокой точностью, специфичностью и чувствительностью, не требует больших трудозатрат и времени исследования. 3 ил., 4 табл.
Реферат
Изобретение относится к медицине, а именно к урологии и нефрологии, и может быть использовано для диагностики мочекаменной болезни (уролитиаза).
В настоящее время известны различные клинико-лабораторные и инструментальные методы диагностики уролитиаза. Среди лабораторных методов, основанных на структурных исследованиях мочи, наиболее информативные связаны с исследованиями в моче наличия и свойств белка Тамма-Хорсфалла (БТХ). БТХ выделяется клетками почечных канальцев и является основным мочевым белком. Биологическая роль БТХ чрезвычайно разнообразна: будучи основным экскретируемым белком, он выполняет функции защиты от инфекций и стабилизирует солевую среду мочи, повышая в ней порог растворимости солей, и этим препятствуя их первичной кристаллизации.
Известен способ диагностики уролитиаза, основанный на определении количества БТХ в моче методом иммуноферментного анализа (ИФА) [Wai-Ное Lau, Wing-Seng Leong, Zhari Ismail, and Lay-Harn Gam Qualification and application of an ELISA for the determination of Tamm Horsfall Protein (THP) in human urine and its use for screening of Kidney Stone Disease. // Int. J. Biol. Sci. 2008, 4, pp.215-222]. В данном способе для выделения БТХ выполняют ряд преаналитических процедур по подготовке калибровочных образцов БТХ, стандартных образцов БТХ, а также образцов мочи с использованием их предварительного замораживания-оттаивания и лизирующих компонентов TEA буфера (Triton Х-100). Далее все указанные образцы соединяют и многократно инкубируют с различными индикаторными растворами, после чего определяют оптическую плотность образцов при двух длинах волн света 450 нм и 620 нм. По результатам измерения калибровочных образцов БТХ строят калибровочную кривую зависимости оптической плотности от концентрации БТХ и по этой кривой определяют концентрацию БТХ в образцах мочи и среднеквадратическую ошибку (СКО) способа по результатам измерения стандартных образцов БТХ. Диагноз уролитиаз устанавливают, если концентрация БТХ превышает 37 мг/мл у мужчин и 42 мг/мл у женщин.
Выполнение способа требует проведения большого числа сложных преаналитических процедур, а также использования большого числа разнообразных и дорогостоящих реагентов. В свою очередь, невозможность достижения полного распада оксалатных микрокристаллов и выхода БТХ в раствор, приводит к ошибкам определения концентрации БТХ. Кроме того, из-за большого числа этапов при реализации способа происходит накопление ошибок и увеличение суммарной ошибки, что, снижает его диагностическую точность.
Известен способ диагностики уролитиаза, включающий определение количества БТХ в моче методом денатурирующего электрофореза в полиакриламидном геле (ПААГ) [Wai-Hoe Lau, Wing-Seng Leong, Zhari Ismail, and Lay-Harn Gam SDS-PAGE-Based Quantitative Assay for Screening of Kidney Stone Disease // Biol Proced Online. 2009 May 15; 11:145-160]. В данном способе для определения концентрации БТХ выполняют ряд преаналитических процедур по приготовлению стандартных и калибрровочных образцов БТХ, а также образцов мочи с выполнением их предварительного замораживания-оттаивания и последующего нагревания с применением буферных растворов. Далее все указанные образцы соединяют, наносят в лунки пластины акриламидного геля и проводят электрофорез полученной смеси, после чего пластину геля сканируют и определяют концентрацию БТХ. По результатам измерения калибровочных образцов БТХ строят калибровочную кривую зависимости оптической плотности от концентрации БТХ и по этой кривой определяют концентрацию БТХ в образцах мочи и СКО способа по результатам измерения стандартного образцов БТХ. Диагноз уролитиаз устанавливают, если концентрация БТХ в образцах, выделенных из мочи пациентов ниже 5.6 мкг/мл.
Выполнение способа, как и описанного выше, требует применения большого числа сложных преаналитических процедур, применение которых нарушает межмолекулярные взаимодействия в процессе проведении исследований, что приводит к искажению истинных характеристик и, следовательно, снижению точности таких способов. Во-первых, возможна потеря части БТХ при процедурах переосаждения, во-вторых, при проведении процедуры электрофореза возможно снижение точности определения концентрации БТХ из-за неравномерности электрического поля в геле, в-третьих, снижение точности и достоверности способа возникает из-за сложности идентификации БТХ вследствие наличия в моче других белков. Способ также требует использования большого числа разнообразных и дорогостоящих реагентов.
Наиболее близким к заявленному изобретению является способ диагностики уролитиаза [Ланда СБ. и др «Клинико-лабораторный консилиум» 2008 г. N6 (25) с.33-38], основанный на выявлении в нативной моче олигомерной формы БТХ, имеющей молекулярный вес (MB) 7 МДа и представляющей собой гибкую нить диаметром 4-5 нм и длиной 600 нм с гидродинамическим радиусом (Rh) около 100 нм, обозначенной Т&НЕ(7) в работе Maxfield М. Fractionation of the urinary mucoprotein of Tamm and Horsfall // Arch. Biochem. 1960, 89, где в скобках приведена цифра, соответствующая молекулярной массе конкретной олигомерной формы БТХ, в данном случае - 7 МДа. Пробу мочи разделяют на два одинаковых образца. Первый образец оставляют без изменения, а ко второму добавляют такое количество NaCl, чтобы его конечная концентрация в образце составляла 0.6М, обеспечивающего последующую седиментацию БТХ. Оба образца инкубируют в течение 24 часов при 4°C и затем центрифугируют в течение 30 мин при ускорении 10000 g. На установке динамического светорассеяния получают гистограммы распределения частиц, присутствующих в первом и втором образах, по размерам. Поскольку NaCl полимеризует Т&НЕ(7) в макромолекулярные формы, осаждаемые центрифугированием, сравнение гистограмм распределения частиц позволяет выявить в первом образце пик частиц с Rh около 100 нм, соответствующий Т&НЕ(7). Уролитиаз диагностируют при отсутствии пика частиц с Rh около 100 нм, как в первом, так и во втором образцах. При наличии в первом образце пика частиц с Rh около 100 нм и отсутствии его во втором образце, диагностируют отсутствие уролитиаза. В данном способе высокочувствительный биофизический метод динамического светорассеивания обладает наибольшей чувствительностью при выявлении следовых количеств белковых тел в нативной моче по сравнению с описанными выше аналогами.
Однако известный способ обладает рядом недостатков. Во-первых, представляется сложным провести точную идентификацию на гистограмме полидисперсного образца, каким является моча, пика, соответствующего форме Т&НЕ(7). Во-вторых, возможно присутствие в моче частиц с Rh близким к 100 нм, не являющихся БТХ. Поэтому для достижения определенной стабильности результатов приходится проводить многократные измерения одного и того же образца и далее усреднять полученные результаты. Влияние вышеуказанных факторов снижает эффективность выявления всей массы БТХ, присутствующей в пробе мочи. Необходимость многократного проведения измерений для усреднения получаемых результатов и предварительное инкубирование образцов в течение 24 часов усложняет исследование и увеличивает его длительность.
Технический результат, достигаемый изобретением, заключается в повышении/точности, специфичности и упрощении способа диагностики уролитиаза.
Заявленный технический результат достигается в способе диагностики уролитиаза, включающем разделение исходной пробы мочи на два одинаковых образца, извлечение белка Тамма-Хорсфалла во втором образце при помощи реагента для идентификации белка Тамма-Хорсфалла, получение методом динамического светорассеяния гистограмм распределения частиц по размерам в обоих образцах и определение процентного содержания олигомерной формы Т&НЕ(7) белка Тамма-Хорсфалла по гистограмме распределения частиц по размерам в образце цельной мочи сравнением с гистограммой второго образца, в котором в качестве реагента для идентификации белка Тамма-Хорсфалла используют моноклональные антитела, вступающие с белком Тамма-Хорсфалла в имунно-афинную реакцию, дополнительно из второго образца извлекают белок Тамма-Хорсфалла Т&НЕ(28) и в обоих образцах мочи определяют процентное содержание олигомерной формы Т&НЕ(28) в свободном состоянии и в агрегатах с микрокристаллами оксалатов, определяют соотношение содержания выявленных олигомерных форм по формулам:
С1=Т&НЕ(28)А/Т&НЕ(7)
C2=T&HE(28)F/T&HE(7),
где - T&HE(28)F - содержание олигомерной формы Т&НЕ(28) белка Тамма-Хорсфалла в свободном состоянии (в %);
- Т&НЕ(28)А - содержание олигомерной формы белка Тамма-Хорсфалла в агрегатах с микрокристаллами оксалатов (в %), и при соотношении С1>1.5 и любом значении соотношения С2 диагностируют уролитиаз, при соотношениях C1<0.1 и С2<1.81 диагностируют отсутствие заболевания, а при соотношениях С1<1,5 и С2>1.81 пациента относят к группе риска развития уролитиаза.
Известно, что БТХ в различных условиях может существовать как минимум в четырех олигомерных формах, среди которых наиболее значимы две: Т&НЕ(7) и Т&НЕ(28) с молекулярной массой 28 МДа, состоящей из 4 нитей Т&НЕ(7) обеспечивающих высокую жесткость макромолекулы Т&НЕ(28) [Maxfield М. Fractionation of the urinary mucoprotein of Tamm and Horsfall // Arch. Biochem. 1960, 89, 281-285].
При этом Olivkr С.J., Pikk R.R. & el. [Olivkr C.J., Pikk R.R, Cleave A.J, Peacocke A.R. Determination of the Diffusion Coefficient and Molecular Weight of Tamm-Horsfall Glycoprotein by Intensity Fluctuation Spectroscopy // BIOPOLYMERS, VOL.10 (1971) N9 pp 1731-1733] определили, что размер (Rh) формы T&HE(7) составляет около 100 нм.
Были проведены исследования в группе пациентов из 51 человека с верифицированным диагнозом уролитиаз и группе из 57 здоровых людей без уролитиаза, сопоставимых по возрасту и полу.
В результате исследования было обнаружено, что у здоровых людей, при низкой концентрации солей в моче, БТХ существует в виде формы Т&НЕ(7). При повышении концентрации солей (т.е. ионной силы) в моче происходит обратимый переход Т&НЕ(7)→Т&НЕ(28), а при уменьшении концентрации соли происходит обратный переход Т&НЕ(28)→Т&НЕ(7). При этом за счет повышенной жесткости форма Т&НЕ(28) существует в растворе в виде микрофибрил, которые образуют коллоидные структуры типа микрогеля, препятствующие агрегации кристаллов оксалатов.
При уролитиазе изначально значительная часть БТХ исходно находится в виде формы Т&НЕ(28). При этом увеличение концентрации катионов выше физиологического уровня приводит к экранированию анионного заряда БТХ и агрегации данной формы с микрокристаллами оксалатов кальция. При взаимодействии мицелл Т&НЕ(28) с микрокристаллами оксалатов кальция образуются нерастворимые агрегаты. Образовавшиеся агрегаты Т&НЕ(28) с микрокристаллами - Т&НЕ(28)А, являются зародышами мочевых конкрементов (центрами кристаллизации).
В ходе исследований методом динамического светорассеивания было выявлено, что форма T&HE(28)F имеет Rh порядка 370÷500 нм и форма БТХ в агрегатном состоянии с микрокристаллами мочевых солей Т&НЕ(28)А имеет Rh от примерно 1500 нм и более. Это позволяет определить диапазон размеров на гистограмме распределения, по которой идентифицируется та или иная олигомерная форма БТХ.
Было установлено, что у здорового человека основной вклад в рассеяние вносит форма Т&НЕ(7), тогда как у пациента из группы риска и больных уролитиазом основной вклад в рассеяние вносит форма Т&НЕ(28) в свободном состоянии, и кроме того, у больного уролитиазом - форма Т&НЕ(28) в виде агрегатов с оксалатами.
Таким образом, из установления указанных фактов следует, что идентифицировав в моче формы Т&НЕ(7) и Т&НЕ(28), и определив, связана ли форма Т&НЕ(28) с микрокристаллами мочевых солей, становится возможным установить патогенетические признаки уролитиаза. При этом количественное соотношение T&HE(28)F и Т&НЕ(7), а также количественное соотношение Т&НЕ(28)А и Т&НЕ(7), служит критерием для диагностики уролитиаза.
При определении диагностических критериев уролитиаза использовались общепринятые принципы оценки доказательной информативности, приведенные, например, в работе В.В. Власова Введение в доказательную медицину. // Изд. Медиа Сфера. - 2000. - 245 с.
Были исследованы распределения коэффициентов С1 и С2 в референтных группах здоровых и больных уролитиазом.
Анализ показал, что графики распределения коэффициента С1 практически не пересекаются. Если для здоровых людей С1 практически всегда <0.1, то для больных уролитиазом он >1.50. Поэтому значение решающего порога коэффициента С1 был выбиран равным 1.50.
Выбор величины решающего порога коэффициента С2 в месте пересечения графиков распределений референтных групп показал при удовлетворительной эффективности (92.6%) и абсолютной диагностической чувствительности относительно низкую диагностическую специфичность. Уменьшение решающего порога до величины, когда специфичность достигала 100%, позволило увеличить диагностическую эффективность до 99,07%. Незначительное уменьшение величины диагностической чувствительности до 98.07% является приемлемым. Таким образом величина решающего порога для коэффициента С2 была принята равной 1.81.
В таблице 1 представлены расчетные данные для решающего порога коэффициента С1=1.50 и решающего порога коэффициента С2=1.81.
| Таблица 1 | ||
| Параметр | Абс. величина | |
| Решающий порог коэффициента | С1=1.50 | С2=1.81 |
| Выборка | 108 | 108 |
| Уролитиаз | 51 | 51 |
| Здоровые | 57 | 57 |
| Истинно положительные результаты | 51 | 51 |
| Истинно отрицательные результаты | 57 | 56 |
| Ложноположительные результаты | 0 | 0 |
| Ложноотрицательные результаты | 0 | 1 |
| Диагностическая эффективность | 100.00 | 99.07 |
| Диагностическая чувствительность | 100.00 | 98.07 |
| Диагностическая специфичность | 100.00 | 100.00 |
Заключение об отсутствии уролитиаза принимают при соотношении вкладов в рассеяние олигомерных форм С1=Т&НЕ(28)А/Т&НЕ(7)<0.1 и C2=T&HE(28)F/T&HE(7)<1.81. Диагноз уролитиаз устанавливают, если С1>1.5 при любом значении С2.
В случае, когда С1<1.5 и С2>1.81 констатируют принадлежность пациента к группе риска развития уролитиаза. В этом случае имеется в виду следующее. Действительно, при указанных значениях коэффициентов С1 и С2 невозможно сделать определенное заключение о наличии или отсутствии заболевания. Однако данное состояние характеризуется наличием уже вполне определенной концентрации олигомерной формы БТХ Т&НЕ(28)А, т.е. макромолекулярных соединений органического матрикса - БТХ Т&НЕ(28) и неорганического лиганда (чаще всего, оксалат кальция). Эти макромолекулы, переходя в состояние геля, могут явиться центром кристаллизации для солей щавелевой кислоты и образования «оксалатных» конкрементов с последующей их верификацией инструментальными методами и развития клиники мочекаменной болезни, прежде всего, при нарушении пассажа мочи по мочевыводящим путям. Однако свойства динамической биофизической системы «золь» - «гель», состоящей из олигомерных форм БТХ Т&НЕ, могут индивидуально неопределенно долгое время сохранять свойства «золя», способствуя выведению значительного количества оксалатов в форме БТХ Т&НЕ(28)А. Емкость этой саногенетической системы индивидуальна. Частое увеличение концентрации солей щавелевой кислоты и, следовательно, увеличение осмолярности мочи, а также приближение pH мочи к изоэлектрической точке этих соединений приводит к сдвигу системы в зону «геля» с последующим запуском процесса кристаллизации и образованию конгломератов в мочевых путях. Таким образом, данное состояние с биофизической точки зрения является неустойчивым, что и выделило данную диагностическую область в «группу риска».
В ходе исследований дополнительно решался вопрос о надежной идентификации именно БТХ среди иных компонентов мочи. Поскольку и Т&НЕ(7) и Т&НЕ(28) являются олигомерными формами БТХ, их можно строго идентифицировать посредством иммуно-афинного связывания со специфическими антителами. Иммобилизация антител на микросферах носителях позволяет специфически извлечь БТХ из исследуемого образца мочи. Сравнение гистограмм распределения частиц по размерам в образце цельной мочи с образцом, подвергшимся процедуре специфического связывания и извлечения БТХ, позволяет строго идентифицировать все формы БТХ: Т&НЕ(7), а также Т&НЕ(28) как в свободном состоянии - T&HE(28)F, так и в составе агрегатов с микрокристаллами оксалатов - Т&НЕ(28)А. Предварительное специфическое выявление всех форм БТХ с последующей их достоверной верификацией по размерам макромолекул обеспечивает точность комплексной аналитической системы идентификации конкретных форм: Т&НЕ(7), Т&НЕ(28)А и T&HE(28)F, а следовательно и достоверность расчета соотношений различных форм БТХ, на которых основан способ диагностики уролитиаза.
В предложенном способе преаналитический этап исследования не превышает 30 минут, а процесс выявления и количественной оценки всех форм БТХ является несложным за счет четкости идентификации БТХ и не требует проведения повторных исследований.
Способ позволяет выявлять наличие биологического дефекта биофизической системы саногенеза, т.е. условия для кристаллообразования, что позволяет программировать мероприятия по профилактике заболевания и оценивать эффективность лечебной тактики, сокращая расходы на лечение и улучшая качество жизни пациентов.
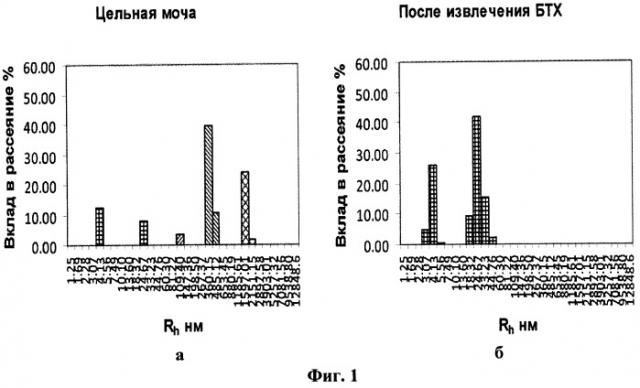
На фигуре 1 представлены гистограммы распределения частиц по размерам в образцах мочи больного уролитиазом: (а) - в образце цельной мочи, (б) - в образце после извлечения БТХ.
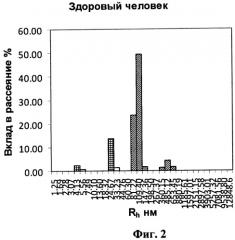
на фигуре 2 - гистограмма образца цельной мочи здорового человека;
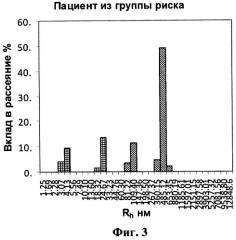
на фигуре 3 - гистограмма образца цельной мочи пациента из группы риска.
Способ осуществляют, например, следующим образом.
От пробы утренней мочи испытуемого пациента в микропробирки отбирают два образца по 0.4 мл. Один образец оставляют без изменений. Ко второму образцу добавляют 10 мкл моноклональных антител против БТХ и 50 мкл раствора белка A (Staphylococcus aureus), иммобилизованного на агарозных микросферах. Белок А с высокой афинностью связывается с Fc-участком антител, взаимодействуя при этом с тяжелыми цепями иммуноглобулинов IgG1, IgG2, IgG4, IgA и IgE человека, при этом участки легких цепей иммуноглобулинов специфически взаимодействуют с БТХ и легко осаждаются при низкой скорости центрифугирования. После 15-ти минутной инкубации при комнатной температуре оба образца центрифугируют 5 мин при 5000 об/мин и отбирают супернатант. Образец цельной мочи и супернатант второго образца измеряют на установке динамического светорассеяния и получают гистограммы распределения частиц по размерам в обоих образцах. В качестве установки динамического светорассеяния может быть использован, например, лазерный корреляционный спектрометр ЖС-03 производства ООО «ИНТОКС» (Россия, ТУ 9443-003-25902369-97).
Далее, путем сравнения гистограмм распределения в обоих образцах, идентифицируют в образце цельной мочи олигомерные формы БТХ: Т&НЕ(7) в диапазоне примерно Rh 90÷110 нм, T&HE(28)F в диапазоне примерно Rh370÷500 нм и Т&НЕ(28)А в диапазоне примерно Rh 1500÷5000 нм по наличию соответствующих пиков на гистограмме образца исходной мочи и одновременному отсутствию данных пиков на гистограмме второго образца (Фиг.1). С помощью управляющей программы установки динамического рассеяния на гистограмме цельной мочи определяют вклад в суммарное рассеяние (в %). При интерпретации результатов имеется в виду, что вклад в рассеяние каждого типа частиц есть площадь под соответствующим пиком по отношению к суммарной площади под всеми столбцами гистограммы.
На основании полученных числовых данных определяют соотношение выявленных олигомерных форм по формулам:
,
и при соотношении С1>1.5 и любом значении соотношения С2 диагностируют уролитиаз, при соотношениях С1<0.1 и С2<1.81 диагностируют отсутствие заболевания, а при соотношениях С1<1,5 и С2>1.81 пациента относят к группе риска развития уролитиаза.
Способ иллюстрируется следующими примерами.
Пример 1. Пациентка Р. 62 лет. Билатеральный нефролитиаз. Коралловидный камень правой почки. Пиелолитотомия слева (2001 год), дистанционная удадарно-волновая литотрипсия слева (2006 год). При УЗИ и в/в урографии в проекции правой почки определяется коралловидный конкремент, занимающий всю полостную систему почки, размером до 7 см, чашечно-лоханочная система расширена. Слева в проекции средних и нижних групп чашечек определяются три конкремента до 0.8 см в диаметре. В общем анализе мочи лейкоцитов 20-30 в п/зрения, бактериурия ++. Уровень креатинина крови 0.18 ммоль/л.
Исследование содержания БТХ в моче по описанному выше способу дало следующие результаты (табл.2, фиг.1):
| Таблица 2 | ||||
| Форма БТХ | Rh среднее, нм | Вклад, % | С1 | С2 |
| 4.13 | 12.42 | 7.58 (>1.5) | 14.87 (>1.81) | |
| 24.67 | 8.03 | |||
| Т&НЕ(7) | 109.40 | 3.39 | ||
| T&HE(28)F | 387.04 | 50.45 | ||
| Т&НЕ(28)А | 1636.56 | 25.71 |
При сравнении гистограмм (фиг.1а и б) видно, что на гистограмме образца с извлеченной БТХ (фиг.1б) отсутствуют пики с Rh порядка 100 нм, 350-500 нм и более 1500 нм, присутствующие на гистограмме цельной мочи (фиг.1а). Поскольку из второго образца был специфически извлечен БТХ, можно утверждать, что пик с Rh среднее = 109.40 соответствует форме Т&НЕ(7), пик с Rh среднее = 387.04 - свободной форме T&HE(28)F, а пик с Rh среднее = 1636.56 - агрегатам формы Т&НЕ(28)А с микрокристаллами солей.
Полученные результаты свидетельствуют о наличии уролитиаза у пациентки, что подтверждается и клиническими данными.
Пример 2. Обследуемый Л. 45 лет, проходивший диспансерное обследование. Проведение ультразвукового исследования (УЗИ), а также анализ мочи, не выявил патологии, в том числе, не выявил наличия уролитиаза. Исследование содержания БТХ в моче по заявляемому способу дало следующие результаты (табл.3, фиг.2):
| Таблица 3 | ||||
| Форма БТХ | Rh среднее, нм | Вклад, % | С1 | С2 |
| 4.49 | 3.00 | 0.00 (0.1) | 0.10 (<1.81) | |
| 25.44 | 14.93 | |||
| Т&НЕ(7) | 101.22 | 74.76 | ||
| T&HE(28)F | 503.29 | 7.31 |
Полученные результаты показали, что молекулы БТХ располагаются в диапазоне ≈100 нм - Т&НЕ(7) и ≈500 нм - T&HE(28)F. Молекулы Т&НЕ(28)А у обследуемого не обнаружены.
Данные этого исследования свидетельствуют о сохранной биофизической системе мочеобразования - у обследуемого отсутствует уролитиаз.
Пример 3. Пациент Г. 54 лет, поступил с клиникой левосторонней почечной колики. При проведении УЗИ слева определялось: расширение чашечно-лоханочной системы, большое количество микролитов (до 0.3-0.4 см) в проекции средних и верхних групп чашечек. В общем анализе мочи наблюдалась выраженная оксалатурия. На фоне инфузионной спазмолитической терапии пациент отмечал отхождение «песка» с мочой. Повторное проведение УЗИ после отхождения «песка» патологии не выявило. Исследование содержания БТХ в моче по заявляемому способу дало следующие результаты (табл.4, фиг.3):
| Таблица 4 | ||||
| Форма БТХ | Rh среднее, нм | Вклад, % | С1 | С2 |
| 3.77 | 12.73 | 0.00 (<1.5) | 3.91 (>1.81) | |
| 24.67 | 11.50 | |||
| Т&НЕ(7) | 103.05 | 15.42 | ||
| T&HE(28)F | 482.11 | 60.35 |
Полученные результаты показали, что молекулы БТХ располагаются в диапазоне ≈100 нм - Т&НЕ(7) и ≈500 нм - T&HE(28)F. Молекулы Т&НЕ(28)А у пациента не обнаружены.
В соответствии с заявленным изобретением пациента следует отнести к группе риска развития уролитиаза. Учитывая клиническую картину с эпизодом почечной колики, но без верификации конкрементов, можно рассматривать этот случай как дебют кристаллообразования, которое может развиться в мочекаменную болезнь.
Использование заявленного способа позволяет на основании патогенетического подхода к определению диагностически значимых форм БТХ проводить разграничение обследуемых не только на группы больных уролитиазом и здоровых, но и выделить группу риска развития уролитиаза. Способ обладает высокой точностью, специфичностью и чувствительностью, не требует больших трудозатрат и времени исследования.
Способ диагностики уролитиаза, включающий разделение исходной пробы мочи на два одинаковых образца, извлечение белка Тамма-Хорсфалла во втором образце при помощи реагента для идентификации белка Тамма-Хорсфалла, получение методом динамического светорассеяния гистограмм распределения частиц по размерам в обоих образцах и определение процентного содержания олигомерной формы Т&НЕ(7) белка Тамма-Хорсфалла по гистограмме распределения частиц по размерам в образце цельной мочи сравнением с гистограммой второго образца, отличающийся тем, что в качестве реагента для идентификации белка Тамма-Хорсфалла используют моноклональные антитела, вступающие с белком Тамма-Хорсфалла в имунно-афинную реакцию, дополнительно из второго образца извлекают белок Тамма-Хорсфалла Т&НЕ(28) и в обоих образцах мочи определяют олигомерную форму Т&НЕ(28) белка Тамма-Хорсфалла в свободном состоянии и в агрегатах с микрокристаллами оксалатов, определяют соотношение выявленных олигомерных форм по формуламС1=Т&НЕ(28)А/Т&НЕ(7),С2=Т&HE(28)F/T&НЕ(7),где - T&HE(28)F - содержание олигомерной формы Т&НЕ(28) белка Тамма-Хорсфалла в свободном состоянии, %;- Т&НЕ(28)А - содержание олигомерной формы Т&НЕ(28) белка Тамма-Хорсфалла в агрегатах с микрокристаллами оксалатов, %,и при соотношении С1>1,5 и любом значении соотношения С2 диагностируют уролитиаз, при соотношениях С1<0,1 и С2<1,81 диагностируют отсутствие заболевания, а при соотношениях С1<1,5 и С2>1,81 пациента относят к группе риска развития уролитиаза.