Композиция, содержащая частицы hcmv
Иллюстрации
Показать всеГруппа изобретений относится к области медицины, в частности к вирусологии. Композиции содержат агент, выбранный из группы, содержащей вирионы HCMV, плотные тельца HCMV и NIEP HCMV, при этом композиция способна проявлять иммунный ответ, в то время как вирионы, NIEP и/или плотные тельца не способны к слиянию. Заявлен способ производства композиции, а также применения агента, выбранного из группы, состоящей из вириона HCMV, плотного тельца HCMV и NIEP HCMV, при этом агент не способен к слиянию, для получения вакцины. Группа изобретений обеспечивает получение композиции, не обладающей остаточной инфекционностью, но обеспечивающей иммунный ответ, включающий нейтрализующие антитела против антигена. 9 н. и 34 з.п. ф-лы, 1 табл., 2 пр., 19 ил.
Реферат
Изобретение относится к композиции, содержащей агент, в которой такой агент выбран из группы, включающей вирионы HCMV, плотные тельца HCMV и NIEP HCMV, к применению таких композиций и способу производства такой композиции.
Цитомегаловирус человека (HCMV), β-герпесвирус, представляет собой повсеместно встречающийся патоген. У иммунокомпетентного человека инфекция HCMV обычно незаметна, проявляющаяся слабо выраженными и неспецифическими симптомами. В отличие от этого, в определенных группах риска, например у пациентов с ослабленным иммунитетом, таких как пациенты со СПИДом или получателей пересаженных органов, и после внутриутробной инфекции, инфицирование HCMV обладает серьезными проявлениями.
Для лечения инфекций HCMV доступны химиотерапевтические препараты. Успех противовирусной химиотерапии инфекции HCMV, тем не менее, ограничен, в частности, токсичностью лекарственных средств и развитием устойчивых вариантов вируса, если увеличена продолжительность лечения. Кроме того, профилактическое или терапевтическое применение противовирусной гипериммунной сыворотки, как оказалось, обладает только ограниченной эффективностью.
В течение многих лет проводили работу по разработке вакцины против HCMV. Таким образом, предпринимались попытки вызвать необходимый иммунитет при помощи ослабленных (аттенюированных) живых вакцин. Такие вакцины, тем не менее, обладали только ограниченной эффективностью. Причинами этого могут являться, среди прочего, ограниченная жизнеспособность таких аттенюированных вирусов у людей и специфичные для штаммов изменения антигенных свойств. Помимо непригодности при индукции постоянного иммунитета, использование живой вакцины должно оцениваться критически; отсутствие знания о патогенетических механизмах при инфекции HCMV и риск реактивации штамма вакцины после иммунодепрессии делает использование живой вакцины, по меньшей мере, сомнительным в таких клинических ситуациях.
Во избежание таких рисков в последнее время предпочтительно развивались стратегии для разработки субъединичных вакцин против HCMV, которые содержат белки из вирусной оболочки, синтезированные в различных системах экспрессии. Такие белки оболочки, особенно гликопротеины gB и gH, представляют собой основные антигены-мишени для нейтрализующих антител против HCMV. Нейтрализующие антитела способны предотвратить инфицирование. Индуцировать такие нейтрализующие антитела при помощи субъединичной вакцины с gB возможно как у экспериментальных животных, так и в клинических исследованиях. Тем не менее, у людей гуморальный иммунный ответ, индуцированный таким образом, как оказалось, является непродолжительным и не подходит для профилактики инфекции во всех случаях. Это неблагоприятно в отношении широкого применения субъединичных вакцин, основанных исключительно на gB HCMV. Причинами, которые выдвигаются в качестве предположения относительно ограниченной эффективности таких антигенных препаратов, в свою очередь, являются штаммоспецифическая изменчивость иммунного ответа, недостаток индукции адекватной клеточной иммунной реакции и структурные ограничения используемого антигена, эпитопы которого, как известно в некоторых случаях, являются конформационно-зависимыми.
На основе данного опыта, следовательно, требования, которым должна удовлетворять эффективная и широко применимая вакцина HCMV, указаны ниже: (1) пролонгированная индукция нейтрализующих антител, которые защищают от инфекции HCMV перекрывающим несколько штаммов образом. Для этого необходима эффективная индукция так называемого «ответа хэлперных клеток» (CD4-положительных T-лимфоцитов) против HCMV, чтобы способствовать созреванию секретирующих антитела B-лимфоцитов. (2) Индукция образования цитотоксических T-клеток против HCMV. Лимфоциты данного типа имеют первостепенную важность для пресечения инфекции HCMV, которая имеет место, и для ограничения распространения вируса в организме. (3) Снижение до минимума побочных эффектов при помощи вакцины. Невозможно оценить риск, который мог бы иметь место от жизнеспособного вируса при заражении, который, согласно последним данным, будет обладать способностью переходить в латентное состояние после иммуносуппрессии. Следовательно, цель должна заключаться в том, чтобы получить нежизнеспособный вирусный антиген в качестве вакцины.
Вакцина такого типа описана в международной патентной заявке WO 00/53729.
Хотя такой тип вакцин несомненно целесообразен, необходимо соответствие высоким стандартам с точки зрения уменьшения остаточной инфекционности такого вида вирусных частиц из-за возможного присутствия остаточных инфекционных вирионов HCMV. Следовательно, проблема, лежащая в основе настоящего изобретения заключалась в том, чтобы получить композицию, содержащую частицы HCMV и, более конкретно, вирионы HCMV и/или плотные тельца HCMV, не обладающие остаточной инфекционностью, в частности без остаточной инфекционности при анализе, как описано в настоящем документе.
Дальнейшая проблема, лежащая в основе настоящего изобретения, заключается в том, чтобы получить препараты частиц HCMV, которые не являются инфекционными, но обеспечивают индукцию антигенспецифичного CD8+ цитотоксического T-клеточного ответа. Следующая проблема, лежащая в основе настоящего изобретения, заключается в том, чтобы получить препараты частиц HCMV, которые не являются инфекционными, но обеспечивают индукцию антигенспецифичного иммунного ответа, при этом такой иммунный ответ включает антитела против антигена, предпочтительно, нейтрализующие антитела против антигена.
Данная и другие проблемы решена посредством объектов независимых пунктов формулы изобретения. Предпочтительные варианты осуществления можно заимствовать из зависимых пунктов многозвенной формулы изобретения.
Более конкретно, проблема, лежащая в основе настоящего изобретения, решена в первом аспекте посредством композиции, содержащей агент, выбранный из группы, включающей вирионы HCMV, плотные тельца HCMV и NIEP HCMV, где композиция способна проявлять иммунный ответ, в то время как вирионы, NIEP и/или плотные тельца не способны к слиянию. В варианте осуществления агент не является инфекционным.
Проблема, лежащая в основе настоящего изобретения, решена во втором аспекте посредством композиции, содержащей агент, выбранный из группы, включающей вирионы HCMV, плотные тельца HCMV и NIEP HCMV, где композиция способна проявлять иммунный ответ, в то время как вирионы, NIEP и/или плотные тельца не способны к слиянию, где композицию можно получить способом, включающим стадии:
a) получения одного или нескольких агентов;
b) обработки агента(ов) для того, чтобы лишить их способности к слиянию, в тоже время все еще оставляя их способными индуцировать иммунный ответ.
В варианте осуществления агент не является инфекционным.
В варианте осуществления первого и второго аспектов иммунный ответ представляет собой антигенспецифичный CD8+ ответ.
В варианте осуществления первого и второго аспектов иммунный ответ представляет собой антигенспецифичный цитотоксический T-клеточный ответ.
В варианте осуществления первого и второго аспектов иммунный ответ представляет собой антигенспецифичный CD8+ цитотоксический T-клеточный ответ.
В варианте осуществления первого и второго аспектов иммунный ответ представляет собой антигенспецифичный гуморальный иммунный ответ, предпочтительно иммунный ответ представляет собой антигенспецифичный гуморальный иммунный ответ, при котором антитела представляют собой нейтрализующие антитела.
В варианте осуществления первого и второго аспектов иммунный ответ представляет собой антигенспецифичный ответ CD4+ хелперных T-клеток.
В варианте осуществления первого и второго аспектов антиген представляет собой антиген HCMV, где антиген HCMV предпочтительно выбран из группы, включающей антиген pp65, производные антигена pp65, pp28 и производные pp28, pp150 и производные pp150, gB и производные gB, gH и производные gH и предранние антигены и их производные, гликопротеины и производные гликопротеинов, предпочтительно, гликопротеины HCMV и производные гликопротеинов HCMV, при этом гликопротеины предпочтительно представляют собой gM и производные gM или gN и производные gN.
В группе предранних антигенов предранний антиген-1 (IE-1) является особенно предпочтительным.
В варианте осуществления первого и второго аспектов антиген инактивирован.
В варианте осуществления первого и второго аспектов композиция представляет собой фармацевтическую композицию или диагностическую композицию.
Проблема, лежащая в основе настоящего изобретения, решена в третьем аспекте посредством применения агента, где агент выбран из группы, включающей вирион HCMV, плотное тельце HMCV и NIEP HCMV, или композиции, включающей такой агент, где агент не способен к слиянию, для производства лекарственного средства, предпочтительно, для проявления иммунного ответа против одного или нескольких антигенов HCMV.
Проблема, лежащая в основе настоящего изобретения, решена в четвертом аспекте посредством применения агента, где агент выбран из группы, включающей вирион HCMV, плотное тельце HMCV и NIEP HCMV, или композиции, включающей такой агент, предпочтительно композиции, определенной в третьем аспекте, где композиция и/или агент были подвергнуты инактивации, для производства лекарственного средства для проявления иммунного ответа, предпочтительно, иммунного ответа против одного или нескольких антигенов HCMV.
Проблема, лежащая в основе настоящего изобретения, решена в пятом аспекте посредством применения агента, где агент выбран из группы, включающей вирион HCMV, плотное тельце HMCV и NIEP HCMV, или композиции, включающей такой агент, где агент не способен к слиянию, для производства вакцины.
Проблема, лежащая в основе настоящего изобретения, решена в шестом аспекте посредством применения агента, где агент выбран из группы, включающей вирион HCMV, плотное тельце HMCV и NIEP HCMV, или композиции, включающей такой агент, предпочтительно, композиции, определенной в третьем аспекте, где композиция и/или агент были подвергнуты инактивации, для производства вакцины.
В варианте осуществления третьего и четвертого аспекта иммунный ответ представляет собой антигенспецифичный CD8+ ответ.
В варианте осуществления с третьего по шестой аспект иммунный ответ представляет собой антигенспецифичный цитотоксический T-клеточный ответ.
В варианте осуществления с третьего по шестой аспект иммунный ответ представляет собой антигенспецифичный CD8+ цитотоксический T-клеточный ответ.
В варианте осуществления с третьего по шестой аспект иммунный ответ представляет собой антигенспецифичный гуморальный иммунный ответ, предпочтительно, иммунный ответ представляет собой антигенспецифичный гуморальный иммунный ответ, при котором антитела представляют собой нейтрализующие антитела.
В варианте осуществления с третьего по шестой аспект иммунный ответ представляет собой антигенспецифичный ответ CD4+ хелперных T-клеток.
В варианте осуществления с третьего по шестой аспект антиген представляет собой антиген HCMV, где антиген HCMV предпочтительно выбран из группы, включающей антиген pp65, производные антигена pp65, pp28 и производные pp28, pp150 и производные pp150, gB и производные gB, gH и производные gH и предранние антигены и их производные, гликопротеины и производные гликопротеинов, предпочтительно, гликопротеины HCMV и производные гликопротеинов HCMV, где гликопротеины предпочтительно представляют собой gM и производные gM или gN и производные gN.
В варианте осуществления пятого и шестого аспекта вакцина предназначена для лечения и/или профилактики инфекции HCMV.
В варианте осуществления пятого и шестого аспекта вакцина предназначена для лечения и/или профилактики заболевания, вызванного HCMV у донора трансплантата и/или получателя трансплантата.
Проблема, лежащая в основе настоящего изобретения, решена в седьмом аспекте посредством применения агента, где агент выбран из группы, включающей вирион HCMV, плотное тельце HMCV и NIEP HCMV, или композиции, включающей такой агент, где агент не способен к слиянию, для производства диагностического средства.
Проблема, лежащая в основе настоящего изобретения, решена в восьмом аспекте посредством применения агента, где агент выбран из группы, включающей вирион HCMV, плотное тельце HMCV и NIEP HCMV, или композиции, включающей такой агент, где композиция и/или агент были подвергнуты инактивации, для производства диагностического средства.
Проблема, лежащая в основе настоящего изобретения, решена в девятом аспекте посредством способа производства композиции, определенной в первом и во втором аспекте, включающего стадии
a) получения агента, выбранного из группы, включающей вирионы HCMV, NIEP HCMV и плотные тельца HCMV;
b) обработки агента для того, чтобы лишить его способности к слиянию, в то время как указанный агент все еще способен индуцировать иммунный ответ.
В варианте осуществления девятого аспекта обработка на стадии b) представляет собой одну меру или любую комбинацию мер, выбранных из группы, включающей обработку УФ-излучением, облучение с высокой энергией, обработку при низком значении pH, термическую обработку и обработку при помощи сшивающих средств.
В предпочтительном варианте осуществления девятого аспекта обработка УФ-излучением представляет собой обработку УФС-излучением, при этом длина волны составляет приблизительно 100-280 нм, или обработку длинноволновым УФ-излучением.
В рамках настоящего изобретения, помимо использования для инактивации УФС-излучения, также можно использовать длинноволновое УФ-излучение. В таком случае длинноволновое УФ-излучение используется совместно с фотореактивным средством, которое активируется при указанной длине волны УФ-излучения. В варианте осуществления такое фотореактивное средство представляет собой амотосален, который используют совместно с УФА-излучением, 4'-аминометил-4,5',8-триметилпсорален, который используется совместно с УФA-излучением, и диметилметиленовый синий, который используют совместно с УФA- и УФB-излучением, соответственно.
В варианте осуществления девятого аспекта обработка УФ-излучением представляет собой применение диапазона доз приблизительно от 100 до приблизительно 2000 мДж/см2, предпочтительно, приблизительно от 100 до приблизительно 1000 мДж/см2 и, более предпочтительно, приблизительно от 150 до приблизительно 900 мДж/см2.
В варианте осуществления девятого аспекта перед, одновременно или после обработки УФ-излучением агент подергается облучению гамма-лучами.
В предпочтительном варианте осуществления девятого аспекта облучение с высокой энергией представляет собой облучение гамма-лучами.
В дополнительном предпочтительном варианте осуществления девятого аспекта гамма-излучение применительно к облучению гамма-лучами используют в диапазоне доз приблизительно от 15 до приблизительно 70 кгр, более предпочтительно, приблизительно от 20 до приблизительно 65 кгр и, более предпочтительно, приблизительно от 20 до приблизительно 60 кгр.
В варианте осуществления девятого аспекта обработка представляет собой обработку при низком значении pH, и обработка при низком значении pH включает воздействие на агент рН приблизительно от 0 до 5, предпочтительно, от 1 до 4,5 и, более предпочтительно, от 2 до 4,5.
В предпочтительном варианте осуществления девятого аспекта агент подвергают обработке при низком значении pH в течение приблизительно от 0,5 до 24 часов, предпочтительно, приблизительно от 0,5 до 12 часов и, более предпочтительно, приблизительно от 0,5 до 6 часов.
В варианте осуществления девятого аспекта агент подвергают обработке при низком значении pH при температуре приблизительно от 1 до 50°C, предпочтительно, при приблизительно от 1 до приблизительно 45°C и, более предпочтительно, при приблизительно от 1 до приблизительно 40°C.
В варианте осуществления девятого аспекта термическая обработка включает инкубацию агента при температуре в диапазоне приблизительно от 37,5°C до приблизительно 65°C, предпочтительно, при температуре в диапазоне приблизительно от 37,5 до приблизительно 60°C и, более предпочтительно, при температуре в диапазоне приблизительно от 37,5 до приблизительно 56°C.
В предпочтительном варианте осуществления девятого аспекта агент инкубируют в течение периода времени в диапазоне приблизительно от 5 секунд до приблизительно 36 часов, предпочтительно, в диапазоне приблизительно от 5 секунд до приблизительно 30 часов и, более предпочтительно, в диапазоне приблизительно от 5 секунд до приблизительно 24 часов.
В варианте осуществления девятого аспекта обработка представляет собой обработку при помощи одного или нескольких сшивающих средств, при этом сшивающее средство, каждое и независимо друг от друга, выбрано из группы, включающей лактоны, этилаты и альдегиды.
В варианте осуществления девятого аспекта сшивающее средство представляет собой β-пропиолактон.
В варианте осуществления девятого аспекта сшивающее средство представляет собой этиленоксид.
В варианте осуществления девятого аспекта сшивающее средство представляет собой формальдегид.
В варианте осуществления девятого аспекта агент подвергают воздействию сшивающего средства при концентрации сшивающего средства, и более предпочтительно β-пропиолактона, в среде, содержащей агент, находящейся в диапазоне приблизительно от 0,05 до приблизительно 10% (об./об.), предпочтительно, в диапазоне приблизительно от 0,05 до приблизительно 10% (об./об.) и, более предпочтительно, в диапазоне приблизительно от 0,05 до приблизительно 7,5% (об./об.).
В варианте осуществления девятого аспекта агент инкубируют со сшивающим средством, и предпочтительно с β-пропиолактоном, в течение периода времени в диапазоне от приблизительно от 1 минуты до приблизительно 72 часов, предпочтительно, приблизительно от 1 минуты до приблизительно 48 часов и, более предпочтительно, приблизительно от 1 минуты до приблизительно 24 часов.
В варианте осуществления девятого аспекта агент инкубируют при температуре в диапазоне приблизительно от 1°C до приблизительно 60°C, предпочтительно, при температуре в диапазоне приблизительно от 1°C до приблизительно 50°C, более предпочтительно, при температуре в диапазоне приблизительно от 1°C до приблизительно 40°C.
Согласно известному уровню техники считается, что частицы HCMV для того, чтобы вызвать антигенспецифичный CD8+ цитотоксический T-клеточный ответ на вирусные антигены и зараженные вирусом клетки, должны слиться с мембраной клетки-мишени (Pepperl et al. 2000 J Virol 74:6132-6146). Такое слияние считают необходимым предварительным условием для того, чтобы направить вирусные антигены по пути процессинга и презентации антигена молекулами MHC класса I, либо непосредственно после проникновения в клетки, либо после внутриклеточной транскрипции и трансляции вирусных белков (Pepperl et al 2000 J Virol 74:6132-6146). Презентация антигена посредством пути MHC класса I, в свою очередь, является необходимым предварительным условием для иммунной системы, чтобы быть способной осуществить или проявить антигенспецифичный CD8+ цитотоксический T-клеточный ответ на вирусные антигены и зараженные вирусом клетки.
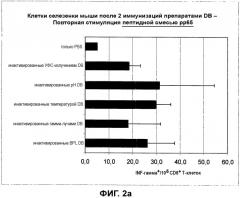
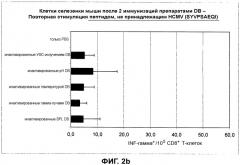
Авторы настоящего изобретения к настоящему времени обнаружили, что частицы HCMV, которые больше не способны к слиянию, все еще способны вызывать такой тип антигенспецифичного CD8+ цитотоксического T-клеточного ответа на вирусные антигены и зараженные вирусом клетки. Это применимо, в частности, к частицам HCMV, которые обработали или обрабатывают или получают, используя одно или несколько средств и способов, соответственно, описанных в настоящем документе для или применительно к какой-либо инактивации и процедуре инактивации, соответственно. Данная первая находка по настоящему изобретению до большой степени неожиданна, поскольку согласно известному уровню техники, такая способность к слиянию частиц HCMV, как думали, является необходимым предварительным условием для данного вида T-клеточного ответа, как уже указано выше.
Такое отсутствие способности к слиянию можно обеспечить, применяя к частицам HCMV средства и способы, по существу, обычно известные в данной области для инактивации HCMV или снижения инфекционности HCMV и частиц HCMV, предпочтительно те средства и способы, описываемые в настоящем документе, которые также обозначают как средства и способы, соответственно, описываемые в настоящем документе, для или применительно к инактивации и процедурам инактивации. Такие инактивирующие средства и способы или средства и способы инактивации, соответственно, применяют и осуществляют до такой степени, что указанное отсутствие способности к слиянию налагается или придается таким частицам HCMV.
Вторая находка, лежащая в основе настоящего изобретения относится к получению частиц HCMV или композиций, включающих такие частицы HCMV, не обладающие инфекционностью, предпочтительно без остаточной инфекционности, при этом указанные частицы HCMV и композиции, включающие их, получают, используя любые средства и способы, соответственно, описываемые в настоящем документе, применительно к первому аспекту по настоящему изобретению, начиная с частиц HCMV или содержащих частицы HCMV композиций, все еще содержащих инфекционные частицы HCMV и, в особенности, вирионы HCMV. Также такой тип частиц HCMV, как было к удивлению обнаружено, подходит для индукции иммунного ответа, как описано в настоящем документе, то есть, в частности, антигенспецифичного CD8+ цитотоксического T-клеточного ответа, антигенспецифичного гуморального иммунного ответа, при этом гуморальный иммунный ответ предпочтительно представляет собой ответ, обусловленный антигенспецифичными нейтрализующими антителами, и антигенспецифичного ответа CD4+ хелперных T-клеток.
Среди специалистов в данной области, общеизвестно, что для индукции антигенспецифичного гуморального иммунного ответа и антигенспецифичного CD8+ цитотоксического T-клеточного ответа, соответственно, необходимо появление антигенспецифичных CD4+ хэлперных T-клеток. Следовательно, в настоящем изобретении появление антигенспецифичных CD4+ хэлперных T-клеток подтверждается проявлением специфических для pp65 цитотоксических CD8+ T-клеточных ответов и появлением антител, в частности, нейтрализующих антител, специфичных для антигенов HCMV. Таким образом, частицы HCMV, которые подвергали обработке для того, чтобы инактивировать остаточную инфекционность HCMV и лишить материал способности к слиянию, все еще способны вызвать образование антигенспецифичных CD4+ хэлперных T-клеток.
Предпочтительно используемый в настоящем документе термин отсутствие остаточной инфекционности обозначает, что никакие инфекционные частицы и, в особенности, никакие инфекционные частицы HCMV, невозможно определить в образце или композиции, содержащей частицы HCMV, используя анализ инфекционности, более предпочтительно, анализ инфекционности, как описано в настоящем документе. Другими словами, композиция или препарат, содержащий одно или несколько плотных телец HCMV, вирионов HCMV и/или NIEP HCMV, представляют собой композицию и препарат, соответственно, в которых невозможно определить никакого инфекционного HCMV или частицы HCMV в том же самом анализе инфекционности. Специалист в данной области признает, будет ли определяться предел чувствительности и если да, то до какой степени, то есть как много таких частиц HCMV, тем не менее, присутствует в соответствующей композиции и препарате, соответственно.
Предпочтительно используемый в настоящем документе термин частицы HCMV включает вирионы HCMV, плотные тельца HCMV и NIEP HCMV.
Предпочтительно используемые в настоящем документе вирионы HCMV представляют собой инфекционные вирусные частицы, которые состоят из мембраны, тегумента (оболочки) и капсида, который содержит вирусную ДНК.
Предпочтительно используемые в настоящем документе плотные тельца (DB) HCMV представляют собой неинфекционные частицы HCMV, которые утратили капсид и ДНК HCMV, но включают мембрану и тегумент.
Предпочтительно используемые в настоящем документе NIEP HCMV представляют собой неинфекционные заключенные в оболочку частицы HCMV, которые утратили ДНК, но содержат мембрану, капсид и тегумент.
Предпочтительно используемый в настоящем документе термин плотные тельца включает как нерекомбинантные, так и рекомбинантные плотные тельца. Рекомбинантные плотные тельца предпочтительно экспрессируют один или несколько гетерологичных антигенов.
Предпочтительно используемый в настоящем документе термин NIEP включает как нерекомбинантные, так и рекомбинантные NIEP. Рекомбинантные NIEP экспрессируют один или несколько гетерологичных антигенов.
Предпочтительно используемый в настоящем документе термин вирионы включает как нерекомбинантные, так и рекомбинантные вирионы. Рекомбинантные вирионы предпочтительно экспрессируют один или несколько гетерологичных антигенов.
Предпочтительно используемый в настоящем документе термин гетерологичный антиген представляет собой антиген, который экспрессируется в различном окружении при экспрессии. В одном из вариантов осуществления такое отличающееся окружение при экспрессии представляет собой окружение, где антиген представляет собой антиген, который не свойственен соответствующим плотным тельцам дикого типа, NIEP дикого типа и вириону дикого типа. Точнее говоря, гетерологичный антиген предпочтительно представляет собой антиген, который представляет собой либо собственный, либо внутренний компонент частицы HCMV, включая в качестве неограничивающих примеров неструктурный антиген HCMV или антиген гетерологичного организма, предпочтительно, гетерологичный патоген. В дополнительном варианте осуществления такое отличающееся окружение при экспрессии представляет собой окружение, которое отличается от окружения дикого типа в том, что промотор, который контролирует экспрессию антигена, отличается от промотора, контролирующего экспрессию антигена плотных телец дикого типа, NIEP дикого типа и вирионов дикого типа. В дополнительном варианте осуществления различное окружение состоит из различных трансляционных систем или трансляционного фона, где экспрессируется антиген, которые, опять же, отличаются от систем дикого типа и фона дикого типа. Более определенно, плотные тельца дикого типа представляют собой плотные тельца HCMV дикого типа, NIEP дикого типа представляют собой NIEP HCMV дикого типа и вирионы дикого типа представляют собой вирионы HCMV дикого типа.
Предпочтительно используемый в настоящем документе термин дикий тип обозначает штамм или происходящий из штамма объект, который способен формировать плотные тельца, предпочтительно в условиях культивирования клеток in vitro. Такой дикий тип или штамм дикого типа предпочтительно представляет собой Ad169 и Towne.
Будет признано, что любое утверждение, вариант осуществления, особенность или преимущество, описываемое в настоящем документе в отношении частиц HCMV, также, и в особенности, применимы к плотным телам HCMV и NIEP HCMV и, более конкретно, применимы к плотным тельцам HCMV.
Предпочтительно используемый в настоящем документе термин способность к слиянию обозначает способность вирусных или субвирусных частиц, таких как HCMV, сливаться с клеткой-мишенью, опосредованную слиянием мембран вирусных и субвирусных частиц, соответственно, с клеточной мембраной клетки-мишени. Такие вирусные и субвирусные частицы, соответственно, обозначают как «способные к слиянию»; при этом такие вирусные и субвирусные частиц, соответственно, которые не способны сливаться с клеткой-мишенью обозначают как неспособные к слиянию.
Основываясь на находке авторов настоящего изобретения, а именно, что такие частицы HCMV, включающие в качестве неограничивающих примеров вирионы HCMV, плотные тельца HCMV и NIEP HCMV, которые обрабатывают или обработали для инактивации их остаточной инфекционности HCMV, все же способны эффективно индуцировать антигенспецифичный CD8+ цитотоксический T-клеточный ответ в отношении вирусных антигенов, несмотря на доказанную потерю способности к слиянию, средства и способы инактивации инфекционности HCMV и, более определенно, инактивации остаточной инфекционности HCMV при помощи средств и в условиях, соответственно, которые сопровождаются потерей способности к слиянию, можно применить к частице HCMV, содержащейся в препаратах и композициях, соответственно, чтобы получить как безопасную вакцину HCMV, так и антигенспецифичный CD8+ цитотоксический T-клеточный ответ.
Частицы HCMV, которые образуют исходный продукт для получения частиц HCMV и их композиций, соответственно, каждые в качестве объекта по настоящему изобретению, предпочтительно представляют собой вирусные частицы, которые высвобождаются после инфицирования клетки млекопитающих HCMV. Такие частицы HCMV, которые используют в качестве исходного продукта, окружены липидной мембраной, которая дает возможность частицам сливаться с определенными клетками млекопитающих таким образом, что их содержимое входит в цитоплазму клетки, хотя, в соответствии с первым аспектом по настоящему изобретению, такие частицы, получаемые при обработке их средствами и способами, соответственно, описываемыми в настоящем документе применительно к инактивации или подходящих для инактивации, не способны к слиянию. Вне зависимости от этого, мембрана частиц HCMV содержит вирусные гликопротеины, которые представляют собой основные антигены для нейтрализующих вирусы антител. Кроме того, они содержат вирусный антиген pp65 (ppUL83), который является весьма иммуногенной мишенью для хелперных T-клеток и представляет собой основной антиген для индукции цитотоксических T-лимфоцитов (CTL) против HCMV.
Тип иммунного ответа, вызываемый частицами HCMV и, в особенности, вирионами HCMV, NIEP HCMV и/или плотными тельцами HCMV и композиции, их содержащие, соответственно, каждые в соответствии с настоящим изобретением, представляют собой, безотносительно к способу введения, ответ хелперных T-клеток типа Th1. Ввиду данной характерной черты частицы HCMV и, в особенности, вирионы HCMV, плотные тельца HCMV и/или NIEP HCMV, и композиции, содержащие, по меньшей мере, одну из них, соответственно, подходят для вакцины против HCMV.
Специалист в данной области признает, что частицы HCMV по настоящему изобретению и любую композицию, их содержащую, можно использовать для получения лекарственного средства, которое применяют для лечения и/или профилактики заболевания, предпочтительно, такое заболевание представляет собой заболевание, которое вызвано HCMV в качестве возбудителя заболевания или условно-патогенного агента.
В предпочтительном варианте осуществления лекарственное средство представляет собой вакцину.
Особая группа субъектов, предпочтительно млекопитающие и, более предпочтительно, люди, для лечения и/или профилактики у которых используют такое лекарственное средство, в соответствии с настоящим изобретением представляют собой людей, страдающих заболеванием или подверженных риску возникновения заболевания, вызванного HCMV, при этом такие субъекты являются донорами трансплантатов и/или реципиентами трансплантатов. Специалисты в данной области также признают, что частицы HCMV по настоящему изобретению и любую композицию, их содержащую, можно использовать для получения диагностического средства. Более предпочтительно, такая диагностика предназначена для выявления заболевания, которое вызвано HCMV в качестве возбудителя заболевания или условно-патогенного агента.
В заключение, частицы HCMV можно использовать для получения или производства лекарственного средства или диагностического средства, при этом лекарственное средство и диагностическое средство являются одним из средств, выбранных из группы, включающей антитела, аптамеры и шпигельмеры, при этом средства направлены, предпочтительно, специфически направлены, против одной или нескольких частиц HCMV по настоящему изобретению. Получение таких антител, аптамеров и шпигельмеров известны специалисту в данной области.
Производство антитела, специфичного для частиц HCMV по настоящему изобретению известно специалисту в данной области и, например, описано у Harlow, E., and Lane, D., "Antibodies: A Laboratory Manual," Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, (1988). Предпочтительно, применительно к настоящему изобретению можно использовать моноклональные антитела, которые можно получить согласно протоколу Cesar и Milstein и дополнительных разработок на его основе. Антитела, как используют в настоящем документе, включают в качестве неограничивающих примеров полные антитела, фрагменты или производные антител такие, как Fab-фрагменты, Fc-фрагменты и одноцепочечные антитела, при условии, что они подходят и способны связывать частицы HCMV по настоящему изобретению. Помимо моноклональных антител также можно использовать и/или получать поликлональные антитела. Получение поликлональных антител также известно специалисту в данной области и, например, описано у Harlow, E., and Lane, D., "Antibodies: A Laboratory Manual," Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, (1988). Предпочтительно, антитела, применяемые для терапевтических целей, представляют собой гуманизированные антитела или антитела человека, как определено выше.
Антитела, которые можно использовать по настоящему изобретению, могут содержать один или несколько маркеров или меток. Такие маркеры или метки можно применять для обнаружения антитела либо при его диагностическом применении, либо его терапевтическом применении. Предпочтительно, маркеры и метки выбраны из группы, включающей авидин, стрептавидин, биотин, золото и флуоресцеин, и используются, например, в способах ELISA. Данные и дополнительные маркеры, а также способы описаны, например, у Harlow, E., and Lane, D., "Antibodies: A Laboratory Manual," Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, (1988).
Также в рамки настоящего изобретения входит тот факт, что метка или маркер проявляет дополнительную функцию помимо детектирования, такую как взаимодействие с другими молекулами. Такое взаимодействие может представлять собой, например, специфическое взаимодействие с другими соединениями. Данные другие соединения могут либо являться соединениями, присущими системе, где используют антитело, такой как организм человека или животного, либо представлять собой образец, который анализируют, используя соответствующее антитело. Подходящие маркеры могут представлять собой, например, биотин или флуоресцеин с их специфически взаимодействующими партнерами, такими как авидин и стрептавидин и тому подобным, присутствующими на соответствующем соединении или структуре для взаимодействия с таким образом маркированным или помеченным антителом.
Аптамеры в качестве объекта по настоящему изобретению представляют собой D-нуклеиновые кислоты, которые являются либо одноцепочечными, либо двухцепочечными и которые специфически взаимодействуют с молекулой-мишенью. Производство или селекция аптамеров описана, например, в европейском патенте EP 0533838. В основном, выполняют следующие ниже стадии. Во-первых, получают смесь нуклеиновых кислот, то есть возможные аптамеры, при этом каждая нуклеиновая кислота, как правило, содержит сегмент из нескольких, предпочтительно, по меньшей мере, восьми следующих друг за другом рандомизированных нуклеотидов. Данная смесь впоследствии связывается с молекулой-мишенью, посредством чего нуклеиновая кислота(ы) связывается с молекулой-мишенью, например, исходя из повышенной аффинности к мишени или с большей силой в отношении нее по сравнению со смесью-кандидатом. Связывающаяся нуклеиновая кислота(ы) впоследствии отделяется/отделяются от остатка смеси. Необязательно, таким образом полученную нуклеиновую кислоту(ы) апмлифицируют, используя, например, полимеразную цепную реакцию. Данные стадии можно повторять несколько раз получая в результате смесь, содержащую повышенное соотношение нуклеиновых кислот, специфически связывающихся с мишенью, из которой затем необязательно отбирают конечную связывающуюся нуклеиновую кислоту. Данную специфически связывающуюся нуклеиновую кислоту(ы) обозначают как аптамеры. Очевидно, что любую стадию способа для получения или идентификации образцов аптамеров в смеси отдельных нуклеиновых кислот можно использовать для того, чтобы определить их послед