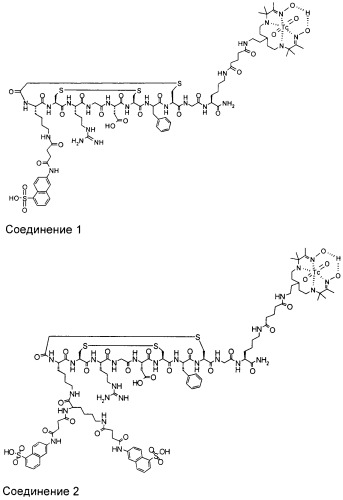
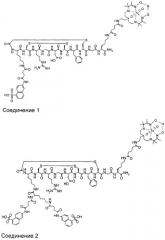
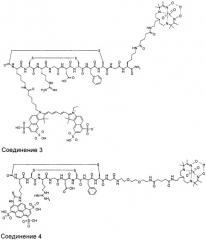
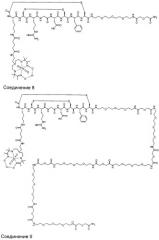
Способ визуализации
Иллюстрации
Показать всеИзобретение относится к способу определения наличия, локализации и/или степени фиброгенеза в печени субъекта. Заявленный способ включает предоставление субъекта, которому введено детектируемое количество соединения формулы I, предоставление возможности соединению формулы I связаться с активированными клетками печени, экспрессирующими интегрины, в указанной печени, детекцию сигналов, испускаемых указанным соединением формулы I, способом визуализации in vivo, и генерирование изображения, отображающего локализацию и/или величину указанных сигналов. Соединение формулы I представляет собой соединение
где G - глицин; D - аспарагиновая кислота; X1 представляет собой аминокислоту, Х2 и Х4 независимо представляют собой аминокислотные остатки, боковые цепи которых соединены вместе с образованием циклизующего мостика, Х3 - аргинин, М - метиларгинин или миметик аргинина; Х5 - тирозин, фенилаланин, 3-йод-тирозин, С4-6циклоалкилаланин или нафтилаланин; Х6 - тиолсодержащая аминокислота. W1 и W2 независимо представляют собой возможную линкерную группировку, где указанная линкерная группировка представляет собой радикал формулы -(L)1-15-. При этом L независимо представляет собой -С(=О)-, -CR′2-, -CR′=CR′-, -C=C-, -CR′2CO2-, -CO2CR′2-, -NR′-, -NR′CO-, -CONR′-, -NR′(C=O)NR′-, -NR′(C=S)NR′-, -SO2NR′-, -NR′SO2-, -CR′2OCR2, -CR′2SCR′2-, -CR′2NR′CR′2-, C4-8 циклогетероалкиленовую группу, С4-8 циклоалкиленовую группу, С6-12ариленовую группу, C3-12 гетероариленовую группу, группировку аминокислоты, полиалкиленгликоля, полимолочной кислоты или полигликолевой кислоты. Каждая группа R′ независимо представляет собой Н или С1-10алкил, С3-10алкиларил, С2-10алкоксиалкил, С1-10гидроксиалкил, С1-10фторалкил, либо 2 или более групп R1 вместе с атомами, к которым они присоединены, образуют карбоциклическое, гетероциклическое насыщенное или ненасыщенное кольцо. Z1 и Z2 независимо включают визуализирующую группировку, группировку сахара и группировку органического красителя или водород, при условии, что по меньшей мере один из Z1 и Z2 включает визуализирующую группировку. Изобретение обеспечивает диагностирование фиброза печени на ранних стадиях. 8 з.п. ф-лы, 5 ил., 6 табл., 10 пр.
Реферат
Область техники
Настоящее изобретение относится к способу визуализации in vivo и, в частности, к новому применению некоторых известных агентов визуализации in vivo. Предпочтительными способами визуализации in vivo по изобретению являются однофотонная эмиссионная компьютерная томография (SPECT) и позитронная эмиссионная томография (PET).
Предшествующий уровень техники
Повреждающие факторы, которые могут вызвать фиброз печени, среди них хронический вирусный гепатит, неалкогольный стеатогепатит (NASH), паразитемия, врожденные нарушения обмена веществ и токсическое поражение вследствие употребления алкоголя, имеют высокий показатель распространения на обширной территории. Все эти факторы означают, что фиброз, приводящий к циррозу и возможному раку печени, остается главной причиной заболеваемости и смертности во всем мире. Только в Великобритании болезнь печени является в настоящее время пятой наиболее распространенной причиной смертности, и распространенность этого заболевания повышается (Iredale, 2003, BMJ, Vol.327, pp.143-147).
Существуют два типа жировой дистрофии печени: неалкогольная жировая дистрофия печени (NAFLD) и NASH. Полагают, что около 24% населения США имеют NAFLD, которая прогрессирует в NASH с низкой частотой. NAFLD ассоциирована с метаболическим синдромом, который связывают с ожирением, гиперлипидемией, гипертензией и диабетом II типа. Полагают, что около 47 миллионов граждан США имеют метаболический синдром. Считается установленным, что 8,6 миллиона человек населения США имеют NASH, который может быть ассоциирован с фиброзом и циррозом, при этом у 20-28% пациентов с NASH цирроз развивается в течение одного десятилетия. В силу вышесказанного NAFLD имеет очень широкое распространение и представляет менее тяжелый исход в спектре NAFLD, которая может прогрессировать в NASH и, в конечном счете, в цирроз печени. Фиброз печени является индикатором риска прогрессирования от NASH к циррозу.
Современные подходы детекции фиброза печени имеют некоторые ощутимые недостатки. Биопсия печени с гистологическим анализом структуры отложения коллагена считается "золотым стандартом" для оценки стадии болезни печени и фиброза печени. Однако данная процедура является в некоторой степени болезненной, эпизодически заканчивается летальным исходом, связана с высокой стоимостью, ошибками при отборе проб и высокой вариабельностью результатов у разных специалистов в гепатопатологии при классификации степени фиброза. В результате отбора образцов печени при биопсии оценивают только 1/50000 часть печени, что может приводить к ошибкам при постановке диагноза. Кроме того, так как маркером фиброзной ткани служит коллаген, то он не является идеальной мишенью активного заболевания, поскольку может быть обнаружен на поздних стадиях активного фиброза, а также когда процесс заболевания разрешен. В настоящее время не существует никакого способа, которым можно эффективно характеризовать и регистрировать фиброз печени с использованием неинвазивной процедуры. Это негативно влияет на возможность раннего терапевтического вмешательства, которое могло бы замедлить или остановить развитие фиброза печени. Кроме того, с целью осуществления мониторинга прогрессирования болезни во времени рекомендуется проводить повторные биопсии каждые 3-5 лет. Существует ограниченное количество доступных тестов крови для детекции фиброза печени, поскольку они не могут быть использованы для оценки степени фиброза или для различения фиброза и цирроза. Следовательно, в настоящее время не существует никакого доступного способа, которым можно отличить NAFLD от NASH или удовлетворительно определить в количественном выражении и охарактеризовать фиброз при NASH.
Звездчатые клетки печени (HSC) по праву считаются основными фиброкомпетентными клетками печени. При прогрессирующем фиброзе печени HSC активируются и пролиферируют, но в процессе разрешения фиброза наблюдается обширный апоптоз HSC, который сопровождается разрушением рубцовой ткани печени. Прогрессирующая стадия процесса фиброза называется фиброгенезом. Имеется сообщение о положительной регуляции экспрессии интегрина активированными HSC (Zhou et al., J. Biol. Chem. 2004; 279(23): 23996-24006). Активация HSC критична для инициации и развития фиброгенеза и последующего фиброза печени. Поэтому маркеры активации HSC представляются возможными мишенями для визуализации фиброгенеза. В связи с этим, маркерами данного процесса, которые недавно стали известными, являются интегрины (Zhou et al., 2004, J. Biol. Chem., 279: 23996-24006; Patsenker et al., 2007, J. Hepatol., 46(5):878-887; Zhou et al., 2006, J. Biol. Chem., 281:39757-39765; Carloni etal., 1996, Gastroenterology, 110:1127-36).
Использование соответственно меченных, связывающихся с интегринами соединений для применений в визуализации in vivo описано ранее.
В WO 2004/020435 описаны интегрин-связывающие пиперидинильные соединения, полезные в лечении заболеваний, ассоциированных с патологической положительной регуляцией или дисрегуляцией клеточной пролиферации, обусловленной экспрессией ау-интегрина или его подтипа. В WO 2004/020435 также описано, что соединения по изобретению можно конъюгировать с группировкой, подходящей для визуализации in vivo, и использовать в качестве неинвазивного опухолевизуализирующего агента.
В WO 2007/088041 описан класс низкомолекулярных интегрин-связывающих соединений, полезных в лечении и/или предупреждении заболевания, предпочтительно представляющего собой заболевание, опосредованное αvβ1-интегрином. Фиброз печени включен в качестве конкретного заболевания, при котором находят применение соединения из WO 2007/088041. В дополнение к лечению и предупреждению в WO 2007/0880041 указано, что описанные там соединения могут включать визуализирующую in vivo группировку и использоваться для визуализации in vivo.
WO 2003/006491, WO 2005/012335 и WO 2005/123767 относятся к соединениям на основе RGD-пептида (аргинин-глицин-аспарагиновая кислота), связывающимся с рецепторами, ассоциированными с ангиогенезом, где указанные рецепторы включают интегрины. Описанные соединения включают либо антинеопластический агент, либо визуализирующую in vivo группировку, и отмечаются как полезные в лечении и визуализации in vivo заболеваний, ассоциированных с ангиогенезом.
В WO 2006/054904 описано применение RGD-пептидов, меченных визуализирующей in vivo группировкой в качестве контрастных агентов, мишенью для которых является внеклеточный матрикс (ЕСМ). Указано, что данные контрастные агенты полезны в диагностике и мониторинге заболеваний, связанных с избыточным образованием коллагена, включая фиброз печени. Однако имеется препятствие при использовании RGD-пептидов для визуализации in vivo фиброза печени, поскольку известно, что экскреция меченных радиоактивной меткой интегрин-связывающих RGD-пептидов осуществляется главным образом через гепатобилиарную систему (Haubner 1999, J. Nuc. Med.; 40:1061-71). К тому же, как упомянуто выше, коллаген не является идеальным маркером активного фиброза, поскольку может быть обнаружен, когда процесс заболевания разрешен, а также на поздних стадиях активного заболевания. Будет более благоприятным выявление ранней, активной стадии, когда применение схемы лечения, вероятно, более адекватно и, также вероятно, более клинически эффективно, например, ранних стадий фиброза при NASH до развития цирроза печени. Следовательно, существует необходимость в способе идентификации ранних стадий фиброза печени (также называемых "фиброгенезом") и тем самым во вмешательстве в процесс заболевания на стадии, когда лечение может быть наиболее эффективным.
Краткое изложение сущности изобретения
Настоящее изобретение относится к способу, полезному в облегчении идентификации фиброгенеза в печени субъекта. Согласно изобретению также предложено соединение для применения в способе идентификации фиброгенеза в печени субъекта. Другой аспект изобретения относится к соединению для применения в изготовлении лекарственного средства для применения в способе идентификации фиброгенеза в печени субъекта. Настоящее изобретение демонстрирует, что соединения на основе RGD-пептида можно эффективно использовать для детекции активированных звездчатых клеток печени (HSC), тем самым предложен способ, полезный в ранней диагностике фиброза печени.
Краткое описание графических материалов
На Фиг.1 и Фиг.2 показано специфическое связывание Соединения 6 как с активированными звездчатыми клетками печени человека, так и с мембранами ЕА-Ну926. Величина Ki была определена равной ~10 нМ в анализе с использованием мембран ЕА-Ну926, а величина ЕС50 как ~1 нМ в анализе с использованием LX-2-клеток. Специфичность связывания в LX-2-анализе была показана на основании специфического ингибирования связывания Соединения 6 нерадиоактивным Соединением 6. Низкоаффинное соединение с "перестановленной" структурой, взятое в качестве отрицательного контроля, не связывается с интегринами или активированными звездчатыми клетками.
На Фиг.3 продемонстрировано специфическое поглощение Соединения 8 печенью крыс с лигированными желчными протоками (BDL) в сравнении с RGD-пептидом с "испорченной" структурой, взятым в качестве отрицательного контроля, для которого не наблюдали никакого поглощения печенью. Кроме того, поглощение печенью при BDL было пропорционально степени фиброгенеза, причем максимальное поглощение наблюдали на 10-е и 15-е сутки после операции, когда фиброгенез находится на своем максимальном уровне.
На Фиг.4 показана значительная положительная регуляция альфаv-интегрина при BDL на 15-е сутки после операции. В совокупности с Фиг.4, Фиг.5 демонстрирует корреляцию между экспрессией альфаv-интегрина и поглощением соединения в печени животных с BDL в каждый момент времени после операции.
Подробное описание изобретения
В одном из аспектов настоящее изобретение относится к соединению формулы I для применения в способе определения наличия, локализации и/или степени фиброгенеза в печени субъекта, включающем следующие стадии:
(1) предоставление субъекта, которому введено детектируемое количество соединения формулы I;
(2) предоставление возможности соединению формулы I связаться с любой тканью, характеризующейся фиброгенезом, в указанной печени;
(3) детекция сигналов, испускаемых указанным соединением формулы I, способом визуализации in vivo; и
(4) генерирование изображения, отображающего локализацию и/или величину указанных сигналов;
где указанное соединение формулы I определено следующим образом:
где:
G представляет собой глицин;
D представляет собой аспарагиновую кислоту;
X1 представляет собой аминокислоту, выбранную из аспарагиновой кислоты, глутаминовой кислоты, лизина, гомолизина или С3-6 диаминоалкановой кислоты или их производных;
Х2 и Х4 независимо представляют собой аминокислотные остатки, боковые цепи которых соединены вместе с образованием циклизующего мостика, такие как остатки цистеина или гомоцистеина, образующие дисульфидные или простые тиоэфирные связи, либо других аминокислот, способных к образованию циклизующего мостика, таких как аспарагиновая кислота и лизин;
Х3 представляет собой аргинин, N-метиларгинин или миметик аргинина;
Х5 представляет собой тирозин, фенилаланин, 3-йод-тирозин, С4-6 циклоалкилаланин или нафтилаланин или их производные;
Х6 представляет собой тиол-содержащую аминокислоту, которая образует либо простую тиоэфирую связь, либо тиоацетальную связь, соединяющую Х6 с группой С(=О);
W1 и W2 независимо представляют собой возможную линкерную группировку, где W1, когда присутствует, соединен с группировкой боковой цепи аминокислоты X1, и W2, когда присутствует, соединен с карбоксигруппой в Х6; и
Z1 и Z2 независимо представляют собой визуализирующую группировку, группировку сахара и группировку органического красителя или водород, при условии, что по меньшей мере один из Z1 и Z2 представляет собой визуализирующую группировку.
Для указанного соединения формулы I:
X1 предпочтительно представляет собой лизин;
Х2 и Х4 предпочтительно независимо представляют собой цистеин или гомоцистеин и наиболее предпочтительно оба представляют собой цистеин;
Х3 предпочтительно представляет собой аргинин;
Х5 предпочтительно представляет собой циклогексилаланин, фенилаланин или 3-йод-тирозин и наиболее предпочтительно фенилаланин;
Х6 предпочтительно представляет собой цистеин или гомоцистеин и наиболее предпочтительно цистеин.
В предпочтительном воплощении соединения формулы I:
X1 представляет собой лизин;
Х2 и Х4 независимо представляют собой цистеин или гомоцистеин;
Х3 представляет собой аргинин;
Х5 представляет собой фенилаланин или 3-йод-тирозин; и
Х6 представляет собой цистеин или гомоцистеин.
В наиболее предпочтительном воплощении соединения формулы I:
X1 представляет собой лизин;
Х2 и Х4 оба предстаавляют собой цистеин;
Х3 представляет собой аргинин;
Х5 представляет собой фенилаланин; и
Х6 представляет собой цистеин.
В соответствии с настоящим изобретением термин "фиброгенез" относится, в частности, к активной, прогрессирующей стадии фиброза, когда, среди других событий, звездчатые клетки печени (HSC) активированы и экспрессируют интегрины. HSC по праву считаются основными фиброкомпетентными клетками печени. При фиброгенезе HSC активируются и пролиферируют, но при разрешении фиброза наблюдается обширный апоптоз HSC, который сопровождается разрушением рубцовой ткани печени. Кроме того, при фиброгенезе отложения компонентов внеклеточного матрикса (ЕСМ), таких как коллаген, пока не происходит.Следовательно, присутствие компонентов ЕСМ является характеристикой более поздних стадий фиброза и разрешения фиброза. Поэтому выявление процесса заболевания во время фиброгенеза обеспечивает лучшее указание на активную форму заболевания, при которой применение лечения будет наиболее адекватно.
В настоящем изобретении "аминокислота" состоит из аминогруппы, карбоксильной группы, атома водорода и группировки боковой цепи аминокислоты, при этом все они соединены (в случае альфа-аминокислоты) с одним атомом углерода, обозначаемым как альфа-углерод. Аминокислоты включают природные аминокислоты, но этим не ограничиваются. Природными аминокислотами являются такие аминокислоты, из остатков которых образованы природные белки, и они хорошо известны специалистам в области, соответствующей настоящему изобретению. Термин "ее производные", когда его используют в данном описании применительно к аминокислоте, означает аминокислоту, боковая цепь которой представляет собой производное по боковой цепи природной аминокислоты (см. "Amino Acid Derivatives", 1999, Oxford University Press, Barrett, Ed.).
Под термином "миметик аминокислоты" понимают синтетические аналоги природных аминокислот, которые представляют собой изостеры, то есть разработаны с целью имитации пространственной и электронной структуры природного соединения. Такие изостеры хорошо известны специалистам в данной области техники и включают депсипептиды, ретроинверсопептиды, тиоамиды, циклоалканы или 1,5-дизамещенные тетразолы (см. М. Goodman, Biopolymers, 24, 137, (1985)), но не ограничиваются ими.
Термин "циклизующий мостик" относится к любой комбинации аминокислот или аминокислот и групп -(СН2)0- или -(СН2)0-С6Н4- с функциональными группами, позволяющими введение мостика (где о представляет собой положительное целое число от 1 до 10). Предпочтительными примерами являются дисульфиды, дисульфидные миметики, такие как карбамостик -(СН2)4-, тиоацеталь, мостики на основе простого тиоэфира (цистатион или лантионин), мостики, содержащие сложные эфиры и простые эфиры, и амидные мостики. Предпочтительно, чтобы один мостик образовывал дисульфидную связь, а второй мостик содержал простую тиоэфирную (сульфидную) связь. Если циклизующий мостик образован двумя аминокислотами, как в случае Х2 и Хд, например, то боковая цепь одного из цистеинов или гомоцистеинов присоединена к боковой цепи одной из аминокислот цистеина, гомоцистеина, серина, треонина или альдегид-содержащей аминокислоты с образованием циклизующего мостика.
"Миметиком аргинина" является синтетический аналог природного аргинина, который представляет собой изостер, подобно тому, как определено выше для аминокислотного миметика.
Пептидная часть соединения формулы I может быть синтезирована с использованием всех известных способов химического синтеза, но особенно полезной является методология твердофазного синтеза Меррифилда, в которой применяют автоматический пептидный синтезатор (J. Am. Chem. Soc, 85: 2149 (1964)). Стандартные процедуры стратегии синтеза описаны в Е. Atherton & R.C. Sheppard, "Solid Phase Peptide Synthesis: a Practical Approach", 1989, IRL Press, Oxford.
Для синтеза используют смолу с кислотолабильной линкерной группой, к которой посредством образования амидной связи присоединен остаток желаемой, защищенной с С-конца аминокислоты. Например, может быть использована так называемая высвобождающая амидную группу АМ-смола Ринка (Rink amide AM resin) с линкером (диметоксифенил-аминометил)-фенокси- (Rink, Н. (1987), Tetrahedron Lett. 30, p.3787). В результате отщепления пептида от этой смолы под действием кислоты будет образовываться амид пептида. Альтернативно, можно использовать О-бис-(аминоэтил)этиленгликоль-тритил-смолу (K. Barlos et al. (1988), Liebigs Ann. Chem., p.1079), в результате отщепления от которой под действием кислоты образуется пептид с первичным амином в виде "ручки".
Мечение визуализирующей группировкой может быть соответственно осуществлено посредством "соединения-предшественника", которое является производным указанного соединения формулы I, разработанным таким образом, чтобы химическая реакция с подходящей химической формой желаемой визуализирующей группировки/группировок для получения желаемого соединения формулы I протекала сайт-специфическим образом; могла быть проведена за минимальное число стадий (в идеальном случае за одну стадию); и без необходимости существенной очистки (в идеальном случае без какой-либо дополнительной очистки). Такие соединения-предшественники являются синтетическими и соответственно могут быть получены с хорошей степенью химической чистоты. Соединение-предшественник возможно может содержать одну или более защитных групп для конкретных функциональных групп соединения формулы I.
Под термином "защитная группа" понимают группу, которая ингибирует или подавляет нежелательные химические реакции, но которая разработана таким образом, что оказывается весьма реакционноспособной для возможного отщепления ее от рассматриваемой функциональной группы в достаточно мягких условиях, при которых остальная часть молекулы не модифицируется. После удаления защиты получают желаемый продукт. Защитные группы хорошо известны специалистам в данной области техники и соответственно выбраны, для аминогрупп, из: Вое (где Вое представляет собой трет-бутилоксикарбонил), Fmoc (где Fmoc представляет собой флуоренилметоксикарбонил), трифторацетила, аллилоксикарбонила, Dde (то есть 1-(4,4-диметил-2,6-диоксоциклогексилиден)этила) или Npys (то есть 3-нитро-2-пиридин-сульфенила); и для карбоксильных групп: из метилового сложного эфира, трет-бутилового сложного эфира или бензилового сложного эфира. Для гидроксильных групп подходящими защитными группами являются: метил, этил или трет-бутил; алкоксиметил или алкоксиэтил; бензил; ацетил; бензоил; тритил (Trt) или триалкилсилил, такой как тетрабутилдиметилсилил. Для тиоловых групп подходящими защитными группами являются: тритил и 4-метоксибензил. Использование дополнительных защитных групп описано в "Protective Groups in Organic Synthesis", Theorodora W. Greene and Peter G.M. Wuts (3-е издание, John Wiley & Sons, 1999).
"Линкерная группировка" по настоящему изобретению представляет собой радикал формулы -(L)n-, где:
каждый L независимо представляет собой -С(=О)-, -CR′2-, -CR′=CR′-, -ОС-, -CR′2CO2-, -CO2CR′2-, -NR′-, -NR′CO-, -CONR′-, -NR′(C=O)NR′-, -NR′(C=S)NR′-, -SO2NR′-, -NR′SO2-, -CR′2OCR′2-, -CR′2SCR′2-, -CR′2NR′CR′2-, С4-8 циклогетероалкиленовую группу, С4-8 циклоалкиленовую группу, С5-12 ариленовую группу, С3-12 гетероариленовую группу, группировку аминокислоты, полиалкиленгликоля, полимолочной кислоты или полигликолевой кислоты;
n представляет собой целое число от 1 до 15;
каждая группа R′ независимо представляет собой Н или С1-10алкил, С3-10алкиларил, С2-10алкоксиалкил, С1-10гидроксиалкил, С1-10фторалкил, либо 2 или более групп R′ вместе с атомами, к которым они присоединены, образуют карбоциклическое гетероциклическое насыщенное или ненасыщенное кольцо;
при условии, что указанная линкерная группировка представляет собой цепь, состоящую не более чем из 100 атомов, предпочтительно не более чем из 50 атомов. Линкерная группировка наиболее предпочтительно представляет собой цепь из 10-50 атомов и особенно предпочтительно цепь из 10-30 атомов. Предпочтительными группами L являются -С(=О)-, -СН2-, -NH-, -NHC(=O)-, -C(=O)NH-, -CH2-O-CH2- и аминокислоты.
Предпочтительно, чтобы линкер действовал как группировка-биомодификатор. "Группировка-биомодификатор" функционирует в качестве группировки, модифицирующей фармакокинетику и скорости клиренса из крови соединения формулы I. Примером подходящей группировки-биомодификатора является группировка на основе монодисперсного полиэтиленгликолевого (ПЭГ) структурного звена, содержащего 1-10 единиц указанного структурного звена. В дополнение к этому, указанная группировка-биомодификатор также может быть представлена 1-10 аминокислотными остатками. Предпочтительными аминокислотными остатками для указанной группировки-биомодификатора являются остатки заряженных аминокислот, таких как лизин и глутаминовая кислота, или заряженных неприродных аминокислот, таких как цистеиновая кислота и фосфоноаланин. Кроме этого, могут быть включены аминокислоты глицин, аспарагиновая кислота и серии. В предпочтительном воплощении группировка-биомодификатор содержит монодисперсную ПЭГ-подобную структуру 17-амино-5-оксо-6-аза-3,9,12,15-тетраоксагептадекановую кислоту формулы II:
где m представляет собой целое число от 1 до 10 и где С-концевое звено представляет собой амидную группировку. Такая группировка-биомодификатор действует, модифицируя фармакокинетику и скорости клиренса соединений из крови. Функция группировки-биомодификатора в настоящем изобретении заключается в снижении поглощения в тканях и увеличении экскреции через почки, приводя в результате к уменьшению фоновых помех и получению лучшего изображения in vivo. Кроме того, группировка-биомодификатор может представлять собой группировку, предпочтительно являющуюся производным глутаровой и/или янтарной кислоты, и/или звеном на основе полиэтиленгликоля, и/или звеном соединения формулы II, которое проиллюстрировано выше. Природа линкерной группировки не должна препятствовать аффинности соединения формулы I к своим рецепторам-мишеням. К тому же, линкерная группировка не должна увеличивать фоновое поглощение печенью соединения формулы I, как это может происходить, например, если были использованы чрезмерно большие звенья на основе полиэтиленгликоля.
Когда либо Z1, либо Z2 представляет собой группировку сахара, то она тоже может действовать как группировка-биомодификатор. "Группировка сахара" представляет собой углеводную группу, обычно являющуюся альдегидным или кетоновым производным многоатомного спирта. Она может представлять собой мономер (моносахарид), такой как фруктоза или глюкоза, или два сахара, соединенные вместе с образованием дисахарида. Дисахариды включают такие сахара, как сахароза, которая состоит из глюкозы и фруктозы. Термин "сахар" включает как замещенные, так и незамещенные сахара и производные Сахаров. Предпочтительно, сахар выбран из глюкозы, глюкозамина, галактозы, галактоза ми на, маннозы, лактозы, фукозы и их производных, таких как сиаловая кислота, производное глюкозамина. Сахар предпочтительно представляет собой α- или β-аномер. В частности, сахар может быть манно- или галакто-пиранозидом. Гидроксильные группы в молекуле сахара могут быть защищены, например одной или более чем одной ацетильной группой. Группировка сахара предпочтительно N-ацетилирована. Предпочтительные примеры таких Сахаров включают N-ацетил-галактозамин, сиаловую кислоту, нейраминовую кислоту, N-ацетилгалактозу и N-ацетил-глюкозамин.
"Группировкой органического красителя" может быть любой органический краситель, который взаимодействует со светом в диапазоне длин волн в электромагнитном спектре от ультрафиолетового света до ближнего инфракрасного. Предпочтительные группировки органического красителя включают группы, имеющие пространственно делокализованную электронную систему. Наиболее предпочтительной группировкой органического красителя является цианиновый краситель (CyDye™). Цианиновые красители представляют собой соединения, определяемые полиеновой цепью, содержащей нечетное количество атомов углерода, связанных чередующимися одиночными и множественными, предпочтительно двойными, углерод-углеродными связями, заканчивающейся на каждом из двух концов аминогруппой, одна из которых кватернизирована. Цианиновые и аналогичные арил-линкер-арил-содержащие хромофоры возможно несут боковые или конденсированные кольцевые заместители. Общее описание цианиновых красителей и их синтез описаны в US 6048982, US 5268486 и ЕР 1037947. Цианиновые красители для настоящего изобретения предпочтительно выбраны из группы, содержащей карбоцианины, оксацианины, тиацианины и азацианины.
Стадия "детекции" изложенного в данном описании способа включает детекцию сигналов, испускаемых "визуализирующей группировкой" соединения формулы I, с помощью детектора, чувствительного к указанным сигналам. Данную стадию детекции также можно понимать как сбор данных сигнала. Примерами сигналов, испускаемых визуализирующей группировкой, подходящих для применения в настоящем изобретении, являются любые, которые могут быть подвергнуты детекции: (1) вне организма человека, такие как гамма-излучение; или (2) посредством использования детекторов, разработанных для применения in vivo, таких как радиационные детекторы, разработанные для использования во время проведения операции. Стадию "генерирования" изложенного в данном описании способа осуществляют, используя компьютер с применением алгоритма реконструкции к полученным данным сигнала с получением на выходе набора данных. Этот набор данных затем обрабатывают, генерируя изображения, показывающие интересуемые области внутри субъекта.
Визуализирующая группировка соединения по изобретению предпочтительно выбрана из:
(1) иона радиоактивного металла;
(2) гамма-испускающего радиоактивного галогена;
(3) позитрон-испускающего радиоактивного вещества, не являющегося металлом; и
(4) иона парамагнитного металла.
Когда визуализирующая группировка представляет собой ион радиоактивного металла, то есть радиоактивный металл, подходящие радиоактивные металлы могут быть либо позитрон-испускающими, такими как 64Cu, 48V, 52Fe, 55Co, 94mTc или 68Ga; либо γ-испускающими, такими как 99mTc, 111In 113mIn или 67Ga. Предпочтительными радиоактивными металлами являются 99mTc, 64Cu, 68Ga и 111In. Наиболее предпочтительные радиоактивные металлы являются у-испускающими, особенно 99mTc.
Когда визуализирующая группировка представляет собой ион парамагнитного металла, такие подходящие ионы металлов включают: Gd(III), Mn(II), Cu(II), Cr(III), Fe(III), Co(II), Er(II), Ni(II), Eu(III) или Dy(III). Предпочтительными ионами парамагнитных металлов являются ионы Gd(III), Mn(II) и Fe(III), причем особенно предпочтителен Gd(III).
Когда визуализирующая группировка соединения формулы I представляет собой ион металла, он предпочтительно присутствует в виде металлического комплекса иона металла с синтетическим лигандом. Под термином "металлический комплекс" понимают координационный комплекс иона металла с одним или более чем одним лигандом. Строго предпочтительно, чтобы металлический комплекс был "устойчив к транс-хелатированию", то есть не подвергался легко обмену лиганда на другие лиганды, потенциально конкурирующие за центры координации металла. Потенциально конкурирующие лиганды включают другие эксципиенты в композиции in vitro (например, радиопротекторы или антимикробные консерванты, используемые в такой композиции) или эндогенные соединения in vivo (например, глутатион, трансферрин или белки плазмы). Термин "синтетический" имеет общепринятое значение, то есть искусственный, в противоположность выделенному из природных источников, например, из организма млекопитающего. Преимущество таких соединений заключается в том, что их получение и состав примесей можно полностью контролировать.
Лиганды, подходящие для применения в настоящем изобретении, которые образуют металлические комплексы, устойчивые к транс-хелатированию, включают: хелатирующие агенты, где 2-6, предпочтительно 2-4 донорных (для металла) атома организованы таким образом, что в результате образуются 5- или 6-членные хелатные кольца (имеющие при этом не образующий координационных связей остов, составленный или из атомов углерода, или из не образующих координационных связей гетероатомов, соединенных с донорными для металла атомами); или монодентатные лиганды, содержащие донорные атомы, которые образуют прочную связь с ионом металла, такие как изонитрилы, фосфины или диазениды. Примерами типов донорных атомов, которые хорошо связываются с металлами, как части хелатирующих агентов являются: амины, тиолы, амиды, оксимы и фосфины. Фосфины образуют такие прочные металлические комплексы, что даже монодентатные или бидентатные фосфины образуют подходящие металлические комплексы. Линейная геометрия изонитрилов и диазенидов такова, что она не позволяет им легко инкорпорировать в хелатирующие агенты, и поэтому их обычно используют в качестве монодентатных лигандов. Примеры подходящих изонитрилов включают простые алкилизонитрилы, такие как трет-бутилизонитрил, и эфир-замещенные изонитрилы, такие как MIBI (то есть 1-изоциано-2-метокси-2-метилпропан). Примеры подходящих фосфинов включают тетрофосмин и монодентатные фосфины, такие как трис(3-метоксипропил)фосфин. Примеры подходящих диазенидов включают лиганды серии HYNIC (гидразиноникотинамидов), то есть гидразин-замещенные пиридины или никотинамиды.
Когда ионом металла является ион технеция, подходящие хелатирующие агенты, образующие металлические комплексы, устойчивые к транс-хелатированию, включают, но этим не ограничиваются:
(1) диоксимы диаминов;
(2) N3S-лиганды, имеющие тиолтриамидный набор донорных атомов, такие как MAG3 (меркаптоацетилтриглицин), и родственные лиганды; или имеющие диамидпиридинтиоловый набор донорных атомов, такие как Pica (пиколинамид);
(3) N2S2-лиганды, имеющие диаминдитиоловый набор донорных атомов, такие как ВАТ (бисаминоэтантиол) или ECD (то есть димер этилцистеината), или амидаминдитиоловый набор донорных атомов, такие как МАМА (моноаминмоноамид);
(4) N4-лиганды с открытой цепью или макроциклические лиганды, имеющие тетраминовый, амидтриаминовый или диамиддиаминовый набор донорных атомов, такие как циклам (1,4,8,11-тетраазациклотетрадекан), монооксоциклам, диоксоциклам; и
(5) N2O2-лиганды, имеющие диаминдифенольный набор донорных атомов.
Предпочтительными хелатирующими агентами по изобретению, когда визуализирующая группировка представляет собой технеций, являются диоксимы диаминов и тетраамины, предпочтительные варианты которых теперь будут описаны более подробно.
Предпочтительными диоксимами диаминов являются соединения формулы VII:
где каждый из Е1-Е6 независимо представляет собой группу R*;
каждый R* представляет собой Н или С1-10алкил, С3-10алкиларил, С2-10алкоксиалкил, С1-10гидроксиалкил, С1-10фторалкил, С2-10карбоксиалкил или C1-10аминоалкил, или две или более групп R* вместе с атомами, к которым они присоединены, образуют карбоциклическое гетероциклическое насыщенное или ненасыщенное кольцо, и где одна или более групп R* конъюгирована с СВР;
и Q′ представляет собой мостиковую группу формулы -(J′)e-;
где е равно 3, 4 или 5, и каждый J′ независимо представляет собой -О-, -NR*- или -C(R*)2-, при условии что -(J′)e- содержит максимально одну группу J′, представляющую собой -О- или -NR*-.
Предпочтительные группы Q′ приведены ниже:
Q′ представляет собой -(CH2)(CHR*)(CH2)-, то есть оксим пропиленамина или производные PnAO;
Q′ представляет собой -(CH2)2(CHR*)(CH2)2-, то есть оксим пентиленамина или производные PentAO;
Q′ представляет собой -(CH2)2NR*(CH2)2-.
Е1-Е6 предпочтительно выбраны из: C1-3алкила, алкиларила, алкоксиалкила, гидроксиалкила, фторалкила, карбоксиалкила или аминоалкила. Наиболее предпочтительно, каждая группа Е1-Е6 представляет собой СН3.
Диоксим диамина предпочтительно конъюгирован либо с группой R* в Е1 или Е6, либо с группой R* группировки Q′. Наиболее предпочтительно, чтобы он был конъюгирован с группой R* группировки Q′. Если он конъюгирован с группой R* группировки Q′, то группа R* предпочтительно находится в положении головы мостика. В таком случае Q′ предпочтительно представляет собой -(CH2)(CHR*)(CH2)-, -(CH2)2(CHR*)(CH2)2- или -(CH2)2NR*(CH2)2-, наиболее предпочтительно -(CH2)2(CHR*)(CH2)2-. Особенно предпочтительный диоксим диамина имеет формулу VIIa:
где:
каждый из Е7-Е20 независимо представляет собой группу R*, которая определена выше;
G представляет собой N или CR*; и
Y′ представляет собой место присоединения к пептидной части соединения формулы I.
Предпочтительным хелатором формулы VIIa является соединение формулы VIIb:
где G является таким, как определено выше, и предпочтительно представляет собой СН. Способ получения Хелата I описан в WO 03/006070.
Предпочтительными тетрааминными хелаторами являются соединения формулы VIII:
где:
Y′′ представляет собой точку присоединения к остатку соединения формулы I; и
Е21-Е26 представляют собой группы R*, которые определены ранее.
Наиболее предпочтительный тетрааминный хелатор имеет формулу VIIIa:
где Y" является таким, как определено выше. Способ синтеза хелатора формулы VIIIa описан в WO 06/008496.
Вышеописанные лиганды особенно подходят для образования комплексов с технецием, например, 94mTc или 99mTc, и более полно описаны Jurisson и соавт.(Chem.Rev., 99, 2205-2218 (1999)). Данные лиганды также полезны для других металлов, таких как медь (64Cu или 67Cu), ванадий (например, 48V), железо (например, 52Fe) или кобальт (например, 55Со).
Другие подходящие лиганды описаны в WO 91/01144 (Sandoz), где включены лиганды, которые особенно подходят для индия, иттрия и гадолиния, особенно лиганды на основе макроциклических аминокарбоксилата и аминофосфоновой кислоты. Лиганды, образующие неионные (то есть нейтральные) металлические комплексы с гадолинием, известны и описаны в US 4885363. Особенно предпочтительными для гадолиния являются хелаторы, включая DTPA (диэтилентриамин-пентауксусную кислоту), этилендиамин-тетрауксусную кислоту (EDTA), триэтилентетраамин-гексауксусную кислоту (ТТНА), 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусную кислоту (DOTA), 10-(2-гидроксипропил)-1,4,7,10-тетраазациклододекан-1,4,7-триуксусную ки