Производные хиназолина, ингибирующие активность egfr
Иллюстрации
Показать всеНастоящее изобретение относится к новым производным хиназолина формулы
, где каждый из R1, R2 и R5, независимо, представляет собой Н; один из R3 и R4 представляет собой
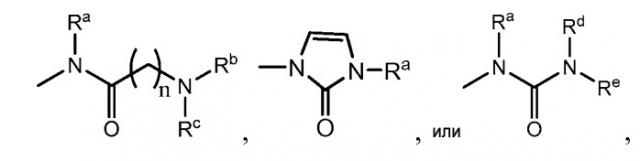
где n - 1 или 2; каждый Ra представляет собой Н, С1-10алкил, необязательно замещенный заместителем, выбранным из группы, включающей С1-10алкокси, С1-10алкансульфонил, карбоксигруппу, 5-6-членный моноциклический гетероциклоалкил, имеющий один или несколько гетероатомов, выбранных из О и N, где атом N может быть замещен C1-10алкилом, фенил, необязательно замещенный галогеном, 5-6-членный моноциклический гетероарил, имеющий один или несколько гетероатомов, выбранных из N и S, 7-членный бициклический гетероциклоалкил, имеющий 2 атома N; С2-10алкенил; С2-10алкинил; циклоалкил, представляющий собой насыщенную циклическую группу, содержащую 3-6 атомов углерода; каждый из Rb и Rc, независимо, представляет собой Н или С1-10алкил, необязательно замещенный С1-10алкокси, или Rb и Rc, вместе с атомом азота, с которым они связаны, образуют бициклическое кольцо следующей формулы:
где каждый из m1, m2, m3 и m4 - 0, 1 или 2; А - СН; В - NR, где R - Н или С1-10алкил; и каждый из Ri, Rii, Riii, Riv, Rv, Rvi, Rvii и Rviii - Н; или 6-7-членный моноциклический гетероциклоалкил, содержащий 1-2 атома N, необязательно замещенный заместителем, выбранным из группы, включающей гидрокси, С1-10алкил, необязательно замещенный С1-10алкокси, С1-10алкил, необязательно замещенный С3-6циклоалкилом; и каждый из Rd и Re, независимо, представляет собой Н, С2-10алкенил; С2-10алкинил; или C1-10алкил, необязательно замещенный заместителем, выбранным из группы, включающей С1-10алкилокси, гидрокси, CN, 5-6-членный моноциклический гетероциклоалкил, имеющий 1 или 2 атома N, необязательно замещенный С1-10алкилом, галогеном или 5-6-членным гетероциклоалкилом, имеющим 1 атом N, фенил, необязательно замещенный галогеном, циклоалкил, представляющий собой насыщенную циклическую группу, содержащую 3-6 атомов углерода, 5-6-членный моноциклический гетероарил, имеющий один или 2 атома N; или Rd и Re, вместе с азотом, с которым они связаны, образуют 5-6-членный насыщенный гетероциклоалкил, имеющий 1-2 гетероатома, выбранных из N и О, необязательно замещенный заместителем, выбранным из группы, включающей C1-10алкил (который необязательно замещен С3-6циклоалкилом, С1-10алкокси, галогеном), 5-членный гетероциклоалкил, имеющий один атом N, галоген, C1-10алкансульфонил, С1-10алкилкарбонил, необязательно замещенный галогеном; или Rd и Re, вместе с азотом, с которым они связаны, образуют 7-10-членный, насыщенный, бициклический гетероциклоалкил, содержащий 1-2 гетероатома, выбранных из N и О, необязательно замещенный C1-10алкилом; а другой из R3 и R4 представляет собой Н, галоген или С1-10алкокси; Х представляет собой NRf где Rf представляет собой Н; Y представляет собой фенил, замещенный C2-4 алкинилом; и Z представляет собой N. Также изобретение относится к конкретным производным хиназолина, фармацевтической композиции на его основе и способу лечения рака. Технический результат: получены новые производные хиназолина, ингибирующие активность EGFR. 4 н. и 7 з.п. ф-лы, 171 пр.
Реферат
Перекрестная ссылка на родственные заявки
По данной заявке испрашивается приоритет согласно заявке на патент США No. 12/164610, поданной 30 июня 2008 г. Ее содержание включено в настоящее описание путем ссылки во всей своей полноте.
Предпосылки создания изобретения
Связывание эпидермального фактора роста (EGF) с рецептором эпидермального фактора роста (EGFR) активирует активность тирозинкиназы и тем самым запускает реакции, которые ведут к пролиферации клеток. Сверхэкспрессия и сверхактивность EGFR может приводить к некотролируемому делению клеток - предрасположенность к раку. См., например, Science, 2004, 304:1497-1500.
Соответственно, соединения, которые инигибируют сверхэкспрессию и сверхактивность EGFR, представляют собой потенциальные кандидаты для лечения рака.
Краткое изложение сущности изобретения
Данное изобретение основано на открытии того факта, что ряд хиназолиновых соединений ингибирует активность EGFR.
В одном аспекте данное изобретение относится к соединению следующей формулы:
где каждый из R1, R2 и R5, независимо, представляет собой H, галоген, нитро, амино, циано, гидрокси, алкил, алкенил, алкинил, арил, циклоалкил, гетероциклоалкил, гетероарил, алкокси, алкилтио, алкилкарбонил, карбокси, алкоксикарбонил, карбониламино, сульфониламино, аминокарбонил или аминосульфонил; один из R3 и R4 представляет собой
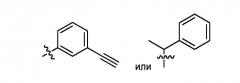
где n представляет собой 1, 2, 3, 4 или 5; каждый из Ra, Rb и Rc, независимо, представляет собой H, алкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил или гетероарил, или Rb и Rc, вместе с атомом азота, с которым они связаны, образуют 3-12 членное, насыщенное, ненасыщенное или ароматическое кольцо, содержащее 1-3 гетероатома, выбранных из N, O и S; и каждый из Rd и Re, независимо, представляет собой H, алкил, алкенил или алкинил; или Rd и Re, вместе с азотом, с которым они связаны, образуют 3-12 членное, насыщенное, ненасыщенное или ароматическое кольцо, содержащее 1-3 гетероатома, выбранных из N, O и S; а другой из R3 и R4 представляет собой H, галоген, нитро, амино, циано, гидрокси, алкил, алкенил, алкинил, арил, циклоалкил, гетероциклоалкил, гетероарил, алкокси, алкилтио, алкилкарбонил, карбокси, алкоксикарбонил, карбониламино, сульфониламино, аминокарбонил или аминосульфонил; X представляет собой O, S, или NRf, где Rf представляет собой H, алкил, алкенил, алкинил, арил, циклоалкил, гетероциклоалкил, гетероарил, алкилкарбонил, алкоксикарбонил, аминокарбонил или аминосульфонил; Y представляет собой фенил, необязательно замещенный галогеном, нитро, циано, алкилом, алкенилом или алкинилом, или необязательно является сконденсированным с другим 3-8 членным кольцом; или Y представляет собой алкил, замещенный фенилом, который необязательно является замещенным галогеном, нитро, циано, алкилом, алкенилом или алкинилом, или необязательно является сконденсированным с другим 3-8 членным кольцом; и Z представляет собой N или C-CN.
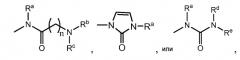
Ссылаясь на вышеуказанную формулу, одна подгруппа соединений характеризуется тем, что один из R3 и R4 представляет собой
,
где n равно 1, и каждый из Ra, Rb и Rc, независимо, представляет собой H, алкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил или гетероарил.
Другая подгруппа соединений характеризуется тем, что один из R3 и R4 представляет собой
,
где n представляет собой 1 или 2; Ra представляет собой H, алкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил или гетероарил; и Rb и Rc, вместе с атомом азота, с которым они связаны, образуют 3-12 членное, насыщенное, ненасыщенное или ароматическое кольцо, содержащее 1-3 гетероатома, выбранных из N, O и S. В некоторых соединениях Rb и Rc, вместе с атомом азота, с которым они связаны, образуют бициклическое кольцо следующей формулы:
где каждый из m1, m2, m3 и m4, независимо, представляет собой 0, 1, 2 или 3; A представляет собой N или CR; B представляет собой NR или CRR', каждый R и R', независимо, представляет собой H, алкил или галоген; и каждый из Ri, Rii, Riii, Riv, Rv, Rvi, Rvii и Rviii, независимо, представляет собой H, алкил или галоген.
Еще одна подгруппа соединений характеризуется тем, что один из R3 и R4 представляет собой
,
где Ra представляет собой H, алкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил или гетероарил.
Еще одна подгруппа соединений характеризуется тем, что один из R3 и R4 представляет собой
где Ra представляет собой H, алкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил или гетероарил; и каждый из Rd и Re, независимо, представляет собой H, алкил, алкенил или алкинил; или Ra представляет собой H, алкил, алкенил или алкинил; и Rd и Re, вместе с азотом, с которым они связаны образуют 3-12 членное, насыщенное, ненасыщенное или ароматическое кольцо, содержащее 1-3 гетероатома, выбранных из N, O и S.
Следующая другая группа соединений характеризуется тем, что X представляет собой O, NH или N-CH3; Z представляет собой N; или Y представляет собой
.
Термин "алкил" в данном описании относится к линейному или разветвленному углеводороду, содержащему 1-10 атомов углерода. Примеры алкильных групп включают, но не ограничиваются указанным, метил, этил, н-пропил, изопропил, н-бутил, изобутил и трет-бутил. Термин "алкокси" относится к -O-алкилу.
Термин "алкенил" в данном описании относится к C2-10 линейному или разветвленному углеводороду, содержащему одну или более C=C двойных связей. Примеры алкенильных групп включают, но не ограничиваются указанным, винил, 2-пропенил и 2-бутенил.
Термин "алкинил" в данном описании относится к C2-10 линейному или разветвленному углеводороду, содержащему одну или более C≡C тройных связей. Примеры алкинильных групп включают, но не ограничиваются указанным, этинил, 2-пропинил и 2-бутинил.
Термин "арил" относится к 6-углеродной моноциклической, 10-углеродной бициклической, 14-углеродной трициклической ароматической кольцевой системе, где каждое кольцо может иметь 1-4 заместителя. Примеры арильных групп включают, но не ограничиваются указанным, фенил, нафтил и антраценил.
Термин "циклоалкил" относится к насыщенной и частично ненасыщенной циклической углеводородной группе, имеющей 3-12 углеродов. Примеры циклоалкильных групп включают, но не ограничиваются указанным, циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил, циклогептил и циклооктил.
Термин "гетероарил" относится к ароматической 5-8-членной моноциклической, 8-12-членной бициклической или 11-14-членной трициклической кольцевой системе, имеющей один или несколько гетероатомов (таких как O, N или S). Примеры гетероарильных групп включают пиридил, фурил, имидазолил, бензимидазолил, пиримидинил, тиенил, хинолинил, индолил и тиазолил. Термин "гетероаралкил" относится к алкильной группе, замещенной гетероарильной группой.
Термин "гетероциклоалкил" относится к неароматической 3-8-членной моноциклической, 8-12-членной бициклической или 11-14-членной трициклической кольцевой системе, имеющей один или несколько гетероатомов (таких как O, N или S). Примеры гетероциклоалкильных групп включают, но не ограничиваются указанным, пиперазинил, пирролидинил, диоксанил, морфолинил и тетрагидрофуранил. Гетероциклоалкил может представлять собой сахаридное кольцо, например, глюкозил.
Упомянутые в данном описании алкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил, гетероарил и алкокси включают как замещенные, так и незамещенные фрагменты. Примеры заместителей включают, но не ограничиваются указанным, галоген, гидроксил, амино, циано, нитро, меркапто, алкоксикарбонил, амидо, карбокси, алкансульфонил, алкилкарбонил, карбамидо, карбамил, карбоксил, тиоуреидо, тиоцианато, сульфонамидо, алкил, алкенил, алкинил, алкилокси, арил, гетероарил, циклоалкил, гетероциклоалкил, в которых алкил, алкенил, алкинил, алкилокси, арил, гетероарил, циклоалкил, и гетероциклоалкил дополнительно могут быть замещенными.
Описанные выше хиназолиновые соединения включают их фармацевтически приемлемые соли, сольват и пролекаство, если это применимо.
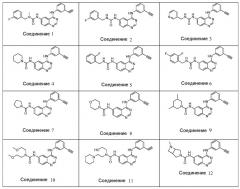
Примеры соединений по данному изобретению показаны ниже:
Другой аспект данного изобретения относится к способу лечения рака. Способ включает введение субъекту, болеющему раком, эффективного количества одного или нескольких хиназолиновых соединений по данному изобретению. Примеры рака, предназначенного для лечения, включают, но не ограничиваются указанным, рак легких, рак головы и шеи, колоректальный рак, рак поджелудочной железы, рак ободочной кишки, рак молочной железы, рак яичника, рак предстательной железы, рак желудка, рак почки, рак печени, рак мозга, рак костей и лейкемию.
Также в объем данного изобретения входят (1) композиция, содержащая одно или несколько описанных выше хиназолиновых соединений и фармацевтически приемлемый носитель, для применения при лечении рака и (2) применение одного или нескольких хиназолиновых соединений для получения лекарственного средства для лечения рака. Подробности одного или более вариантов осуществления данного изобретения приведены в нижеследующем описании. Другие отличительные признаки, задачи и преимущества данного изобретения будут ясны из описания и формулы изобретения.
Подробное описание изобретения
Хиназолиновые соединения по данному изобретению могут быть синтезированы из коммерчески доступных исходных веществ с помощью способов, хорошо известных в данной области. Например, как показано на схеме ниже, можно связать подходящее производное 4-хлорхиназолина с бензольным соединением для получения соединения по данному изобретению.
,
Z представляет собой N или С-CN
X представляет собой O, S, NH или NCH3.
Полученное таким образом соединение может быть дополнительно модифицировано по периферическим положениям для получения других соединений по данному изобретению. Синтетические химические трансформации, которые можно использовать при синтезе целевых хиназолиновых соединений, описаны, например, в R. Larock, Comprehensive Organic Transformations, VCH Publishers (1989); T.W. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis, 3rd Ed., John Wiley and Sons (1999); L. Fieser and M. Fieser, Fieser and Fieser's Reagents for Organic Synthesis, John Wiley and Sons (1994); and L. Paquette, ed., Encyclopedia of Reagents for Organic Synthesis, John Wiley и Sons (1995) и их последующих изданиях.
Перед применением соединения могут быть очищены колоночной хроматографией, высокоэффективной жидкостной хроматографией, кристаллизацией и другими подходящими методами. Хиназолиновые соединения по данному изобретению при контакте с EGFR ингибируют активность данных рецепторов. Эффективное количество одного или нескольких данных соединений соответственно можно использовать для лечения разных видов рака, которые связаны со сверхэкспрессией и сверхактивностью EGFR.
Термин «эффективное количество» относится к количеству хиназолинового соединения, которое требуется для того, чтобы вызвать предназначенный эффект у субъекта. Эффективные количества могут изменяться, как понятно специалистам в данной области, в зависимости от пути введения, применения эксципиента и возможности совместного использования с другими агентами. Термин «лечение» относится к введению одного или нескольких из вышеуказанных хиназолиновых соединений субъекту, который болеет раком или имеет симптомы рака, или имеет предрасположенность к раку с целью излечения, исцеления, облегчения, уменьшения тяжести, изменения, вылечивания, улучшения состояния, облегчения состояния или воздействия на рак, симптомы рака или предрасположенность к раку.
Для практической реализации данного способа композицию, содержащую одно или несколько хиназолиновых соединений по данному изобретению, можно вводить перорально, парентерально или посредством ингаляции спрея или с помощью имплантированного резервуара. Термин «парентерально», как он использован в данном описании, включает подкожный, внутрикожный, внутривенный, внутримышечный, внутрисуставный, внутриартериальный, внутрисиновиальный, внутринадчревный, внутриоболочечный, внутрь пораженного органа, внутричерепной методы инъекции или вливания.
Пероральная композиция может представлять собой любую перорально приемлемую дозированную форму, включая, но не ограничиваясь указанным, таблетки, капсулы, эмульсии и водные суспензии, дисперсии и растворы. Обычно используемые носители для таблеток включают лактозу и кукурузный крахмал. К таблеткам также обычно добавляют лубриканты, такие как стеарат магния. Для перорального введения в виде капсулы используемые разбавители включают лактозу и высушенный кукурузный крахмал. Когда перорально вводят водные суспензии и эмульсии, активный ингредиент может быть суспендирован или растворен в масляной фазе в сочетании с эмульгирующими или суспендирующими агентами. При желании, могут быть добавлены некоторые подсластители, ароматизаторы или красители.
Стерильная композиция для инъекции (например, водная или масляная суспензия) может быть получена в соответствии с методами, известными в данной области с использованием подходящих диспергирующих или смачивающих агентов (такой как, например, Tween 80) и суспендирующих агентов. Стерильные инъекционные препараты также могут представлять собой стерильный инъекционный раствор или суспензию в нетоксичном парентерально приемлемом разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. К приемлемым носителям и растворителям, которые можно использовать, относятся манит, вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла обычно применяют в качестве растворителя или суспендирующей среды (например, синтетические моно или диглицериды). Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, можно использовать при получении инъекционных препаратов, как и природные фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, особенно в их полиоксиэтилированных вариантах. Такие масляные раствор и суспензии также могут содержать длинноцепочечный спиртовой разбавитель или диспергирующее средство, или карбоксиметилцеллюлозу или аналогичные диспергирующие агенты.
Композиция для ингаляции может быть получена в соответствии со способами, хорошо известными в области фармацевтических препаратов, и может быть получена в виде растворов в физиологическом растворе с использованием бензилового спирта или других подходящих консервантов, промоторов всасывания для повышения биодоступности, фторуглеродов и/или других солюбилизирующих или диспергирующих агентов, известных в данной области.
Композиция для наружного применения может быть получена в виде масла, крема, лосьона, мази и тому подобного. Подходящие носители для композиции включают растительное и минеральные масла, белый вазелин (бесцветный мягкий парафин), разветвленные жиры и масла, животные жиры и высокомолекулярные спирты (больше чем С12). Предпочтительными носителями являются те, в которых растворим активный ингредиент. Также могут быть включены эмульгаторы, стабилизаторы, увлажнители и антиоксиданты, а также при желании агенты, придающие цвет и аромат. Кроме того, в таких наружных препаратах дополнительно можно использовать усилители чрезкожной проницаемости. Примеры таких усилителей проницаемости можно найти в патентах США 3989816 и 4444762. Кремы предпочтительно получают из смеси минерального масла, самоэмульгируемого пчелиного воска и воды, с данной смесью смешивают активный ингредиент, растворенный в небольшом количестве масла, такого как миндальное масло. Примером такого крема является крем, который включает примерно 40 частей воды, примерно 20 частей пчелиного воска, примерно 40 частей минерального масла и примерно 1 часть миндального масла. Мази могут быть получены путем смешивания раствора активного ингредиента в растительном масле, таком как миндальное масло, с теплым мягким парафином и охлаждением смеси. Примером такой мази является мазь, которая включает примерно 30% по весу миндального масла и примерно 70% по весу бесцветного мягкого парафина.
Носитель в фармацевтической композиции должен быть «приемлемым» в том смысле, что он является совместимым с активными ингредиентами препарата (и предпочтительно способен их стабилизировать) и не является вредным для субъекта, подвергаемого лечению. Например, солюбилизирующие агенты, такие как циклодекстрины (которые образуют специфические, более растворимые комплексы с одним или несколькими активными хиназолиновыми соединениями экстракта) можно использовать в качестве фармацевтических эксципиентов для доставки активных ингредиентов. Примеры других носителей включают коллоидный диоксид кремния, стеарат магния, целлюлозу, лаурилсульфат натрия и D&C желтый № 10.
Подходящие анализы in vitro можно использовать для предварительной оценки эффективности вышеописанных соединений хиназолина в качестве ингибиторов активности EGFR. Дополнительно может быть исследована эффективность соединений при лечении рака в анализах in vivo. Например, соединения могут быть введены животному (например, мышиная модель), имеющему рак, и затем оценивают его терапевтическое действие. На основании этих результатов также может быть определен подходящий диапазон дозировки и путь введения.
Без дальнейшего уточнения предполагается, что приведенное выше описание адекватно делает пригодным настоящее изобретение. Соответственно, следующие конкретные примеры следует рассматривать только как иллюстративные и не ограничивающие оставшуюся часть изобретения каким-либо образом.
Пример 1:
Синтез 1-(3-фторбензил)-3-(4-(3-этинилфениламино)хиназолин-6-ил)-1-метилмочевины (Соединение 1)
Путь синтеза соединения 1 показан ниже:
К раствору 5-нитроантранилонитрила (1,00 г, 6,13 ммоль) в диоксане (25 мл) добавляли диметилацеталь диметилформамида (0,88 г, 7,36 ммоль). После перемешивания при 100оС в течение 2 часов, реакционную смесь охлаждали до комнатной температуры и помещали в холодильник. Осадок отфильтровывали, промывали несколько раз холодным эфиром и сушили в вакууме, получая 1,30 г (97%) продукта - (E)-N'-(2-циано-4-нитрофенил)-N,N-диметилформамидина, в виде твердого вещества желтого цвета.
Смесь (E)-N'-(2-циано-4-нитрофенил)-N,N-диметилформамидина (1,00 г, 4,58 ммоль) и 3-аминофенилацетилена (0,64 г, 5,49 ммоль) в HOAc (15 мл) перемешивали при 100°С в течение 3 часов. Полученную смесь охлаждали до комнатной температуры. Осадок отфильтровывали, промывали простым эфиром и сушили в вакууме, получая 1,23 г (93%) N-(3-этинилфенил)-6-нитрохиназолин-4-амина в виде твердого вещества желтого цвета.
Смесь N-(3-этинилфенил)-6-нитрохиназолин-4-амина (1,00 г, 3,45 ммоль) и SnCl2·2H2O (3,10 г, 13,8 ммоль) в этилацетате (35 мл) нагревали при кипении с обратным холодильником в течение 2 часов и затем охлаждали до комнатной температуры. После того как рН смеси был доводен до 9-10 с использованием 5% водного раствора NaHCO3, смесь подвергали экстракции EtOAc. Объединенные органические слои промывали насыщенным раствором соли и H2O и сушили. Растворитель удаляли при пониженном давлении, получая 0,79 г (89%) N4-(3-этинилфенил)хиназолин-4,6-диамина в виде твердого вещества желтого цвета.
К раствору N4-(3-этинилфенил)хиназолин-4,6-диамина (100 мг, 0,38 ммоль) в ДМФ (2 мл), содержащем пиридин (37 мкл, 0,46 ммоль), добавляли фенилхлорформиат (49 мкл, 0,38 ммоль) по каплям при комнатной температуре. Через 10 минут добавляли (3-фторбензил)метиламин (52,9 мг, 0,38 ммоль) и реакционную смесь нагревали при 80°С в течение 1 часа. После охлаждения до комнатной температуры реакционную смесь разбавляли этилацетатом и промывали водой. Объединенные органические слои концентрировали и очищали на колонке с силикагелем, получая соединение 1 в виде твердого вещества желтого цвета с 86% выходом.
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,83 (с, 1H), 8,89 (с, 1H), 8,55 (д, J=8 Гц, 2H), 8,04 (с, 1H), 7,79 (дд, J=2,4 Гц, 2,0 Гц, 1H), 7,79 (дд, J=2,0 Гц, 2,4 Гц, 1H), 7,74 (д, J=2,0 Гц 1H), 7,41-7,37 (м, 3H), 7,13-7,10 (м, 3H), 4,64 (с, 2H), 4,20 (с, 1H), 3,03 (с, 3H); Масс-спектр (m/e): 426 (M+1).
Примеры 2-59: Синтез соединений 2-59
Соединения 2-59 получали способом, аналогичным описанному в примере 1.
Соединение 2:
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,83 (с, 1H), 8,88 (с, 1H), 8,79 (с, 1H) 8,43 (д, J=8 Гц, 2H), 8,10 (с, 1H), 7,94 (т, J=2,4 Гц, 1H), 7,82 (т, J=2,0 Гц, 1H), 7,80 (д, J=2,0 Гц, 1H), 7,42~7,36 (м, 3H), 7,09-7,06 (м, 3H), 4,48 (с, 2H), 3,53 (с, 1H); Масс-спектр (m/e): 412 (M+1).
Соединение 3:
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,42 (с, 1H), 8,93 (с, 1H), 8,63 (с, 1H), 8,53 (с, 1H), 8,44 (д, J=3,2 Гц, 2H), 8,21 (с, 1H), 7,35 (т, J=2,4 Гц, 1H), 7,32~6,88 (м, 5H), 6,80 (д, J=2,0 Гц 1H), 6,68 (д, J=2,4 Гц, 1H), 6,65 (с, 1H), 4,44 (с, 2H), 4,04 (с, 1H); Масс-спектр (m/e): 395 (M+1).
Соединение 4:
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,68 (с, 1H), 9,14 (с, 1H), 8,51 (с, 1H), 8,51 (д, J=2,0 Гц, 1H), 8,11 (с, 1H), 7,89 (т, J=2,0 Гц,2H), 7,72 (д, J=8 Гц, 1H), 7,40 (т, J=3,6 Гц, 1H), 7,21 (д,J=4 Гц, 1H), 4,24 (с, 1H), 3,46 (с, 4H), 1,53 (с, 6H); Масс-спектр (m/e): 372 (M+1).
Соединение 5:
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,83 (с, 1H), 8,88 (с, 1H), 8,79 (с, 1H), 8,43 (д, J=8 Гц, 2H), 8,10 (с, 1H), 7,94 (т, J=2,4 Гц, 1H), 7,82 (т, J=2,0 Гц, 1H), 7,80 (д, J=2,0 Гц, 1H), 7,42~7,36 (м, 3H), 7,09-7,06 (м, 3H), 4,48 (с, 2H), 3,53 (с, 1H); Масс-спектр (m/e): 412 (M+1).
Соединение 6:
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,83 (с, 1H), 8,87 (д, 1H), 8,79 (с, 1H) 8,43 (д, J=8 Гц, 2H), 8,10 (с, 1H), 7,94 (т, J=2,4 Гц, 1H), 7,80 (д, J=2,0 Гц, 1H), 7,42~7,36 (м, 3H), 7,09-7,06 (м, 3H), 4,48 (с, 2H), 3,53 (с, 1H); Масс-спектр (m/e): 430 (M+1).
Соединение 7:
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,77 (с, 1H), 8,57 (д, J=10,8 Гц, 1H), 8,50 (с, 1H), 8,04 (с, 1H), 7,96 (д, J=2 Гц, 1H), 7,89 (д, J=8 Гц, 1H), 7,69 (д, J=20 Гц, 1H), 7,35 (т, J=8,0 Гц, 1H), 4,20(с, 1H), 2,49 (с, 4H), 1,86 (с, 4H); Масс-спектр (m/e): 358 (M+1).
Соединение 8:
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,77 (с, 1H), 9,02 (с, 1H), 8,53 (с, 1H), 8,5l (д, J=2 Гц, 1H), 8,05 (с, 1H), 7,88 (т, J=8 Гц, 2H), 7,72 (д, J=8 Гц, 1H), 7,38 (д, J=8 Гц, 1H), 7,20 (д, J=7,2 Гц, 1H), 4,18 (с, 1H), 3,65 (т, J=4,4 Гц, 4H), 3,51 (т, J=4,8 Гц, 4H); Масс-спектр (m/e): 374 (M+1).
Соединение 9:
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,77 (с, 1H), 8,99 (с, 1H), 8,52 (с, 2H), 8,05 (с, 1H), 7,93 (м, 2H), 7,69 (д, J=8,8 Гц, 1H), 7,38 (т, J=8 Гц, 1H), 7,19 (д, J=8 Гц, 1H), 4,23 (с, 1H), 2,23-0,91 (м, 8H), 0,91 (м, J=2,8 Гц, 6H); Масс-спектр (m/e): 400 (M+1).
Соединение 10:
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,83 (с, 1H), 8,75 (с, 1H), 8,52 (с, 1H), 8,44 (с, 1H), 7,90 (м, 2H), 7,71 (д, J=8,4 Гц, 2H), 7,39 (т, J=8 Гц, 1H), 7,20 (д, J=8 Гц, 1H), 4,20 (с, 1H), 3,59 (с, 4H), 3,53 (с, 4H), 3,53 (с, 6H); Масс-спектр (m/e): 420 (M+1).
Соединение 11:
1H ЯМР (ДМСО-d6, 400 МГц): δ 8,5 (с 1H), 8,06 (с, 1H), 8,05 (с, 1H), 7,68-7,80 (д, J=9,2 Гц, 3H), 7,39-7,42 (т, J=8,0 Гц 1H), 7,29-7,31 (д, J=3,2 Гц, 1H), 7,20-7,20 (д, J=0,4 Гц, 1H), 4,08-4,12 (т, J=8,0 Гц, 2H), 3,67-3,73 (м, 4H), 3,21-3,25 (м, 6H), 1,65-1,85 (м, 6H); Масс-спектр (m/e): 459,3 (M+1).
Соединение 13:
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,81 (с, 1H), 8,63 (с, 1H), 8,54 (с, 1H), 8,49 (с, 1H), 8,51 (с, 1H), 8,05 (с, 1H), 7,92 (м, 2H), 7,70 (д, J=12 Гц, 1H), 7,37 (т, J=2,4 Гц, 1H), 7,19 (д, J=4 Гц, 1H), 4,17 (с, 1H), 3,71(м, 2H), 3,76 (м, 2H), 3,16 (м, 1H), 2,70 (м, 1H), 2,18-2,07 (м, 8H), 1,73 (м, 1H), 1,31 (м, 1H); Масс-спектр (m/e): 441 (M+1).
Соединение 14:
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,76 (с, 1H), 8,97 (с, 1H), 8,51 (д, J=8,8, 2H), 8,05 (с, 1H), 7,89 (т, J=8,8 Гц, 2H), 7,71(д, J=8,8 Гц, 1H), 7,38 (т, J=8,0 Гц, 1H), 7,20 (д, J=8 Гц, 1H), 4,19 (с, 1H), 3,54 (с, 4H), 2,26 (т, J=2 Гц, 2H), 0,87 (д, J=4 Гц, 1H), 0,49 (д, J=8 Гц, 2H), 0,1l (с, 2H); Масс-спектр (m/e): 427 (M+1).
Соединение 15:
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,95 (с, 1H), 8,87 (с, 1H), 8,51 (с, 1H), 8,47 (с, 1H), 8,03 (с, 1H), 7,85 (м, 2H), 7,69 (д, J=8,8 Гц, 1H), 7,37 (т, J=8,0 Гц, 1H), 7,19 (д, J=8 Гц, 1H), 4,41 (с, 1H), 4,08 (с, 1H), 4,05 (с, 1H), 2,94 (т, J=10,8 Гц, 2H), 2,17 (т, J=4 Гц, 1H), 1,86 (т, J=6 Гц, 2H), 1,66 (с, 4H), 1,33 (м, 2H); Масс-спектр (m/e): 401 (M+1).
Соединение 17:
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,96 (с, 1H), 9,44 (с, 1H), 8,50 (с, 1H), 8,45 (с, 1H), 8,00 (с, 1H), 7,88 (т, J=2,8 Гц, 1H), 7,70 (д, J=8,8 Гц, 1H), 7,36 (т, J=8,0 Гц, 1H), 7,19 (д, J=7,6 Гц, 1H), 6,85 (д, J=6 Гц, 1H), 4,19 (с, 1H), 3,33 (м, 4H), 3,22 (с, 3H); Масс-спектр (m/e): 362 (M+1).
Соединение 18:
1H ЯМР (ДМСО-d6, 400 МГц): δ 8,51 (с, 1H), 8,47-8,46 (д, J=2,4 Гц, 1H), 7,97 (с, 1H), 7,93-7,91 (дд, J=2,4 Гц, 8,8 Гц, 1H), 7,83-7,81 (дд, J=1,6 Гц, 8,4 Гц, 1H), 7,77-7,74 (д,J=8,8 Гц, 1H), 7,40-7,36 (т, J=8,0 Гц, 1H), 7,28-7,26 (дд, J=1,2 Гц, 8 Гц, 1H), 3,78-7,74 (т, J=6,4 Гц, 2H), 3,52 (с, 1H), 2,93-2,90 (м, 1H), 2,86-2,82 (т, J=6,0 Гц, 2H), 1,13-1,10 (м, 2H), 0,97-0,95 (м, 2H); Масс-спектр (m/e): 397,4 (M+1).
Соединение 19:
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,77 (с, 1H), 8,90 (с, 1H), 8,55-8,55 (д, J=2 Гц, 1H), 8,44 (с, 1H), 8,18-8,17 (д, J=1,2 Гц, 1H), 8,07 (с, 1H), 7,94-7,91 (дд, J=2 Гц, 9,2 Гц, 1H), 7,70-7,65 (м, 2H), 7,56-7,54 (д, J=8,8 Гц, 1H), 7,43-7,40 (м, 1H), 7,17-7,09 (м, 3H), 4,64 (с, 2H), 3,03 (с, 3H); Масс-спектр (m/e): 417,5 (M+1).
Соединение 20:
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,78 (с, 1H), 8,71 (с, 1H), 8,54-8,53 (д, J=1,6 Гц, 1H), 8,52 (с, 1H), 8,06 (с, 1H), 7,96-7,90 (м, 2H), 7,71-7,69 (д, J=9,2 Гц, 1H), 7,40-7,36 (т, J=8 Гц, 1H), 7,20-7,19 (д, J=7,2 Гц, 1H), 4,20 (с, 1H), 3,43-3,41 (м, 2H), 2,99 (с, 3H), 1,13-1,09 (т, J=7,2 Гц, 3H); Масс-спектр (m/e): 346,4 (M+1).
Соединение 22:
1H ЯМР (CD3OD, 400 МГц): δ 8,49 (с, 1H), 8,40-8,39 (д, J=2,4 Гц, 1H), 7,99 (с, 1H), 7,94 (с, 1H), 7,80-7,77 (д, J=8,8 Гц, 1H), 7,74-7,72 (д, J=8,8 Гц, 1H), 7,62-7,57 (м, 1H), 7,39-7,35 (т, J=7,6 Гц, 1H), 7,28-7,26 (д, J=7,6 Гц, 1H), 3,55 (с, 1H), 3,56-3,49 (м, 4H), 2,85-2,78 (м, 6H), 1,28-1,25 (т, J=6,8 Гц, 3H), 1,19-1,15 (т, J=6,8 Гц, 6H); Масс-спектр (m/e): 431,5 (M+1).
Соединение 23:
1H ЯМР (CD3OD, 400 МГц): δ 8,51 (с, 1H), 8,39-8,39 (д, J=2,4 Гц, 1H), 7,98 (с, 1H), 7,83 (с, 1H), 7,81-7,78 (дд, J=2 Гц, 9,6 Гц, 1H), 7,75-7,73 (д, J=9,4 Гц, 1H), 7,41-7,37 (т, J=8 Гц, 1H), 7,30-7,27 (м, 1H), 3,53 (с, 1H), 3,46-3,43 (т, J=7,2 Гц, 4H), 1,68-1,65 (м, 4H), 1,45-1,40 (м, 4H), 1,03-0,99 (т, J=7,2 Гц, 6H); Масс-спектр (m/e): 416,5 (M+1).
Соединение 24:
1H ЯМР (CD3OD, 400 МГц): δ 8,50 (с, 1H), 8,40-8,39 (д, J=2,0 Гц, 1H), 7,97 (с, 1H), 7,83-7,81 (д, J=8,4 Гц, 1H), 7,75-7,68 (м, 2H), 7,41-7,37 (т, J=8,4 Гц, 1H), 7,29-7,27 (м, 1H), 3,61-3,58 (т, J=6,0 Гц, 2H), 3,53 (с, 1H), 3,12 (с, 1H), 2,72-2,69 (т, J=6,0 Гц, 2H), 2,45 (с, 6H); Масс-спектр (m/e): 389,5 (M+1).
Соединение 25:
1H ЯМР (CD3OD, 400 МГц): δ 8,51 (с, 1H), 8,40-8,39 (д, J=2 Гц, 1H), 7,98 (с, 1H), 7,83-7,80 (дд, J=2,4 Гц, 9,2 Гц, 1H), 7,75-7,73 (д, J=9,2 Гц, 1H), 7,41-7,27 (т, J=8 Гц, 1H), 7,29-7,27 (д, J=7,6 Гц, 1H), 3,53 (с, 1H), 3,53-3,48 (т, J=7,6 Гц, 2H), 3,39-3,36 (т, J=6,8 Гц, 2H), 1,77-1,71 (м, 2H), 1,15-1,14 (м, 1H), 1,02-0,98 (т, J=7,2 Гц, 3H), 0,62-0,58 (м, 2H), 0,37-0,34 (м, 2H); Масс-спектр (m/e): 400,5 (M+1).
Соединение 26:
1H ЯМР (CD3OD, 400 МГц): δ 8,75 (с, 1H), 8,73-8,72 (д, J=2 Гц, 1H), 8,08-8,05 (дд, J=2,4 Гц, 9,2 Гц, 1H), 7,92-7,92 (д, J=1,2 Гц, 1H), 7,83 (с, 1H), 7,81 (с, 1H), 7,78-7,75 (м, 1H), 7,50-7,47 (м, 2H), 3,80-3,77 (т, J=6,4 Гц, 2H), 3,63 (с, 1H), 3,24 (с, 3H), 2,86-2,83 (т, J=6,4 Гц, 2H); Масс-спектр (m/e): 371,4 (M+1).
Соединение 27:
1H ЯМР (CD3OD, 400 МГц): δ 8,50 (с, 1H), 8,40-8,39 (д, J=2,4 Гц, 1H), 7,79 (с, 1H), 7,82-7,79 (дд, J=2,0 Гц, 8,8 Гц, 2H), 7,73-7,71 (д, J=8,8 Гц, 1H), 7,40-7,36 (т, J=8,0 Гц, 1H), 7,28-7,26 (д, J=8,4 Гц, 1H), 3,53 (с, 1H), 3,51-3,4 (кв, J=7,2 Гц, 2H), 3,46-3,42 (т, J=7,6 Гц, 2H), 1,68-1,64 (м, 2H), 1,45-1,40 (м, 2H), 1,28-1,25 (т, J=7,2 Гц, 3H), 1,02-0,99 (т, J=7,6 Гц, 3H); Масс-спектр (m/e): 388,5 (M+1)
Соединение 28:
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,76 (с, 1H), 8,91 (с, 1H), 8,53 (с, 1H), 8,49 (с, 1H), 8,04 (с, 1H), 7,90 (д, J=8 Гц, 1H), 7,75 (д, J=8,8 Гц, 1H), 7,39 (т, J=8,0 Гц, 1H), 7,20 (д, J=7,6 Гц, 1H), 4,19 (с, 1H), 3,50 (с, 8H), 2,43 (с, 4H), 2,16 (с, 6H); Масс-спектр (m/e): 444 (M+1).
Соединение 29:
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,78 (с, 1H), 9,11 (с, 1H), 8,52 (с, 2H), 8,04 (с, 1H), 7,91 (д, J=8 Гц, 2H), 7,69 (т, J=8,0 Гц, 1H), 7,37 (д, J=7,6 Гц, 1H), 7,18 (д, J=7,6 Гц, 1H), 4,19 (с, 1H), 3,65-3,23 (м, 12H), 3,14 (с, 3H); Масс-спектр (m/e): 431 (M+1).
Соединение 30:
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,78 (с, 1H), 9,15 (с, 1H), 8,50 (с, 1H), 8,41 (с, 1H), 8,03 (с, 1H), 7,88 (д, J=8 Гц, 1H), 7,84 (д, J=8,8 Гц, 1H), 7,70 (д, J=8,8 Гц, 1H), 7,38 (т,J=8,0 Гц, 1H), 7,20 (д, J=7,6 Гц, 1H), 6,45 (т, J=2,4 Гц, 1H), 4,19 (с, 1H), 2,38 (т, J=6,4 Гц, 6H), 1,52 (м, J=5,2, 4H), 1,40 (м, 2H), 1,23 (с, 2H); Масс-спектр (m/e): 415 (M+1).
Соединение 32:
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,77 (с, 1H), 9,01 (с, 1H), 8,50 (с, 1H), 8,40 (с, 1H), 8,02 (с, 1H), 7,85 (т, J=8,0 Гц, 2H), 7,71 (д, J=8,8 Гц, 1H), 7,39 (т, J=8,0 Гц, 1H), 7,20 (д, J=6,8 Гц, 1H), 6,44 (т, J=2,4 Гц, 1H), 4,19 (с, 1H), 3,27 (м, 4H), 2,54 (м, 4H), 1,70 (с, 4H); Масс-спектр (m/e): 401 (M+1).
Соединение 33:
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,46 (с, 1H), 8,87 (с, 1H), 8,50 (с, 1H), 8,44 (с, 1H), 8,03 (с, 1H), 7,88 (д, J=8 Гц, 2H), 7,70 (д, J=5,2 Гц, 1H), 7,38 (т, J=8,0 Гц, 2H), 7,20 (д, J=8 Гц, 2H), 4,21 (с, 1H), 3,20 (м, 2H), 2,95 (м, 2H); Масс-спектр (m/e): 398 (M+1).
Соединение 34:
1H ЯМР (CDCl3, 400 МГц): δ 9,79 (с, 1H), 8,50 (с, 1H), 8,45-8,36 (м, 2H), 8,05 (с, 1H), 7,97-7,95 (д, J=8,4 Гц, 1H), 7,92-7,90 (д, J=8,4 Гц, 1H), 7,68-7,65 (д, J=8,8 Гц, 1H), 7,38-7,34 (т, J=7,6 Гц, 1H), 7,19-7,17 (д, J=7,6 Гц, 1H), 4,19 (с, 1H), 3,58-3,56 (м, 2H), 1,74-1,60 (м, 4H), 1,26-1,23 (м, 6H), 0,91-0,86 (м, 6H); Масс-спектр (m/e): 416,5 (M+1).
Соединение 35:
1H ЯМР (CDCl3, 400 МГц): δ 9,86 (с, 1H), 9,20 (с, 1H), 8,56-8,56 (д, J=2 Гц, 1H), 8,53 (с, 1H), 8,06 (с, 1H), 7,98-7,95 (дд, J=2 Гц, 8,8 Гц, 1H), 7,93-7,91 (д, J=8,4 Гц, 1H), 7,73-7,70 (д, J=8,8 Гц, 1H), 7,39-7,35 (т, J=7,2 Гц, 1H), 7,20-7,18 (д, J=7,6, 1H), 4,20 (с, 1H), 3,79-3,75 (т, J=6,8 Гц, 4H), 2,85-2,82 (т, J =6,8 Гц, 4H); Масс-спектр (m/e): 410,4 (M+1).
Соединение 36:
1H ЯМР (CDCl3, 400 МГц): δ 9,77 (с, 1H), 8,69 (с, 1H), 8,53-8,51 (м, 2H), 8,05 (с, 1H), 7,95-7,89 (м, 2H), 7,69-7,67 (д, J=8,8, 1H), 7,39-7,35 (т, J=7,2 Гц, 1H), 7,19-7,17 (д, J=7,2 Гц, 1H), 4,19 (с, 1H), 2,98 (с, 3H), 1,51-1,50 (м, 2H), 1,26-1,25 (м, 6H), 0,84 (с, 3H); Масс-спектр (m/e): 402,5 (M+1).
Соединение 37:
1H ЯМР (CD3OD, 400 МГц): δ 8,50 (с, 1H), 8,40-8,40(д, J=2,0 Гц, 1H), 7,97 (с, 1H), 7,80-7,77 (м, 2H), 7,74-7,71 (д, J=9,2 Гц, 1H), 7,38-7,36 (т, J=238,0 Гц, 1H), 7,28-7,27 (д, J=7,6 Гц, 1H), 4,29-4,29 (д, J=2,4 Гц, 2H), 3,53 (с, 1H), 3,18 (с, 3H), 2,75-2,73 (т, J=2,4 Гц, 1H); Масс-спектр (m/e): 356,4 (M+1).
Соединение 38:
1H ЯМР (ДМСО-d6, 400 МГц): δ 8,51 (с, 1H), 8,49 (с, 1H), 7,94 (с, 1H), 7,91-7,88 (дд, J=1,6 Гц, 9,2 Гц, 1H), 7,80-7,78 (д, J=8,8 Гц, 1H), 7,76-7,76 (д, J=0,8 Гц, 1H), 7,46-7,44 (т, J=8,8 Гц, 1H), 7,38-7,36 (т, J=7,6 Гц, 1H), 7,29-7,28 (м, 1H), 7,27-7,24 (т, J=8,4 Гц, 1H), 4,60 (с, 4H), 3,51 (с, 1H); Масс-спектр (m/e): 382,4 (M+1)
Соединение 39:
1H ЯМР (CDCl3, 400 МГц): δ 9,78 (с, 1H), 8,77 (с, 1H), 8,53-8,52 (д, J=2 Гц, 1H), 8,51 (с, 1H), 8,04 (с, 1H), 7,94-7,88 (м, 2H), 7,70-7,68 (д, J=8,8 Гц, 1H), 7,39-7,353 (т, J=8 Гц, 1H), 7,19-7,17 (д, J=7,6 Гц, 1H), 5,84-5,79 (м, 1H), 5,22-5,16 (м, 2H), 4,19 (с, 1H), 4,02-4,01 (д, J=4,8 Гц, 2H), 2,97 (с, 1H); Масс-спектр (m/e): 357,4 (M+1).
Соединение 40:
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,81 (с, 1H), 9,23 (с, 1H), 8,52 (с, 2H), 8,49 (с, 1H), 8,04 (с, 1H), 7,90 (м, 2H), 7,70 (д, J=8,8 Гц, 1H), 7,37 (т, J=7,6 Гц, 1H), 7,18 (д, J=7,6 Гц, 1H), 4,19 (с, 1H), 3,87 (т, J=8 Гц, 2H), 3,59 (с, 2H), 2,06 (м, 2H) 1,72 (с, 2H); Масс-спектр (m/e): 408 (M+1).
Соединение 41:
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,78 (с, 1H), 9,11 (с, 1H), 8,51 (с, 2H), 8,04 (с, 1H), 7,90 (д, J=8,8 Гц, 2H), 7,69 (д, J=8,8 Гц, 1H), 7,37 (т, J=8,0 Гц, 1H), 7,18 (д, J=8,8 Гц, 1H), 4,19 (с, 1H), 3,68(м, 4H), 2,59 (м, 6H), 1,07 (м, 3H); Масс-спектр (m/e): 401 (M+1).
Соединение 42:
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,77 (с, 1H), 9,13 (с, 1H), 8,51 (с, 2H), 8,04 (с, 1H), 7,92 (т, J=7,6 Гц, 2H), 7,69 (д, J=8,8 Гц, 1H), 7,37 (т, J=8,0 Гц, 1H), 7,18 (д, J=6,0 Гц, 1H), 4,19 (с, 1H), 3,88 (с, 4H), 3,59 (т, J=5,2 Гц, 4H), 1,64 (т, J=5,2 Гц, 4H); Масс-спектр (m/e): 430 (M+1).
Соединение 43:
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,76 (с, 1H), 9,92 (с, 1H), 8,51 (с, 2H), 8,04 (с, 1H), 7,90 (д, J=8 Гц, 2H), 7,68 (д, J=8,8 Гц, 1H), 7,37 (т, J=8,0 Гц, 1H), 7,17 (д, J=8,8 Гц, 1H), 4,19 (с, 1H), 2,76 (т, J=12 Гц, 1H), 2,41 (т, J=10,8 Гц, 6H), 1,66-1,42 (м, 6H), 1,22-1,07 (м, 8H); Масс-спектр (m/e): 428 (M+1).
Соединение 44:
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,77 (с, 1H), 8,90 (с, 1H), 8,51 (д, J=6,8, 2H), 8,03 (с, 1H), 7,87(т, J=8,8 Гц, 2H), 7,71 (д, J=8,8 Гц, 1H), 7,37 (т, J=8,0 Гц, 1H), 7,18 (д, J=8 Гц, 1H), 4,18(с, 1H), 3,67 (м, 8H), 1,15 (д, J=2,0 Гц, 1H), 0,79 (м, 4H); Масс-спектр (m/e): 441 (M+1).
Соединение 45:
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,79 (с, 1H), 9,18 (с, 1H), 8,54 (д, J=4,4 Гц, 2H), 8,05 (с, 1H), 7,89 (м, 2H), 7,74-7,71 (д, J=8,8 Гц, 1H), 7,41-7,37 (т, J=8,0 Гц, 1H), 7,21-7,19 (д, J=7,6 Гц, 1H), 4,20 (с, 1H), 3,65 (шир.с, 4H), 3,18 (шир.с, 4H), 2,94 (с, 3H); Масс-спектр (m/e): 451,5 (M+1).
Соединение 46:
1H ЯМР (CD3OD, 400 МГц): δ 8,51 (с 1H), 8,06 (с 1H), 8,05 (с, 1H), 7,68-7,80 (д, J=9,2 Гц, 3H), 7,39-7,42 (т, J=8,0 Гц, 1H), 7,29-7,31 (д, J=3,2 Гц, 1H), 7,20-7,20 (д, J=0,4 Гц, 1H), 4,08-4,12 (т, J=8,0 Гц, 2H), 3,67-3,73 (т, J=8,0 Гц, 2H); Масс-спектр (m/e): 348,1 (M+1).
Соединение 47:
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,82 (с, 1H), 8,93 (с, 1H), 8,52-8,46 (м, 4H), 8,03 (с, 1H), 7,90-7,88 (м, 2H), 7,72-7,70 (м, 2H), 7,37 (с, 2H), 7,19-7,18 (м, 1H), 4,74 (с, 2H), 4,20 (с, 1H), 3,33-3,35 (м, 2H), 1,07-1,05 (м, 1H), 0,42-0,41 (м, 2H), 0,23-0,19 (м, 2H); Масс-спектр (m/e): 449,5 (M+1).
Соединение 48:
1H ЯМР (CDCl3, 400 МГц): δ 9,78 (с, 1H), 8,70 (с, 1H), 8,53-8,48 (м, 4H), 8,02-7,97 (м, 2H), 7,88-7,84 (м, 1H), 7,74-7,65 (м, 2H), 7,32 (с, 2H), 7,19 (с, 1H), 4,54 (с, 2H), 4,19 (с, 1H), 2,65-2,58 (м, 1H), 0,96-0,89 (м, 2H), 0,76-0,75 (м, 2H); Масс-спектр (m/e): 435,5 (M+1).
Соединение 49:
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,79 (с, 1H), 9,04 (с, 1H), 8,50 (с, 1H), 8,41 (с, 1H), 8,03 (с, 1H), 7,90-7,84 (м, 2H), 7,71-7,69 (д, J=8,8 Гц, 1H), 7,41-7,37 (т, J=8,0 Гц, 1H), 7,21-7,19 (д, J=7,6 Гц, 1H), 6,82-6,80 (д, J=8,0 Гц, 1H), 4,20 (с, 1H), 3,87-3,82 (м, 2H), 3,75-3,73 (шир.с, 1H), 3,43-3,38 (т, J=9,2 Гц, 2H), 1,85-1,81 (д, J=5,6 Гц, 2H), 1,44-1,40 (м, 2H); Масс-спектр (m/e): 388,4 (M+1).
Соединение 50:
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,79 (с, 1H), 9,09-9,05 (м, 1H), 8,50 (с, 1H), 8,41 (с, 1H), 8,03 (с, 1H), 7,89-7,84 (м, 2H), 7,72-7,70 (д, J=9,2 Гц, 1H), 7,41-7,37 (т, J=8,0 Гц, 1H), 7,21-7,19 (д, J=7,2 Гц, 1H), 6,69-6,65 (м, 1H), 4,20 (с, 1H), 3,73-3,40 (т, J=7,2 Гц, 2H), 2,62-2,59 (т, J=7,2 Гц, 2H), 2,10 (с, 3H); Масс-спектр (m/e): 378,4 (M+1).
Соединение 51:
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,79 (с, 1H), 9,02 (с, 1H), 8,50 (с, 1H), 8,41 (с, 1H), 8,03 (с, 1H), 7,89-7,84 (м, 2H), 7,71-7,69 (д, J=8,8 Гц, 1H), 7,41-7,37 (т, J=8,8 Гц, 1H), 7,21-7,19 (д, J=7,2 Гц, 1H), 6,69 (м, 1H), 4,20 (с, 1H), 3,24-3,20 (т, J=6,8 Гц, 2H), 2,55-2,53 (т, J=7,2 Гц, 2H), 2,06 (с, 3H), 2,55-2,53 (тт, J=6,8 Гц, 7,2 Гц, 2H); Масс-спектр (m/e): 392,5 (M+1).
Соединение 52:
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,83 (с, 1H), 9,37 (с, 1H), 8,54 (д, J=8,8, 2H), 8,08 (с, 1H), 7,93 (т, J=8,8 Гц, 2H), 7,74 (д, J=9,2 Гц, 1H), 7,39 (т, J=8,0 Гц, 1H), 7,20 (д, J=7,6 Гц, 1H), 4,23 (с, 1H), 3,55 (м, 8H); Масс-спектр (m/e): 469(M+1).
Соединение 53:
1H ЯМР (ДМСО-d6, 400 МГц): δ 9,77 (с, 1H), 9,01 (с, 1H), 8,52 (д, J=6,8, 2H), 8,05 (с, 1H), 7,88 (м, 2H), 7,72 (д, J=7,2 Гц, 1H), 7,39 (т, J=8,4 Гц, 1H), 7,20 (д, J=7,6 Гц, 1H), 4,20 (с, 1H), 3,66 (д, J=6,4 Гц, 2H), 3,54 (т, J=5,2 Гц, 4H), 2,66 (т, J=4,8 Гц, 4H); Масс-спектр (m/e): 455(M+1).
Соединение 54:
1H ЯМР (CD3OD, 400 МГц): δ 8,49 (с, 1H), 8,37 (с, 1H), 7,96 (с, 1H), 7,81-7,79 (д, J=7,2 Гц, 1H), 7,74-7,73 (м, 2H), 7,40-7,36 (т, J=8,0 Гц, 1H), 7,27-7,25 (д, J=7,2 Гц, 1H), 3,64-3,62 (шир.с, 4H), 3,52 (с, 1H), 2,53-2,51 (шир.с, 4H), 2,35 (с, 3H); Масс-спектр (m/e): 387,5 (M+1).
Соединение 55:
1H ЯМР (CD3OD, 400 МГц): δ 8,48 (с, 1H), 8,37 (с, 1H), 7,96 (с, 1H), 7,81-7,79 (д, J=7,2 Гц, 1H), 7,74-7,73 (м, 2H), 7,40-7,36 (т, J=8,0 Гц, 1H), 7,27-7,25 (д, J=7,2 Гц, 1H), 3,64-3,61 (шир.с, 4H), 3,52 (с, 1H), 2,77-2,74 (м, 1H), 2,64-2,62 (шир.с, 4H), 1,12-1,10 (д, J=6,4 Гц, 3H); Масс-спектр (m/e): 415,5 (M+1).
Соединение 56:
1H ЯМР (CD3OD, 400 МГц): δ 8,48 (с, 1H), 8,37 (с, 1H), 7,96 (с, 1H), 7,81-7,79 (д, J=7,2 Гц, 1H), 7,74-7,73 (м, 2H), 7,40-7,36 (т, J=8,0 Гц, 1H), 7,27-7,25 (д, J=7,2 Гц, 1H), 4,34-4,31 (д, J=13,6 Гц, 2H), 3,51 (с, 1H), 2,97-2,91 (т, J=12,4 Гц, 2H), 2,52-2,48 (м, 1H), 2,33 (с, 6H), 2,00-1,97 (д, J=11,6 Гц, 2H), 1,49-1,45 (м, 2H); Масс-спектр (m/e): 415,5 (M+1).
Соединение 57:
1H ЯМР (CD3OD, 400 МГц): δ 8,48 (с, 1H), 8,37 (с, 1H), 7,96 (с, 1H), 7,81-7,79 (д, J=7,2 Гц, 1H), 7,74-7,73 (м, 2H), 7,40-7,36 (т, J=8,0 Гц, 1H), 7,27-7,25 (д, J=7,2 Гц, 1H), 4,34-4,31 (д, J=13,6 Гц, 2H), 3,51 (с, 1H), 2,98-2,91 (т, J=13,2 Гц, 3H), 2,73 (м, 4H), 1,96-1,93 (д, J=12,4 Гц, 2H), 1,56-1,53 (м, 2H), 1,14-1,10 (т, J=7,6 Гц, 6H); Масс-спектр (m/e): 443,5 (M+1).
Соединение 58:
Масс-спектр (m/e): 443 (M+1).
Соединение 59:
Масс-спектр (m/e): 45,2 (M+1).
Пример 60: Синтез N-(4-(3-этинилфениламино)-7-фторхиназолин-6-ил)пиперидин-1-карбоксамида (Соединение 60)
Путь синтеза соединения 60 показан ниже:
2-Амино-4-фторбензойную кислоту (1,55 г, 10 ммоль) в формамиде (5 мл) нагревали при 150°С в течение 6 часов. Смесь охлаждали до комнатной температуры при перемешивании. Осадок отфильтровывали и промывали этиловым эфиром, получая 1,3 г 7-фторхиназолин-4-ола (78%).
7-Фторхиназолин-4-ол (1 г, 6,0 ммоль) растворяли в концентрированной H2SO4 (3 мл) при 0°C. Добавляли по каплям при перемешивании в течение 15 минут концентрированную HNO3 (3 мл). Смесь нагревали при 100°С в течение 3 часов, и выливали в смеси лед-вода при перемешивании после охлаждения до комнатной температуры. Осадок отфильтровывали и перекристаллизовывали из HOAc, получая 0,60 г 7-фтор-6-нитрохиназолин-4-ола (38%).
7-Фтор-6-нитрохиназолин-4-ол (518 мг, 2 ммоль) растворяли в хлористом тиониле (3 мл), содержащем 2 капли ДМФ. Раствор нагревали при кипении с обратным холодильником в течение 3 часов и затем растворитель удаляли при пониженном давлении. Остаток, 4-хлор-7-фтор-6-нитрохиназолин, использовали непосредственно на следующей стадии без очистки.
4-Хлор-7-фтор-6-нитрохиназолин и 3-этинилбензоламин (234 мг, 2 ммоль) растворяли в изопропаноле (5 мл) и нагревали при кипении с обратным холодильником в течение 3 часов. После охлаждения до комнатной температуры, осадок отфильтровывали и промывали водой, получая 0,59 г N-(3-этинилфенил)-7-фтор-6-нитрохиназолин-4-амина (95%).
Смесь N-(3-этинилфенил)-7-фтор-6-нитрохиназолин-4-амина (310 мг, 1 ммоль) и SnCl2-2H2O (171 мг, 4,5 ммоль) в этилацетате (35 мл) нагревали при кипении с обратным холодильником в течение 2 часов. После охлаждения до комнатной температуры, смесь обрабатывали 5% водным раствором NaHCO3 для доведения значения его pH до 9-10. Затем смесь экстрагировали EtOAc. Объединенные органические слои промывали насыщенным раствором соли и H2O и сушили. Растворитель удаляли при пониженном давлении, получая 225 мг (81%) N4-(3-этинилфенил)-7-фторхиназолин-4,6-диамина в виде твердого вещества желтого цвета.
N4-(3-этинилфенил)-7-фторхиназолин-4,6-диамин (100 мг, 0,36 ммоль) растворяли в ДМФ (3 мл), содержащем пиридин (35 мкл, 0,432 ммоль). Фенилхлорформиат (46 мкл, 0,36 ммоль) прикапывали к смеси при комнатной температуре и нагревали при 70°С в течение 1 часа, получая фенил 4-(3-этинилфениламино)-7-фторхиназолин-6-илкарбамат. Полученное соединение использовали непосредственно на следующей стадии без очистки. Затем добавляли амин (0,36 ммоль) и перемешивали при 70°С в течение 2,5 часов. После охлаждения до комнатной