Способ получения резидентных стволовых клеток сердца млекопитающего из образцов миокарда
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, клеточной и тканевой инженерии. Описан способ получения резидентных стволовых клеток сердца млекопитающего, экспрессирующих поверхностные маркеры c-kit, и/или sca-1, и/или MDR1, в ходе которого выделяют образцы ткани миокарда, измельчают их, обрабатывают коллагеназой и трипсином, проводят культивирование на культуральной чашке с покрытием из фибронектина методом эксплантной культуры измельченных образцов с последующей иммуноселекцией. Изобретение позволяет получить обогащенную культуру резидентных стволовых клеток сердца для целей медицины и трансплантологии. 7 з.п. ф-лы, 3 ил., 4 пр.
Реферат
Настоящее изобретение относится к области биотехнологии, в частности к клеточной и тканевой инженерии, и может быть использовано в медицине и ветеринарии при разработке клинического метода восстановления миокарда и лечения заболеваний сердечно-сосудистой системы. Предлагается метод получения культуры резидентных стволовых клеток сердца (СКС), предназначенный для тканевой инженерии и заключающийся в выделении мультипотентных СКС из ткани миокарда для использования в качестве инструмента клеточной терапии заболеваний сердечно-сосудистой системы.
Хроническая сердечная недостаточность в подавляющем большинстве случаев, возникающая в результате перенесенного инфаркта миокарда (ИМ), представляет собой важную медицинскую, социальную и экономическую проблему. Около 1% взрослого населения развитых стран страдает сердечной недостаточностью (ХСН), а у людей старше 70 лет частота ХСН на порядок выше (около 10%). При этом в российской популяции частота ХСН выше, чем в развитых странах, и достигает 6% [Хроническая сердечная недостаточность / Ф.Т.Агеев [и др]. - М.: Изд-во Гэотар-медиа, 2010]. Несмотря на то что эффективность лечения ХСН возросла за последние двадцать лет, возможности современных методов восстановления функции сердца остаются весьма ограниченными. Это обусловлено в значительной степени отсутствием эффективных средств, позволяющих восстановить необратимо утраченный миокард. В последние годы большие надежды на решение этой проблемы возлагают на развитие методов клеточной терапии [Хроническая сердечная недостаточность /Ф.Т.Агеев [и др]. - М.: Изд-во Гэотар-медиа, 2010], в частности на использование мезенхимальных стволовых клеток костного мозга, для которых была продемонстрирована возможность кардиомиоцитарной дифференцировки как in vitro, так и in vivo [Fukuda, K. Development of regenerative cardiomyocytes from mesenchymal stem cells for cardiovascular tissue engineering // Artif Organs. - 2001. - V.25. - P.187-93; Kajstura, J., Leri A., Finato N., et al. Myocyte proliferation in end-stage cardiac failure in humans // Proc Nati Acad Sci USA. - 1998. - V.95. - P.8801-5; Kawada, H., Fujita J., Kinjo K. et al. Nonhematopoietic mesenchymal stem cells can be mobilized and differentiate into cardiomyocytes after myocardial infarction // Blood. - 2004. - V.104. - Р.3581-7; Povsic, T.J., O'Connor C.M. Cell therapy for heart failure: the need for a new therapeutic strategy // Expert Rev CardiovascTher. - 2010. - V.8. - P.1107-26].
Однако в результате проведенных экспериментальных и клинических исследований не было показано достаточно высокой эффективности клеточной терапии ХСН и не была подтверждена возможность замещения утраченного миокарда за счет дифференцировки трансплантированных клеток [Lipinski, M.J., Biondi-Zoccai G.G., AbbateA., et al. Impact of intracoronary cell therapy on left ventricular function in the setting of acute myocardial infarction: a collaborative systematic review and meta-analysis of controlled clinical trials // J Am Coil Cardiol. - 2007. - V.50. - P.1761-7; Murry, C.E., Field L.J., Menasche P. Cell-based cardiac repair: reflections at the 10-year point // Circulation. - 2005. - V.112. - P.3174-83; Rubart, M., Field L.J. Stem cell differentiation: cardiac repair // Cells Tissues Organs. - 2008. - V.188. - P.202-11]. Эффекты, наблюдаемые при трансплантации клеток костного мозга, были обусловлены в основном их паракринной активностью, подавляющей апоптоз кардиомиоцитов и стимулирующей ангиогенез и активность собственных резидентных стволовых клеток сердца [Hatzistergos K.E., Quevedo H., Oskouei B.N., et al. Bone Marrow Mesenchymal Stem Cells Stimulate Cardiac Stem Cell Proliferation and Differentiation // Circ Res. - 2009. - V.116. - №27. - P.15885-90; Satija, N.K., Singh V.K., Verma Y.K., et al. Mesenchymal stem cell-based therapy: a new paradigm in regenerative medicine // J Cell Mol Med. - 2009. - V.13. - P.4385-402]. На сегодняшний день ученые заняты поиском новых источников аутологичных стволовых/прогениторных клеток для терапии ХСН. В этом аспекте большой интерес представляют недавно открытые резидентные СКС [Beltrami, A.P., Barlucchi L., Torella D., et al. Adult cardiac stem cells are multipotent and support myocardial regeneration // Cell. - 2003. - V.114. - P.763-768]. Термином «резидентная СКС» обозначается неоднородная популяция низкодифференцированных клеток, обнаруживаемых в миокарде, способных к самообновлению и дифференцировке в клетки сердца (кардиомиоциты, эндотелиальные и гладкомышечные клетки сосудов). Выделяют несколько популяций СКС: 1) клетки, несущие на поверхности рецептор к фактору стволовых клеток (c-kit+ клетки); 2) клетки, несущие на поверхности антиген sca-1, характеризующий стволовые клетки мыши (sca-1+ клетки); 3) клетки, экспрессирующие транскрипционный фактор Islet-1, присутствующий в эмбриональных клетках, формирующих сердце в эмбриогенезе (Islet-1+ клетки). Существование резидентных СКС, участвующих в регенеративных процессах, делает особенно актуальной разработку подходов к активации эндогенного механизма регенерации сердца. Помимо этого применение аутологичных (полученных от самого пациента) СКС для лечения сердечно-сосудистых заболеваний представляется перспективным, так как не требует проведения иммуносупрессивной терапии и исключает возможность переноса инфекционных агентов от донора. Однако, учитывая крайне малое содержание СКС в ткани миокарда, для разработки клинически приемлемой технологии использования этих клеток для клеточной кардиомиопластики необходима разработка клинически приемлемого метода получения СКС из образцов миокарда, которые возможно без вреда для больного получать либо в ходе оперативных вмешательств, либо при проведении биопсии миокарда по клиническим показаниям. Такой метод также абсолютно необходим для разработки методов стимуляции эндогенных СКС и регенеративных процессов в сердце, так как это требует изучения свойств СКС больных сердечно-сосудистыми заболеваниями, что возможно только на культурах этих клеток.
Многие годы считалось, что сердце является терминально дифференцированным органом, а зрелые кардиомиоциты не способны вступать в митоз [Bucher, O.Z. Problem der Amitose // Handb. Allgem.Pathol. - 1971. - V.11. - P.626-699; Grundmann, E. Histologische Untersuchungenu der die Wirkungen experimentallen Sauerstoffmangels auf das KatzenHerz // Beitr. Pathol.Anat. Allgem. Pathol. - 1951. - V.111. - P.36-76], хотя возможность пролиферации других клеток миокарда, таких как фибробласты, гладкомышечные и эндотелиальные клетки, не отрицалась. Предполагалось, что, дифференцируясь вскоре после рождения, кардиомиоциты сохраняются на протяжении всей жизни и не способны к обновлению. Развитие современных методов исследований позволило изменить эти представления. Образование новых кардиомиоцитов происходит в норме и при патологических состояниях на протяжении всей жизни при участии стволовых клеток [Kajstura, J., Urbanek K., Peri S., et al. Cardiomyogenesis in the adult human heart // Circ Res. - 2010. - V.107. - P.305-15]. Оказалось, что около 1% клеток взрослого сердца обновляется в течение года и 45% кардиомиоцитов являются новообразованными к 50 годам [Bergmann, О., Bhardwaj R.D., Bernard S., et al. Evidence for cardiomyocyte renewal in humans // Science. - 2009. - V.324. - P.98-102]. Альтернативным методом оценки регенеративных возможностей миокарда (использование йоддезоксиуридина) [Kajstura, J., Urbanek K., Peri S., et al. Cardiomyogenesis in the adult human heart // CircRes. - 2010. - V.107. - P.305-15] было показано, что 22% новых кардиомиоцитов, 20% фибробластов и 13% эндотелиальных клеток образуется в течение года. Таким образом, время жизни этих клеток составляет 4, 4,5 и 8 лет соответственно [Kajstura, J., Urbanek K., Peri S., et al. Cardiomyogenesis in the adult human heart // Circ Res. - 2010. - V.107. - P.305-15]. Эти результаты свидетельствуют о том, что кардиомиоциты достаточно интенсивно обновляются - старые кардиомиоциты замещаются на новые. Работами последних лет показано, что это обновления осуществляется за счет СКС, которые активируются при возникновении поражения миокарда, пролиферируют и мигрируют в область поражения, где участвуют в замещении погибших клеток миокарда, дифференцируясь в них [Beltrami А.Р., Barlucchi L., Torella D., et al. Adult cardiac stem cells are multipotent and support myocardial regeneration // Cell. - 2003. - V.114. - P.763-768]. Тем не менее, при длительно текущих заболеваниях (ИБС, ХСН, сахарный диабет), обширных поражениях миокарда, старении эндогенных регенеративных возможностей миокарда оказывается недостаточно для поддержания клеточного гомеостаза. При этих состояниях снижается функциональная активность СКС - их способность к пролиферации, миграции и дифференцировке. Кроме этого увеличивается количество прогениторных клеток, гибнущих за счет апоптоза. В совокупности это приводит к уменьшению численности функционально полноценных СКС и отсутствию эффективной регенерации миокарда. Решением этой проблемы может стать клеточная кардиомиопластика, основанная на использовании аутологичных резидентных СКС, получаемых от больного и наращиваемых в культуре до необходимого количества. Популяция этих клеток характеризуется экспрессией одного или нескольких поверхностных маркеров стволовых клеток (c-kit (рецептор к фактору стволовых клеток - SCF), sca-1, MDR1, Islet-1) и отсутствием экспрессии маркеров гематопоэтических клеток (CD34, CD45, CD20, CD8) [Beltrami, А.Р., Barlucchi L., Torella D., et al. Adult cardiac stem cells are multipotent and support myocardial regeneration // Cell. - 2003. - V.114. - P.763-768]. В миокарде животных количество СКС клеток было небольшим, приблизительно 1 клетка на 104 кардиомиоцита. СКС способны к самообновлению, пролиферации и обладали мультипотентностью (способностью к дифференцировке в кардиомиоцитарном, эндотелиальном и гладкомышечном направлениях in vitro и in vivo), а при трансплантации после инфаркта миокарда способствовали уменьшению зоны некроза и поддержанию насосной функции сердца [Dawn, В., Stein A.B., Urbanek K., et al. Cardiac stem cells delivered intravascularly traverse the vessel barrier, regenerate infarcted myocardium, and improve cardiac function // Proc Nati Acad Sci USA. - 2005. - V.102. - P.3766-71].
Методы получения СКС человека, описанные в литературе, основаны на использовании 2 основных источников для выделения клеток: биопсии миокарда [US 2010061966] и аневризмы ЛЖ [RU 2366706]. Однако биопсия миокарда не является рутинным методом обследования пациентов, проводится только по строгим медицинским показания (прогрессирующая ХСН неясной этиологии, нарушения ритма и проводимости неясного генеза, для диагностики миокардита и кардиомиопатии и др.) и позволяет получить очень маленькие образцы миокарда (0,1-0,3 мг). Это не позволяет рассматривать биоптаты миокарда в качестве оптимальною источника для получения СКС. Второй источник ткани для получения СКС (аневризма сердца, которая иссекается при оперативном вмешательстве) также имеет ряд недостатков. Аневризма сердца возникает после обширного ИМ вследствие выпячивания потерявшей свой тонус стенки сердца под действием повышенного внутрижелудочкового давления. Ткань хронической постинфарктной аневризмы представлена в основном фиброзной тканью, лишенной мышечных волокон. Отсутствие мышечной ткани и резкое уменьшение количества СКС в отдаленном постинфарктном периоде [Urbanek, K., Torella D., Sheikh F., et al. Myocardial regeneration by activation of multipotent cardiac stem cells in ischemic heart failure // Proc Nati Acad Sci USA. - 2005. - V.102. - №24. - P.8692-7] накладывают определенные ограничения для использование хронической аневризмы для выделения СКС.
Метод получения СКС, предлагаемый в качестве изобретения, позволяет проводить выделение стволовых клеток из образцов миокарда независимо от их размера, полученных из любого отдела сердца человека и животных. Разработанный метод позволяет многократно увеличить (нарастить) ex vivo количество получаемых резидентных СКС, используя культивирование в виде эксплантной культуры, а затем выполнить селекцию с помощью иммуномагнитного сортинга строго определенной популяции стволовых клеток. Метод культивирования эксплантной культуры был выбран авторами по следующим соображениям. Паракринные факторы клеток микроокружения регулируют выживаемость и пролиферацию стволовых клеток in vitro и in vivo [Urbanek, K., Cesselli D., Rota M., et al. Stem ceil niches in the adult mouse heart // Proc Nati Acad Sci USA. - 2006. - V.103. - №24. - P.9226-31]. Следовательно, эксплантная культура может служить аналогом клеточной ниши ех vivo, в которой поддержание и пролиферация резидентных СКС осуществляется с помощью взаимодействия и паракринных факторов клеток микроокружения.
Метод отработан при использовании в качестве оптимального источника для получения резидентных СКС человека ушка правого предсердия (ПП), которое отсекается в ходе стандартного этапа операции аортокоронарного шунтирования.
Данный метод может быть использован для получения СКС из любого образца миокарда человека или животного (млекопитающего). При получении культуры СКС для клеточной терапии или изучения их свойств необходима разработка протокола получения чистой культуры СКС, лишенной клеток гематопоэтической природы. В литературе описаны исследования, указывающие, что значительная часть (около половины) СКС коэкспрессирует панлейкоцитарный маркер CD45 [Kubo, H., Jaleel N., Kumarapeli A., Berretta R.M., et al. Increased cardiac myocyte progenitors in failing human hearts // Circulation. - 2008. - V.118. - №6. - P.649-57], что указывает на их гематопоэтическую природу и костномозговое происхождение. Следовательно, при разработке методики выделения необходимо исключить возможность попадания в культуру СКС клеток гематопоэтической природы. Большинство исследователей отрицает возможность присутствия гематопоэтических c-kit+ клеток в миокарде человека и животных. В связи с этим в большинстве методик выделение СКС проводится только с помощью применения метода иммуномагнитной селекции [RU 2366706; Bearzi, С., Leri A., LoMonaco F., et al. Identification of a coronary vascular progenitor cell in the human heart // Proc Nati Acad Sci USA. - 2009. - V.106. - №37. - P.15885-90] или клеточного сортинга [Hosoda, Т., D'Amario D., Cabral-Da-Silva M.C., et al. Clonality of mouse and human cardiomyogenesis in vivo // Proc Nati Acad Sci USA. - 2009. - V.106. - №40. - P.169-174], как правило, по одному антигену - c-kit, характерному для СКС. Эти методы выделения имеют ряд недостатков, связанных с малым количеством получаемых СКС, ограниченным маленьким объемом образцов миокарда, а также с невозможностью получить чистую культуру СКС в связи с присутствием клеток гематопоэтической природы, которые также могут нести на своей поверхности этот антиген.
Таким образом, несмотря на документированную способность популяции c-kit-положительных (c-kit+) СКС к самообновлению, пролиферации, дифференцировке в клетки миокарда и участию в его регенерации, клиническое использование этой популяции ограничено в связи с недостаточной отработкой методик их выделения из малых образцов миокарда человека и экспансии в культуре.
Задачей изобретения является создание нового способа выделения стволовых клеток, позволяющего получить обогащенную популяцию резидентных СКС из любых образцов миокарда человека и животных (млекопитающих). Данный результат достигается за счет использования эксплантной культуры, которая позволяет многократно увеличить (нарастить) количество резидентных СКС ех vivo, и последующего проведения иммуномагнитной селекции для получения строго определенной популяции стволовых клеток.
Поставленная задача решается тем, что в способе выделения резидентных стволовых клеток сердца из образцов миокарда, включающем измельчение образцов, обработку их ферментами и проведение иммуномагнитной селекции, согласно изобретению после обработки образцов ферментами осуществляют культивирование методом эксплантной культуры на культуральной чашке, при этом культуральную чашку используют с покрытием из фибронектина, а в качестве ферментов для обработки образцов используют вещества, обеспечивающие частичное расщепление ткани образца и адгезию эксплантов к поверхности культуральной чашки. Измельчение образцов миокарда проводят до получения кусочков размером 1-3 мм3. Для обработки образцов миокарда используют протеолитические ферменты. Обработку ферментами образцов миокарда проводят в растворе, содержащем 0-0,5% коллагеназы А и 0-0,2% трипсина в фосфатно-солевом буфере, в течение 1-30 минут при 37°С. Фибронектин для покрытия культуральных чашек используют в концентрации от 1 до 1000 мкг/мл. Культивирование образцов миокарда (эксплантов) проводят в среде IMDM, содержащей 1-20% фетальной сыворотки теленка, 100 ед./мл пенициллина, 100 мкг/мл стрептомицина и 2 мМ Л-глутамина, в течение 7-40 дней при 37°С в атмосфере 5% СО2, со сменой среды каждые 1-5 дней. Иммуномагнитную селекцию клеток эксплантной культуры для получения резидентных стволовых клеток проводят с поверхностными маркерами c-kit, и/или sca-1, и/или MDR1. При этом иммуномагнитная селекция клеток эксплантной культуры из одного образца миокарда может быть осуществлена от 1-5 последовательных этапов с интервалами 5-21 день.
Изобретение поясняется чертежами.
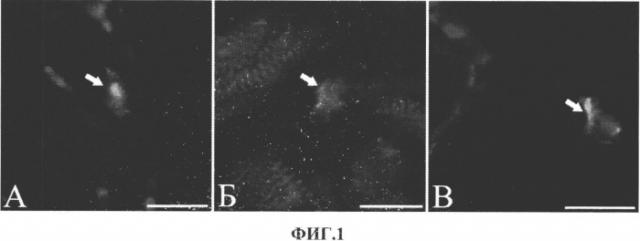
На фиг.1 представлено визуальное отображение экспрессии маркеров кардиомиоцитов и гладкомышечных клеток в c-kit+ CKC ткани ушка правого предсердия сердца человека. Стрелки указывают на окрашенные CKC, экспрессирующие маркеры кардиомиоцитов (Gata 4 (А), саркомерный α-актинин (Б)) и гладкомышечных клеток (гладкомышечный α-актин (В)). Масштабный отрезок 10 мкм.
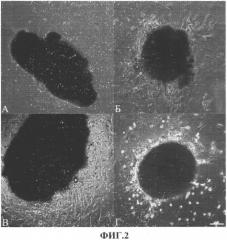
На фиг.2 показано культивирование клеток ушка правого предсердия методом эксплантной культуры. На фигуре присутствуют следующие обозначения: А - 7 день культивирования; Б - образование монослоя фибробластоподобных клеток (11 день); В, Г - появление округлых клеток на поверхности клеток с фибробластоподобной морфологией (19 день). Масштабный отрезок 20 мкм.
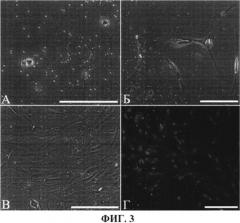
На фиг.3 представлены c-kit позитивные CKC ушка правого предсердия, полученные методом иммуномагнитной селекции. На фигуре присутствуют следующие обозначения: А - через 24 часа после селекции; Б - через 5 суток после селекции; В - монослой c-kit клеток (14 дней); Г - маркер c-kit на поверхности CKC.
Таким образом, заявляется способ получения клеточной культуры резидентных СКС, предназначенной для их использования в качестве инструмента клеточной терапии заболеваний сердечно-сосудистой системы, изучения их биологии и механизмов их участия в регенерации сердца с целью разработки методов стимуляции эндогенных механизмов регенерации миокарда. Предлагаемая методика основана на том, что в ткани миокарда присутствуют резидентные СКС, которые образуются в нем в период эмбрионального развития, способны к мультипотентной дифференцировке in vitro и in vivo и участию в процессах обновления и регенерации миокарда. Эти уникальные характеристики делают СКС потенциально более привлекательными для клеточной терапии с целью регенерации миокарда, чем любые другие клетки, выделяемые из других источников (костный мозг, кровь, скелетные мышцы или жировая ткань) и имеющие ограниченный дифференцировочный потенциал.
В настоящем изобретении в качестве источника СКС предлагается использовать образцы миокарда, полученные из любых отделов сердца человека и животных (млекопитающих) с использованием основных маркеров стволовых клеток, таких как С-kit, Sca-1, MDR1, Isletl, SSEA1 и др. В качестве изобретения предлагается методика получения культуры СКС, основанная на сочетании методов эксплантной культуры с последующей иммуномагнитной селекцией. Подробное описание метода выделения резидентных c-kit+ СКС из образца ушка ПП сердца человека представлено в примере 1.
Согласно разработанной методике образцы миокарда доставляли в лабораторию в растворе фосфатно-солевого буфера без Са++ и Mg++ в течение 1 часа после получения. В условиях культурального бокса с ламинарным потоком воздуха образцы миокарда измельчали с помощью ножниц до получения кусочков размером 1-3 мм3 и после ферментативной обработки (1-30 минут при 37°С при постоянном покачивании на шейкере в растворе с 0-0,5% коллагеназы и 0-0,2% трипсина), культивировали на чашках, покрытых фибронектином 1-1000 мкг/мл, в специальной среде (IMDM, содержащей 1-20% фетальной сыворотки теленка, 100 ед./мл пенициллина, 100 мкг/мл стрептомицина и 2 мМ Л-глутамина). Через 7-10 дней с момента начала культивирования вокруг экспланта начинали появляться клетки фибробластоподобной морфологии. На 7-40 день культивирования вокруг эксплантов образовывался монослой клеток, поверх которых располагались округлые прозрачные клетки с узким ободком цитоплазмы. Длительное культивирование клеток эксплантов в описанных условиях при отсутствии факторов, поддерживающих жизнеспособность клеток гематопоэтической природы, позволяло полностью избавиться от гематопоэтических/тучных клеток в культуре. Кроме того, условия культивирования эксплантов являлись благоприятными для культивирования СКС, что позволяло длительно сохранять их иммунофенотип, недифференцированное состояние и многократно увеличить их количество в сравнении с их содержанием в исходном образце. После наращивания клетки эксплантной культуры использовали для выделения резидентных СКС на основании экспрессии поверхностных маркеров (C-kit, Sca-1, MDR1). Для этого клетки эксплантной культуры обрабатывали средой для открепления клеток Accutase («ICT», США) в течение 1-20 минут (под визуальным контролем под микроскопом). Полученные клетки фильтровали через нейлоновые мембраны с размером пор 40 микрон и далее использовали для иммуномагнитной селекции. Для проведения селекции СКС использовали коммерческие наборы для иммуномагнитной селекции клеток компаний «Miltenyi Biotec» (США) и «Dynal Biotech» (Норвегия). Проводили несколько этапов иммуномагнитной селекции клеток эксплантной культуры, получаемых из одного и того же образца миокарда. Проведение повторной иммуномагнитной селекции осуществляли каждые 7-14 дней культивирования эксплантной культуры. Эта процедура позволяла многократно повысить количество стволовых клеток, извлекаемых из каждого образца миокарда, и получить культуру, содержащую 95-98% резидентных СКС. Полученные СКС сохраняли свой иммунофенотип, недифференцированное состояние, не экспрессируют маркеров гематопоэтических и тучных клеток, были способны к пролиферации и обладали основными свойствами стволовых клеток.
Таким образом, объектом настоящего изобретения является метод, который позволяет проводить эффективное выделение резидентных СКС без примеси гематопоэтических и тучных клеток из любых образцов миокарда человека и животных. Разработанный метод выделения стволовых клеток из миокарда может служить основой для разработки технологии клеточной терапии на основе резидентных СКС.
При осуществлении изобретения помимо методов, подробно раскрытых в нижеследующих примерах, были использованы известные методики, описанные также в цитированных источниках.
Пример 1. Метод выделения резидентных с kit+ стволовых клеток из образцов миокарда ушка ПП сердца человека
Иссечение ушка ПП проводили при канюляции ПП для подключения к аппарату искусственного кровообращения в ходе стандартного этапа операции аортокоронарного шунтирования. Перед началом выделения были проанализировали срезы миокарда ушка ПП для выявления клеток-предшественников кардиомиоцитов и клеток сосудов с помощью метода иммунофлуоресцентного окрашивания ткани (пример 2). В ткани миокарда c-kit+ CKC экспрессировали маркер пролиферации Ki-67, а также транскрипционные факторы и структурные белки кардиомиоцитов и клеток сосудов, что характеризует их как прогениторные клетки и клетки-предшественники. В c-kit+ клетках ушка ПП была выявлена экспрессия транскрипционного фактора Gata 4, характерного для ранних этапов кардиомиоцитарной дифференцировки, а также саркомерного α-актинина-белка сократительного аппарата кардиомиоцитов, характеризующего более поздние этапы этого типа дифференцировки (фиг.1). Также были обнаружены c-kit+ клетки, локализованные вблизи крупных сосудов и экспрессирующие белок гладкомышечных клеток - гладкомышечный α-актин (фиг.1) и маркер перицитов NG2.
Учитывая присутствие c-kit+ CKC в образцах миокарда с признаками дифференцировки в кардиомиоциты и клетки сосудов in vivo проведено выделение культуры резидентных c-kit+ CKC по методике, включающей подготовку эксплантной культуры с последующей иммуномагнитной селекцией.
1.1 Получение эксплантной культуры клеток ушка ПП
Образец миокарда ушка ПП (в 10 мл раствора фосфатно-солевого буфера без Са++ и Mg++) был доставлен в лабораторию в течение 1 часа после иссечения в ходе операции аортокоронарного шунтирования. В условиях стерильного культурального бокса с ламинарным потоком воздуха кусочки ткани измельчали ножницами до получения размеров кусочков 1-3 мм3, затем промывали раствором ФСБ 3 раза (для удаления клеток крови). Далее проводили обработку ткани раствором ферментов (0,1% коллагеназы А («Rochediagnostics», США) и 0,2% трипсина («Invitrogen», США) в фосфатно-солевом буфере) при 37°С в течение 15 минут при постоянном покачивании на шейкере. После инкубации к раствору ферментов с кусочками ткани добавляли тройной объем среды IMDM, содержащей 10% фетальной сыворотки теленка («Hyclone», США), и центрифугировали 10 мин со скоростью 1000 оборотов/мин (200g). После центрифугирования проводили удаление жидкости над осадком. Промывку ткани средой и центрифугирование повторяли 2 раза. Затем кусочки ткани миокарда ресуспендировали в среде культивирования (IMDM, содержащей 10% фетальной сыворотки коровы, 100 ед./мл пенициллина, 100 мкг/мл стрептомицина, 2 мМ Л-глутамина) и помещали на пластиковые культуральные чашки, предварительно покрытые фибронектином (20 мкг/мл) (фиг.2). Каждые три дня производили частичную замену среды (около 50% от общего объема). Экспланты культивировали до момента появления прозрачных округлых клеток, находящихся на слое фибробластов (21 день).
Для анализа иммунофенотипа клеток эксплантной культуры использовали методы проточной цитофлуориметрии и иммунофлуоресцентного окрашивания (примеры 3, 4). После 3 недель культивирования эксплантов ушка ПП было выявлено несколько субпопуляций клеток на основе экспрессии поверхностных маркеров, соответствующих зрелому эндотелию и его предшественникам - CD31+ (1,3±0,7%), CD34+ (2,3±1,54%)), мезенхимальным клеткам - CD105+ (85,6±6,6%); CD73+ (92,6±4,2%), CD90+ (91,87±6,53%)) и СПКС - c-kit+ (3,37±6,7%), sca-1+ (0,33±0,24%)). Характерной особенностью c-kit+ клеток в эксплантной культуре ушка ПП было отсутствие маркеров гематопоэтических (CD45, CD34, Lin1) и тучных клеток (триптаза, CD33). Кроме того, c-kit+ клетки в эксплантной культуре не экспрессировали маркеров зрелых/дифференцированных эндотелиальных (CD31, KDR), гладкомышечных (Gata 6, гладкомышечный α-актин) клеток и кардиомиоцитов (Nkx 2,5, тропонинI, саркомерный α-актинин).
1.2 Сортировка клеток эксплантной культуры методом иммуномагнитной селекции с использованием антител к c-kit
Через 21 день с момента начала культивирования клетки эксплантной культуры использовали для проведения иммуномагнитной селекции и получения обогащенной культуры резидентных c-kit+ СКС. Для сортинга использовались первичные моноклональные антитела к антигену c-kit человека («Biolegend», США) и вторичные антитела к Fc-фрагменту мышиных IgG («DynalBiotech», Норвегия), конъюгированные с магнитными бусинами (размер 4,5 мкм). Клетки эксплантной культуры обрабатывали средой для открепления клеток Accutase («ICT», США) в течение 10 минут (под визуальным контролем под микроскопом). Полученные клетки профильтровали через нейлоновые мембраны с размером пор 40 микрон и далее использовали для иммуномагнитной селекции.
Перед проведением иммуномагнитной селекции вторичные антитела, конъюгированные с бусинами, отмывали от азида натрия в 10 мл буфера для селекции (фосфатно-солевой буфер без Са++ и Mg++/0,l% бычьего сывороточного альбумина/2 мМ ЭДТА, рН 7,4) 2 раза на магните. Далее в 100 мкл холодного буфера для селекции проводили инкубацию первичных моноклональных антител к антигену c-kit человека («Biolegend», США) и вторичных антител к Fc-фрагменту мышиных IgG, связанных с бусинами, в течение 30 минут при постоянном покачивании и перемешивании при +4°С. После инкубации пробирку с магнитными бусами и антителами помещали в магнитное поле. Далее 3 раза проводили отмывку на магните несвязавшихся антител с помощью буфера для селекции (10 мл). После промывки к суспензии клеток (эксплантной культуры) добавляли 7 мл буфера для селекции с антителами (проинкубированные первичные и вторичные антитела) исходя из расчета 3 бусины на клетку и инкубировали при постоянном покачивании и перемешивании на +4°С в течение 40 минут. После инкубации пробирку ставили на магнит на 3 минуты, после чего убирали среду с несвязавшимися клетками. Затем добавляли 10 мл буфера для селекции, ресуспендировали пипеткой и снова ставили на магнит. Эту процедуру повторяли 5 раз. Затем клетки, связанные с магнитными бусами, ресуспендировали в среде культивирования (фиг.3).
Полученные этим методом резидентные c-kit+ CKC экспрессировали маркер Ki-67, что указывает на их способность к пролиферации in vitro. Отсутствие маркеров CD45, CD34, Lini и триптазы указывает на отсутствие гематопоэтических и тучных клеток в культуре c-kit+ клеток, выделенных из эксплантной культуры. Свежевыделенные c-kit+ клетки не окрашивались специфическими антителами (примеры 3, 4) на маркеры кардиомиоцитов (десмин, α-саркомерный актин, α-саркомерный актинин и коннексин-43), гладкомышечных (α-гладкомышечный актин, десмин), эндотелиальных клеток (CD31, vW) и фибробластов (виментин, фибронектин), что свидетельствует об отсутствии спонтанной дифференцировки в выбранных условиях культивирования эксплантов. Было обнаружено, что выделенные с помощью этого метода резидентные c-kit+ CKC обладают основными свойствами стволовых клеток.
Пример 2. Иммунофлуоресцентное окрашивание ткани миокарда
Ткань миокарда замораживали в жидком азоте. Криосрезы миокарда (толщиной 7 мкм) фиксировали в 3,7%-ном растворе формалина в течение 15 мин. Для снижения неспецифического связывания антител с образцами на срезы наносили блокирующий раствор (10% бычьего сывороточного альбумина в фосфатно-солевом буфере) на 30 мин. После удаления блокирующего раствора срезы инкубировали с первичными антителами к антигенам c-kit («Dako», США, и «Biolegend», США), саркомерному α-актинину («Sigma», США), CD31 («BDPharmingen», США), MDR1 («Chemicon», США), Sca-1 («AbDSerotec», США), Islet-1 («Abeam», США), CD45 («Abeam», США), CD34 («BDPharmingen», США; «SantaCruz», США), IGF-1R («Calbiochem», США), C-met («Zymed», США), α-гладкомышечному актину («Sigma», США), VEGFR2 («Abeam», США), CD105 («AbDSerotec», США), NG2 («Chemicon», США), Nkx 2,5 («Abeam», США), Gata 4 («SantaCruz», США), Ki-67 («BDPharmingen», США), триптазе («SantaCruz», США) в разведениях, рекомендованных производителем, в течение 60 мин. Затем срезы отмывали от первичных антител в ФСБ, инкубировали в течение 60 мин со вторичными флуоресцентно-меченными антителами AlexaFluor («Invitrogen», США) в разведении 1:2000 в растворе 1% бычьего сывороточного альбумина в фосфатно-солевом буфере и затем 3 раза отмывали от антител в фосфатно-солевом буфере. Ядра докрашивали DAPI. После отмывки срезы на стеклах заключали в среде Aquapolymount («Polysciencesinc», США). Препараты анализировали с использованием флуоресцентного микроскопа Axiovert 200M («Zeiss», Германия). Документирование изображений производили с помощью цифровой видеокамеры Axiocam HRC («Zeiss», Германия) и обработки изображения в программах Axiovision 3.1 («Zeiss», Германия) и AdobePhotoShopCS («AdobeSystems», США).
Пример 3. Иммунофлуоресцентное окрашивание выделенных клеток и проточная цитофлуориметрия
Для анализа методом проточной цитофлуориметрии суспензию выделенных клеток отмывали в ФСБ с 1% ФБС и азидом натрия (0,09%) и окрашивали антителами, конъюгированными с флуоресцентными метками к CD117-RPE («DAKO», США); 1:100), SCA-1-FITC («MiltenyiBiotec», США; 1:100), CD34-APC («DAKO», США; 1:200), CD31-FITC («BDPharmingen», США; 1:100), CD45-RPE-Cy5 («DAKO», CUIA; 1:100), CD33-FITC («BDPharmingen», США; 1:100), CD105-FITC («AbD Serotec», США; 1:100), CD73-PE («BD Pharmingen», США; 1:100), CD90-FITC («BDPharmingen», США; 1:100), Linl-FITC («BD Pharmingen», США; 1:100) с использованием соответствующих контролей: IgG1-RPE («DAKO», США; 1:100), IgG1-APC («DAKO», США; 1:200), IgG1-FITC («BDPharmingen», США; 1:100). Антитела разводили в фосфатно-солевом буфере с 1% фетальной сыворотки коров и окрашивали клетки при комнатной температуре в течение 30 минут. Затем клетки отмывали от излишков антител в ФСБ. Анализ проводили на клеточном сортере MoFlo («DakoCytomation», Дания) или на проточном цитофлуориметре BDFACSCanto™II («BDPharmingen», США).
Пример 4. Иммунофлуоресцентное окрашивание клеток
Клетки, культивированные на стеклах, промывали в фосфатно-солевом буфере и фиксировали 4% формалином в течение 15 минут. Для снижения неспецифического связывания антител с клетками препараты инкубировали в блокирующем растворе (1% бычьего сывороточного альбумина/10% сыворотки донора вторых антител/фосфатно-солевой буфер) в течение 30 минут. После удаления излишка блокирующего раствора клетки инкубировали в течение 60 мин с первичными антителами (в концентрациях, рекомендованных изготовителем) в растворе (1% бычий сывороточный альбумин/фосфатно-солевой буфер). Использовали первичные антитела против c-kit («Dako», США, и «Biolegend», США), саркомерного α-актинина («Sigma», США), саркомерного α-актина («Sigma», США), CD31 («BDPharmingen», США), vW («Sigma», США), CD45 («Abeam», США), CD34 («BDPharmingen», США), α-гладкомышечного актина («Sigma», США), VEGFR2 («Abeam», США), Nkx 2,5 («Abeam», США, и «SantaCruz», США), Gata 4 («SantaCruz», США), ТропонинаI («SantaCruz», США), Ki-67 («BDPharmingen», США), триптазы («SantaCruz», США), коннексина-43 («Zymedlaboratoriesinc», США). Клетки отмывали от излишков антител 3 раза в фосфатно-солевом буфере. Затем инкубировали клетки в течение 60 минут с вторичными антителами AlexaFluor («Invitrogen», США), меченными TexasRed или FITC в стандартном разведении 1:2000 в растворе (1% бычьего сывороточного альбумина/фосфатно-солевой буфер). Отмывали клетки от излишков антител в фосфатно-солевом буфере 3 раза. Ядра клеток докрашивали DAPI. После отмывки в фосфатно-солевом буфере стекла с клетками заключали в Aquapolymount («Polysciencesinc», США).
Полученные таким образом препараты анализировали с помощью флуоресцентного микроскопа Axiovert 200M («Zeiss», Германия). Документирование изображений производили с помощью цифровой видеокамеры Axiocam HRC («Zeiss», Германия) и обработки изображения в программах Axiovision 3.1 («Zeiss», Германия) и AdobePhotoShop («AdobeSystems», США).
1. Способ получения резидентных стволовых клеток сердца млекопитающего, экспрессирующих поверхностные маркеры c-kit, и/или sca-1, и/или MDR1, в ходе которого выделяют образцы ткани миокарда, измельчают образцы, осуществляют их ферментативную обработку коллагеназой и трипсином и проводят культивирование на культуральной чашке с покрытием из фибронектина и дальнейшую иммуномагнитную селекцию, отличающийся тем, что культивирование на культуральной чашке с покрытием из фибронектина осуществляют методом эксплантной культуры измельченных образцов, полученных после их ферментативной обработки, которую используют для частичного расщепления ткани образца и адгезии эксплантов к поверхности культуральной чашки.
2. Способ по п.1, отличающийся тем, что измельчение образцов миокарда проводят до получения кусочков размером 1-3 мм3.
3. Способ по п.1, отличающийся тем, что для обработки образцов миокарда используют протеолитические ферменты.
4. Способ по п.3, отличающийся тем, что обработку ферментами образцов миокарда проводят в растворе, содержащем 0-0,5% коллагеназы А и 0-0,2% трипсина, в течение 1-30 минут при 37°С.
5. Способ по п.1, отличающийся тем, что фибронектин для покрытия культуральных чашек используют в концентрации от 1 до 1000 мкг/мл.
6. Способ по п.1, отличающийся тем, что культивирование образцов миокарда (эксплантов) проводят в среде IMDM, содержащей 1-20% фетальной сыворотки теленка, 100 ед./мл пенициллина, 100 мкг/мл стрептомицина и 2 мМ Л-глутамина в течение 7-40 дней при 37°С в атмосфере 5% СО2, со сменой среды каждые 1-5 дней.
7. Способ по п.1, отличающийся тем, что иммуномагнитную селекцию клеток эксплантной культуры для получения резидентных стволовых клеток проводят с поверхностными маркерами c-kit, и/или sca-1, и/или MDR1.
8. Способ по п.9, отличающийся тем, что иммуномагнитную селекцию клеток эксплантной культуры из одного образца миокарда проводят от 1 до 5 последовательных этапов с интервалами 5-21 день.