Способ оценки радиочувствительности рака верхних дыхательных путей
Иллюстрации
Показать всеИзобретение относится к области медицине, а именно онкологии, и может быть использовано для оценки радиочувствительности рака верхних дыхательных путей. Для этого определяют частоту гемопоэтических стволовых клеток с иммунофенотипом CD34+CD45low среди лимфоцитов периферической крови на стадиях рака Т3 или Т4 до лечения и сравнивают с ее дискриминационным уровнем 6,0×10-4. При значениях более 6,0×10-4 прогнозируют высокую радиочувствительность опухоли, а при значениях менее или равно 6,0×10-4 прогнозируют низкую радиочуствительность опухоли. Использование данного способа позволяет прогнозировать радиочуствительность злокачественных новообразований на облучение для оценки показаний к проведению лучевой терапии больных раком верхних дыхательных путей на стадии Т3 или Т4. 2 пр., 3 ил., 2 табл.
Реферат
Изобретение относится к области медицины, точнее, к области онкологии, касающейся иммунологического анализа связывания клеток крови с антителами, меченными флуорохромами.
Известно, что радиочувствительность рака верхних дыхательных путей (ВДП) (как и других локализаций) сильно различается на индивидуальном уровне при одних и тех же клинико-морфологических показателях опухолевого процесса (анатомическая область, стадия, гистологический тип, степень дифференцировки опухолевых клеток). Этот факт делает неэффективным использование радиотерапии у части больных и определяет необходимость выявления таких пациентов еще до начала лечения с целью его оптимизации. Среди причин широкой индивидуальной вариабельности радиочувствительности следует указать хорошо известные биологические факторы - различия в оксигенации опухолей, пролиферативной активности опухолевых клеток и т.д. [1]. В последние годы интенсивно исследуются молекулярно-биологические показатели (профиль генной экспрессии, различные мутации, наличие папиллома-вирусной инфекции), также влияющие на радиочувствительность опухолей [2-7].
Известен способ определения радиочувствительности опухоли слизистых оболочек полости рта (патент РФ №2387472, МПК A61N 5/067 публ. 2008). Способ состоит в определении прогностических показателей по исходному уровню экспрессии антигена Ki-67 в опухоли и соотношению интенсивностей флуоресценции на определенных длинах волн (420 нм, 460 нм, 520 нм, 560 нм, 608 нм) в опухоли и интактной ткани после воздействия лазерного излучения (370 нм и 532 нм) на опухоль и окружающую ее интактную ткань. Определение радиочувствительности проводят по сумме всех критериев прогноза.
Недостатком этого способа являются достаточно трудоемкие манипуляции с использованием лазерного излучения и использование инвазивных методов получения биологического материала (образцов опухолевой ткани).
Известен способ прогнозирования индивидуальной радиочувствительности в условиях гипоксии (патент РФ №2075078, МПК A61N 5/00 G01N 33/48 публ. 1997). Способ состоит в проведении гипоксической пробы с двухкратным взятием биопсии кожи до и после пробы. Выполняют гистологическую обработку биоптатов для выявления тканевых базофилов с помощью тиазинового красителя, а затем подсчитывают все структурно-метаболические формы тканевых базофилов и осуществляют прогноз расчетным путем.
Недостатком этого способа является необходимость использования инвазивных методов получения биологического материала и трудоемкие манипуляции, чаще всего используемые лишь в экспериментальных исследованиях и непригодные для широкого практического применения.
Известны способы идентификации и количественной оценки гемопоэтических стволовых клеток (ГСК) в периферической крови человека с помощью проточной цитометрии в онкогематологии и аутотрансплантации. Способы основаны на использовании моноклональных антител (МКАТ) к белковым маркерам кластеров дифференцировки (cluster of differentiation - CD), характерным для ГСК. При этом лучшими антителами для идентификации ГСК человека признаются МКАТ к CD34 III класса [8, 9]. Для проточной цитометрии используют МКАТ к CD34, меченные флуорохромами, чаще всего фикоэритрином (ФЭ) (патент США №4520110, Европейский патент №76695, Канадский патент №1179942). Добавление в исследуемый образец дополнительных антител, меченных другими флуорохромами, чаще всего - флуоресцеинизотиоционатом (ФИТЦ) или перидининхлорофиллином, позволяет увеличить специфичность и точность идентификации ГСК [10].
Наиболее близким техническим решением является использование специального коммерческого набора компании Becton Dickinson (США) под названием ProCOUNT. Набор включает меченые флуорохромами МКАТ и ДНК-связывающий краситель, а также порядок действий при подготовке и анализе образцов крови (инструкция производителя прилагается к набору). В частности, протокол ProCOUNT включает использование пары МКАТ к CD34-ФЭ и CD45-перидининхлорофиллин, что обеспечивает выявление ГСК по интенсивному связыванию МКАТ к CD34 (CD34+ - высокая экспрессия маркера CD34) и слабому связыванию МКАТ к CD45 (CD45low - низкая экспрессия маркера CD45). Протокол включает также использование ДНК-связывающего красителя и анализ количества CD34+CD45low клеток с низким боковым светорассеянием, что позволяет исключить дебрис (разрушенные клетки).
Недостатки прототипа - отсутствуют данные о прогностическом значении количества ГСК в крови человека как фактора, определяющего радиочувствительность злокачественных новообразований человека.
Ни один из известных методов идентификации и количественной оценки ГСК не применяют как способ прогнозирования радиочувствительности злокачественных новообразований. Опыт российских и зарубежных исследований свидетельствует о том, что ГСК способны дифференцироваться в эндотелиальные клетки, стимулировать ангиогенез и тем самым поддерживать кровоснабжение и оксигенацию опухоли, которая является одним из основных факторов ее радиочувствительности [11-14].
Технический результат заявленного изобретения заключается в повышении точности оценки показаний к проведению лучевой терапии больных раком ВДП в стадиях Т3 или Т4 на основе нового принципа прогнозирования радиочувствительности злокачественных новообразований.
Сущность изобретения заключается в том, что у больного раком ВДП на стадии Т3 или Т4 до лечения с помощью меченых МКАТ определяют частоту ГСК, циркулирующих в периферической крови, и сравнивают ее с дискриминационным уровнем - 6,0·10-4. По частоте ГСК прогнозируют характер реакции новообразования на лучевую терапию больных раком ВДП. При этом, если частота ГСК в крови больного до лечения составляет более 6,0·10-4, то прогнозируют высокую радиочувствительность опухоли. Если частота ГСК менее или равна 6,0·10-4, прогнозируют низкую радиочувствительность опухоли.
Перечень фигур:
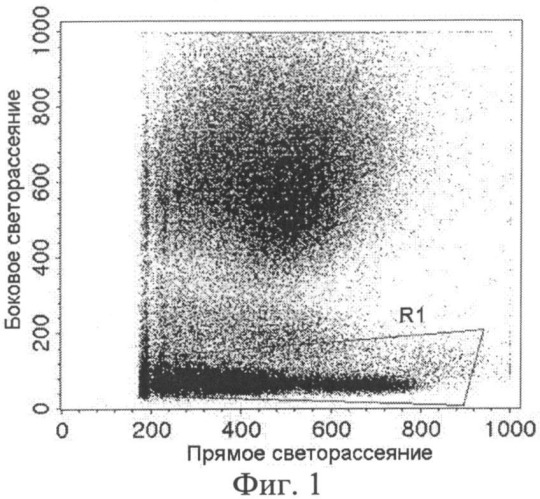
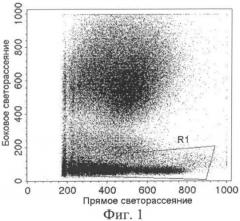
Фиг.1 - Распределение клеток по интенсивности прямого и бокового светорассеяния. R1 (область исследования) - регион клеток с низким боковым светорассеянием.
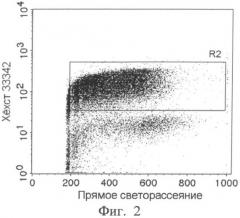
Фиг.2 - Распределение клеток по прямому светорассеянию и окрашиванию ДНК-связывающим красителем Хехст33342 (R2 - регион ядросодержащих клеток).
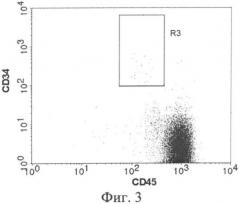
Фиг.3 - Распределение клеток, взятых из регионов.R1 (фиг.1)и R2 (фиг.2), по интенсивности связывания МКАТ к CD45 и МКАТ к CD34. R3 - регион клеток с иммунофенотипом CD34+CD45low (область исследования).
Порядок реализации способа:
I этап включает сбор образцов и окрашивание клеток периферической крови больных раком ВДП на стадии Т3 или Т4 до лечения с помощью моноклональных антител и ДНК-связывающего красителя. Сбор и окрашивание образцов крови выполняют следующим образом:
1. Образец крови объемом не менее 0,5 мл забирают из локтевой вены в пробирку с гепарином в конечной концентрации 25 ед/мл крови. Окрашивание образца начинают не позднее, чем через 24 часа после пункции вены;
2. В маркированную пробирку вносят 100 мкл гепаринизированной крови, 20 мкл МКАТ, меченных ФИТЦ, к CD45 и 20 мкл МКАТ, меченных ФЭ, к CD34 (Becton Dickinson - BD, США);
3. Смесь крови, МКАТ к CD45 и МКАТ к CD34 тщательно перемешивают и инкубируют при комнатной температуре в темноте в течение 20 минут, затем лизируют эритроциты. Для этого концентрированный лизирующий раствор FACS-Lysing (BD, USA) разводят дистиллированной водой в 10 раз, после чего 1 мл готового раствора вносят в пробирку со смесью крови и указанных МКАТ, перемешивают и инкубируют в темноте в течение 10-12 мин;
4. Осаждают лейкоциты центрифугированием при 300 g 5 минут;
5. Производят двукратное отмывание клеток крови в 1 мл 0,01 М фосфатного солевого буфера, рН 7,2 (ФСБ), содержащего 0,15 М NaCl, с помощью центрифугирования (300g в течение 5 минут);
6. В пробирку с осадком вносят 200 мкл ФСБ и 5 мкл ДНК-связывающего красителя Хехст 33342 в концентрации 250 мкг/мл («Sigma», США). Смесь перемешивают и инкубируют в течение 15 минут.
II этап включает - получение данных с помощью проточной цитометрии:
1. Образец, подготовленный как описано на I этапе, анализируют на проточном цитометре FACS Vantage (BD, США), оснащенном лазерами с длиной волны 364 и 488 нм, или на других проточных цитофлуориметрах с указанными характеристиками;
2. Для измерения флуоресценции ФИТЦ, а используют узкополосные фильтры 530/30 нм, для ФЭ - 575/30 нм, для Хехста 33342 - 424/20 нм;
3. В каждом образце анализируют по 200 тысяч клеток. Данные об интенсивности прямого и бокового светорассеяния, флуоресценции ФИТЦа, ФЭ, Хехста 33342 сохраняют файл. Полученные результаты записывают в цифровом виде;
4. Сохраненные данные обрабатывают с помощью программы CellQuestPro (BD, USA) или другого программного обеспечения с необходимыми характеристиками.
III этап состоит в обработке данных, собранных с помощью проточной цитометрии, в соответствии с алгоритмом идентификации ГСК по следующим критериям:
- сильная экспрессия маркера CD34 на поверхности клеток (CD34+);
- слабая экспрессия общелейкоцитарного маркера CD45 (CD45low).;
- низкое боковое светорассеяние, характерное для лимфоидных популяций;
- интенсивное окрашивание Хехстом 33342, что позволяет дифференцировать ядросодержащие клетки от дебриса, конгломератов тромбоцитов и др. неспецифических событий и, в конечном итоге, обеспечивает высокую точность количественного анализа ГСК.
В частности, анализ проточноцитометрических данных с целью выявления и определения частоты ГСК в периферической крови включает:
1. построение точечного графика распределения клеток по прямому и боковому светорассеянию (фиг.1). В распределении выделяют регион лимфоидных клеток (R1) с низким боковым светорассеянием и определяют количество клеток в R1;
2. построение точечного графика распределения клеток по прямому светорассеянию и интенсивности флуоресценции Хехста 33342 (фиг.2). На графике выделяют регион ядросодержащих клеток (R2), характеризующихся высокой флуоресценцией;
3. построение точечного графика распределения клеток по интенсивности флуоресценции МКАТ к CD34 и CD45 (фиг.3). График строят только для клеток, удовлетворяющих одновременно условиям R1 и R2. На графике выделяют регион клеток (R3) с иммунофенотипом CD34+ CD45low и определяют количество клеток в R3;
4. расчет относительного количества (частоты) ГСК путем деления количества клеток в R3 на число клеток в R1.
IV этап: Прогнозирование радиочувствительности опухоли:
1. Частоту ГСК, вычисленную по п.4 III этапа, сравнивают с дискриминационным уровнем, обоснование которого приводится в примере №1.
2. Если частота ГСК в крови больного до лечения более 6,0·10-4, вероятность высокой регрессии опухоли в ответ на лучевое воздействие составляет 74%, поэтому прогнозируется высокая радиочувствительность опухоли. Если частота ГСК менее или равна 6,0·10-4, прогнозируется низкая радиочувствительность опухоли.
Пример №1. Степень регрессии злокачественных опухолей ВДП (стадии Т3 или Т4) после I этапа лучевой терапии в группах больных с различным количеством циркулирующих ГСК до лечения
Частота ГСК клеток определена в периферической крови 65 больных раком ВДП до лечения в соответствии с методикой, подробно описанной выше. Больные были госпитализированы для лечения в отделение лучевого и хирургического лечения заболеваний верхних дыхательных путей ФГБУ МРНЦ Минздравсоцразвития России. Стадия Т3 диагностирована у 45 больных, Т4 - у 20 больного. Регионарные лимфатические узлы были вовлечены в опухолевый процесс у 31 больных, у остальных 34 больных признаков поражения лимфатических узлов не отмечено. Все больные находились в стадии М0. Лечение начинали с проведения курса лучевой терапии до суммарной очаговой дозы (СОД) 35-40 Гр с последующим 2-х недельным перерывом, по окончании которого эндоскопически оценивали степень регрессии опухоли. При сокращении объема новообразования более 50% опухоль расценивали как радиочувствительную и консервативное лечение продолжали до дозы 60-65 Гр. При уменьшении опухоли на 50% и менее проводилось хирургическое лечение в необходимом объеме.
Частота ГСК в крови больных до лечения варьировала от 1,7·10-4 до 57,5·10-4. Среднее значение ГСК в крови составляло 10,2·10-4. Степень регрессии первичного очага в группах больных раком ВДП на стадиях Т3 или Т4 с разной частотой ГСК в периферической крови до лечения показана в таблице 1. Результаты подсчетов по критерию χ2 свидетельствуют о более высокой радиочувствительности опухолей в группе больных с высокой частотой циркулирующих ГСК по сравнению с таковой при низком количестве ГСК (р=0,001). Так, регрессия первичного очага более 50% отмечена у 74% больных с высокой частотой ГСК (более 6,0·10-4) и только у 31% больных с низкой частотой таких клеток. Установленный дискриминационный уровень частоты ГСК (6,0·10-4) является оптимальным, т.к. другие дискриминационные уровни частоты ГСК имели меньшее прогностическое значение.
| Таблица 1 | ||
| Степень регрессии первичного очага в группах больных раком ВДП на стадиях Т3 или Т4 с разной частотой ГСК в периферической крови до лечения | ||
| Частота ГСК, ×10-4 | Регрессия первичного очага | |
| Более 50% | Менее 50% | |
| >6,0 | 29/39 (74%) | 10/39(26%) |
| ≤6,0 | 8/26(31%) | 18/26(69%) |
| *В таблице указано число больных (в скобках процент больных в соответствующей подгруппе). |
Пример №1 доказывает прогностическое значение частоты циркулирующих ГСК до лечения в отношении непосредственной реакции опухоли на облучение и обосновывает использование дискриминационного уровня частоты этих клеток 6,0·10-4 как критерия для классификации опухолей по радиочувствительности. Такой подход является информативным для оценки показаний к проведению лучевой терапии больных раком верхних дыхательных путей в стадии Т3 или Т4.
Пример №2. Степень регрессии злокачественных опухолей ВДП (стадии Т1 или Т2) после I этапа лучевой терапии в группах больных с различным количеством циркулирующих ГСК до лечения
Частота ГСК клеток определена в периферической крови 27 больных раком ВДП до лечения в соответствии с методикой, подробно описанной выше. Больные были госпитализированы для лечения в отделение лучевого и хирургического лечения заболеваний верхних дыхательных путей ФГБУ МРНЦ Минздравсоцразвития России. Стадия Т1 наблюдалась у 8, Т2 - у 19 больных. Регионарные лимфатические узлы были вовлечены в опухолевый процесс у 9 больных, у остальных 18 больных признаков поражения лимфатических узлов не отмечено. Все больные находились в стадии МО. Лечение начинали с проведения курса лучевой терапии до СОД 35-40 Гр с последующим 2-х недельным перерывом, по окончании которого эндоскопически оценивали степень регрессии опухоли. При сокращении объема новообразования более 50% консервативное лечение продолжали до дозы 60-65 Гр. При уменьшении опухоли на 50% и менее проводилось хирургическое лечение в необходимом объеме.
Частота ГСК в крови больных до лечения варьировала от 3,6·10-4 до 60,5·10-4. Среднее значение ГСК в крови составляло 11,7·10-4. Степень регрессии опухолей не отличалась в группах больных с разной частотой циркулирующих ГСК до лечения (таблица 2). Результаты подсчетов по критерию χ2 свидетельствуют о сходной радиочувствительности опухолей в группе больных с высокой и низкой частотой циркулирующих ГСК (р>0,05). Так, регрессия первичного очага более 50% отмечена у 68% больных с высокой частотой ГСК (более 6,0·10-4) и у 62% больных с низкой частотой таких клеток.
| Таблица 2 | ||
| Степень регрессии первичного очага в группах больных раком ВДП на стадиях Т1 или Т2 с разной частотой ГСК в периферической крови до лечения | ||
| Частота ГСК, ×10-4 | Регрессия первичного очага | |
| Более 50% | Менее 50% | |
| >6,0 | 13/19 (68%) | 6/19(32%) |
| ≤6,0 | 5/8 (62%) | 3/8 (38%) |
| *В таблице указано число больных (в скобках процент больных в соответствующей подгруппе. |
Вместе примеры №1 и №2 свидетельствуют, что данное изобретение применимо только в случае опухолей относительно большого размера (Т3 или Т4), когда оксигенация опухолей зависит от количества ГСК.
Доказательство достижения технического результата
Как показывает пример №1, новый принцип позволяет прогнозировать радиочувствительность рака ВДП на стадиях Т3 или Т4 с высокой статистической значимостью (р=0,001) до начала лечения. Информация об индивидуальной радиочувствительности злокачественных новообразований повышает точность оценки показаний к проведению лучевой терапии больных раком ВДП и, таким образом, улучшает планирование лечения. Кроме того, выявление пациентов со злокачественными новообразованиями, резистентными к стандартным вариантам радиационного воздействия, еще до начала лечения способствует разработке оптимальной стратегии их лечения, включая использование особых режимов фракционирования дозы редкоионизирующего излучения, использование адронной терапии, комбинированных методов лечения и.т.д. Следует также отметить, что для прогнозирования радиочувствительности рака ВДП используют относительно малоинвазивный способ получения биологического материала (периферической крови) и известный метод подготовки материала к анализу, что имеет существенное значение для широкого распространения данного способа оценки радиочувствительности рака ВДП.
Литература
1. Деденков А.Н., Пелевина И.И., Саенко А.С. Прогнозирование реакции опухолей на лучевую и лекарственную терапию / Москва: «Медицина», 1987, 159 с.
2. Thomas GR, Nadiminti H., Regalado J et al., Molecular predictors of clinical outcome in patients with head and neck squamous cell carcinoma // Int J Exp Pathol, 2005, V.86, N6, P.347-363.
3. Vu HL, Sikora AG, Fu S, Kao J. et al. HPV-induced oropharyngeal cancer, immune response and response to therapy // Cancer Lett., 2010, V.288, N2, P.149-155.
4. Lallemant В, Evrard A, Chambon G. et al. Gene expression profiling in head and neck squamous cell carcinoma: Clinical perspectives // Head Neck, 2010, V.32, N12, P.1712-1719.
5. Vozenin MC, Lord HK, Haiti D, Deutsch E. Unravelling the biology of human papillomavirus (HPV) related tumours to enhance their radiosensitivity // Cancer Treat Rev., 2010, V.36, N8, P.629-636.
6. Ambatipudi S., Gerstung M, Gowda R et al. Genomic Profiling of Advanced-Stage Oral Cancers Reveals Chromosome 11q Alterations as Markers of Poor Clinical Outcome // PLoS One, 2011, V.6, N2, e17250.
7. Pang et al., Radiosensitization of oropharyngeal squamous cell carcinoma cells by human papillomavirus 16 oncoprotein E6∗I // Int J Radiat Oncol Biol Phys., 2011, V.79, N3, P.860-865.
8. Sims L.C., Brecher M.E., Gertis К. et al. Enumeration of CD34-positive stem cells: evaluation and comparison of three methods // J. Hematother, 1997, V.6, N3, P.213-226.
9. Куртова и др. Количественный учет CD34+ гемопоэтических стволовых клеток в цельной пуповинной крови // Клеточная трансплантология и тканевая инженерия, 2006, T.1, N3, С.66-71.
10. Sutherland D.R., Anderson L., Keeney M. et al. The ISHAGE guidelines for CD34+ cell determination by flow cytometry. International Society of Hematotherapy and Graft Engineering // J. Hematother., 1996, V.5, N3, P.213-226.
11. Wright M.A., Wiers K., Vellody K. et al. Stimulation of immune suppressive CD34+ cells from normal bone marrow by Lewis carcinoma tumors // Cancer Immunol Immunother., 1998, V.46, P.253-260.
12. Young M.R.I Tumor skewing of CD34+ progenitor cell differentiation into endothelial cells // Int. J. Cancer, 2004, V.109, P.516-524.
13. Fang S, Salven P. Stem cells in tumor angiogenesis // J Mol Cell Cardiol., 2011, V.50, N2, P.290-295.
14. Дарьялова С.Л., Бойко А.В., Черниченко А.В. Современные возможности лучевой терапии злокачественных опухолей // Российский онкологический журнал, 2000, №1, С.48-55.
Способ оценки радиочувствительности рака верхних дыхательных путей, включающий определение частоты гемопоэтических стволовых клеток с иммунофенотипом CD34+CD45low среди лимфоцитов периферической крови, отличающийся тем, что частоту гемопоэтических стволовых клеток с иммунофенотипом CD34+CD45low на стадиях рака Т3 или Т4 до лечения сравнивают с ее дискриминационным уровнем 6,0·10-4 и при значениях более 6,0·10-4 прогнозируют высокую радиочувствительность опухоли, а при значениях менее или равно 6,0·10-4 прогнозируют низкую радиочуствительность опухоли.