Антигипоксант и способ его получения
Иллюстрации
Показать всеИзобретение относится к области фармацевтики и медицины и касается антигипоксанта, представляющего собой аминокислоту глицин, иммобилизованную на частицах детонационного наноалмаза размером 2-10 нм, и способа его получения. Продукт обладает низкой токсичностью и высокой эффективностью. 2 н. и 2 з.п. ф-лы, 5 ил., 8 табл., 3 пр.
Реферат
Изобретение относится к медицине, в частности к фармакологии, и касается антигипоксанта - лекарственного средства для коррекции гипоксии, представляющего собой глицин, иммобилизованный на частицах детонационного наноалмаза.
Проблема гипоксии на протяжении многих десятилетий является чрезвычайно актуальной в медицине, в том числе в военной и спортивной, и привлекает постоянное внимание клиницистов и фармакологов с точки зрения профилактики, лечения и изучения механизмов развития различных патологических состояний, включая острые и хронические нарушения мозгового кровообращения и внезапную смерть [1]. Гипоксию рассматривают как несоответствие энергопотребности клетки энергопродукции в системе митохондриального окислительного фосфорилирования [2]. Гипоксия является механизмом, запускающим каскад биохимических «поломок», приводящих сначала к функциональным, а затем и структурным нарушениям деятельности различных органов и систем. Причины генерализованной гипоксии разделяют на экзогенные («горная» и кессонная болезни, нахождение в замкнутом пространстве, неисправность аппарата искусственной вентиляции легких и др.) и эндогенные (пневмония, пневмоторакс, бронхоспазм, сердечно-сосудистая недостаточность, анемия, отравление тяжелыми металлами, цианидами и др.). К локальной гипоксии (ишемия мозга, миокарда, конечностей) приводят местный спазм сосудов, атеросклероз, нарушения кровоснабжения, вызванные тромбом и др. [3]. При любой гипоксии первично развивается угнетение энергетического обмена, которое проявляется уменьшением содержания креатинфосфата (особенно в головном мозге) и АТФ при одновременном увеличении концентрации аденозинди- и аденозинмонофосфорных кислот, а также неорганического фосфата. Это приводит к нарушениям мембранного транспорта, процессов биосинтеза и других функций клеток, а также к внутриклеточному лактоацидозу, увеличению внутриклеточной концентрации свободного кальция и активации перекисного окисления липидов [3].
Известно, что процесс окислительного фосфорилирования происходит в митохондриях [4]. Гипоксия прежде всего нарушает процессы окисления субстратов цикла Кребса и пентозного цикла НАД-зависимыми дегидрогеназами. При этом начинает усиленно образовываться ацетальдегид, который, в свою очередь, взаимодействует со спиртами, тиолами и аминами с образованием полуацеталей, полукеталей и карбиноламинов. В результате нарушаются структура и функции клеточных и субклеточных, в частности, митохондриальных, мембран, хроматина и медиаторных систем.
Для связывания ацетальдегида и его дальнейшего окисления с целью восстановления жизнедеятельности клеток и работоспособности организма в целом известно применение заменимой аминокислоты глицина [3]. Выявлено, что в условиях гипоксии под влиянием глицина увеличивалась продолжительность жизни нейронов коры головного мозга [5]. На модели гипоксии синусоидальных эндотелиальных клеток печени было показано, что глицин предотвращает снижение уровня АТФ и защищает клетки от некротической гибели [6]. В работе [7] установлено, что глицин предотвращает перекисные процессы и тем самым блокирует разобщение митохондрий. В работе [8] выявлено, что глицин значительно улучшает механометаболические показатели перфузируемого сердца; на фоне действия аминокислоты наблюдалось повышенное по сравнению с контролем потребление кислорода сердцем в условиях гипоксического воздействия. Это может свидетельствовать о восстановлении окислительной и фосфорилирующей способности дыхательной цепи и повышении уровня АТФ в кардиомиоцитах. В этих процессах глицин является индуктором, что приводит к образованию эндогенного глицина, который может использоваться клеткой в качестве протектора при гипоксическом воздействии. Механизм антигипоксического действия глицина связывают с его способностью связывать ацетальдегид, образуя с ним L-треонин, благодаря чему повышенный при гипоксии уровень свободного ацетальдегида в клетке снижается, что существенно ослабляет его инактивирующее действие на убихинон, который тем самым остается в активном состоянии и продолжает выполнять свою функцию переносчика восстановительных эквивалентов от НАДН к цитохромам [8].
В современной терапевтической практике глицин применяют также как средство, ослабляющее влечение к алкоголю, уменьшающее явления абстиненции, депрессивные нарушения, повышенную раздражительность, нормализующее сон, а также в комплексном лечении нарушений мозгового кровообращения [9].
Применяемый фармакопейный глицин назначают в виде таблеток (по 0,1 г) под язык 3-4 раза в день.
Актуальность и практическая значимость нахождения методов эффективной коррекции гипоксии требуют разработки и поиска новых антигипоксантов, повышающих выживаемость человека в условиях острой гипоксии. Арсенал имеющихся лекарственных средств с антигипоксическим действием ограничен, широта и эффективность лечебных доз сравнительно невелики. Специфическая антигипоксантная активность препаратов, имеющихся в настоящее время в распоряжении врачей-клиницистов, проявляется не при всех видах гипоксии, а некоторые антигипоксанты оказывают нежелательные побочные действия. В связи с этим чрезвычайно важным и необходимым для нужд медицины является нахождение, изучение и внедрение в практику безопасных, высокоактивных препаратов антигипоксантного действия с большой широтой эффективных доз.
Известен глицин, иммобилизованный на частицах детонационного наноалмаза с размером 2-10 нм, применяемый в качестве связующего компонента в полимерных композитах [10, 11]. Способ его получения заключается в следующем [11]. Навеску наноалмаза помещают в реактор в постоянном токе гелия и отжигают при температуре 150-470°C в течение 3-4 ч. Далее проводят фторирование образцов наноалмаза при температуре 50-500°C в течение 1-24 ч контактированием со смесью газообразных фтора и водорода. Для получения глицина, иммобилизованного на частицах наноалмаза, фторированный наноалмаз обрабатывают ультразвуком в о-дихлорбензоле в течение 20-30 мин, добавляют гидрохлорид этилового эфира глицина (NH2CH2COOCH2CH3HCl) и несколько капель пиридина. Полученную смесь перемешивают при температуре 130-140°C в течение 8-12 ч. Образовавшийся продукт фильтруют, промывают этанолом и сушат под вакуумом при 70°C.
Дополнительной характеристикой этого вещества является размер его частиц в суспензии, равный, по данным динамического рассеяния света (ДРС), 310 нм[11].
Особенностью данного вещества является наличие на поверхности частиц наноалмаза помимо молекул глицина также атомов фтора. Хотя их количество авторами декларируется менее 1% ат., в действительности экспериментально установлено, что концентрация фтора на поверхности наноалмаза может достигать 14% ат. и более. Это обусловлено тем, что связь C-F (Есв.=115 ккал/г-атом) является прочной и фторпроизводные углерода инертны по отношению ко многим веществам. Поэтому при химической иммобилизации глицина на поверхность наноалмаза, содержащего атомы фтора, молекулы глицина замещаются на атомы фтора лишь частично. При этом известно, что присутствие в органическом веществе фтора и его производных повышает его токсичность и может изменять показатели микросомальной системы биотрансформации ксенобиотиков в печени [12]. Так, наличие атомов фтора в ближайшем наноструктурном аналоге наноалмаза - фуллерене (C60) - повышает его общую токсичность в 2,4-5 раз [13]. Кроме того, фтор и его соединения способны накапливаться в различных объектах окружающей среды и присутствовать в них в различных количествах [14]. Поэтому глицин, иммобилизованный на частицах наноалмаза, которые содержат атомы фтора, нежелательно использовать в медицинской практике в качестве лекарственного средства.
Использование глицина, иммобилизованного на частицах детонационного наноалмаза, как антигипоксанта в научной и патентной литературе не описано.
Поэтому получение антигипоксанта, представляющего собой глицин, иммобилизованный на частицах детонационного наноалмаза, не содержащих атомов фтора, с повышенной дисперсностью в суспензии, применяемого в качестве лекарственного средства, а также снижение уровня экологической и эндоэкологической опасности, упрощение и удешевление способа его получения, представляют собой актуальную и практически значимую задачу.
Целью и задачей изобретения является повышение эффективности антигипоксического действия глицина без проявления каких-либо побочных и токсических воздействий, снижение дозировки препарата и расширение номенклатуры антигипоксических лекарственных средств.
Поставленная задача решается с помощью описываемого в соответствии с изобретением антигипоксанта, представляющего собой глицин, иммобилизованный на частицах детонационного наноалмаза размером 2-10 нм, не содержащих атомов фтора и имеющих оболочку толщиной до 1 нм, с содержанием глицина до 21±3% масс., и способа его получения.
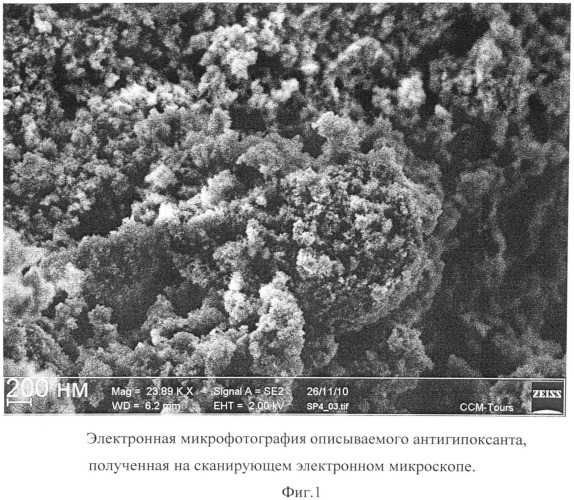
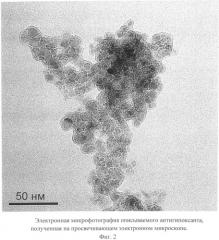
Описываемый антигипоксант в виде глицина, иммобилизованного на частицах детонационного наноалмаза, не содержащих на своей поверхности атомов фтора, представляет собой ультрадисперсный порошок (Фиг.1) темно-серого цвета или темно-серого цвета с зеленоватым или темно-синим оттенками с размером частиц от 2 до 10 нм, имеющих оболочку толщиной до 1 нм (Фиг.2), размером агрегатов в водной суспензии до 100 нм (Фиг.3) и содержанием глицина до 21±3% масс, входящего в состав поверхностной оболочки.
На Фиг.1 отчетливо видно наличие у описываемого антигипоксанта ультрадисперсной структуры из частиц с размером, меньшим разрешающей способности использованного прибора (от 20 нм).
Микрофотография частиц описываемого антигипоксанта получена на автоэмиссионном сканирующем электронном микроскопе сверхвысокого разрешения Zeiss Ultra Plus (Carl Zeiss, Германия).
На Фиг.2 видно, что размер частиц описываемого антигипоксанта, покрытых оболочкой толщиной до 1 нм, равен 2-10 нм.
Микрофотография частиц описываемого антигипоксанта получена на просвечивающем электронном микроскопе Jeol 1011 (JEOL, Япония).
На Фиг.3. приведена кривая распределения размеров частиц в суспензии описываемого антигипоксанта, из которой следует, что размеры частиц в суспензии не превышают 100 нм.
Измерение распределения размера частиц описываемого антигипоксанта в суспензии проводили методом ДРС на приборе ZetaSizer (Malvern Instruments, США). По оси абсцисс отложена логарифмическая шкала размера частиц в нм. По оси ординат - процентное содержание частиц с определенными размерами.
Элементный состав поверхности частиц описываемого антигипоксанта по данным рентгенофотоэлектронной спектроскопии (РФЭС) приведен в табл.1.
| Таблица 1 | |||
| Элементный состав и энергии связи поверхностных атомов описываемого антигипоксанта | |||
| Наименование характеристики | Химические элементы | ||
| C | O | N | |
| Атомные, % | 77,5-94,5 | 4-14 | 1,5-8,5 |
| Энергии связи, эВ | 285,2±0,5 | 530,7±0,5 | 399,8±0,5 |
Исследование поверхности описываемого антигипоксанта проводили на приборе LAS-3000 (Riber, Франция), оснащенном полусферическим анализатором ОРХ-150. Для возбуждения фотоэлектронов использовали немонохроматизированное рентгеновское излучение алюминиевого анода (AlKα=1486,6 эВ) при напряжении на трубке 12 кВ и токе эмиссии 20 мА. Калибровку фотоэлектронных пиков проводили по линии углерода С 1s с энергией связи 285 эВ. Вакуум в рабочей камере составлял 6,7·10-8 Па. Для получения высокого вакуума был использован ионный насос.
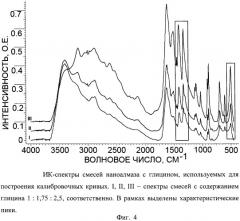
Количество глицина в описываемом антигипоксанте определяют следующим образом. Готовят смеси наноалмаза с разным содержанием глицина. Берут навески каждой смеси равной массы. Регистрируют их ИК-спектры, выбирают на них наиболее интенсивные характеристические сигналы, которые соотносят с полосами ИК-спектра исходного глицина. Затем строят калибровочные кривые зависимости интенсивности сигнала в ИК-спектре от содержания глицина в навеске. Далее, по интенсивности выбранных характеристических полос исследуемого антигипоксанта по калибровочным кривым определяют количественное содержание в нем глицина. По полученным данным определяют среднее значение величины содержания глицина в описываемом антигипоксанте.
Описываемый способ получения антигипоксанта заключается в следующем. Детонационный наноалмаз отжигают в токе газообразного водорода при температуре 500-1200°C в течение 1-8 ч, затем подвергают жидкофазному хлорированию молекулярным хлором при фотохимическом воздействии видимым светом при температуре 50-70°C в течение 36-60 ч с последующей промывкой четыреххлористым углеродом,
центрифугированием и сушкой под вакуумом. Модифицированный хлором наноалмаз растворяют в полярном растворителе с образованием суспензии. Добавляют третичный амин и глицин и обрабатывают полученную смесь ультразвуком в течение 5-60 мин с последующим выдерживанием при 50-80°C в течение 12-48 ч, центрифугированием, промывкой растворителем и сушкой. Обработку ультразвуком ведут в течение 5-60 мин, в качестве третичного амина используют триэтиламин и в качестве полярного растворителя применяют пиридин, низший алифатический спирт, водно-спиртовую смесь или воду.
Описываемый антигипоксант не содержит атомов фтора (табл.1), а также атомов других галогенов, в количестве, превышающем ошибку прибора (0,1% ат.), так как в процессе получения антигипоксанта все атомы хлора заменяются на молекулы глицина и уходят с поверхности наноалмаза в виде молекул НС1.
Исследование специфической противогипоксической активности заявляемого антиоксиданта в сравнении с фармакопейным глицином и широко применяемым в медицинской практике препаратом мексидолом было проведено согласно [15, 16]. Оно осуществлялось при использовании двух методик с различным генезом гипоксических состояний: нормобарической гипоксии с гиперкапнией в гермообъеме и гемической гипоксии [17, 18]. Эти методики являются базисными моделями при поиске и изучении веществ с противогипоксической активностью.
Исследование выполнено на белых беспородных половозрелых мышах самцах массой 23-28 г по 10 голов в каждой группе. Всего использовано 140 животных.
В результате исследований показано, что описываемый антигипоксант обладает выраженной противогипоксической активностью в условиях моделей нормобарической гипоксии с гиперкапнией в гермообъеме и гемической гипоксии, что характеризуется статистически достоверным увеличением времени выживания животных в условиях гипоксии. Противогипоксический эффект описываемого антигипоксанта имеет дозозависимый характер и усиливается с увеличением дозы от 10 до 20 мг/кг и выявляется как при однократном, так и при повторном введении. По противогипоксической активности в тесте нормобарической гипоксии заявляемый антигипоксант не уступает фармакопейному глицину и препарату сравнения мексидолу, а в тесте гемической гипоксии существенно превосходит фармакопейный глицин и мексидол.
Исследование острой токсичности описываемого антигипоксанта было проведено согласно Методическим указаниям по изучению острой токсичности, изложенных в [19].
При проведении эксперимента регистрировались следующие показатели: характер шерстяного покрова, изменение состояния слизистых оболочек, птоз верхнего века, повышенная уринация, повышенная дефекация, повышенная саливация, пилоэрекция, вокализация, боковое положение, ритм и глубина дыхательных движений, агрессивность, пугливость, тремор, судороги, изменение порогов болевой реакции, изменение позы, каталепсия, нарушение координации движений в тесте вращающегося стержня, удерживание в течение 5 секунд на перевернутой сетчатой платформе, перелезание с перевернутой сетчатой платформы наверх, наличие пинеального, роговичного рефлексов, седации, стереотипии и груминга, гибель животного.
Статистическая обработка результатов была осуществлена с помощью статистических пакетов "BioStat" для Windows. Рассчитывали средние показатели по группе и стандартные ошибки показателей.
Полученные результаты убедительно показывают, что описываемый антигипоксант при внутрибрюшинном введении мышам в дозах 75, 150 и 225 мг/кг, также как и фармакопейный глицин, не вызывает признаков интоксикации и гибели животных на протяжении 14 сут. наблюдения.
Описываемый антигипоксант не только позволяет повысить терапевтическую эффективность фармакопейного препарата глицина, но и расширить ассортимент эффективных и безопасных антигипоксических средств.
Краткое описание графических материалов.
Фиг.1. Электронная микрофотография описываемого антигипоксанта, полученная на сканирующем электронном микроскопе.
Фиг.2. Электронная микрофотография описываемого антигипоксанта, полученная на просвечивающем электронном микроскопе.
Фиг.3. Распределение размеров частиц описываемого антигипоксанта в водной суспензии по данным метода ДРС.
Фиг.4. ИК-спектры смесей наноалмаза с глицином, используемых для построения калибровочных кривых. I, II, III - спектры смесей с содержанием глицина 1:1,75:2,5, соответственно. В рамках выделены характеристические пики.
Фиг.5. Калибровочные кривые для каждой характеристической полосы ИК-спектра смеси наноалмаза с глицином, а, б, в - калибровочные кривые для полос 1407, 1332 и 504 см-1, соответственно.
Изобретение иллюстрируется следующими примерами.
Пример 1.
300 мг исходного детонационного наноалмаза отжигают в токе газообразного водорода со скоростью 3,0 л/ч при температуре 1000°C в течение 6 ч. Затем отожженный наноалмаз подвергают жидкофазному хлорированию молекулярным хлором, растворенным в 40 мл CCl4 до 6% масс. Cl2. Реакцию хлорирования проводят при фотохимическом воздействии видимым светом в течение 60 ч при температуре 60°C. Затем образец промывают CCl4 с центрифугированием суспензии при 6000 об/мин и высушивают под давлением 0,1 мм. рт.ст. до постоянного веса. Затем из хлорированного наноалмаза получают суспензию, используя 40 мл водно-спиртовой смеси (вода:метанол=1:1), в которую вносят 300 мг глицина в виде свободной аминокислоты (NH2CH2COOH) с добавлением 1 мл триэтиламина. Полученную смесь обрабатывают ультразвуком (50 Вт) в течение 60 мин и выдерживают при постоянном перемешивании при температуре 65°C в течение 30 ч. Полученный продукт промывают большим количеством этанола, центрифугируют и высушивают под вакуумом при 70°C в течение всей ночи. Остаточная влажность продукта составляет 2,2%. Выход целевого продукта составляет 279 мг (93%). Продукт представляет собой темно-серый с синеватым оттенком ультрадисперсный порошок (Фиг.1) с размерами первичных частиц 2-10 нм (Фиг.2), имеющих оболочку поверхностного слоя до 1 нм. В суспензии размер частиц порошка не превышает 100 нм (Фиг.3). Элементный состав поверхности частиц полученного продукта приведен в табл.2.
| Таблица 2 | |||
| Данные РФЭС полученного продукта | |||
| Наименование характеристики | Химические элементы | ||
| C | O | N | |
| Атомные, % | 80,1±0,1 | 11,5±0,1 | 8,4±0,1 |
| Энергии связи, эВ | 285,2±0,5 | 530,7±0,5 | 399,6±0,5 |
Для определения массовой доли глицина в полученном продукте готовят 3 смеси наноалмаза с глицином с содержанием последнего 1:1,75:3,5, соответственно. Для каждой смеси берут навеску массой 0,0035 г и тщательно перетирают в ступке с 0,090 г KBr. 0,070 г полученной смеси прессуют в таблетку и снимают ее ИК-спектр (Фиг.4). Характеристические полосы выбирают при 1407, 1332 и 504 см-1, соответственно, и строят для них калибровочные графики (Фиг.5). Интенсивность соответствующих характеристических на ИК-спектре полученного образца массой 0,0035 г составила 0,23, 0,22 и 0,10 о.е., соответственно. Из калибровочных кривых а, 6, в на Фиг.5 определяют величину содержания глицина в полученном образце, которая составляет 0,00057±8·10-5 г. Следовательно, массовая доля глицина в навеске образца составляет 21±3% масс.
Пример 2.
Изучение противогипоксической активности описываемого средства в условиях нормобарической гипоксии с гиперкапнией в гермообъеме.
Исследование выполнено на белых беспородных половозрелых мышах-самцах массой 23-28 г по 10 животных в группе, всего 100 голов.
Животных получали из Центрального питомника лабораторных животных «Столбовая», Московская область. Содержание животных соответствовало правилам лабораторной практики при проведении доклинических исследований в РФ (ГОСТ 3 51000.3-96 и 51000.4-96), нормативному документу «Санитарные правила по устройству, оборудованию и содержанию вивариев», утвержденных Главным Государственным санитарным врачом 06.04.1973 г. №1045-73, и Приказу МЗ РФ №267 от 19.06.2003 г. «Об утверждении правил лабораторной практики» (GLP) с соблюдением Международных рекомендаций Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях (1997 г.). Животные содержались в виварии при температурном режиме 20-22°C, при световом цикле - 12 часов светлый и 12 часов темный периоды, в пластмассовых клетках T/4A размером 580×375×200 мм с верхней крышкой из нержавеющей стали и подстилкой обеспыленной из деревянной стружки. Животные содержались при постоянном доступе к корму и воде с использованием полного рациона экструдированного брикетированного корма (ГОСТ на корм P 50258-92) и питьевой воды. При проведении экспериментов учитывались требования Комиссии по проблеме этики отношения к животным Российского национального Комитета по биоэтике при Российской академии наук и этические нормы, изложенные в «Международных рекомендациях по проведению медико-биологических исследований с использованием животных» (1985 г.). Опыты проводили в первую половину дня.
В тесте нормобарической гипоксии с гиперкапнией («баночной» гипоксии) мышей одинакового веса (разброс не более 2-х г) помещали по одному животному в герметически закрываемые банки объемом 200 см3 или 250 см3, которые плотно закрывали крышкой и смазывали герметиком. Животное при дыхании в замкнутом пространстве поглощает кислород и выдыхает углекислый газ (ререспирация), вследствие чего возникает дефицит кислорода во вдыхаемом воздухе и развивается гипоксия. Регистрировали время выживания (резервное время) животных в условиях гипоксии. Вещества вводили внутрибрюшинно в объеме 0,1 мл на 10 г веса мыши однократно за 40 минут до помещения животного в гермообъем (банки объемом 200 см3). При изучении антигипоксической активности описываемого антигипоксанта при повторном внутрибрюшинном введении описываемый антигипоксант вводили 2 раза (за 4 часа и 40 мин) до помещения животного в гермообъем (банки объемом 250 см3). Животным контрольной группы вводили дистиллированную воду.
Специфическую фармакологичекую активность заявляемого средства исследовали в сравнении с фармакопейным глицином и препаратом сравнения мексидолом.
Статистическая обработка результатов была осуществлена с помощью статистических пакетов "BioStat" для Windows. Рассчитывали средние показатели по группе и стандартные ошибки показателей.
Установлено, что контрольные животные, помещенные в условия нормобарической гипоксии с гиперкапнией, погибают в среднем в течение 15-ти мин (табл.3). Из табл.3 видно, что заявляемый антигипоксант в дозе 0,5 мг/кг не оказывал антигипоксического действия, в дозе 1 мг/кг наблюдалась тенденция к увеличению времени выживания, в дозе 5 мг/кг он достоверно увеличивал (на 14,85%) время выживания мышей, в дозе 10 мг/кг время выживания мышей в условиях нормобарической гипоксии с гиперкапнией достоверно увеличивалось на 21,49% (табл.3). Фармакопейный глицин в дозе 1 мг/кг не оказывал противогипоксического действия, а в дозе 10 мг/кг достоверно увеличивал (на 13,67%) время выживания мышей в условиях нормобарической гипоксии (табл.3). Препарат мексидол в десятикратно превышающей дозе (100 мг/кг) также достоверно увеличивал продолжительность жизни в условиях нормобарической гипоксии и имел схожий терапевтический эффект по сравнению с описываемым антигипоксантом в дозе 10 мг/кг.
| Таблица 3 | ||
| Противогипоксическая активность описываемого антигипоксанта, фармакопейного глицина и мексидола при однократном введении в тесте нормобарической гипоксии с гиперкапнией у мышей | ||
| Вещества | Доза, мг/кг | Продолжительность жизни, мин |
| Контроль | - | 15,08±0,45 |
| Антигипоксант | 0,5 | 14,54±0,19 |
| Антигипоксант | 1 | 16,09±0,21 |
| Антигипоксант | 5 | 17,32±0,6* |
| Антигипоксант | 10 | 18,32±0,43* |
| Фармакопейный глицин | 1 | 15,32±0,42 |
| Фармакопейный глицин | 10 | 17,14±0,41* |
| Мексидол | 100 | 18,01±0,12* |
| * - p<0,05 достоверность различий по критерию Манна-Уитни по сравнению с группой контроля |
Описываемый антигипоксант в дозе 20 мг/кг (внутрибрюшинно, 2 раза: за 4 часа и 40 мин до посадки в гермообъем) достоверно увеличивал на 35,63% по сравнению с контрольной группой продолжительность жизни животных в условиях гипоксии с гиперкапнией. (Табл. 4).
| Таблица 4 | ||
| Противогипоксическая активность описываемого антигипоксанта в тесте нормобарической гипоксии с гиперкапнией при повторном введении | ||
| Группа, доза, число животных | Доза, мг/кг | Продолжительность жизни, мин |
| Контроль | - | 25,56±1,28 |
| Антигипоксант | 20 | 34,26±2,03* |
| *- p<0,05 достоверность различий по критерию Манна-Уитни по сравнению с группой контроля. |
Изучение противогипоксической активности описываемого средства в условиях гемической гипоксии.
Исследование выполнено на белых беспородных половозрелых мышах самцах массой 23-26 г по 10 животных в группе, всего 40 голов. Для получения гипоксии мышам вводили подкожно нитрит натрия в дозе 300 мг/кг и регистрировали время выживания (резервное время) животных в условиях возникающей гипоксии. Описываемый антигипоксант и фармакопейный глицин вводили однократно в объеме 0,1 мл на 10 г веса мыши внутрибрюшинно за 40 мин до введения нитрита натрия. Животным контрольной группы вводили дистиллированную воду. Статистическая обработка результатов была осуществлена с помощью статистических пакетов "BioStat" для Windows. Рассчитывали средние показатели по группе и стандартные ошибки показателей.
Установлено, контрольные животные в условиях гемической гипоксии, погибают в среднем в течение 18 мин после введения нитрита натрия (табл.5). Описываемый антигипоксант в дозе 10 мг/кг статистически достоверно и существенно (в 1,73 раза) увеличивал по сравнению с контролем время выживания мышей. Противогипоксическое действие описываемого антиоксиданта имеет дозозависимый характер и усиливается с увеличением дозы. Фармакопейный глицин в дозе 10 мг/кг статистически достоверно увеличивал (в 1,45 раза по сравнению с контролем) время выживания мышей в условиях гемической гипоксии (табл.5). В этих условиях мексидол в дозе 100 мг/кг не увеличивал продолжительность выживания животных по сравнению с контролем.
| Таблица 5 | ||
| Противогипоксическая активность описываемого антигипоксанта, фармакопейного глицина и мексидола в тесте гемической гипоксии | ||
| Вещества | Доза, мг/кг | Продолжительность жизни, мин |
| Контроль, диет. Вода | 17,58±0,75 | |
| Антигипоксант | 10 | 30,49±2,4* |
| Фармакопейный глицин | 10 | 25,50±3,57* |
| Мексидол | 100 | 20,5±3,45 |
| * - p<0,05 достоверность различий по критерию Манна-Уитни по сравнению с группой контроля. |
Таким образом, полученные данные свидетельствуют о наличии выраженной притивогипоксической активности описываемого средства в условиях моделей нормобарической гипоксии с гиперкапнией в гермообъеме и гемической гипоксии, что характеризуется статистически достоверным увеличением времени выживания животных в условиях гипоксии. Противогипоксический эффект описываемого антигипоксанта имеет дозозависимый характер и усиливается с увеличением дозы от 10 до 20 мг/кг и выявляется как при однократном, так и при повторном введении. По противогипоксической активности в тесте нормобарической гипоксии заявляемый антигипоксант не уступает фармакопейному глицину и препарату сравнения мексидолу, а в тесте гемической гипоксии существенно превосходит фармакопейный глицин и мексидол.
Пример 3.
Изучение побочных эффектов и токсического действия описываемого антигипоксанта.
Исследование проводили на белых беспородных половозрелых мышах-самцах массой 20-24 г возрастом 2-3 месяца. Экспериментальные животные содержались аналогично примеру 2. Всего использовалось 42 животных - 7 групп по 6 мышей.
Регистрацию возможных побочных эффектов, признаков интоксикации и гибели животных проводили через 1 ч - 14 сут. после внутрибрюшинного введения описываемого антигипоксанта в сравнении с фармакопейным глицином в тех же дозах.
В результате исследования было установлено, что описываемый антигипоксант при внутрибрюшинном введении мышам в дозах 75, 150 и 225 мг/кг не вызывал признаков интоксикации и гибели животных на протяжении 14 сут. (табл.6-8). При этом описываемый антигипоксант также не вызывал у мышей изменения шерстяного покрова, состояния слизистых оболочек. Также отсутствовали птоз верхнего века, повышенная уринация, дефекация, саливация, пилоэрекция, вокализация, боковое положение. В пределах нормы были ритм и глубина дыхательных движений, отсутствовали агрессивность, пугливость, тремор, судороги, каталепсия, стереотипия и груминг. Не наблюдалось изменения позы. У животных были сохранены пинеальный, роговичный и болевой рефлексы. На протяжении всех 14 сут. наблюдения животные удерживались на перевернутой сетчатой платформе в течение 5 с (табл.6-8).
| Таблица 6 | |||||||
| Изучение возможных побочных эффектов и гибели мышей через 1 час после введения фармакопейного глицина и описываемого антигипоксанта (показатель изменения в группе в %) | |||||||
| Показатели | Группы | ||||||
| Контроль | Антигипоксант/доза, мг/кг | Фармакопейный глицин/доза, мг/кг | |||||
| 75 | 150 | 225 | 75 | 150 | 225 | ||
| Изменение характера шерстяного покрова | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение состояния слизистых оболочек | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Птоз верхнего века | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная уринация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная дефекация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная саливация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие пилоэрекция | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие вокализации | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие бокового положения | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Нарушение ритма и глубины дыхательных движений | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие агрессивности | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение реакции на постукивание по клетке | 0 | 0 | 0 | 33,3* | 0 | 0 | 33,3* |
| Повышенная пугливость | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие тремора | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие судорог | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение порогов болевой реакции | 0 | 66,7* | 100* | 100* | 0 | 100* | 100* |
| Изменение позы, каталепсия | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Нарушение координации движений в тесте вращающегося стержня | 0 | 16,7 | 50* | 50* | 33,3* | 33,3* | 50* |
| Удерживание 5 с на перевернутой сетчатой платформе | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| Перелезание с перевернутой сетчатой платформы наверх | 100 | 66,7* | 66,7* | 50* | 66,7* | 66,7* | 66,7* |
| Наличие пинеального рефлекса | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| Наличие роговичного рефлекса | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| Наличие седации | 0 | 66,7* | 100* | 100* | 0 | 100* | 100* |
| Наличие стереотипии | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие груминга | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Гибель животного | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| +- P<0,05 - относительно контроля по критерию χ2 |
| Таблица 7 | |||||||
| Изучение возможных побочных эффектов и гибели мышей через 24 часа после введения фармакопейного глицина и описываемого антигипоксанта (показатель изменения в группе в %) | |||||||
| Показатели | Группы | ||||||
| Контроль | Антигипоксант/доза, мг/кг | Фармакопейный глицин/доза, мг/кг | |||||
| 75 | 150 | 225 | 75 | 150 | 225 | ||
| Изменение характера шерстяного покрова | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение состояния слизистых оболочек | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Птоз верхнего века | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная уринация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная дефекация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная саливация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие пилоэрекция | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие вокализации | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие бокового положения | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Нарушение ритма и глубины дыхательных движений | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие агрессивности | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение реакции на постукивание по клетке | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная пугливость | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие тремора | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие судорог | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение порогов болевой реакции | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение позы, каталепсия | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Нарушение координации движений в тесте вращающегося стержня | 0 | 0 | 0 | 0 | 33,3* | 16,7 | 33,3* |
| Удерживание 5 с на перевернутой сетчатой платформе | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| Перелезание с перевернутой сетчатой платформы наверх | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| Наличие пинеального рефлекса | 100 | 100 | 100 | 100 | 100 | 100 | 66,6* |
| Наличие роговичного рефлекса | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| Наличие седации | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие стереотипии | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие груминга | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Гибель животного | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| * - P<0,05 - относительно контроля по критерию χ2 |
| Таблица 8 | |||||||
| Изучение возможных побочных эффектов и гибели мышей через 14 сут. после введения фармакопейного глицина и описываемый антигипоксант (показатель изменения в группе в %) | |||||||
| Показатели | Группы | ||||||
| Контроль | Антигипоксант/доза, мг/кг | Фармакопейный глицин/доза, мг/кг | |||||
| 75 | 150 | 225 | 75 | 150 | 225 | ||
| Изменение характера шерстяного покрова | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение состояния слизистых оболочек | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Птоз верхнего века | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная уринация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная дефекация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная саливация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие пилоэрекция | 0 | 0 | 0 | 0 | 0 | 0 |