Седативное средство и способ его получения
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности к фармакологии и фармацевтике, и касается седативного средства, представляющего собой глицин, иммобилизованный на частицах детонационного наноалмаза размером 2-10 нм, и способа его получения. 2 н. и 2 з.п. ф-лы, 5 ил., 13 табл., 4 пр.
Реферат
Изобретение относится к медицине, в частности, к фармакологии, и касается седативного средства, представляющего собой глицин, иммобилизованный на частицах детонационного наноалмаза.
В настоящее время психотропные лекарственные средства, вызывающие седацию - подавление реакции на постоянные раздражители со снижением уровня спонтанной активности и мышления с одновременным снижением тревожности, широко применяются в медицинской практике, главным образом, для лечения различных невротических состояний. Считается, что такие седативные средства, снижающие ощущение тревоги и обладающие успокаивающим эффектом, влияют на центральную нервную систему (ЦНС) без заметных нарушений ее функций, при этом их действие характеризуется градуальным дозозависимым подавлением функции ЦНС. Механизм действия седативных средств к настоящему времени полностью не выявлен. Седативные препараты могут снижать возбудимость ЦНС, усиливать процессы торможения и оказывать регулирующее действие на ЦНС, восстанавливая равновесие между процессами возбуждения и торможения [1].
Несмотря на широкое применение в медицине большого ассортимента седативных лекарственных средств, достаточно эффективных препаратов до сих пор не имеется. В ряде случаев одни лекарственные средства проявляют недостаточный терапевтический эффект, в других - слишком «жестки» и при их применении возможны различные побочные эффекты [1].
Известно, что заменимая аминокислота глицин (NH2CH2COOH), являясь центральным нейромедиатором тормозного типа действия, проявляет седативное действие и улучшает метаболические процессы в тканях мозга [2]. В современной терапевтической практике глицин применяют как средство, ослабляющее влечение к алкоголю, уменьшающее явления абстиненции, депрессивные нарушения, повышенную раздражительность, нормализующее сон, а также в комплексном лечении нарушений мозгового кровообращения [2]. В основе фармакологического действия глицина лежит эффект амплификации метаболических и нейротрансмиттерных процессов, возникающих за счет усиления его эндогенного синтеза. Увеличить внутриклеточный синтез глицина можно, только используя пути передачи сигнала, обусловленные взаимодействием с рецепторными системами. Его взаимодействие с глициновыми рецепторами приводит к открытию хлорных каналов, гиперполяризации мембраны и распространению торможения. Наряду с этим, глицин способен выступать в роли аллостерического коагониста глутаматных рецепторов. Связываясь в специфическом сайте, он усиливает способность глутамата и N-метил-D-аспарата (NMDA) открывать катионный канал [3,4].
Применяемый фармакопейный глицин назначают в виде таблеток (по 0,1 г) под язык 3-4 раза в день.
Известен глицин, иммобилизованный на частицах детонационного наноалмаза с размером 2-10 нм, применяемый в качестве связующего компонента в полимерных композитах [5, 6]. Способ его получения заключается в следующем [6]. Навеску наноалмаза помещают в реактор в постоянном токе гелия и отжигают при температуре 150-470°С в течение 3-4 ч. Далее проводят фторирование образцов наноалмаза при температуре 50-500°С в течение 1-24 ч контактированием со смесью газообразных фтора и водорода. Для получения глицина, иммобилизованного на частицах наноалмаза, фторированный наноалмаз обрабатывают ультразвуком в о-дихлорбензоле в течение 20-30 мин, добавляют гидрохлорид этилового эфира глицина (NH2CH2COOCH2CH3·HCl) и несколько капель пиридина. Полученную смесь перемешивают при температуре 130-140°С в течение 8-12 ч. Образовавшийся продукт фильтруют, промывают этанолом и сушат под вакуумом при 70°С.
Дополнительной характеристикой этого вещества является размер его частиц в суспензии, равный, по данным динамического рассеяния света (ДРС), 310 нм [6].
Особенностью данного вещества является наличие на поверхности частиц наноалмаза помимо молекул глицина также атомов фтора. Хотя их количество авторами декларируется менее 1% ат., в действительности экспериментально установлено, что концентрация фтора на поверхности наноалмаза может достигать 14% ат. и более. Это обусловлено тем, что связь C-F (Есв.=115 ккал/г-атом) является прочной и фторпроизводные углерода инертны по отношению ко многим веществам. Поэтому при химической иммобилизации глицина на поверхность наноалмаза, содержащего атомы фтора, молекулы глицина замещаются на атомы фтора лишь частично. При этом известно, что присутствие в органическом веществе фтора и его производных повышает его токсичность и может изменять показатели микросомальной системы биотрансформации ксенобиотиков в печени [7]. Так, наличие атомов фтора в ближайшем наноструктурном аналоге наноалмаза - фуллерене (С60) - повышает его общую токсичность в 2,4-5 раз [8]. Кроме того, фтор и его соединения способны накапливаться в различных объектах окружающей среды и присутствовать в них в различных количествах [9]. Поэтому глицин, иммобилизованный на частицах наноалмаза, которые содержат атомы фтора, нежелательно использовать в медицинской практике в качестве лекарственного средства.
Поэтому получение глицина, иммобилизованного на частицах детонационного наноалмаза, не содержащих атомов фтора, с повышенной дисперсностью в суспензии, применяемого в качестве лекарственного средства, а также снижение уровня экологической и эндоэкологической опасности, упрощение и удешевление способа его получения, представляют собой актуальную и практически значимую задачу.
Целью изобретения является повышение эффективности седативного действия глицина без проявления каких-либо побочных и токсических воздействий, снижение дозировки препарата и расширение номенклатуры седативных лекарственных средств.
Использование глицина, иммобилизованного на частицах детонационного наноалмаза, как седативного средства в научной и патентной литературе не описано.
Поставленная цель решается с помощью описываемого в соответствии с изобретением седативного средства, представляющего собой глицин, иммобилизованный на частицах детонационного наноалмаза размером 2-10 нм, не содержащих атомов фтора и имеющих оболочку толщиной до 1 нм, с содержанием глицина до 21±3% масс, и способа его получения.
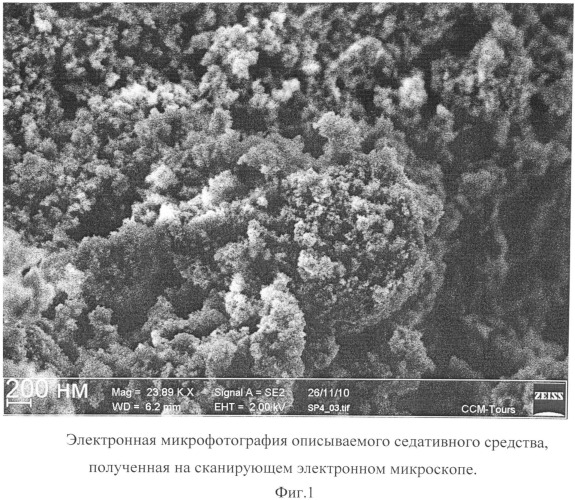
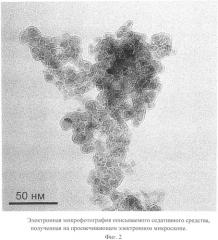
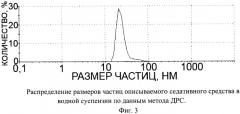
Описываемое седативное средство в виде глицина, иммобилизованного на частицах детонационного наноалмаза, не содержащих на своей поверхности атомов фтора, представляет собой ультрадисперсный порошок (Фиг.1) темно-серого цвета или темно-серого цвета с зеленоватым или темно-синим оттенками с размером частиц от 2 до 10 нм, имеющих оболочку толщиной до 1 нм (Фиг.2), размером агрегатов в водной суспензии до 100 нм (Фиг.3) и содержанием глицина до 21±3% масс, входящего в состав поверхностной оболочки.
На Фиг.1 отчетливо видно наличие у описываемого седативного средства ультрадисперсной структуры из частиц с размером, меньшим разрешающей способности использованного прибора (от 20 нм).
Микрофотография частиц описываемого седативного средства получена на автоэмиссионном сканирующем электронном микроскопе сверхвысокого разрешения Zeiss Ultra Plus (Carl Zeiss, Германия).
На Фиг.2 видно, что размер частиц описываемого седативного средства, покрытых оболочкой толщиной до 1 нм, равен 2-10 нм.
Микрофотография частиц описываемого седативного средства получена на просвечивающем электронном микроскопе Jeol 1011 (JEOL, Япония).
На Фиг.3 приведена кривая распределения размеров частиц в суспензии описываемого седативного средства, из которой следует, что размеры частиц в суспензии не превышают 100 нм.
Измерение распределения размера частиц описываемого седативного средства в суспензии проводили методом ДРС на приборе ZetaSizer (Malvern Instruments, США). По оси абсцисс отложена логарифмическая шкала размера частиц в нм. По оси ординат - процентное содержание частиц с определенными размерами.
Элементный состав поверхности частиц описываемого седативного средства по данным рентгенофотоэлектронной спектроскопии (РФЭС) приведен в табл.1.
| Таблица 1 | |||
| Элементный состав и энергии связи поверхностных атомов описываемого седативного средства | |||
| Наименование характеристики | Химические элементы | ||
| С | О | N | |
| Атомные % | 77,5-94,5 | 4-14 | 1,5-8,5 |
| Энергии связи, эВ | 285,2±0,5 | 530,7±0,5 | 399,8±0,5 |
Исследование поверхности описываемого седативного средства проводили на приборе LAS-3000 (Riber, Франция), оснащенном полусферическим анализатором ОРХ-150. Для возбуждения фотоэлектронов использовали немонохроматизированное рентгеновское излучение алюминиевого анода (AlKα=1486,6 эВ) при напряжении на трубке 12 кВ и токе эмиссии 20 мА. Калибровку фотоэлектронных пиков проводили по линии углерода С 1s с энергией связи 285 эВ. Вакуум в рабочей камере составлял 6,7·10-8 Па. Для получения высокого вакуума был использован ионный насос.
Количество глицина в описываемом седативном средстве определяют следующим образом. Готовят смеси наноалмаза с разным содержанием глицина. Берут навески каждой смеси равной массы. Регистрируют их ИК-спектры, выбирают на них наиболее интенсивные характеристические сигналы, которые соотносят с полосами ИК-спектра исходного глицина. Затем строят калибровочные кривые зависимости интенсивности сигнала в ИК-спектре от содержания глицина в навеске. Далее, по интенсивности выбранных характеристических полос исследуемого седативного средства по калибровочным кривым определяют количественное содержание в нем глицина. По полученным данным определяют среднее значение величины содержания глицина в описываемом седативном средстве.
Описываемый способ получения седативного средства заключается в следующем. Детонационный наноалмаз отжигают в токе газообразного водорода при температуре 500-1200°С в течение 1-8 ч, затем подвергают жидкофазному хлорированию молекулярным хлором при фотохимическом воздействии видимым светом при температуре 50-70°С в течение 36-60 ч с последующей промывкой четыреххлористым углеродом,
центрифугированием и сушкой под вакуумом. Модифицированный хлором наноалмаз растворяют в полярном растворителе с образованием суспензии. Добавляют третичный амин и глицин и обрабатывают полученную смесь ультразвуком в течение 5-60 мин с последующим выдерживанием при 50-80°С в течение 12-48 ч, центрифугированием, промывкой растворителем и сушкой. Обработку ультразвуком ведут в течение 5-60 мин, в качестве третичного амина используют триэтиламин и в качестве полярного растворителя применяют пиридин, низший алифатический спирт, водно-спиртовую смесь или воду.
Описываемое седативное средство не содержит атомов фтора (табл.1), а также атомов других галогенов, в количестве, превышающем ошибку прибора (0,1% ат.), так как в процессе получения седативного средства все атомы хлора заменяются на молекулы глицина и уходят с поверхности наноалмаза в виде молекул HCl.
В процессе фармакологических исследований была проведена работа по изучению специфического седативного действия описываемого лекарственного средства и его безвредности в сравнении с фармакопейным глицином.
Оценку седативного эффекта проводили согласно Методическим указаниям по изучению активности веществ, обладающих нейропсихотропной активностью, изложенных в [10].
Специфическое действие изучалось на белых беспородных мышах-самцах с использованием сертифицированной методики - актометра Opto-Varimex (Colambus Instrument, США). Статистическая обработка результатов была проведена с помощью программного обеспечения BioStat для Windows. Рассчитывали средние показатели по группе и стандартные ошибки показателей.
Полученные результаты свидетельствуют о том, что фармакопейный глицин в дозе 10 мг/кг седативной активности в актометре не проявляет (табл.3-5). Также он не проявил статистически достоверного седативного эффекта через 1, 4 и 8 ч после введения.
Описываемое седативное средство вызвало достоверное снижение горизонтальной (на 67%) и вертикальной (на 93,6%) двигательной активности уже через 10 мин после введения. Снижение горизонтальной и вертикальной двигательной активности оставалось достоверным и составляло более 50% от контроля и через 4 и 8 часов после однократного введения описываемого седативного средства (табл.3-5).
Исследование острой токсичности описываемого седативного средства было проведено согласно Методическим указаниям по изучению острой токсичности, изложенных в [10].
При проведении эксперимента регистрировались следующие показатели: характер шерстяного покрова, изменение состояния слизистых оболочек, птоз верхнего века, повышенная уринация, повышенная дефекация, повышенная саливация, пилоэрекция, вокализация, боковое положение, ритм и глубина дыхательных движений, агрессивность, пугливость, тремор, судороги, изменение порогов болевой реакции, изменение позы, каталепсия, нарушение координации движений в тесте вращающегося стержня, удерживание в течение 5 секунд на перевернутой сетчатой платформе, перелезание с перевернутой сетчатой платформы наверх, наличие пинеального, роговичного рефлексов, седации, стереотипии и груминга, гибель животного.
Статистическая обработка результатов была осуществлена с помощью статистических пакетов "BioStat" для Windows. Рассчитывали средние показатели по группе и стандартные ошибки показателей.
Полученные результаты убедительно показывают, что описываемое седативное средство при внутрибрюшинном введении мышам в дозах 75, 150 и 225 мг/кг, также как и фармакопейный глицин не вызывали признаков интоксикации и гибели животных на протяжении 14 сут. наблюдения.
В результате проведенного фармакологического исследования установлено наличие у описываемого седативного средства выраженного специфического седативного эффекта, превосходящего седативное действие фармакопейного глицина, и отсутствие побочных эффектов и токсического действия в дозе, превышающей терапевтическую более чем в 20 раз.
Описываемое седативное средство не только позволяет повысить терапевтическую эффективность фармакопейного препарата глицина, но и расширить ассортимент эффективных и безопасных седативных средств.
Краткое описание графических материалов.
Фиг.1. Электронная микрофотография описываемого седативного средства, полученная на сканирующем электронном микроскопе.
Фиг.2. Электронная микрофотография описываемого седативного средства, полученная на просвечивающем электронном микроскопе.
Фиг.3. Распределение размеров частиц описываемого седативного средства в водной суспензии по данным метода ДРС.
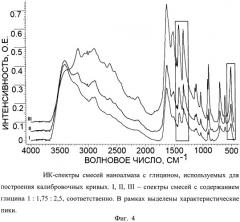
Фиг.4. ИК-спектры смесей наноалмаза с глицином, используемых для построения калибровочных кривых. I, II, III - спектры смесей с содержанием глицина 1:1,75:2,5, соответственно. В рамках выделены характеристические пики.
Фиг.5. Калибровочные кривые для каждой характеристической полосы ИК-спектра смеси наноалмаза с глицином, а, б, в - калибровочные кривые для полос 1407, 1332 и 504 см-1, соответственно.
Изобретение иллюстрируется следующими примерами.
Пример 1.
300 мг исходного детонационного наноалмаза отжигают в токе газообразного водорода со скоростью 3,0 л/ч при температуре 1000°С в течение 6 ч. Затем отожженный наноалмаз подвергают жидкофазному хлорированию молекулярным хлором, растворенным в 40 мл CCl4 до 6% масс. Cl2. Реакцию хлорирования проводят при фотохимическом воздействии видимым светом в течение 60 ч при температуре 60°С. Затем образец промывают CCl4 с центрифугированием суспензии при 6000 об/мин и высушивают под давлением 0,1 мм. рт.ст. до постоянного веса. Затем из хлорированного наноалмаза получают суспензию, используя 40 мл водно-спиртовой смеси (вода:метанол=1:1), в которую вносят 300 мг глицина в виде свободной аминокислоты (NH2CH2COOH) с добавлением 1 мл триэтиламина. Полученную смесь обрабатывают ультразвуком (50 Вт) в течение 60 мин и выдерживают при постоянном перемешивании при температуре 65°С в течение 30 ч. Полученный продукт промывают большим количеством этанола, центрифугируют и высушивают под вакуумом при 70°С в течение всей ночи. Остаточная влажность продукта составляет 2,2%. Выход целевого продукта составляет 279 мг (93%). Продукт представляет собой темно-серый с синеватым оттенком ультрадисперсный порошок (Фиг.1) с размерами первичных частиц 2-10 нм (Фиг.2), имеющих оболочку поверхностного слоя до 1 нм. В суспензии размер частиц порошка не превышает 100 нм (Фиг.3). Элементный состав поверхности частиц полученного продукта приведен в табл.2.
| Таблица 2 | |||
| Данные РФЭС полученного продукта | |||
| Наименование характеристики | Химические элементы | ||
| С | О | N | |
| Атомные % | 80,1±0,1 | 11,5±0,1 | 8,4±0,1 |
| Энергии связи, эВ | 285,2±0,5 | 530,7±0,5 | 399,6±0,5 |
Для определения массовой доли глицина в полученном продукте готовят 3 смеси наноалмаза с глицином с содержанием последнего 1:1,75:3,5, соответственно. Для каждой смеси берут навеску массой 0,0035 г и тщательно перетирают в ступке с 0,090 г KBr. 0,070 г полученной смеси прессуют в таблетку и снимают ее ИК-спектр (Фиг.4). Характеристические полосы выбирают при 1407, 1332 и 504 см-1, соответственно, и строят для них калибровочные графики (Фиг.5). Интенсивность соответствующих характеристических полос на ИК-спектре полученного образца массой 0,0035 г составила 0,23, 0,22 и 0,10 о.е., соответственно. Из калибровочных кривых а, б, в на Фиг.5 определяют величину содержания глицина в полученном образце, которая составляет 0,00057±8·10-5 г. Следовательно, массовая доля глицина в навеске образца составляет 21±3% масс.
Пример 2.
Исследование специфической седативной активности описываемого средства.
Исследование выполнено на белых беспородных половозрелых мышах-самцах массой 25-28 г.
Животных получали из Центрального питомника лабораторных животных «Столбовая», Московская область. Содержание животных соответствовало правилам лабораторной практики при проведении доклинических исследований в РФ (ГОСТ 3 51000.3-96 и 51000.4-96), нормативному документу «Санитарные правила по устройству, оборудованию и содержанию вивариев», утвержденных Главным Государственным санитарным врачом 06.04.1973 г. №1045-73, и Приказу МЗ РФ №267 от 19.06.2003 г. «Об утверждении правил лабораторной практики» (GLP) с соблюдением Международных рекомендаций Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях (1997 г.). Животные содержались в виварии при температурном режиме 20-22°С, при световом цикле - 12 часов светлый и 12 часов темный периоды, в пластмассовых клетках Т/4 А размером 580×375×200 мм с верхней крышкой из нержавеющей стали и подстилкой обеспыленной из деревянной стружки. Животные содержались при постоянном доступе к корму и воде с использованием полного рациона экструдированного брикетированного корма (ГОСТ на корм Р 50258-92) и питьевой воды. При проведении экспериментов учитывались требования Комиссии по проблеме этики отношения к животным Российского национального Комитета по биоэтике при Российской академии наук и этические нормы, изложенные в «Международных рекомендациях по проведению медико-биологических исследований с использованием животных» (1985 г.). Опыты проводили в первую половину дня.
Для изучения специфической седативной активности продукта, полученного в примере 1, использовалась сертифицированная методика, позволяющая оценить различные виды двигательной активности, с использованием актометра Opto-Varimex (фирма «Columbus Instrument)), США), которая рекомендуется для изучения седативного действия веществ согласно «Методическим указаниям по изучению нейролептической активности фармакологических веществ» [10].
В качестве критериев, характеризующих седативное действие, использовались показатели горизонтальной и вертикальной двигательной активности. Перемещения животных фиксировались на счетчике в условных единицах. Эксперимент проводили в течение 8 ч.
Продукт, полученный в примере 1, вводили однократно внутрибрюшинно или внутрь (интрагастрально при помощи специального зонда) в дозах 5 и 10 мг/кг. Регистрация горизонтальной и вертикальной двигательной активности в актометре Opto-Varimex проводилась через 10 минут, 30 мин, 1, 4 и 8 ч после введения вещества. Чтобы избежать привыкания к ситуации и феномена угашения двигательной активности, для оценки эффектов продукта, полученного по примеру 1, на каждой временной точке использовали отдельные группы животных: по 10 мышей в каждой группе - на контроль и исследования фармакологической активности описываемого седативного средства, по 6 мышей в группе - на исследования фармакологической активности фармакопейного глицина. Всего использовалось 88 животных. В качестве препарата сравнения использовали фармакопейный глицин. В качестве контроля использовали дистиллированную воду. Статистическая обработка результатов была осуществлена с помощью статистических пакетов "BioStat" для Windows. Рассчитывали средние показатели по группе и стандартные ошибки показателей.
При изучении горизонтальной двигательной активности при внутрибрюшинном введении установлено, что в контрольной группе животных средняя горизонтальная активность через 1 ч после введения дистиллированной воды составила 230,96 перемещений. Этот показатель достоверно не изменился и через 8 часов (табл.3).
| Таблица 3 | ||||
| Изучение седативного действия вещества, полученного по примеру 1, при однократном внутрибрюшинном введении по показателям горизонтальной двигательной активности мышей в актометре Opto-Varimex | ||||
| Вещество | Доза, мг/кг | Время регистрации эффекта, ч | Средняя горизонтальная активность (перемещения) в ед. | % снижения двигательной активности относительно контроля |
| Контроль | 1 | 230,96±10,23 | - | |
| Седативное средство | 10 | 1/6 | 75,78±10,76* | 67,19 |
| Седативное средство | 10 | ½ | 43,46±9,35* | 81,18 |
| Седативное средство | 10 | 1 | 21,98±6,4* | 90,48 |
| Седативное средство | 10 | 4 | 25,49±7,66* | 88,96 |
| Седативное средство | 10 | 8 | 74,68±10,51* | 67,62 |
| Фармакопейный глицин | 10 | 1/6 | 190,62±18,26 | 17,47 |
| Фармакопейный глицин | 10 | 1 | 227,08±17,41 | 1,68 |
| Фармакопейный глицин | 10 | 4 | 211,14±14,70 | 8,59 |
| Фармакопейный глицин | 10 | 8 | 219,54±12,42 | 4,95 |
| Контроль | 10 | 8 | 204,57±14,53 | - |
| * - р<0,01 по сравнению с контрольной группой, критерий Манна-Уитни |
Описываемое седативное средство, полученное по примеру 1, в дозе 10 мг/кг вызывало достоверное снижение (на 67%) горизонтальной двигательной активности уже через 10 мин после введения. Через 30 мин и через 1 ч снижение горизонтальной двигательной активности постепенно усиливалось и уменьшение составило 81% и 90% по сравнению с контролем, соответственно (табл.3). Снижение горизонтальной двигательной активности оставалось достоверным и составляло более 50% от контроля и через 4 и 8 часов после однократного введения описываемого седативного средства.
Фармакопейный глицин в дозе 10 мг/кг при однократном внутрибрюшинном введении не вызывал снижения двигательной активности через 10, 30 мин, 1, 4 и 8 ч после введения (табл.3).
При изучении вертикальной двигательной активности при внутрибрюшинном введении веществ, установлено, что в контрольной группе животных средняя вертикальная активность через 1 ч после введения дистиллированной воды составила 4,28 перемещений. Этот показатель достоверно не изменился и через 8 ч после введения дистиллированной воды (табл.4).
| Таблица 4 | ||||
| Изучение седативного действия описываемого средства при однократном внутрибрюшинном введении по показателям вертикальной двигательной активности мышей в актометре Opto-Varimex | ||||
| Вещества | Доза, мг/кг | Время регистрации эффекта, ч | Средняя вертикальная активность в минуту, ед. | % снижения двигательной активности относительно контроля |
| Контроль | 10 | 1 | 4,28±0,29 | - |
| Седативное средство | 10 | 1/6 | 0,27±0,09 | 93,67 |
| Седативное средство | 10 | ½ | 0±0* | 100 |
| Седативное средство | 10 | 1 | 0±0* | 100 |
| Седативное средство | 10 | 4 | 0,01±0,01* | 99,77 |
| Седативное средство | 10 | 8 | 0,37±0,08* | 91,36 |
| Фармакопейный глицин | 10 | 1 | 3,34±0,35# | 21,73 |
| Фармакопейный глицин | 10 | 4 | 2,38±1,32* | 44,39 |
| Контроль | 10 | 8 | 3,73±0,35 | - |
| * - р<0,01 по сравнению с контрольной группой, критерии Манна-Уитни | ||||
| # - р<0,05 по сравнению с контрольной группой, критерий Манна-Уитни |
Описываемое седативное средство в дозе 10 мг/кг при однократном внутрибрюшинном введении вызывало выраженное достоверное снижение (на 93,6%) вертикальной двигательной активности уже через 10 минут после введения. Через 30 минут и через 1 час после однократного введения оно полностью устраняло вертикальную двигательную активность. Существенное снижение вертикальной двигательной активности сохранялось и через 4 ч (на 99%) и через 8 ч (на 89,9%) (табл.4).
Фармакопейный глицин в дозе 10 мг/кг при однократном введении внутрибрюшинно, как через 1 ч, так и через 4 ч после введения, статистически недостоверно снижал вертикальную двигательную активность по сравнению с контролем (табл.4).
Пример 3.
Исследование специфической седативной активности описываемого средства при пероральном (интрагастральном) введении.
Исследование выполнено на белых беспородных половозрелых мышах-самцах массой 25-28 г. Экспериментальные животные содержались аналогично примеру 1. На каждой временной точке использовали отдельные группы животных: по 10 мышей в каждой группе - на контроль и исследования фармакологической активности описываемого седативного средства, по 6 мышей в группе - на исследования фармакологической активности фармакопейного глицина. Всего использовалось 62 животных.
При изучении горизонтальной двигательной активности при пероральном (интрагастральном) введении веществ, установлено, что в контрольной группе животных средняя вертикальная активность через 30 мин после введения дистиллированной воды составила 208,4 перемещений (табл.5).
| Таблица 5 | ||||
| Изучение седативного действия описываемого средства при однократном пероральном (интрагастральном) введении по показателям горизонтальной двигательной активности мышей в актометре Opto-Varimex | ||||
| Вещество | Доза, мг/кг | Время регистрации эффекта, ч | Средняя горизонтальная активность (перемещения) в минуту, ед. | % снижения двигательной активности относительно контроля |
| Контроль | ½ | 208,40±21,52 | - | |
| Седативное средство | 10 | ½ | 110,03±19,94* | 47,21 |
| Седативное средство | 10 | 1 | 67,76±11,12* | 67,51 |
| Седативное средство | 10 | 4 | 83,67±9,81* | 59,85 |
| Седативное средство | 10 | 8 | 94,34±7,56* | 54,73 |
| Фармакопейный глицин | 10 | 1 | 189,24±23,13 | 17,47 |
| Фармакопейный глицин | 10 | 4 | 201,75±21,64 | 3,21 |
| * - р<0,05 по сравнению с контрольной группой, критерий Манна-Уитни |
Установлено, что уже через 30 мин после введения (перорально) описываемого седативного средства в дозе 10 мг/кг отмечалось статистически достоверное снижение двигательной активности животных в 1,9 раза по сравнению с контрольной группой. Через 1 час после введения статистически достоверное снижение двигательной активности животных сохранялось и уровень активности был также в 1,9 раза ниже, чем в контрольной группе. Через 4 часа двигательная активность оставалась статистически достоверно сниженной на том же уровне. Через 8 часов наблюдалось статистически достоверное снижение двигательной активности животных в 1,5 раза по сравнению с контрольной группой (табл.5). Полученные результаты свидетельствуют о том, что однократное пероральное (интрагастральное) введение описываемого седативного средства в дозе 10 мг/кг вызывает стойкий статистически достоверный седативный эффект в течение 8 ч наблюдения.
Фармакопейный глицин в дозе 10 мг/кг при однократном введении перорально (интрагастрально) как через 1 ч, так и через 4 ч после введения, статистически недостоверно снижал вертикальную двигательную активность по сравнению с контролем (табл.5).
Пример 4.
Изучение побочных эффектов и токсического действия описываемого седативного средства
Исследование проводили на белых беспородных половозрелых мышах-самцах массой 20-24 г возрастом 2-3 месяца. Экспериментальные животные содержались аналогично примеру 2. Всего использовалось 42 животных - 7 групп по 6 мышей.
Регистрацию изменения поведения, рефлексов, возможных побочных эффектов, признаков интоксикации и гибели животных проводили через 1, 4, 24 ч, 4, 10 и 14 сут. после внутрибрюшинного введения описываемого седативного средства в сравнении с фармакопейной субстанцией глицина в тех же дозах.
В результате исследования было установлено, что описываемое седативное средство при внутрибрюшинном введении мышам в дозах 75, 150 и 225 мг/кг не вызывало признаков интоксикации и гибели животных на протяжении 14 сут. (табл.6-11). При этом описываемое седативное средство также не вызывало у мышей изменения шерстяного покрова, состояния слизистых оболочек. Также отсутствовали птоз верхнего века, повышенная уринация, дефекация, саливация, пилоэрекция, вокализация, боковое положение. В пределах нормы были ритм и глубина дыхательных движений, отсутствовали агрессивность, пугливость, тремор, судороги, каталепсия, стереотипия и груминг. Не наблюдалось изменения позы. У животных были сохранены пинеальный, роговичный и болевой рефлексы. На протяжении всех 14 сут. наблюдения животные удерживались на перевернутой сетчатой платформе в течение 5 с (табл.6-11).
При изучении реакции на болевое раздражение путем сдавливания основания хвоста мыши пинцетом установлено, что у животных после введения описываемого седативного средства в первые 4 ч наблюдения отмечалась сниженная реакция на болевой стимул, по сравнению с контролем, по показателям поворота головы к хвосту и писку. Через 24 ч наблюдения отмечалась нормализация реакции животного на болевой раздражитель. Фармакопейный глицин в дозе 75 мг/кг не вызывал изменение реакции на болевой стимул в течение всех 14 сут. после введения.
Изучение влияние описываемого седативного средства в сравнении с фармакопейным глицином на моторную активность и координацию движений осуществлялось с использованием теста вращающегося стержня (Rota Rod фирма Ugo Basile, Италия). Фиксированная скорость вращения стержня составляла 10 оборотов/мин. Критерием выполнения задания являлось удерживание животного на вращающемся стержне в течение 120 с.Нарушение координации движений наблюдалось через час после введения описываемого седативного средства в дозе 75 мг/кг у 16,7% животных и у 50% при введении препарата в дозах 150 и 225 мг/кг. Через 24 ч, 4, 10 и 14 сут. нарушений моторной активности под влиянием описываемого седативного средства при всех дозах не наблюдалось (табл.6-12).
| Таблица 6 | |||||||
| Изучение возможных побочных эффектов и гибели мышей через 1 час после введения фармакопейного глицина и описываемого седативного средства (показатель изменения в группе в %) | |||||||
| Показатели | Группы | ||||||
| Контроль | Седативное средство/доза, мг/кг | Фармакопейный глицин/доза, мг/кг | |||||
| 75 | 150 | 225 | 75 | 150 | 225 | ||
| Изменение характера шерстяного покрова | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение состояния слизистых оболочек | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Птоз верхнего века | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная уринация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная дефекация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная саливация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие пилоэрекции | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие вокализации | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие бокового положения | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Нарушение ритма и глубины дыхательных движений | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие агрессивности | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение реакции на постукивание по клетке | 0 | 0 | 0 | 33,3* | 0 | 0 | 33,3* |
| Повышенная пугливость | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие тремора | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие судорог | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение порогов болевой реакции | 0 | 66,7* | 100* | 100* | 0 | 100* | 100* |
| Изменение позы, каталепсия | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Нарушение координации движений в тесте вращающегося стержня | 0 | 16,7 | 50* | 50* | 33,3* | 33,3* | 50* |
| Удерживание 5 с на перевернутой сетчатой платформе | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| Перелезание с перевернутой сетчатой платформы наверх | 100 | 66,7* | 66,7* | 50* | 66,7* | 66,7* | 66,7* |
| Наличие пинеального рефлекса | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| Наличие роговичного рефлекса | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| Наличие седации | 0 | 66,7* | 100* | 100* | 0 | 100* | 100* |
| Наличие стереотипии | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие груминга | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Гибель животного | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| *- Р<0,05 - относительно контроля по критерию χ2 |
| Таблица 7 | |||||||
| Изучение возможных побочных эффектов и гибели мышей через 4 часа после введения фармакопейного глицина и описываемого седативного средства (показатель изменения в группе в %) | |||||||
| Показатели | Группы | ||||||
| Контроль | Седативное средство/доза, мг/кг | Фармакопейный глицин/доза, мг/кг | |||||
| 75 | 150 | 225 | 75 | 150 | 225 | ||
| Изменение характера шерстяного покрова | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение состояния слизистых оболочек | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Птоз верхнего века | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная уринация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная дефекация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Повышенная саливация | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие пилоэрекции | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие вокализации | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие бокового положения | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Нарушение ритма и глубины дыхательных движений | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие агрессивности | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение реакции на постукивание по клетке | 0 | 0 | 0 | 16,7 | 0 | 0 | 16,7 |
| Повышенная пугливость | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие тремора | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Наличие судорог | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Изменение порогов болевой реакции | 0 | 66,7* | 100* | 100* | 0 | 100* | 100* |
| Изменение позы, каталепсия | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Нарушение координации движений в тесте вращающегося стержня | 0 | 16,7 | 16,7 | 50* | 33,3* | 16,7 | 33,3* |
| Удерживание 5 с на перевернутой сетчатой платформе | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| Перелезание с перевернутой сетчатой платформы наверх | 100 | 66,7* | 66,7* | 50* | 100* | 83,3 | 66,7* |
| Наличие пинеального рефлекса | 100 | 100 | 100 | 100 | 100 |