Производные хиназолина
Иллюстрации
Показать всеДанное изобретение относится к новым производным хиназолина, имеющим бензофурановый заместитель формулы:
в которой
каждый из R1, R2, R5, R8, R9 и R10 представляет собой Н,
R3 и R4 одинаково представляют собой алкокси или метоксиэтокси группу;
R6 представляет собой алкил;
R7 представляет собой -C(O)NRaRb, причем каждый из Ra и Rb независимо представляет собой Н, алкил, этил, замещенный диэтиламиногруппой, С3-С6циклоалкил, или Ra и Rb вместе образуют циклоалкил;
Z представляет собой N;
Х представляет собой O, S или NR, где R представляет собой Н или алкил. Изобретение также относится к фармацевтической композиции, ингибирующей KDR, на основе этих соединений, способу лечения, связанного с ангиогенезом расстройства, представляющим собой рак, возрастную дегенирацию желтого пятна или хроническое воспалительное заболевание, и способу ингибирования активности фактора роста эндотелия сосудов.
4 н. и 14 з.п. ф-лы,6 пр.
Реферат
УРОВЕНЬ ТЕХНИКИ
Ангиогенез является физиологическим процессом роста новых кровеносных сосудов из ранее существовавших сосудов. Он происходит у здоровых субъектов в ходе залечивания ран, т.е. для восстановления потока крови к тканям после травмы или кровоизлияния.
Избыточный ангиогенез может быть вызван определенными патологическими состояниями, такими как рак, возрастная дегенерация желтого пятна и хроническое воспалительное заболевание. В результате новые кровеносные сосуды питают больные ткани и разрушают нормальные ткани. При раке новые кровеносные сосуды также дают возможность клеткам опухоли проникать в систему кровообращения и оседать в других органах.
Фактор роста эндотелия сосудов (VEGF), гомодимерный гликопротеин и его рецепторы, например, рецептор, содержащий домен с киназной вставкой (KDR), составляют важный путь ангиогенеза. Исследования показали, что ингибирование KDR приводит к апоптозу клеток эндотелия и, таким образом, к подавлению ангиогенеза. См. Rubin M. Tuder, Chest, 2000; 117:281. Следовательно, ингибиторы KDR являются потенциальными кандидатами для лечения связанных с ангиогенезом расстройств.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение основано на открытии, что ряд соединений хиназолина ингибирует активность KDR.
Один аспект данного изобретения относится к соединениям хиназолина следующей формулы (I):
в которой каждый из R1, R2, R3, R4, R5, R6, R7, R8, R9 и R10 независимо представляет собой H, галоген, нитро, амино, циано, гидрокси, алкил, алкенил, алкинил, арил, циклоалкил, гетероциклоалкил, гетероарил, алкокси, алкилтио, алкилкарбонил, карбокси, алкоксикарбонил, карбониламино, сульфониламино, аминокарбонил или аминосульфонил, или R3 и R4 вместе с атомами углерода, к которым они присоединены, образуют 4-7-членное насыщенное, ненасыщенное или ароматическое кольцо, необязательно содержащее 1-3 гетероатома, выбранных из N, O и S; X представляет собой O, S или NR, где R представляет собой H, алкил, алкенил, алкинил, арил, циклоалкил, гетероциклоалкил, гетероарил, алкилкарбонил, алкоксикарбонил, аминокарбонил или аминосульфонил, и Z представляет собой N или C-CN.
Вышеописанные соединения могут иметь один или несколько следующих признаков: X представляет собой O, NH или N-CH3; R7 представляет собой -C(O)NRaRb, причем каждый из Ra и Rb независимо представляет собой H, алкил, алкенил, алкинил, арил, циклоалкил, гетероциклоалкил или гетероарил, или Ra и Rb вместе с атомом азота образуют 3-8-членное кольцо, содержащее 1-3 гетероатома; R6 представляет собой алкил (например, метил); или каждый из R3 и R4 представляет собой алкокси (например, метокси). В одной подгруппе вышеуказанных соединений каждый из Ra и Rb независимо представляет собой H, алкил (например, метил) или циклоалкил (например, циклопропил).
Используемый здесь термин ″алкил″ относится к углеводороду с прямой или разветвленной цепью, содержащему 1-10 атомов углерода. Примеры алкильных групп включают, не ограничиваясь этим, метил, этил, н-пропил, изопропил, н-бутил, изобутил и трет-бутил. Термин ″алкокси″ относится к -O-алкилу.
Используемый здесь термин ″алкенил″ относится к C2-10 углеводороду с прямой или разветвленной цепью, содержащему одну или несколько C=C двойных связей. Примеры алкенильных групп включают, не ограничиваясь этим, винил, 2-пропенил и 2-бутенил.
Используемый здесь термин ″алкинил″ относится к C2-10 углеводороду с прямой или разветвленной цепью, содержащему одну или несколько C≡C тройных связей. Примеры алкинильных групп включают, не ограничиваясь этим, этинил, 2-пропинил и 2-бутинил.
Термин ″арил″ относится к 6-углеродной моноциклической, 10-углеродной бициклической, 14-углеродной трициклической ароматической кольцевой системе, в которой каждое кольцо может иметь от 1 до 4 заместителей. Примеры арильных групп включают, не ограничиваясь этим, фенил, нафтил и антраценил.
Термин ″циклоалкил″ относится к насыщенной и частично ненасыщенной циклической углеводородной группе, содержащей от 3 до 12 атомов углерода. Примеры циклоалкильных групп включают, не ограничиваясь этим, циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил, циклогептил и циклооктил.
Термин ″гетероарил″ относится к ароматической 5-8-членной моноциклической, 8-12-членной бициклической или 11-14-членной трициклической кольцевой системе, имеющей один или несколько гетероатомов (таких как O, N или S). Примеры гетероарильных групп включают пиридил, фурил, имидазолил, бензимидазолил, пиримидинил, тиенил, хинолинил, индолил и тиазолил. Термин ″гетероаралкил″ относится к алкильной группе, замещенной гетероарильной группой.
Термин ″гетероциклоалкил″ относится к неароматической 3-8-членной моноциклической, 8-12-членной бициклической или 11-14-членной трициклической кольцевой системе, имеющей один или несколько гетероатомов (таких как O, N или S). Примеры гетероциклоалкильных групп включают, не ограничиваясь этим, пиперазинил, пирролидинил, диоксанил, морфолинил и тетрагидрофуранил. Гетероциклоалкил может представлять собой кольцо сахарида, например, глюкозил.
Алкил, алкенил, алкинил, циклоалкил, гетероциклоалкил, арил, гетероарил и алкокси, указанные в настоящем описании, включают как замещенные, так и незамещенные фрагменты. Примеры заместителей включают, не ограничиваясь этим, галоген, гидроксил, амино, циано, нитро, меркапто, алкоксикарбонил, амидо, карбокси, алкансульфонил, алкилкарбонил, карбамидо, карбамил, карбоксил, тиоуреидо, тиоцианато, сульфонамидо, алкил, алкенил, алкинил, алкилокси, арил, гетероарил, циклоалкил, гетероциклоалкил, в которых алкил, алкенил, алкинил, алкилокси, арил, гетероарил, циклоалкил и гетероциклоалкил могут быть дополнительно замещенными.
Соединения хиназолина, описанные выше, включают их фармацевтически приемлемые соли, сольваты и пролекарства, если это применимо.
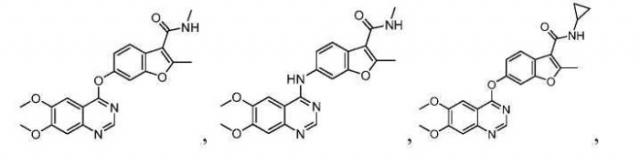
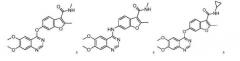
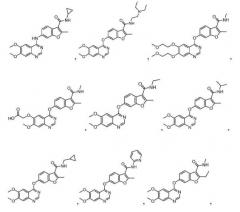
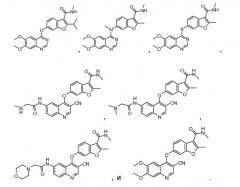
Примеры соединений данного изобретения показаны ниже:
Другой аспект данного изобретения относится к способу подавления ангиогенеза введением нуждающемуся в этом субъекту эффективного количества соединения хиназолина формулы (I), описанного выше.
Еще один аспект данного изобретения относится к способу лечения расстройства, связанного с ангиогенезом (например, рака, возрастной дегенерации желтого пятна или хронического воспалительного заболевания). Способ включает введение субъекту, страдающему связанным с ангиогенезом расстройством, эффективного количества одного или нескольких соединений хиназолина по данному изобретению. Примеры рака включают, но не ограничиваются этим, рак легкого, рак ободочной кишки, рак молочной железы, рак яичника, рак простаты, рак желудка, рак почки, рак печени, рак головного мозга, рак кости и лейкемию. Примеры хронических воспалительных расстройств включают, не ограничиваясь этим, воспалительные заболевания кишечника (такие как болезнь Крона и язвенный колит), прогрессирующий деформирующий артрит, волчанку, псориаз и сахарный диабет.
Кроме того, в объем правовой защиты изобретения включена (1) композиция, содержащая одно или несколько соединений хиназолина, описанных выше, и фармацевтически приемлемый носитель для использования при лечении связанных с ангиогенезом расстройств (например, рака, или возрастной дегенерации желтого пятна, или хронического воспалительного заболевания) и (2) использование одного или нескольких соединений хиназолина для изготовления медикамента для лечения данного расстройства.
Детали одного или нескольких вариантов осуществления изобретения излагаются в описании, приведенном ниже. Другие характерные признаки, цели и преимущества изобретения будут понятны из описания и из формулы изобретения.
ПОДРОБНОЕ ОПИСАНИЕ
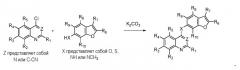
Соединения хиназолина по данному изобретению можно синтезировать из имеющихся в продаже исходных материалов методами, хорошо известными из уровня техники. Например, как показано на схеме 1 ниже, можно конденсировать подходящее производное 4-хлорхиназолина с соединением бензофурана, получая соединение по данному изобретению.
Схема 1
Полученное таким образом соединение можно далее модифицировать по его периферийным положениям, предоставляя другие соединения по изобретению.
Превращения синтетической химии, применимые при синтезе желательных соединений хиназолина, описываются, например, в R. Larock, Comprehensive Organic Transformations, VCH Publishers (1989); T.W. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis, 3rd Ed., John Wiley and Sons (1999); L. Fieser and M. Fieser, Fieser and Fieser's Reagents for Organic Synthesis, John Wiley and Sons (1994); и L. Paquette, ed., Encyclopedia of Reagents for Organic Synthesis, John Wiley and Sons (1995) и их последующих изданиях.
Перед использованием соединения можно очистить колоночной хроматографией, высокоэффективной жидкостной хроматографией, кристаллизацией или другими подходящими методами.
Соединения хиназолина по данному изобретению при контакте с KDR ингибируют данную рецепторную активность. Следовательно, эффективное количество одного или нескольких данных соединений можно использовать для ингибирования ангиогенеза и лечения субъекта, страдающего связанным с ангиогенезом расстройством.
Термин ″эффективное количество″ относится к количеству соединения хиназолина, которое требуется для обеспечения планируемого эффекта у субъекта. Эффективные количества могут различаться, как известно специалистам в данной области, в зависимости от маршрута введения, использования наполнителя и возможности совместного использования с другими агентами. Термин ″лечение″ относится к введению одного или нескольких вышеописанных соединений хиназолина субъекту, который страдает связанным с ангиогенезом расстройством, или имеет симптомы расстройства, или имеет предрасположенность к расстройству, с целью излечения, вылечивания, облегчения, уменьшения, изменения, исцеления, улучшения, поправки или влияния на расстройство, симптомы расстройства или предрасположенность к расстройству.
Для осуществления на практике данного способа композицию, имеющую одно или несколько соединений хиназолина по данному изобретению, можно вводить перорально, парентерально, аэрозолем для ингаляций или посредством имплантированного резервуара. Используемый здесь термин ″парентеральный″ включает методики подкожной, внутрикожной, внутривенной, внутримышечной, внутрисуставной, внутриартериальной, интрасиновиальной, надчревной, интратекальной, внутрь пораженной ткани и внутричерепной инъекции или инфузии.
Оральная композиция может иметь любую орально приемлемую лекарственную форму, включая, но не ограничиваясь этим, таблетки, капсулы, эмульсии и водные суспензии, дисперсии и растворы. Обычно используемые носители для таблеток включают лактозу и кукурузный крахмал. В таблетки также обычно добавляют смазывающие вещества, такие как стеарат магния. Для перорального введения в форме капсулы применимые разбавители включают лактозу и сухой кукурузный крахмал. Когда перорально вводят водные суспензии или эмульсии, активный ингредиент можно суспендировать или растворить в маслянистой фазе вместе с эмульгирующими или суспендирующими веществами. Если желательно, можно добавить определенные подслащивающие, ароматизирующие или окрашивающие агенты.
Рецептуру стерильной инъецируемой (впрыскиваемой) композиции (например, водной или маслянистой суспензии) можно составить в соответствии с методиками, известными из уровня техники, используя подходящие диспергирующие или смачивающие агенты (такие как, например, Tween 80) и суспендирующие агенты. Стерильный впрыскиваемый препарат также может представлять собой стерильный впрыскиваемый раствор или суспензию в нетоксичном парентерально приемлемом разбавителе или растворителе, например, раствор в 1,3-бутандиоле. Среди приемлемых сред и растворителей, которые можно использовать, маннит, вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды обычно используют стерильные, нелетучие масла (например, синтетические моно- и диглицериды). Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, применимы при приготовлении инъецируемых препаратов, также как природные фармацевтически приемлемые масла, такие как оливковое мало или касторовое масло, особенно в их полиоксиэтилированных версиях. Данные масляные растворы или суспензии также могут содержать длинноцепочечные спиртовые разбавители или диспергаторы, или карбоксиметилцеллюлозу или аналогичные диспергирующие вещества.
Композицию для ингаляции можно приготовить согласно методикам, хорошо известным из уровня техники приготовления фармацевтических рецептур, и можно приготовить в виде растворов в физиологическом растворе, используя бензиловый спирт или другие подходящие консерванты, ускорители абсорбции для увеличения биологической доступности, фторуглеводороды и/или другие солюбилизирующие или диспергирующие компоненты, известные из уровня техники.
Рецептуру местной (топической) композиции можно составить в форме масла, крема, лосьона, мази и т.п. Подходящие носители для композиции включают растительные или минеральные масла, медицинский вазелин (белый полутвердый парафин), жиры или масла с разветвленной цепью, животные жиры и высокомолекулярные спирты (содержащие более 12 атомов C). Предпочтительными являются носители, в которых растворим активный ингредиент. Также могут быть включены эмульгаторы, стабилизаторы, увлажнители и антиоксиданты, а также агенты, придающие цвет или аромат, если желательно. Кроме того, в данных топических рецептурах можно использовать усилители проникновения через кожу. Примеры таких усилителей можно найти в патентах США №3989816 и №4444762. Рецептуры кремов предпочтительно составляют из смеси минерального масла, самоэмульгирующегося пчелиного воска и воды, и к данной смеси примешивают активный ингредиент, растворенный в небольшом количестве масла, такого как миндальное масло. Примером такого крема является крем, который включает примерно 40 частей воды, примерно 20 частей пчелиного воска, примерно 40 частей минерального масла и примерно 1 часть миндального масла. Рецептуру мазей можно составить, смешивая раствор активного ингредиента в растительном масле, таком как миндальное масло, с теплым полутвердым парафином и давая возможность смеси охладиться. Примером такой мази является мазь, которая включает примерно 30% по массе миндального масла и примерно 70% по массе белого полутвердого парафина.
Носитель в фармацевтической композиции должен быть ″приемлемым″ в смысле, что он совместим с активными ингредиентами рецептуры (и, предпочтительно, способен их стабилизировать) и не опасен для субъекта, которого надо лечить. Например, в качестве фармацевтических наполнителей для доставки активных ингредиентов можно использовать солюбилизаторы, такие как циклодекстрины (которые образуют специфические, более растворимые комплексы с одним или несколькими активными соединениями хиназола экстракта). Примеры других носителей включают коллоидный диоксид кремния, стеарат магния, целлюлозу, лаурилсульфат натрия и D&C Желтый #10.
Для предварительной оценки эффективности вышеописанных соединений хиназолина для ингибирования активности KDR или ингибирования активности VEGF можно использовать подходящие анализы in vitro. Соединения можно дополнительно исследовать на их эффективность при лечении связанных с ангиогенезом расстройств посредством анализов in vivo. Например, соединения можно вводить животному (например, мышиной модели), страдающему раком, и затем оценивать их терапевтическое действие. На основании данных результатов можно также определить соответствующий диапазон дозировки и способ введения.
Без дальнейшего уточнения считается, что вышеприведенное описание адекватно раскрывает настоящее изобретение. Поэтому следующие ниже конкретные примеры следует истолковывать как исключительно иллюстративные и не ограничивающие никоим образом раскрытие изобретения.
Пример 1: Синтез 6-(6,7-диметоксихиназолин-4-илокси)-N,2-диметилбензофуран-3-карбоксамида:
К раствору 4-хлор-6,7-диметоксихиназолина (1 экв.) в 2 мл CH3CN добавляли 6-гидрокси-N,2-диметилбензофуран-3-карбоксамид (1 экв.) и K2CO3 (1,5 экв.). Смесь кипятили с обратным холодильником при перемешивании в течение 10 часов. После того как растворитель выпаривали, остаток промывали водой, сушили над MgSO4, фильтровали, концентрировали и очищали колоночной хроматографией, получая указанное в заголовке соединение с выходом 85%.
1H ЯМР (ДМСО-d6, 400 МГц) : 2,49 (с, 3H), 2,81 (д, J=8,4 Гц, 3H,10), 3,97 (с, 3H), 3,98 (с, 3H), 7,24 (дд, J=2,0, 8,4 Гц, 1H), 7,38 (с, 1H), 7,58 (с, 1H), 7,61 (д, J=2,0 Гц, 1H), 7,79 (д, J=8,4 Гц, 1H), 7,96 (м, 1H), 8,52 (с, 1H).
МС (m/e): 394,1 (M+1).
Пример 2: Синтез 6-(6,7-диметоксихиназолин-4-иламино)-N,2-диметилбензофуран-3-карбоксамида
Данное соединение получали методом, аналогичным методу, описанному в примере 1.
1H ЯМР (ДМСО-d6, 400 МГц) м.д.: 2,74 (с, 3H), 2,83 (д, J=8,4 Гц, 3H), 3,95 (с, 3H), 3,98 (с, 3H), 7,20 (с, 1H), 7,60 (дд, J=8,4, 2,0 ГЦ, 1H), 7,75 (д, J=8,4 ГЦ, 1H), 7,89 (с, 2H), 8,22 (д, J=2 Гц, 1H), 8,50 (с, 1H), 9,65 (с, 1H).
МС (m/e): 393,15 (M+1).
Пример 3: Синтез N-(2-(диэтиламино)этил)-6-(6,7-диметоксихиназолин-4-илокси)-2-метилбензофуран-3-карбоксамида
Данное соединение получали методом, аналогичным методу, описанному в примере 1.
1H ЯМР (ДМСО-d6, 400 МГц): 8,54 (с, 1H), 7,85 (ушир.с, 1H), 7,84-7,83 (д, J=2,8 Гц, 1H), 7,66 (с, 1H), 7,60 (с, 1H), 7,41 (с, 1H), 7,29-7,27 (д, J=8,0 Гц, 1H), 4,00 (д, J=2,8 Гц, 6H), 2,67 (с, 3H), 2,64-2,51 (м, 8H), 1,02 (ушир.с, 6H).
МС (m/e): 479,5 (M+1).
Пример 4: Синтез N-циклопропил-6-(6,7-диметоксихиназолин-4-илокси)-2-метилбензофуран-3-карбоксамида
Данное соединение получали методом, аналогичным методу, описанному в примере 1.
1H ЯМР (ДМСО-d6, 400 МГц): 8,53 (с, 1H), 8,22 (с, 1H), 7,72-7,70 (д, J=8,8 Гц, 2H), 7,63-7,61 (д, J=8,0 Гц, 1H), 7,41 (с, 1H), 7,26-7,24 (д, J=8,0 Гц, 1H), 4,00 (д, J=2,8 Гц, 6H), 2,88 (ушир.с, 1H), 2,61 (с, 3H), 0,74-0,73 (д, J=5,6 Гц, 2H), 0,63 (ушир.с, 2H).
МС (m/e): 420,4 (M+1).
Пример 5: Синтез 6-(6,7-бис(2-метоксиэтокси)хиназолин-4-илокси)-N,2-диметилбензофуран-3-карбоксамида
Данное соединение получали, следуя процедуре, описанной в примере 1.
МС (m/e): 482,2 (M+1).
Пример 6: Ингибирование активности KDR киназы
Ингибирование активности KDR киназы тестируемыми соединениями оценивали, используя набор реактивов Z'-LYTE™Tyr1 пептид (Invitrogen, Карлсбад, Калифорния, США, Кат. PV3190). Анализ проводили согласно процедурам, рекомендованным производителем.
Вкратце, каждое тестируемое соединение в ДМСО (10 мМ) разбавляли до 1:4 дистиллированной водой, содержащей 8% ДМСО. Раствор помещали в тест-лунку и три контрольных лунки (C1, C2 и C3) в количестве 2,5 мкл/лунка в черный 384-луночный планшет (Thermo labsystems, Кембридж, Великобритания, Кат. 7805). Пептид Z'-LYTE™Tyr1, пептидный субстрат, меченный двумя красителями кумарином-флуоресцеином, смешивали с KDR каталитическим доменом (Invitrogen, Кат. PV3660). 5 мкл киназа/пептидной смеси добавляли в тест-лунку, а также в C1 и C2 лунки, но не в C3 (конечная концентрация: 0,3 мкг/мл киназы, 2 мкМ пептида). 5 мкл фосфор-Tyr1 пептида добавляли в C3 лунку. 2,5 мкл 40 мкМ АТФ добавляли в тест- и C2 лунки и 2,5 мкл 1,33×киназного буфера (1×буфер: 50 мМ N-2-гидроксиэтилпиперазин-N-2-этансульфоновой кислоты (HEPES), рН 7,5; 0,01% Brij-35; 5 мМ MgCl2, 5 мМ MnCl2 и 1 мМ этиленгликольтетрауксусной кислоты, EGTA) добавляли в лунки C1 и C3. Планшет кратковременно вращали со скоростью 1000 об./мин, давая возможность растворам в нижней части лунок хорошо перемешаться, затем герметизировали и встряхивали при 250 об/мин и 25°C в течение 1 часа.
Проявляющий реагент разбавляли до 1:128, следуя инструкциям, данным изготовителем. 5 мкл разбавленного проявляющего реагента добавляли в каждую лунку. Планшет вращали при 1000 об/мин, давая возможность растворам хорошо перемешаться в нижней части лунок, и затем герметизировали и встряхивали при 250 об/мин и 25°C в течение 1 часа.
В каждую лунку добавляли 5 мкл стоп-реагента. Планшет вращали при 1000 об/мин и затем герметизировали при 250 об/мин и 25°C в течение 2 мин. Эмиссию флуоресцеина раствора в каждой лунке измеряли микропланшетным ридером VictorTM3 при возбуждении 400 нм/эмиссии 445 нм и 520 нм. Отношение эмиссии и процент фосфорилирования (″Фосф.″) рассчитывали с помощью следующих ниже уравнений:
где C100% = Средний сигнал эмиссии кумарина 100% Фосф. контроля
C0% = Средний сигнал эмиссии кумарина 0% Фосф. контроля
F100% = Средний сигнал эмиссии флуоресцеина 100% Фосф. контроля
F0% = Средний сигнал эмиссии флуоресцеина 0% Фосф. контроля
Показатель ингибирования рассчитывали следующим образом:
Ингибирование % = (Фосф. в C2 лунке - Фосф. в тестовой лунке)/(Фосф. в C2 лунке)×100%
IC50 величины (концентрацию, требующуюся для ингибирования активности KDR киназы на 50%) вычисляли, исходя из полученных таким образом показателей ингибирования.
Данный результат показал, что соединения 1-5 ингибировали активность KDR. Протестированные соединения имели величины IC50, находящиеся в диапазоне от 0,001 до 10 мкМ.
ДРУГИЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
Все характерные признаки, раскрытые в данном описании, можно объединить в любую комбинацию. Любой характерный признак, раскрытый в данном описании, можно заменить альтернативным характерным признаком, служащим такой же, эквивалентной или аналогичной цели. Таким образом, если это четко не заявлено иначе, каждый описанный характерный признак является только примером общей серии эквивалентных или аналогичных признаков.
Из вышеприведенного описания специалист в данной области может легко установить существенные характеристики настоящего изобретения, и без отклонения от его сущности и объема патентной защиты можно сделать различные изменения и модификации изобретения, чтобы адаптировать его к различным областям использования и условиям. Например, можно изготовить соединения, структурно аналогичные соединениям данного изобретения, и использовать их для осуществления на практике данного изобретения. Таким образом, другие варианты осуществления также входят в объем формулы изобретения.
1. Соединение формулы: в которойкаждый из R1, R2, R5, R8, R9 и R10 представляет собой Н,R3 и R4 одинаково представляют собой алкокси или метоксиэтокси группа;R6 представляет собой алкил;R7 представляет собой -C(O)NRaRb, причем каждый из Ra и Rb независимо представляет собой Н, алкил, этил, замещенный диэтиламиногруппой, С3-С6циклоалкил, или Ra и Rb вместе образуют циклоалкил;Z представляет собой N;Х представляет собой O, S или NR, где R представляет собой Н или алкил.
2. Соединение по п.1, где Х представляет собой O, NH или N-СН3.
3. Соединение по п.1, где R7 представляет собой -C(O)NRaRb, причем каждый из Ra и Rb независимо представляет собой Н, алкил, этил, замещенный диэтиламиногруппой, С3-С6циклоалкил.
4. Соединение по п.3, где каждый из Ra и Rb независимо представляет собой Н, алкил или С3-С6циклоалкил.
5. Соединение по п.1, где R6 представляет собой метил.
6. Соединение по п.4, где Х представляет собой O, NH или N-СН3.
7. Соединение по п.1, где каждый из R3 и R4 представляет собой алкокси.
8. Соединение по п.7, где R7 представляет собой -C(O)NRaRb, причем каждый из Ra и Rb независимо представляет собой Н, алкил, этил, замещенный диэтиламиногруппой, С3-С6циклоалкил.
9. Соединение по п.8, где каждый из Ra и Rb независимо представляет собой Н, алкил или С3-С6циклоалкил.
10. Соединение по п.9, где Ra представляет собой Н и Rb представляет собой метил.
11. Соединение по п.10, где R6 представляет собой алкил.
12. Соединение по п.11, где Х представляет собой O, NH или N-СН3.
13. Соединение по п.9, где каждый из R3 и R4 представляет собой метокси.
14. Соединение по п.1, где соединение представляет собой
15. Фармацевтическая композиция, ингибирующая KDR, включающая терапевтически эффективное количество соединения по п.1 и фармацевтически приемлемый носитель.
16. Способ лечения связанного с ангиогенезом расстройства, включающий введение нуждающемуся в этом субъекту эффективного количества соединения по п.1.
17. Способ по п.16, в котором связанное с ангиогенезом расстройство представляет собой рак, возрастную дегенерацию желтого пятна или хроническое воспалительное заболевание.
18. Способ ингибирования активности фактора роста эндотелия сосудов, включающий контактирование рецептора с эффективным количеством соединения по п.1.