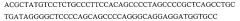Axl-антитела
Иллюстрации
Показать всеНастоящее изобретение относится к области иммунологии. Предложены моноклональные антитела, которые связываются с внеклеточным доменом рецепторной тирозинкиназы AXL и которые, по меньшей мере, частично ингибируют активность AXL, а также их антигенсвязывающие фрагменты. Также рассмотрена выделенная молекула нуклеиновой кислоты, клетка-хозяин и способ получения моноклонального антитела и его антигенсвязывающего фрагмента, а также применение моноклонального антитела или его антигенсвязывающего фрагмента для изготовления лекарственного средства, фармацевтические композиции, способ диагностики и способ профилактики или лечения состояния, связанного с экспрессией, сверхэкспрессией и/или гиперактивностью AXL. Настоящее изобретение может найти дальнейшее применение в терапии и диагностике заболеваний, связанных с AXL. 11 н. и 12 з.п. ф-лы, 20 ил., 24 пр., 3 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к антителам, в частности к моноклональным антителам, которые прикрепляются к внеклеточному домену рецепторной тирозинкиназы AXL и которые, по меньшей мере, частично ингибируют активность AXL.
Предшествующий уровень техники
AXL (Ark, UFO, Tyro-7) рецепторная тирозинкиназа является членом семейства киназ Tyro-3 вместе с другими членами, которыми являются Mer (Eyk, Nyk, Tyro-12) и Sky (Rse, Tyro-3, Dtk, Etk, Brt, Tif). Она активируется посредством присоединения гетерофильного лиганда Gas6, 70-кДа протеинового гомолога, к антикоагуляционному фактору протеину S. В отличие от других рецепторных тирозинкиназ, AXL-тирозиновое фосфорилирование также может быть вызвано посредством гомофильного присоединения. Активация AXL приводит к сигнальному через PI-3-киназа/Akt (Franke et al., Oncogene 22:8983-8998, 2003) и другим путям, типа Ras/Erk и β-катенин/TCF (Goruppi et al., Mol. Cell Biol. 21:902-915, 2001).
AXL слабо экспрессируется во многих нормальных тканях, включая мозг, сердце, скелетные мышцы, органные капсулы и соединительные ткани некоторых других органов, и в моноцитах, но не лимфоцитах. Akt-фосфорилирование, индуцированное AXL, описано для популяции фибробластов (Goruppi et al., Mol Cell Biol 17:4442-4453 1997), эндотелиальных клеток (Hasanbasic et al., Am J Physiol Heart Circ Physiol, 2004), сосудистых гладкомышечных клеток (Melaragno et al., J. Mol. Cell Cardiol. 37:881-887, 2004) и нейронов (Alien et al., Mol. Endocrinol. 13:191-201 1999). Кроме того, AXL участвует в клеточной адгезии и хемотаксисе. Нокауты по AXL приводят к замедлению стабилизации агрегации тромбоцитов и образованию тромбов, результатом чего является снижение активации тромбоцитарного интегрина Ilb3.
Сверхэкспрессия AXL наблюдается во многих типах раковых опухолей, напр., в опухоли молочной железы (Meric et al., Clin. Cancer Res. 8:361-367, 2002; Berclaz et al., Ann. Oncol. 12:819-824, 2001), толстой кишки (Chen et al., Int. J. Cancer 83:579-584, 1999; Craven et al., Int. J. Cancer 60:791-797, 1995), предстательной железы (Jacob et al., Cancer Detect. Prev. 23:325-332, 1999), легких (Wimmel et al., Eur J Cancer 37:2264-2274, 2001), желудка (Wu et al., Anticancer Res 22:1071-1078, 2002), яичников (Sun et al., Oncology 66:450-457, 2004), эндометрия (Sun et al., Ann. Oncol. 14:898-906, 2003), почек (Chung et al., DNA Cell Biol. 22:533-540, 2003), гепатоцеллюлярной (Tsou et al., Genomics 50:331-340, 1998), щитовидной железы (Ito et al., Thyroid 12:971-975, 2002; Ito et al., Thyroid 9:563-567, 1999) и карциноме пищевода (Nemoto et al., 1997), а также при хроническом миелолейкозе - CML (Janssen et al., A novel putative tyrosine kinase receptor with oncogenic potential. Oncogene, 6:2113-2120, 1991; Braunger et al., Oncogene 14:2619-2631 1997; O'Bryan et al., Mol Cell Biol 11:5016-5031, 1991), остром миелоцитарном лейкозе - AML (Rochlitz et al., Leukemia 13:1352-1358, 1999), остеосаркоме (Nakano et al., J. Biol. Chem. 270:5702-5705, 2003), меланоме (van Ginkel et al., Cancer Res 64:128-134, 2004) и в плоскоклеточном раке головы и шеи (Green et al., Br J Cancer. 2006 94:1446-5, 2006).
Кроме того, AXL идентифицирован как ассоциированный с метастазами ген, который активируется в клеточных линиях агрессивной формы рака молочной железы, по сравнению с неинвазивными клетками. In vitro, было обнаружено, что для миграции и инвазии необходима AXL-активность, и эту активность можно ингибировать путем обработки антителами (WO04008147). Аналогично, нейтрализация AXL-активности in vivo, либо через экспрессию доминантного негативного варианта AXL (Vajkoczy, P., et al., Proc. Natl. Acad. Science U.S.A. 103:5799-5804. 2005), либо путем миРНК-опосредованной деактивации AXL (Holland et al., Cancer Res. 65:9294-9303, 2005), предотвращала подкожный и ортотопический клеточный рост в экспериментах на мышах с ксенотрансплантатами.
До сих пор описаны два антитела, которые связываются с AXL и обладают биологической активностью. Одно антитело способно снижать AXL-опосредованную инвазию клеток (WO04008147), тогда как другое антитело, как сообщается, снижает взаимодействие AXL/Лиганд. Однако оба антитела являются поликлональными, что делает их непригодными для терапевтического применения.
Таким образом, ввиду терапевтического потенциала AXL существует острая необходимость получения моноклональных AXL-антител, фрагментов антител или их производных, которые эффективно и специфично блокировали бы AXL-опосредованную сигнальную трансдукцию и которые были бы пригодны для лечения.
Раскрытие изобретения
Соответственно, первый аспект настоящего изобретения относится к моноклональному антителу, включая его фрагмент и производное, которое связывается с внеклеточным доменом AXL, особенно AXL человека, и, по меньшей мере, частично ингибирует активность AXL.
Предпочтительно антитело настоящего изобретения дополнительно обладает, по меньшей мере, одним или более из следующих свойств: способностью снижать или блокировать AXL-опосредованную сигнальную трансдукцию, способностью снижать или блокировать AXL-фосфорилирование, способностью снижать или блокировать пролиферацию клеток, способностью снижать или блокировать ангиогенез, способностью снижать или блокировать миграцию клеток, способностью снижать или блокировать метастазирование опухоли, способностью снижать или блокировать AXL-опосредованную PI3K-сигнальный путь и способностью снижать или блокировать AXL-опосредованный антиапоптоз, вследствие чего повышая, например, чувствительность клеток на лечение антинеопластическим агентом. Кроме того, антитела настоящего изобретения могут проявлять высокую специфичность к AXL, особенно AXL человека, и в большей степени не распознают других членов семейства Tyro-3, напр., MER, и/или SKY, и/или AXL млекопитающих, не относящихся к приматам, таких как AXL мышей. Специфичность антител может быть определена путем измерения перекрестной реактивности, как описано в Примерах.
Термин "активность" относится к биологической функции AXL, которая влияет на фенотип клетки, в частности, но не ограничиваясь, раковые фенотипы, как, например, избежание апоптоза, автономность в сигналах роста, клеточной пролиферации, тканевой инвазии и/или метастазирования, интенсивность сигналов антироста (антиапоптоз) и/или постоянный ангиогенез.
Термин "AXL-опосредованная сигнальная трансдукция" означает активацию вторичных информационных путей, запускаемых посредством прямого или непрямого взаимодействия AXL со вторичной молекулой-мессенджером.
Термин "AXL-фосфорилирование" относится к фосфорилированию аминокислотных остатков, предпочтительно тирозиновых остатков, либо с помощью второго AXL-белка (трансфосфорилирование), или с помощью другого белка, имеющего активность протеинкиназы.
Термин "пролиферация клеток" относится ко всем AXL-включающим процессам, лежащим в основе репродукции клеток человека, в частности, но не ограничиваясь, раковых клеток человека. Они участвуют в или приводят к репликации клеточной ДНК, сепарации дуплицированной ДНК в двух эквивалентных по размеру группах хромосом и физическому делению (называемому цитокинезом) целостных клеток и должны стимулироваться или опосредоваться некаталитическими или каталитическими активностями AXL, предпочтительно включая AXL-фосфорилирование и/или AXL-опосредованную сигнальную трансдукцию.
Термин "ангиогенез" относится ко всем AXL-включающим процессам, которые способствуют росту новых кровеносных сосудов из уже существующих сосудов, в частности, но не ограничиваясь, новых питающих опухоль кровеносных сосудов. Эти процессы включают множество клеточных событий, таких как пролиферация, выживаемость, миграция и спрутинг (прорастание) эндотелиоцитов сосудистой стенки, притяжение и миграцию перицитов, а также образование базальной мембраны для стабилизации сосудов, перфузии сосудов или секреции ангиогенных факторов посредством стромальных или неопластических клеток, и должны быть стимулированными или опосредованными некаталитической или каталитической активностью AXL, предпочтительно включая AXL-фосфорилирование и/или AXL-опосредованную сигнальную трансдукцию.
Термин "метастаз" относится ко всем AXL-включающим процессам, которые способствуют распределению раковых клеток из первичной опухоли, проникновению в лимфатические и/или кровеносные сосуды, циркуляции по кровотоку и росту в отдаленном очаге (метастаз) в нормальных тканях по всему организму. В частности, это относится к клеточным процессам в опухолевых клетках, таким как пролиферация, миграция, безъякорный рост, уклонение от апоптоза или секреция ангиогенных факторов, которые указывают на метастаз и стимулируются или опосредуются некаталитическими или каталитическими активностями AXL, предпочтительно включая AXL-фосфорилирование и/или AXL-опосредованную сигнальную трансдукцию.
Термин "AXL-опосредованный антиапоптоз" относится ко всем AXL-включающим процессам, которые предохраняют человеческие клетки, предпочтительно но не ограничиваясь, раковые клетки человека от запрограммированной гибели клеток (апоптоза). В частности, это относится к процессам, которые предохраняют человеческие клетки, предпочтительно, но не ограничиваясь, раковые клетки человека, от индукции апоптоза через прекращение действия фактора роста, гипоксию, воздействие химиотерапевтических агентов или облучение или инициирования Fas/Apo-1 рецептор-опосредованной передачи сигнала и стимулируются или опосредуются некаталитическими или каталитическими активностями AXL, предпочтительно включая AXL-фосфорилирование и/или AXL-опосредованную сигнальную трансдукцию.
В дополнение, настоящее изобретение включает антитела, чьи связывающие активности с AXL составляют KD=10-5 М или менее, предпочтительно KD=10-7 М или менее и наиболее предпочтительно KD=10-9 М или менее. Составляет ли связывающая активность AXL-антитела настоящего изобретения KD=10-5 М или менее, можно определить с помощью способов, известных из уровня техники. Например, активность можно определить, используя метод поверхностного плазменного резонанса Biacore и/или с помощью ELISA (твердофазного иммуноферментного анализа), EIA (иммуноферментного анализа), RIA (радиоиммунного анализа) или метода флуоресцирующих антител, напр., FACS.
Во втором аспекте антитело может иметь, по меньшей мере, один антигенсвязывающий сайт, напр., один или два антигенсвязывающих сайта. Дополнительно, антитело предпочтительно содержит, по меньшей мере, одну тяжелую цепь иммуноглобулина и, по меньшей мере, одну легкую цепь иммуноглобулина. Иммуноглобулиновая цепь содержит вариабельный домен и, при необходимости, константный домен. Вариабельный домен может содержать определяющие комплементарность участки (CDR), напр. CDR1, CDR2 и/или CDR3 участок, и каркасные участки. Термин "определяющий комплементарность участок" (CDR) четко определен в уровне технике (см., например, Harlow and Lane "Antibodies, a Laboratory Manual", CSH Press, Cold Spring Harbour, 1988) и относится к удлинениям аминокислот в вариабельном участке антитела, который непосредственно контактирует с антигеном.
Дополнительный аспект настоящего изобретения относится к антителу, включая его фрагмент или его производное, которое связывается с внеклеточным доменом AXL, который содержит, по меньшей мере, одну аминокислотную последовательность тяжелой цепи, включающую, по меньшей мере, один CDR, который выбирают из группы, состоящей из:
(a) CDRH1, как показано в SEQ ID NO:16, 22, 28, или CDRH1, последовательность которого отличается на 1 или 2 аминокислотных остатков,
(b) CDRH2, как показано в SEQ ID NO:17, 23, 29, или CDRH2, последовательность которого отличается на 1 или 2 аминокислотных остатков, и
(c) CDRH3, как показано в SEQ ID NO:18, 24, 30, или CDRH3, последовательность которого отличается на 1 или 2 аминокислотных остатков,
и/или, по меньшей мере:
одну аминокислотную последовательность легкой цепи, включающую, по меньшей мере, один CDR, который выбирают из группы, состоящей из:
(d) CDRL1, как показано в SEQ ID NO:13, 19, 25 или CDRL1, последовательность которого отличается на 1 или 2 аминокислотных остатков,
(e) CDRL2, как показано в SEQ ID NO:14, 20, 26 или CDRL2, последовательность которого отличается на 1 или 2 аминокислотных остатков, и
(f) CDRL3, как показано в SEQ ID NO:15, 21, 27 или CDRL3, последовательность которого отличается на 1 или 2 аминокислотных остатков,
или моноклонального антитела, распознающего тот же эпитоп на внеклеточном домене AXL.
В предпочтительном воплощении антитело содержит тяжелую цепь, содержащую, по меньшей мере, один CDR, выбранный из группы, состоящей из:
(a) CDRH1, как показано в SEQ ID NO:16, или CDRH1, последовательность которого отличается на 1 или 2 аминокислотных остатков,
(b) CDRH2, как показано в SEQ ID NO:17, или CDRH2, последовательность которого отличается на 1 или 2 аминокислотных остатков, и
(c) CDRH3, как показано в SEQ ID NO:18, или CDRH3, последовательность которого отличается на 1 или 2 аминокислотных остатков,
и/или легкую цепь, содержащую, по меньшей мере, один CDR, выбранный из группы, состоящей из:
(d) CDRL1, как показано в SEQ ID NO:13, или CDRL1, последовательность которого отличается на 1 или 2 аминокислотных остатков,
(e) CDRL2, как показано в SEQ ID NO:14, или CDRL2, последовательность которого отличается на 1 или 2 аминокислотных остатков, и
(f) CDRL3, как показано в SEQ ID NO:15, или CDRL3, последовательность которого отличается на 1 или 2 аминокислотных остатков,
или моноклональное антитело, распознающее тот же эпитоп на внеклеточном домене AXL.
В дополнительном предпочтительном воплощении, антитело содержит тяжелую цепь, содержащую, по меньшей мере, один CDR, выбранный из группы, состоящей из:
(a) CDRH1, как показано в SEQ ID NO:22, или CDRH1, последовательность которого отличается на 1 или 2 аминокислотных остатков,
(b) CDRH2, как показано в SEQ ID NO:23, или CDRH2, последовательность которого отличается на 1 или 2 аминокислотных остатков, и
(c) CDRH3, как показано в SEQ ID NO:24, или CDRH3, последовательность которого отличается на 1 или 2 аминокислотных остатков,
и/или легкую цепь, содержащую, по меньшей мере, один CDR, выбранный из группы, состоящей из
(d) CDRL1, как показано в SEQ ID NO:19, или CDRL1, последовательность которого отличается на 1 или 2 аминокислотных остатков,
(e) CDRL2, как показано в SEQ ID NO:20, или CDRL2, последовательность которого отличается на 1 или 2 аминокислотных остатков, и
(f) CDRL3, как показано в SEQ ID NO:21, или CDRL3, последовательность которого отличается на 1 или 2 аминокислотных остатков,
или моноклональное антитело, распознающее тот же эпитоп на внеклеточном домене AXL.
В еще дополнительном предпочтительном воплощении антитело содержит тяжелую цепь, содержащую, по меньшей мере, один CDR, выбранный из группы, состоящей из:
(a) CDRH1, как показано в SEQ ID NO:28, или CDRH1, последовательность которого отличается на 1 или 2 аминокислотных остатков,
(b) CDRH2, как показано в SEQ ID NO:29, или CDRH2, последовательность которого отличается на 1 или 2 аминокислотных остатков, и
(c) CDRH3, как показано в SEQ ID NO:30, или CDRH3, последовательность которого отличается на 1 или 2 аминокислотных остатков, и/или легкую цепь, содержащую, по меньшей мере, один CDR, выбранный из группы, состоящей из:
(d) CDRL1, как показано в SEQ ID NO:25, или CDRL1, последовательность которого отличается на 1 или 2 аминокислотных остатков,
(e) CDRL2, как показано в SEQ ID NO:26, или CDRL2, последовательность которого отличается на 1 или 2 аминокислотных остатков, и
(f) CDRL3, как показано в SEQ ID NO:27, или CDRL3, последовательность которого отличается на 1 или 2 аминокислотных остатков,
или моноклональное антитело, распознающее тот же эпитоп на внеклеточном домене AXL.
В другом воплощении настоящее изобретение относится к антителу, содержащему аминокислотную последовательность тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO:8, 10, 12, или, по меньшей мере, ее вариабельный домен или аминокислотную последовательность, имеющую с ней идентичность последовательности, по меньшей мере, 90%, и/или аминокислотную последовательность легкой цепи, выбранную из группы, состоящей из SEQ ID NO:7, 9, 11, или, по меньшей мере, ее вариабельный домен или аминокислотную последовательность, имеющую с ней идентичность последовательности, по меньшей мере, 90%, или изобретение относится к антителу, распознающему тот же эпитоп на внеклеточном домене AXL.
В используемом здесь значении "идентичность последовательности" между двумя полипептидными последовательностями показывает процент аминокислот, которые идентичны между последовательностями. Предпочтительные полипептидные последовательности изобретения имеют идентичность последовательности, составляющую, по меньшей мере, 90%.
В особенно предпочтительном воплощении антитело выбирают из группы, состоящей из 11В7, 11D5, 10D12, или антитела, распознающего аналогичный эпитоп на внеклеточном домене AXL.
Антитело может быть любым антителом естественного и/или синтетического происхождения, напр. антитело млекопитающего. Предпочтительно, константный домен - если таковой присутствует - представляет собой константный домен человека. Константный домен предпочтительно является константным доменом млекопитающего, напр. гуманизированным, или константным доменом человека. Более предпочтительно, антитело является химерным, гуманизированным или антителом человека.
Антитело изобретения может быть IgA-, IgD-, IgE-, IgG- или IgM-типом, предпочтительно IgG- или IgM-типом, включая, но не ограничиваясь, IgG1-, IgG2-, IgG3-, IgG4-, IgM1- и IgM2-типом. В наиболее предпочтительных воплощениях антитело представляет собой IgG1-, IgG2- или IgG4-тип.
Как обсуждалось выше, существует множество изотипов антител. Необходимо понимать, что антитела, которые образуются, сначала не имеют такой изотип, но иногда антитело, как образовано, может обладать любым изотипом, и что антитело может быть антителом с переключенным изотипом при использовании молекулярно клонированных генов V-областей или клонированных генов константных участков или кДНК в соответствующих экспрессирующих векторах, используя общепринятые биомолекулярные технологии, которые хорошо известны из уровня техники, а затем экспрессируются антитела в клетках-хозяевах, используя техники, известные из уровня техники.
Термин антитело включает "фрагменты" или "производные", которые имеют, по меньшей мере, один антигенсвязывающий участок антитела. Фрагменты антител включают Fab фрагменты, Fab' фрагменты F(ab')2 фрагменты, а также Fv фрагменты. Производные антитела включают одноцепочечные антитела, нанотела и диатела. Производные антитела должны также включать каркасные белки, обладающие антитело-подобной связывающей активностью, которые связываются с AXL.
В контексте настоящего изобретения термин "каркасный белок" в используемом здесь значении означает полипептид или белок с экспонированными площадями поверхности, в которых с высокой степенью допустимы аминокислотные вставки, замены или делеции. Примерами каркасных белков, которые могут применяться в соответствии с настоящим изобретением, являются белок А из Staphylococcus aureus, билин-связывающий белок из Pieris brassicae или другие липокалины, белок с анкириновым повтором и фибронектин человека (приведено в Binz and Pluckthun, Curr Opin Biotechnol, 16:459-69, 2005). Создание каркасного белка может рассматриваться как трансплантирование или интегрирование аффинной функции на или в структурный каркас прочно упакованного белка. Аффинная функция означает аффинность к связывающим белкам в соответствии с настоящим изобретением. Каркас может быть структурно отделен от аминокислотных последовательностей, придавая связывающую специфичность. В целом, белки, которые предположительно подходят для разработки таких синтетических аффинных реагентов, могут быть получены с помощью рациональных, или наиболее распространенных, комбинационных методов белковой инженерии, таких как пэннинг против AXL, либо очищенного белка, либо белка, имеющегося на клеточной поверхности, для связывающих агентов в синтетической библиотеке каркасных белков, представленных in vitro, при этом белки могут быть получены специалистом в данной области техники (Skerra, J. Mol. Recog., Biochim Biophys Acta, 1482:337-350, 2000; Binz and Pluckthun, Curr Opin Biotechnol, 16:459-69, 2005). В дополнении, каркасный белок, обладающий антителоподобной связывающей активностью, может быть получен из акцепторного полипептида, содержащего каркасный домен, который может быть соединен со связывающими доменами донорского полипептида для придания связывающей специфичности донорского полипептида каркасному домену, содержащему акцепторный полипептид. Введенные связывающие домены могут включать, например, по меньшей мере, один CDR анти-AXL-антитела, предпочтительно, по меньшей мере, такой, который выбирают из группы SEQ ID NO:13-30. Вставки могут выполняться различными способами, известными специалистам в данной области техники, включая, например, с помощью полипептидного синтеза, синтеза нуклеиновых кислот кодируемой аминокислоты, а также с помощью различных вариантов рекомбинантных методов, хорошо известных специалистам из уровня техники.
Как было определено выше, специфичность антитела, фрагмента антитела или его производного заключается в аминоксилотной последовательности CDR. Константный домен (тяжелая цепь VH и легкая цепь VL) антитела предпочтительно содержит три определяющих комплементарность участка, иногда называемых гипервариабельные участки, фланкированные четырьмя относительно консервативными каркасными участками или "FR". Часто специфичность антитела определяется или в большей степени определяется посредством CDR, таких как CDR из VH-цепи, или ряда CDR. Специалист в данной области без труда оценит, какой константный домен антитела, фрагмента антитела или его производного, имеющий вышеописанные CDR, может быть использован для конструирования антител с дополнительно улучшенной специфичностью и биологической функцией. В связи с чем настоящее изобретение охватывает антитела, фрагменты антител или их производные, содержащие, по меньшей мере, один CDR вышеописанных константных доменов и которые преимущественно имеют практически такие же, аналогичные или улучшенные свойства, что и антитело, описанное в прилагаемых примерах. Начиная с антитела, которое содержит, по меньшей мере, один CDR, который указан в прилагаемом перечне последовательностей и предусмотрен воплощениями изобретения, специалист может комбинировать дополнительные CDR из первоначально идентифицированных моноклональных антител или различных антител для повышения специфичности и/или аффинности. CDR-пересадка хорошо известна из уровня техники и также может использоваться для точного настраивания специфичной аффинности и других свойств антитела, фрагмента или его производного изобретения, поскольку остается природная специфичность. Преимущественно, что антитело, фрагмент или производное содержит, по меньшей мере, два, более предпочтительно, по меньшей мере, три, даже более предпочтительно, по меньшей мере, четыре или, по меньшей мере, пять и в особенности предпочтительно все шесть CDR от природного донорского антитела. В дополнительных альтернативах изобретения CDR из различных природных моноклональных антител могут комбинироваться в новую единицу антитела. В этом случае предпочтительно, чтобы три CDR тяжелой цепи происходили из того же антитела, тогда как три CDR легкой цепи происходили из другого (но не все из одного) антитела. Антитела настоящего изобретения или их соответствующая иммуноглобулиновая цепь(и) могут быть дополнительно модифицированы, используя общепринятые техники, известные из уровня техники, например, путем использования аминокислотной делеции(ий), вставки(ок), замены(н), дополнения(ий), и/или рекомбинации(ий), и/или любой другой модификации(ий), известной из уровня техники, либо в отдельности, либо в комбинации. Способы введения таких модификаций в ДНК-последовательность, лежащую в основе аминокислотной последовательности иммуноглобулиновой цепи, хорошо известны специалисту в данной области техники; см., напр., Sambrook, Molecular Cloning A Laboratory Manual, Cold Spring Harbor Laboratory (1989) N.Y.
Антитела, фрагменты антител или их производные, при необходимости, деиммунизируют для терапевтических целей. Деиммунизированное антитело является белком, лишенным или с небольшим количеством эпитопов, которые могут быть распознаны Т-хелперными лимфоцитами. Пример того, как идентифицировать указанные эпитопы, показан в Tangri et al. (J Immunol. 174:3187-96, 2005). Изготовление фрагментов деиммунизированных антител или их производных можно осуществлять, как описано в патентах США №6054297, 5886152 и 5877293.
В одном воплощении антитела специфично включают "химерные" антитела (иммуноглобулины), в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных из определенных видов или принадлежащих к определенному классу или подклассу антител, между тем как остаток цепи(ей) идентичен или гомологичен соответствующим последовательностям в антителах, полученных из других видов или принадлежащих к другому классу или подклассу антител, а также фрагментов таких антител, поскольку они проявляют желаемую биологическую активность (патент США №4816567; Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984)). Получение химерных антител описано, например, в WO 89/09622.
Предпочтительно, настоящее изобретение относится к химеризированному антителу, содержащему аминокислотную последовательность тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO:38, 39, 41, 42, или, по меньшей мере, ее константный домен или аминокислотную последовательность, имеющую с ней идентичность последовательность, по меньшей мере, 90%, и/или аминокислотную последовательность легкой цепи, которую выбирают из группы, состоящей из SEQ ID NO:37, 40, или, по меньшей мере, ее константный домен или аминокислотную последовательность, имеющую с ней идентичность последовательность, по меньшей мере, 90%, или изобретение относится к антителу, распознающему тот же эпитоп на внеклеточном домене AXL.
В дополнительном воплощении антитела настоящего изобретения являются гуманизированными или полностью человеческими антителами. Гуманизированные формы антител могут создаваться в соответствии с методами, известными из уровня техники, такими как химеризация или пересадка CDR. Альтернативные способы получения гуманизированных антител хорошо известны из уровня техники и описаны, напр., в ЕР-А1 0239400 и W090/07861. Обычно гуманизированное антитело имеет один или более аминокислотных остатков, введенных в него из источника, который не является человеком. Эти нечеловеческие аминокислотные остатки часто называют "импортные" остатки, которые типично взяты из "импортного" константного домена. Гуманизирование может, например, быть выполнено с помощью метода, описанного Winter и его соавторами (Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature, 332:323-327 (1988); Verhoeyen et al., Science, 239:1534-1536 (1988)), путем замещения CDR или CDR-последовательностей нечеловеческого происхождения на соответствующие последовательности антитела человека. Следовательно, такие "гуманизированные" антитела являются химерными антителами (патент США №4816567), в которых практически менее чем интактный человеческий константный домен замещен соответствующей последовательностью из видов, не относящихся к человеку. В практике гуманизированные антитела обычно являются человеческими антителами, в которых некоторые CDR-остатки и, возможно, некоторые FR-остатки замещены остатками аналогичных сайтов из нечеловеческих антител.
Предпочтительно, настоящее изобретение относится к гуманизированному антителу, содержащему аминокислотную последовательность тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO:44, 46, или, по меньшей мере, ее константный домен или аминокислотную последовательность, имеющую с ней идентичность последовательность, по меньшей мере, 90%, и/или аминокислотную последовательность легкой цепи, которую выбирают из группы, состоящей из SEQ ID NO:43, 45, или, по меньшей мере, ее константный домен или аминокислотную последовательность, имеющую с ней идентичность последовательность, по меньшей мере, 90%, или изобретение относится к антителу, распознающему тот же эпитоп на внеклеточном домене AXL.
Один из способов создания полностью человеческих антител включает использование мышиных штаммов XenoMouse®, которые содержат фрагменты эмбрионального типа локуса тяжелой цепи человека и локуса легкой каппа-цепи размером не менее 1000 кб. См., Mendez et al. (Nature Genetics 15:146-156 1997), и Green and Jakobovits (J. Exp. Med. 188:483-495, 1998). Штаммы XenoMouse® доступны от AMGEN, Inc. (ранее ABGENIX, Fremont, CA).
Получение штаммов мышей XenoMouse® обсуждено и определено в патентных заявках США №07/466,008, поданной 12.01.1990; №07/610,515, поданной 08.11.1990; №07/919,297, поданной 24.07.1992; №07/922,649, поданной 30.07.1992; №08/031,801, поданной 15.03.1993; №08/112,848, поданной 27.08.1993; №08/234,145, поданной 28.04.1994; №08/376,279, поданной 20.01.1995; №08/430, 938, поданной 27.04.1995, №08/464,584, поданной 05.06.1995, №08/464,582, поданной 05.06.1995, №08/463,191, поданной 05. 06.1995, №08/462,837, поданной 05.06.1995, №08/486,853, поданной 05.06.1995, №08/486,857, поданной 05.06.1995. №08/486,859, поданной 05.06.1995, №08/462,513, поданной 05.06.1995, №08/724,752, поданной 02.10.1996, №08/759,620, поданной 03.12.1996; в публикации США 2003/0093820, поданной 30.11.2001, и в патентах США №6162963, 6150584, 6114598, 6075181 и 5939598 и японских патентах №3068180 В2, 3068506 В2 и 3068507 В2. См. также европейский патент ЕР 0463151 B1, опубликованный 12.06.1996, международную заявку на патент WO 9402602, опубликованную 03.02.1994, международные заявки на патент WO 9634096, опубликованную 31.10.1996, WO 9824893, опубликованную 11.06.1998, WO 0076310, опубликованную 21.12.2000. Описания каждого из цитируемых выше патентов, заявок и ссылок приведено здесь в полном объеме в виде ссылок.
В альтернативном методе другие исследователи, включая исследователей GenPharm International, Inc., использовали "мини-локусы". Этот подход с использованием мини-локусов заключается в том, что был имитирован локус экзогенного Ig путем включения фрагментов (отдельных генов) из локуса Ig. Таким образом, из одного или нескольких генов VH, одного или нескольких генов DH, одного или нескольких генов JH, константной мю-области и второй константной области (предпочтительно константной гамма-области) создавали конструкцию для введения животному. Этот способ описан в патенте США №5545807, Surani et al., и в патентах США №№5545806, 5625825, 5625126, 5633425, 5661,016, 5770429, 5789650, 5814318, 5877397, 5874299 и 6255458, Lonberg, и в патентах США №№5591669 и 6023010, Krimpenfort & Berns, в патентах США №№5612205, 5721367 и 5789215, Bems et al., и в патенте США №5643763, Choi & Dunn, и в Международных заявках на патент США; GenPharm: рег. №07/574748, поданной 29 августа 1990 г., 07/575962, поданной 31 августа 1990 г., 07/810279, поданной 17 декабря 1991 г., 07/853408, поданной 18 марта 1992 г., 07/904068, поданной 23 июня 1992 г., 07/990860, поданной 16 декабря 1992 г., 08/053131, поданной 26 апреля 1993 г., 08/096762, поданной 22 июля 1993, 08/155301, поданной 18 ноября 1993 г., 08/161739, поданной 3 декабря 1993 г., 08/165699, поданной 10 декабря 1993 г., и 08/209741, поданной 9 марта 1994 г., описания которых включены сюда путем ссылки. См. также Европатент №546073 В1, Международные патентные заявки №№ WO 92/03918, WO 92/22645, WO 92/22647, WO 92/22670, WO 93/12227, WO 94/00569, WO 94/25585, WO 96/14436, WO 97/13852 и WO 98/24884, и патент США №5981175, описания которых включены сюда путем ссылки в полном объеме.
Kirin также продемонстрировал генерирование человеческих антител у мышей, которым путем слияния микроклеток вводили большие фрагменты хромосом или целые хромосомы. См. Европейские патентные заявки №№773288 и 843961, описания которых включены сюда путем ссылки. Дополнительно, были генерированы KMTM-мыши, которые являются результатом кроссбридинга мышей Те (Kirin) и мышей с минилокусами (Medarex) (Humab). Эти мыши имеют человеческие трансхромосомы IgH мышей Kirin и трансген каппа-цепи мышей Genpharm (Ishida et al.,, Cloning Stem Cells 4:91-102, 2002).
Человеческие антитела также могут быть получены способами in vitro. Подходящие примеры включают, но не ограничиваются, фаговое отображение (CAT, Morphosys, Dyax, Biosite/Medarex, Xoma, Symphogen, Alexion (бывший Proliferon), (Affimed) рибосомное отображение (CAT), дрожжевое отображение и им подобные.
Для терапевтических целей антитело можно конъюгировать с терапевтически эффекторной группой, напр. радиоактивной группой или цитотоксичной группой.
Для диагностических целей антитело можно пометить. Подходящие метки включают радиоактивные метки, флуоресцентные метки или ферментативные метки.
Дополнительно используемые в соответствие с настоящим изобретением антитела являются так называемыми ксеногенными антителами. Общий принцип получения ксеногенных антител, таких как человеческие антитела, у мышей описан, напр., в WO 9110741, WO 9402602, WO 9634096 и WO 9633735.
Как обсуждалось выше, антитело изобретения может существовать в различных формах, кроме полных антител, включая, например, Fv, Fab' и F(ab')2, а также с одинарными цепями, см., напр., WO 8809344.
При необходимости, антитела изобретения могут быть мутированы в константных доменах тяжелой и/или легких цепей для изменения связывающего свойства антитела. Например, мутацию можно выполнить в одном или более CDR-участках для повышения или снижения Kd антитела для AXL или для изменения связывающей специфичности антитела. Техники сайт направленного мутагенеза хорошо известны из уровня техники. См, напр., Sambrook et al. and Ausubel et al., supra. Кроме того, мутация может быть выполнена в аминокислотном остатке, который известно, что изменен по сравнению с эмбриональным в вариабельном участке AXL-антитела. В другом аспекте мутации могут вводиться в один или более каркасных участков. Мутация может быть выполнена в каркасном участке или константном домене для повышения периода полураспада AXL-антитела. См., напр., WO 0009560. Мутация в каркасном участке или константном домене может также быть выполнена для изменения иммуногенности антитела с обеспечением сайта для ковалентного или нековалентного связывания с другой молекулой или для изменения таких свойств, как связывание комплемента. Мутации можно выполнять в каждом из каркасных участков, константном домене и вариабельных участках в одном мутированном антителе. Альтернативно, мутации можно выполнить только в одном из каркасных участков, вариабельных участков или константном домене в одном мутированном антителе.
В дополнительном аспекте антитело может иметь константный домен с эффекторными функциями, на основании чего экспрессирующие AXL клетки, которые связывают антитело, фрагмент антитела или его производное на клеточной поверхности, могут подвергаться воздействию иммунной системы. Например, антитело может быть способно фиксировать комплемент и участвовать в комплементзависимой цитотоксичности (CDC). Кроме того, антитело может быть способно связывать рецепторы Fc на эффекторных клетках, таких как моноциты и натуральные киллеры (NK), и участвовать в антителозависимой клеточной цитотоксичности (ADCC).
В еще дополнительном аспекте антитела изобретения пригодны для терапевтического лечения, предпочтительно для лечения гиперпролиферативных заболеваний, сердечнососудистых заболеваний, в частности атеросклероза и тромбоза, связанных с диабетом заболеваний, в частности гломерулярной гипертрофии или диабетической нефропатии, и в особенности нарушений, связанных с, сопровождающихся или вызванных экспрессией, сверхэкспрессией или гиперактивностью AXL. Гиперпролиферативные заболевания предпочтительно выбирают из нарушений связанных с, сопровождающихся или вызванных экспрессией, сверхэкспрессией или гиперактивностью AXL, таких как рак, напр., рак молочной железы, рак толстой кишки, рак легких, рак почки, фолликулярная лимфома, миелолейкоз, рак кожи/меланома, глиобластома, рак яичников, рак предстательной железы, рак поджелудочной железы, пищевод Барретта и рак пищевода, рак желудка, рак мочевого пузыря, рак шейки матки, рак печени, рак щитовидной железы и рак головы и шеи, или гиперпластические и неопластические заболевания или другие гиперпролиферативные заболевания, ассоциированные с экспрессией или сверхэкспрессией AXL.
В другом аспекте антитела настоящего изобретения могут использоваться для введения совместно с антибластомным агентом для лечения одного из вышеуказанных нарушений.
Совместное введение в используемом здесь значении включает введение антитела настоящего изобретения вместе с антинеопластическим агентом, предпочтительно антинеопластическим агентом, индуцирующим апоптоз. Термин совместное введение дополнительно включает введение антитела настоящего изобретения и антинеопластического агента, предпочтительно антинеопластического агента, индуцирующего апоптоз, в виде одной композиции или в виде двух или более раздельных композиций. Совместное введение включает введение антитела настоящего изобретения вместе с антинеопластическим агентом, предпочтительно антибластомный агент, индуцирующим апоптоз, одновременно (т.е. в одно время) или последовательно (т.е. с интервалами).
Изобретение дополнительно относится к молекуле нуклеиновой кислоты, кодирующей антитело, фрагмент антитела или его производное изобретения. Молекулой нуклеиновой кислоты изобретения, кодирующей вышеописанное антитело, фрагмент антитела или его производное, может быть, напр., ДНК, кДНК, РНК, или синтетически полученная ДНК или РНК, или рекомбинантно полученная химерная молекула нукл