Соединения-диады, содержащие в молекуле азогруппы и ядра ферроцена, и их использование в качестве тушителей флуоресценции
Иллюстрации
Показать всеИзобретение относится к способу получения новых соединений-диад (I) с двумя разными, не сопряженными друг с другом, хромофорными фрагментами, содержащими азогруппы и остатки ферроцена, и их использованию для тушения флуоресценции флуорофоров.
где Fc - ферроценил; R1 - Н или Fc; R2 - H или орто- или пара-гидрокси-; R3 - орто- или мета-, или пара-нитро-, или орто- или мета-, или пара-нитрофенилазо-, или пара-N,N-диметиламино-, или пара-карбокси-; L - группа пара-карбамоилвинилиденацетофенона или пара-карбоксамидовинилиденацетофенона, или пара-N-(2-карбамоилэтил)-карбоксамидовинилиденацетофенона, или пара-(4-[метиламино]бутокси)-винилиденацетофенона, или N,N-ди[4{1-(пара-винилиденацетофениламино)-метил-1,2,3-триазолил}бутил]аминогруппа. Способ получения (I) включает альдольно-кротоновую конденсацию ферроценальдегида с пара-замещенным ацетофеноном и взаимодействие полученного ферроценилиденацетофенона (2) с азосоединением, или введение в (2) реакционноспособных групп и азосочетание с диазосолью. Соединения-диады (I) имеют высокие коэффициенты молярной экстинкции, широкий спектр поглощения и электроактивность. Описан также способ тушения флуоресценции флуорофоров в двуцепочечных структурах нуклеиновых кислот с использованием (I). Показана эффективность (I) для тушения флуорофоров в растворе и в составе нуклеиновых кислот в широком спектральном диапазоне, что позволяет использовать (I) для мечения биологических макромолекул и создания олигонуклеотидных гибридизационных зондов для молекулярных методов диагностики. 2 н.п. ф-лы, 8 ил., 2 табл., 8 пр.
Реферат
Изобретение относится к способу получения и использования в качестве тушителей флуоресценции сложных веществ-диад, имеющих в своей молекулярной структуре две функциональные части, общей формулы (I):
где
Fc представляет собой ферроценил-радикал следующего строения:
R1 является атомом водорода, или Fc,
R2 является атомом водорода, или орто- или пара-гидроксилом,
R3 является орто-, или мета- или пара-нитрогруппой, или орто-, или мета- или пара-нитрофенилазогруппой, или пара-N,N-диметиламиногруппой, или пара-карбоксигруппой,
L является пара-карбамоилвинилиденацетофеноновой группой, или пара-карбоксамидовинилиденацетофеноновой группой, или пара-N-(2-карбамоилэтил)-карбоксамидовинилиденацетофеноновой группой, или пара-(4-[метиламино]бутокси)-винилиденацетофеноновой группой, или N,N-ди[4{1-(пара-винилиденацетофениламино)-бутил-1,2,3-триазолил}метил]аминогруппой.
Сочетание в молекулах двух функциональных частей: азогруппы (одна или более) и остатков ферроцена (один или несколько), являющихся хромофорами, обеспечивает уникальные фотофизические и фотохимические свойства данных веществ: высокие коэффициенты молярной экстинкции, широкий спектр поглощения, который представляет собой алгебраическую сумму спектров поглощения составных частей (азокрасителя и ферроцена), электроактивность. Предлагаемые соединения способны тушить флуоресценцию большого числа флуорофоров в широком спектральном диапазоне и могут быть использованы для мечения различных молекул, в том числе биологических, придавая им необычные свойства и позволяя анализировать один и тот же меченый образец с помощью различных физико-химических методов анализа одновременно, например, фотометрических и электрохимических.
Описание чертежей
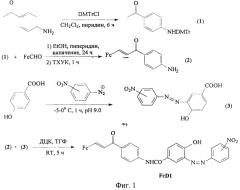
Фиг.1. Схема синтеза диады FcD1.
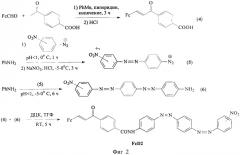
Фиг.2. Схема синтеза диады FcD2.
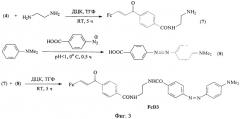
Фиг.3. Схема синтеза диады FcD3.
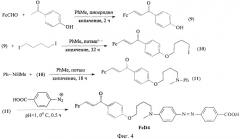
Фиг.4. Схема синтеза диады FcD4.
Фиг.5. Схема синтеза диады FcD5.
Табл.1. Полосы поглощения и динамические константы тушения флуоресценции диад.
Фиг.6. Схема синтеза меченых нуклеиновых кислот.
Табл.2. Использованные олигонуклеотиды.
Фиг.7. Строение олигонуклеотидных дуплексов.
Фиг.8. Профили плавления олигонуклеотидных дуплексных структур.
Описание изобретения
Флуоресцентные методы анализа широко используются в научных исследованиях и на практике. В настоящее время предложены сверхчувствительные методы, позволяющие оперировать единичными молекулами за счет улавливания отдельных квантов светового излучения. Их современные версии являются очень гибкими и позволяют проводить анализ в режиме реального времени с помощью специальных молекулярных систем, которые обеспечивают переключение интенсивности флуоресценции и дают сигнал флуоресценции за счет процессов внутри- и межмолекулярного переноса энергии. Известны несколько механизмов переноса энергии флуоресценции, но в основном используются молекулярные системы с резонансным переносом энергии флуоресценции (FRET) [1, 2]. FRET основан на передаче энергии возбуждения между двумя молекулами или фотоактивными группами, которые выступают в качестве донора и акцептора (тушителя) энергии соответственно.
Наиболее используемыми в биоаналитических приложениях тушителями являются азосоединения (азокрасители): Dabcyl, групп BHQ [3, 4], RTQ [5], LQ [6], QSY [7] и ряд других [8]. В последние годы созданы составные тушители ("супертушители") для взаимодействия с одним флуорофором, что приводит к большей эффективности тушения и увеличивает чувствительность и специфичность анализа. Так, была сравнена эффективность тушения флуорофора FAM в молекулярных биконах с одним, с двумя и с тремя тушителями Dabcyl по 5'-концу [9]. Для тушения люминесценции можно также использовать ферроцен [10]. Известно, что он активно тушит люминесценцию флуорофоров за счет способности дезактивировать как синглетные [11, 12], так и триплетные [13] их состояния. Однако в настоящее время ферроцен при исследовании биообъектов используется исключительно в качестве электроактивной метки [14-20]. Практически нет данных по поводу применимости ферроцена в качестве тушителя флуоресценции красителей, рутинно используемых для мечения нуклеиновых кислот, хотя для ряда приложений производные ферроцена широко используются в люминесцентных системах благодаря их высокой стабильности в видимой области спектра [21-29]. В литературе нет информации об использовании сложных составных соединений: диад, триад и т.д., содержащих в молекуле одновременно остатки ферроцена и азогруппу.
Отличием предлагаемого нами подхода к тушению флуоресценции является использование в качестве тушителей сложных веществ-диад, имеющих в своей молекулярной структуре две функциональные части и являющиеся хромофорами с высокими молярными коэффициентами экстинкции. Нами с использованием методов органической и биоорганической химии были синтезированы диады FcD1-FcD5 на основе производных ферроцена и азокрасителей по схемам, приведенным в разделе «Чертежи» (фиг.1-5).
Для FcD1-FcD5 характерно наличие протяженной системы сопряженных двойных связей в азо-фрагменте, которая обеспечивает эффективную делокализацию электронной плотности π-связей. Азогруппа обусловливает появление интенсивной полосы π→π* перехода в области 280-320 нм. Введение электронодонорного заместителя в сопряженное с азогруппой положение смещает полосу π→π* перехода в видимую область спектра, введение электроноакцепторного заместителя в сопряженное с азогруппой положение второго ароматические остатка еще более усиливает это смещение [30]. Присутствие в полученных красителях электроноакцепторных заместителей: нитро-, карбоксигрупп и электронодонорной диметиламинной группы обусловливает эффективное смещение электронной плотности связей в молекулах, что обеспечивает наличие полосы поглощения в видимой области спектра и высокий молярный коэффициент экстинкции. Ферроценовый фрагмент также является хромофором; кроме того, в нем имеется сопряжение плотности ядра с кратной связью и кетогруппой. Сами по себе производные ферроцена в целом уступают по величине молярного коэффициента экстинкции и эффективности тушения азокрасителям. Как азокрасители, так и производные ферроцена имеют характеристичные полосы поглощения, что обусловливает способность тушения ими только определенных флуорофоров. Объединение двух хромофорных систем в одной молекуле теоретически должно обеспечивать более широкую полосу поглощения для конъюгата и высокие значения молярного коэффициента экстинкции и эффективности тушения флуоресценции, величина которых будет зависеть от характеристик исходных веществ.
Структура соединений FcD1-FcD5 такова, что оба хромофорных фрагмента, во-первых, не обладают собственной флуоресценцией, во-вторых, не имеют сопряжения. Это позволяет считать, что между ними нет взаимодействия и переноса энергии, и спектры поглощения данных веществ будут представлять собой простую алгебраическую сумму спектров поглощения составляющих. Для подтверждения этого были исследованы спектральные характеристики и найдены константы тушения флуоресценции соединений FcD1-FcD5 (табл.1). Оказалось, что для всех соединений характерна уширенная полоса поглощения в электронном спектре в области 470-560 нм. Для FcD1 и FcD3 полоса поглощения имеет два пика.
Тушение может иметь статическую или динамическую природу; в случае ферроцена оно может происходить либо за счет резонансного переноса энергии флуоресценции (FRET), либо за счет переноса электрона. Для эффективного тушения максимум испускания флуорофора и максимум поглощения тушителя должны частично или полностью перекрываться. Нами было изучено тушение диадами флуоресценции 5-карбоксифлуоресцеина (FAM, λисп=520 нм) и Х-родамина (ROX, λисп=605 нм), наиболее часто используемых в качестве репортерных групп при исследовании нуклеиновых кислот. Для указанных красителей были получены значения интенсивности флуоресценции в присутствии разных количеств тушителя. По полученным данным на основании уравнения Штерна-Фольмера были найдены константы тушения флуоресценции (табл.1). Наибольшей константой тушения флуоресценции из синтезированных диад обладает FcD5. Для данного соединения был получен активированный эфир FcD5-NHS и меченый им олигонуклеотид I-Q (фиг.6).
Для изучения возможности тушения флуоресценции диадами в составе нуклеиновых кислот были сконтруированы олигонуклеотидные дуплексные структуры A-D (фиг.7). В них FcD5 и флуоресцентный краситель (FAM или ROX) расположены максимально близко по одну сторону дуплекса на разных цепях. Для указанных структур получены профили плавления (фиг.8). Наличие однонуклеотидной замены дестабилизирует вторичную структуру, что приводит к понижению температуры (дуплексы В и D).
Таким образом, предложенные диады могут выступать эффективными тушителями флуоресценции, в том числе в составе биомакромолекул: белков, нуклеиновых кислот и др. Кроме того, наличие ферроценового ядра в молекулах диад обусловливает их электроактивность, поэтому данные соединения - перспективные предшественники нового типа репортерных групп, которые сочетают как электроактивные свойства, так и способность к тушению флуоресценции. Это позволяет использовать одновременно различные аналитические методы для изучения одних и тех же биологических образцов, меченых только одной диадой.
Предлагаемые способы синтеза диад и использования их в качестве тушителей флуоресценции иллюстрируются приведенными ниже примерами.
Пример 1. Синтез (2, или 3, или 4)-нитро-2'-окси-5'-[N-(пара-ферроценилиденацетофенил)-карбоксамидо]азобензола (FcD1).
К 1.0 г 4,4-диметокситритилхлорида прилили 9 мл дихлорметана, 0 5 мл пиридина и раствор 0.6 г n-аминоацетофенона в 6 мл дихлорметана. Реакционную смесь перемешивали в течение 4.5 ч, после чего раствор упаривали. Получили 1.1 г N-DMTr-n-аминоацетофенона (1) в виде масла. Ферроценальдегид в количестве 0.46 г и 0.98 г (1) растворяли в 4 мл этанола, приливали 200 мкл пиперидина и кипятили с обратным холодильником 24 часа Затем к реакционной смеси присыпали 0.3 г трихлоруксусной кислоты и интенсивно перемешивали 1 ч, приливали 5 мл воды, отделяли органическую фазу. Водный слой экстрагировали дихлорметаном (2×5 мл), органические фазы объединяли, промывали водой (2×5 мл), водную фазу удаляли. Органический слой упаривали, к остатку приливали 5 мл этилацетата и делили на колонке (адсорбент Al2O3, элюент этилацетат:гексан 1:1). Продукт (2) представляет собой темно-фиолетовое масло, Rf=0.38 (silufol, гексанэтилацетат 1:1). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 4.15 (с, 5Н, С6); 4.45 (т, 2Н, С3,4); 4.75 (д, 2Н, С2,5), 6.65 (д, 2Н, CAr2,6); 7.4 (д, 1Н, С8, J 15.3); 7.6 (д, 1H, C7, J 145:3); 7.75 (д, 2Н, CAr3,5).
К охлажденным до 0°C растворам 3 г нитроанилинов в 36 мл 10% HCl и 30 мл H2O постепенно приливали раствор 1,5 г NaNO2 в 10 мл Н2О. Держали при комнатной температуре 40 мин и приливали при охлаждении к растворам 3 г 4-оксибензойной кислоты в 3,5 мл 20% NaOH и 10 мл Н2О. Держали при охлаждении 40 мин, отфильтровывали выпавшие осадки и сушили их на воздухе. Полученные азосоединения (3) выделяли колоночной хроматографией (гексан:этилацетат 1:2). 0,16 г (2) и 0,13 г (3) растворяли в 15 мл безводного ТГФ, добавляли 0,1 г ДЦК. Реакцию проводили при комнатной температуре в течение 5 ч, затем растворитель упаривали. Полученный продукт делили на колонке силикагель, гексан-этилацетат 3:1→1:2. Масс-спектр: m/z 599 [М-Н]+.
Пример 2. Синтез 4-(2', или 3', или 4')-нитрофенилазо-4'-(пара-ферроценилиденацето-фенилкарбоксамидо)азобензола (FcD2).
0,64 ферроценальдегида и 0,5 г 4-ацетилбензойной кислоты растворили в 20 мл толуола, добавили 400 мкл пиперидина и молекулярные сита (3А). Реакционную смесь нагревали 3 ч, после чего добавили 2 мл 10%-ного раствора HCl и фильтровали осадок на фильтре Шотта, несколько раз промывая водой. Получены кристаллы (4) фиолетового цвета Rf=0,3 (этанол:хлороформ 1:1). Спектр ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 4.2 (с, 5Н, С5Н5); 4.6 (с, 2Н, С3,4); 4.8 (с, 2Н, С2,5); 7.4 (д, 1H, C1H, J 15,3); 7.6 (д, 1Н, С2Н, J 15.3); 8.1-8.3 (м, 4Н, 4CArH). Соединение (6) получали двукратным азосочетанием анилина с нитроанилинами согласно примера 1 с образованием промежуточного иона (5). Далее FcD2 получен конденсацией в присутствии ДЦК по аналогии с примером 1. Масс-спектр: m/z 686 [М-Н]+.
Пример 3. Синтез 4-N,N-диметидамино-4'-[N-{2-(пара-ферроценилиденацетофенил-карбоксамидо)этил}карбамоил]азобензола (FcD3).
Соединения (7), (8) И FcD3 получали по аналогии с примером 1. Масс-спектр: m/z 652 [М-Н]+. Пример 4. Синтез 4-карбокси-4'-N-метил-N-[4-бутокси-(пара-ферроценилиденацетофенил)]-азобензола (FcD4).
Соединение (9) получали альдольно-кротоновой конденсацией по аналогии с примером 2. Получено воскообразное вещество темно-фиолетового цвета. Rf=0,58 (дихлорметан:изопропанол 3:1). Спектр ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц) 4.25 (с, 5Н, С5Н5), 4.45 (с, 2Н, С3,4); 4.7 (с, 2Н, С2,5); 7.35 (д, 1H, С1Н, J 13,2); 7.6 (д, 1Н, С2Н, J 13.2), 8.1-8 3 (м, 4Н, 4CArH).
0,3 г (9) и 200 мкл 1,4-дийодбутана растворяли в толуоле, добавляли 0,12 г K2CO3 и кипятили 32 ч. Целевой продукт (10) выделяли колоночной хроматографией (гексан:этилацетат 1:1). Получили игольчатые кристаллы медного цвета Rf=0,65 (гексан:этилацетат 2:1). Соединение (10) вводили во взаимодействие с N-метиланилином в эквимолярном соотношении в толуоле при кипячении в течение 18 ч в присутствии поташа Горячую реакционную массу сливали с осадка, растворитель упаривали. Остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат 1:1). Получили вещество (11) кирпичного цвета. Rf=0,45 (гексан: эти л ацетат 2:1). Соединение (11) вводили в реакцию азосочетания с диазониевой солью n-аминобензойной кислоты. Целевой продукт выделяли флеш-хроматографией (гексан:хлороформ 1:3). Масс-спектр: m/z 640 [М-Н]+.
Пример 5. Синтез 4-карбокси-4'-N,N-ди[4-{1-(пара-ферроценилиденацетофениламино)-бутил-1,2,3-триазолил}метил]аминоазобензола (FcD5).
Соединение (13) получили по аналогии с примером 4 в виде воскообразного вещества темно-фиолетового цвета. На его основе получено азидопроизводное (14) взаимодействием с NaN3 в водно-органической среде. Полным алкилированием анилина пропаргилбромидом синтезировано (15), которое далее по реакции [3+2]-диполярного циклоприсоединения, катализируемого солями меди (I), приводит к аддукту (16). Для этого смешали 15 мл ДМСО, 30 мл водного ацетата триэтиламмония (0,2 М, pH 7), 20 мл 0.1 М раствора (14) в ДМСО и 12.6 мл 8 мМ водного раствора пентагидрата сульфата меди (II), добавляли 8.0 мл 12 5 мМ водного раствора аскорбиновой кислоты и 20 мл 0.1 М раствора (15) в ДМСО. Смесь продували азотом и выдерживали при комнатной температуре в течение суток, после чего смесь вылили в 100 мл воды, добавили 10 мл насыщенного раствора бикарбоната натрия Продукт реакции экстрагировали этилацетатом (3×20 мл), органические фазы сушили над MgSO4, растворитель упаривали. Сухой остаток хроматографировали на силикагеле, элюент изопропанол-дихлорметан 1:1. Последующее азосочетание по аналогии с примером 4 дает FcD5. Масс-спектр: m/z 1088 [М-Н]+.
Пример 6. Электронные спектры поглощения соединений FcD1-FcD5 и исследование эффективности тушения ими флуоресценции красителей в растворе.
Электронные спектры соединений FcD1-FcD5 снимали на УВИ-спектрометре UV-3600 (Shimadzu, Япония) в дипазоне 190-700 нм. Брали растворы указанных соединений в абсолютном этаноле, концентрация 1·10-4 М. Для красителей FAM (λисп=520 нм) и ROX (λисп=605 нм) была получена интенсивность флуоресценции в присутствии различных количеств соединений FcD1-FcD5. Были использованы 2·10-6 М растворы в этаноле Измерение интенсивности флуоресценции проводили на люминесцентном спектрометре LS 55 (PerkinElmer, США). На основании полученных данных были построены кривые тушения в координатах уравнения Штерна-Фольмера и найдены значения констант тушения
Пример 7. Синтез меченых нуклеиновых кислот.
К раствору 1 ммоль FcD5 в 5 мл сухого ТГФ (содержание воды менее 0,003%) приливали раствор 115 мг N-гидроксисукцинимида (NHS, 1 ммоль) и 206 мг дициклогексилкарбодиимида (DCC, 1 ммоль) в 5 мл ТГФ. Реакционную смесь перемешивали при комнатной температуре в течение 5 ч. N,N'-Дициклогексилмочевину высаживали абсолютно сухим диэтиловым эфиром. Смесь выдерживали еще в течение 18 ч при 0°C; выпавшие кристаллы эфира FcD5-NHS отфильтровали, промыли 1 мл диэтилового эфира и сушили в эксикаторе над CaCl2. Выход 65%. Получены темно-бордовые кристаллы
Для получения меченого олигонуклеотида I-Q к раствору 5.5 пмоль амино-олигонуклеотида I в 20 мкд 0.5 М карбонатногомбуфера (NaHCO3/Na2CO3, pH 9) прилили раствор 1 мг FcD5-NHS в 10 мкл ДМСО. Реакционную смесь перемешивали в течение 18 ч при комнатной температуре. Затем прилили 1 мл спирта и выдерживали при -20°C 2 ч, после чего центрифугировали (14000 rpm, 15 мин). Спиртовую фазу отбирали, осадок сушили, ресуспензировали в 100 мкл воды высшей категории качества. Меченый олигонуклеотид выделяли с помощью ВЭЖХ-системы LC-20AT (Shimadzu, Япония).
Пример 8. Исследование эффективности тушения флуоресценции диадой FcD5 в дуплексах
Тушение флуоресценции красителей FAM и ROX диадой FcD5 в дуплексных структурах было исследовано путем их плавления в ДНК-амплификаторе iCycler iQ (BioRad, США) Образцы объемом 30 мкл содержали 0.15 о.е олигонуклеотида I-Q и 0.03 о.е одного из флуоресцентно меченных олигонуклеотидов I-F, II-F, I-R или II-R в 1х SSC-буфере Шаг изменения температуры задавался равным 0.5°C с интервалом 10 с, диапазон изменения температуры от 10 до 95°C.
Литература, принятая во внимание:
1) Schiffrin D., Wilson R. Assay system and novel labelled compounds for use therewith / US Patent 6,576,475. - 2003.
2) Quin Ch., Gregory S., Mandyam R., Brotsky Ch., Cabradilla C.. Use of dark-quenched FRET probes in real-time PCR // Application note. - 2001. - V.7. - P.34.
3) www.biosearchtech.com
4) Tyagi S., Bratu D.P., Kramer F.R. Black Hole Quencher Dyes // Nature Biotechnology. - 1998. - V.16. - P.49-53.
5) www.syntol.ru
6) May J.P., Brown L.J., Rudloff I., Brown T. A new dark quenchers for use in genetic analysis // Chem. commun. - 2003. - V.11. - P.970-971.
7) www.invitrogen.com
8) Laikhter A., Behlke M.A., Walder J., Roberts K.W., Yong Y. Fluorescence quenching azo dyes, their methods of preparation and use / US Patent 7,439,341, - 2008.
9) James Y. Ch., Lin Hui, Tan Weihong. Molecular assembly of superquenchers in signaling molecular interactions // J. Am. Chem. Soc. - 2005. - V.127. - P.12772-12773.
10) Fery-Forgues S., Delavaux-Nicot B. Ferrocene and ferrocenyl derivatives in luminescent systems // Journal of Photochemistry and Photobiology - 2000. - V.132. - P.137-159.
11) Fery-Forgues S., Delavaux-Nicot В., Lavabre D., Rurack K. Intermolecular quenching of excited singlet states by ferrocenyl derivatives: study with ketocyanine dyes // J. of Photochem. Photobiol. A. - 2003. - V.155. - P.107-114.
12) Giasson R., Lee E.J., Zhao X., Wrighton M.S. Inter- and intramolecular quenching of the singlet excited state of porphyrins by ferrocene // J. Phys. Chem. - 1993. - V.97 - P.2596-2601.
13) Xia X.B., Ding Z.F., Liu J.Z. Quenching by unsaturated ferrocene and ferrocenium derivatives of the luminescence of Ru(phen)32+// Journal of Photochemistry and Photobiology - 1995. - V.88. - P.81-84.
14) Anne A., Demaille C. Dynamics of Electron Transport by Elastic Bending of Short DNA Duplexes. Experimental Study and Quantitative Modeling of the Cyclic Voltammetric Behavior of 3-Ferrocenyl DNA End-Grafted on Gold // J. Am. Chem. Soc - 2006 - V 128. - P.542-557.
15) Seiwert В., Karst U. Ferrocene-based derivatization in analytical chemistry // Anal Biochem - 2008. - V.390. - PP.181-200.
16) Anne A., Bonnaudat C, Demaille C., Wang K. Enzymatic Redox 3-End-Labeling of DNA Oligonucleotide Monolayers on Gold Surfaces Using Terminal Deoxynucleotidyl Transferase (TdT)-Mediated Single Base Extension // J. Am. Chem. Soc. - 2007. - V.129. - P.2734-2735.
17) Brazill S.A., Kuh W.G. Capillary Gel Electrophoresis with Sinusoidal Voltammetric Detection: A Strategy To Allow Four-"Color" DNA Sequencing // Anal. Chem. - 2001. - V.73. - P.4882-4890.
18) Gibbs J.M., Park S.-J, Anderson D.R., Watson K.J., Mirkin C.A, Nguyen S.T. Polymer-DNA Hybrids as Electrochemical Probes for the Detection of DNA // J. Am. Chem. Soc. - 2005. - V.127. - P.1170-1178.
19) Staveren D.R, Metzler-Nolte N. Bioorganometallic Chemistry of Ferrocene // Chem. Rev. - 2004. - V.104. - P.5931-5985.
20) Swami N.S., Chou C.-F., Terberueggen R. Two-Potential Electrochemical Probe for Study of DNA Immobilization // Langmuir. - 2005. - V.21. - P.1937-1941.
21) Cao W., Ferrance J.P., Demas J., Landers J.P. Quenching of the Electrochemiluminescence of Tris(2,2-bipyridine)ruthenium (II) by Ferrocene and Its Potential Application to Quantitative DNA Detection // J. Am. Chem. Soc. - 2006. - V.128. - P.7572-7578.
22) Thornton N.B., Wojtowipz H., Netzel Т., Dixon D.W. Intramolecular quenching of porphyrin fluorescence by a covalently linked ferrocene in DNA scaffolding // J.Phys. Chem. - 1998. - V.102. - P.2101-2110.
23) Wang X., Yun W., Dong P., Zhou J., He P., Fang Y. A Controllable Solid-State Ru(bpy)32+Electrochemiluminescence Film Based on Conformation Change of Ferrocene-Labeled DNA Molecular Beacon // Langmuir. - 2008. - V.24. - P.2200-2205.
24) Wu Z.-S., Guo M.-M., Zhang S.-B., Chen C.-R., Jiang J.-H., Shen G.-L., Yu R.-Q. Reusable Electrochemical Sensing Platform for Highly Sensitive Detection of Small Molecules Based on Structure-Switching Signaling Aptamers // Anal. Chem. - 2007. - V.79. - P.2933-2939.
25) Wang X., Dong P., Yun W., Xu Y., He P., Fang Y. Detection of T4 DNA ligase using a solid-state electrochemiluminescence biosensing switch based on ferrocene-labeled molecular beacon // Talanta. - 2010. V.80. P.1643-1647.
26) Zhang J., Chen P., Wu X.Y., Chen J.H., Xu L.J., Chen G.N., Fu F.F. A signal-on electrochemiluminescence aptamer biosensor for the detection of ultratrace thrombin based on junction-probe // Biosens. Bioelectron. - 2011. - V.26. - P.2645-2650.
27) Wang X., Dong P., He P., Fang Y. A solid-state electrochemiluminescence sensing platform for detection of adenosine based on ferrocene-labeled structure-switching signaling aptamer // Anal. Chim. Acta. - 2010. V.658. P.128-132.
28) Shah A., Zaheer M., Qureshi R., Akhter Z., Nazar M.F. Voltammetric and spectroscopic investigations of 4-nitrophenylferrocene interacting with DNA // Spectrochim. Acta. Part A. 2010. - V.75. - P.1082-1087.
29) Morita K., Sato Y., Seino Т., Nishizawa S., Teramae N. Electrochemical and fluorescence detection of cytosine-related SNPs using a ferrocenyl naphthyridine derivative // Nucleic Acids Symp. Ser. - 2007. No.51. P.295-296.
30) Владимиров Ю.А. Физико-химические основы фотобиологических процессов / Учебник для вузов. - М.: Дрофа. - 2006. - С.62-67.
1. Способ получения соединений-диад общей формулы (I): , гдеFc представляет собой ферроценил-радикал следующего строения: ,R1 является атомом водорода или Fc,R2 является атомом водорода, или орто- или пара-гидроксилом,R3 является орто-, или мета- или пара-нитрогруппой, или орто-, или мета- или пара-нитрофенилазогруппой, или пара-N,N-диметиламиногруппой, или пара-карбоксигруппой,L является пара-карбамоилвинилиденацетофеноновой группой, или пара-карбоксамидовинилиденацетофеноновой группой, или пара-N-(2-карбамоилэтил)-карбоксамидовинилиденацетофеноновой группой, или пара-(4-[метиламино]бутокси)-винилиденацетофеноновой группой, или N,N-ди[4{1-(пара-винилиденацетофениламино)-метил-1,2,3-триазолил}бутил]аминогруппой,характеризующийся тем, что для их получения используют в качестве исходного соединения ферроценальдегид, вовлекаемый в реакцию альдольно-кротоновой конденсации с пара-замещенным ацетофеноном с последующим взаимодействием полученного ферроценилиденацетофенона с азосоединением по реакции конденсации амино- и карбоксигруппы соответственно, или с последующим введением в молекулу ферроценилиденацетофенона реакционноспособной группы и взаимодействием по этой группе с диазосолью по реакции азосочетания, приводящим к созданию молекул с двумя разными, не сопряженными друг с другом, хромофорными фрагментами, сочетание которых в одной молекуле обеспечивает высокие коэффициенты молярной экстинкции, широкий спектр поглощения и электроактивность получаемых веществ.
2. Способ тушения флуоресценции флуорофоров в двуцепочечных структурах нуклеиновых кислот, отличающийся тем, что в качестве тушителей используют соединения-диады на основе ферроцена и азокрасителей, полученные по п.1.