Способ гибридного аорто-бедренного репротезирования при инфекции сосудистых имплантов
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к сердечно-сосудистой хирургии. Выполняют выделение анастомозов инфицированного аорто-бифеморального шунта. Выделяют бифуркацию аорты и начальные отделы общих подвздошных артерий. После системной гепаринизации и пережатия артериальных сосудов, находящихся в зоне хирургического интереса, иссекают анастомозы инфицированного протеза и окружающие ткани. После чего в ортотопной позиции формируют анастомозы гомографта с аортой и общими подвздошными артериями, ретроградно через артериотомические отверстия в бедренных артериях выполняют реканализацию со стентированием подвздошных артерий пациента. После контрольной ангиографии дефекты в бедренных артериях замещают вставками из гомографта. Способ позволяет выполнить адекватное восстановление аорто-бедренного артериального русла в ортотопной позиции с использованием тканей, резистентных к реинфекции, кроме того, осуществить комбинацию реканализации со стентированием. 1 пр., 5 ил.
Реферат
Изобретение относится к области медицины, а именно к сердечно-сосудистой хирургии, и может быть использовано при лечении инфекций сосудистых имплантов в аорто-бедренной позиции.
Инфекция сосудистого протеза в аортальной позиции одно из наиболее опасных осложнений в сосудистой хирургии, представляющее большие трудности в лечении [1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11].
По данным литературы, частота подобных осложнений имеет место от 0,2 до 5% случаев после реконструктивных операций с применением искусственных имплантов [4, 5, 6, 7, 8, 10, 12, 13], а смертность от 25 до 75% при риске потери конечности 60% [14].
На основании клинических данных и лабораторных исследований были выработаны основные принципы лечения [15] - удаление инфицированного протеза, полное хирургическое удаление омертвевших и инфицированных тканей для обеспечения заживления раны, сохранение или восстановление кровотока в дистальное русло, интенсивная и длительная антибиотикотерапия для лечения сепсиса и профилактики вторичной инфекции протеза.
При этом при полном удалении инфицированного протеза особую сложность составляет восстановление кровотока в дистальное русло в связи с высокой подверженностью искусственных имплантов к реинфекции [1,15,16].
При полном удалении инфицированного протеза для восстановления кровотока в нижних конечностях существуют сторонники как экстраанатомического шунтирования, так и шунтирования в ортотопной позиции (in situ).
Однако ряд авторов находят не совсем оптимистичными результаты экстраанатомических операций.
Так, R. Yaeger и соавт. [15] отмечают, что проходимость аксиллофеморальных шунтов, имплантированных по поводу инфицированного аортального протеза, ниже проходимости первичных аксиллофеморальных шунтов [11]. Кроме того, от 30 до 43% таких шунтов становятся несостоятельными в отдаленном периоде, возникает необходимость повторных операций на самом шунте или замены его другим протезом для достижения хороших отдаленных результатов и сохранения конечности [17]. Реинфекция экстраанатомических протезов составляет 10-20% больных [18]. Другая проблема экстраанатомических шунтов - инфицирование в зоне перевязанной аорты, частота которого составляет около 10%, и, как следствие, - разрыв перевязанной аорты встречается в 20% случаев и обычно заканчивается фатально [18].
Большое количество осложнений и низкий уровень выживаемости при экстраанатомическом шунтировании привело к развитию направления ортотопного репротезирования.
Основными достоинствами методики in situ являются адекватная реваскуляризация конечностей и лучшие отдаленные результаты анатомических реконструкций по сравнению с экстраанатомическими [19]. Для повторной операции используют как синтетические, так и биологические материалы. В качестве биологического материала применяют глубокие вены конечностей [18, 19, 20].
Суть метода заключается в формировании аутовенозного аорто-бифеморального графта из бедренного венозного сегмента пациента (нео аорто-подвздошная система (NAIS)), описанное Ciaget et al. [17, 20].
При оценке ранних и отдаленных результатов по данным Beck et al. первичная проходимость импланта составляла 97%, проходимость импланта в течение 5 лет наблюдалась у 82% больных [3]. Риск реинфекции импланта крайне низок, но по данным Modrall JG et al. в послеоперационном периоде у каждого четвертого пациента послеоперационное течение осложнилось компартмент синдромом нижних конечностей и венозной недостаточностью нижних конечностей [16].
Известно использование гомографтов в качестве импланта при повторных реконструкциях аорто-бедренного сегмента. Послеоперационная летальность в течение 30 дней после репротезирования гомографтом составила 5,2-6%. В течение первого года 7-12%, в течение 3 лет - 20%. Сохранение нижних конечностей на протяжении 3 лет наблюдения составляет около 87% [17, 21, 22, 23].
Прототипом изобретения является репротезирование аорто-бедренного сегмента с использованием гомографта, предложенное рядом авторов [24].
Недостатками данной методики являются: сложность проведения бранш гомографта в паховые области в связи с рубцовым процессом, высокий риск травмы органов, расположенных в непосредственной близости к сосудистому пучку. Большая площадь контаминации гомографта инфекцией. Возможна нехватка длины бранш гомографта для транспонирования в паховые области.
Цель изобретения - ликвидация инфекционного очага в забрюшинном пространстве и достижение адекватного восстановления кровотока в артерии нижних конечностей тканями, резистентными к инфекции, устранение недостатков известного способа.
Поставленная цель достигается с помощью эндоваскулярной реканализации собственных подвздошных артерий со стентированием и репротезированием инфраренального сегмента аорты гомографтом.
Способ осуществляется следующим образом.
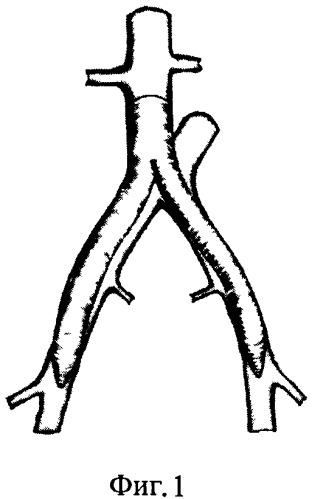
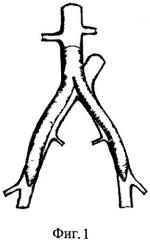
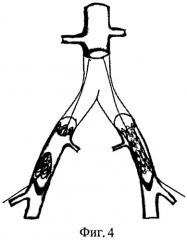
Под эндотрахеальным наркозом пациенту выполняют выделение анастомозов инфицированного аорто-бифеморального шунта, выделяют бифуркацию аорты и начальные отделы общих подвздошных артерий (фиг.1).
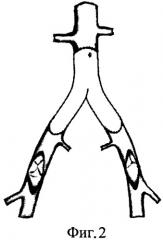
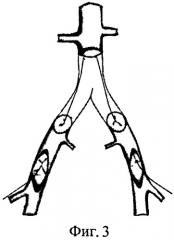
После системной гепаринизации и пережатия артериальных сосудов, находящихся в зоне хирургического интереса, иссекают анастомозы инфицированного протеза и окружающие ткани. После чего в ортотопной позиции формируют анастомозы гомографта с аортой и общими подвздошными артериями (фиг.2). Ретроградно через артериотомические отверстия в бедренных артериях выполняют реканализацию (фиг.3) со стентированием подвздошных артерий (фиг.4). После контрольной ангиографии дефекты в бедренных артериях замещают вставками из гомографта (фиг.5).
Отличием данной методики является то, что путем гибридного оперативного вмешательства осуществляют комбинацию реканализации собственных подвздошных артерий пациента и репротезирование инфраренального сегмента аорты гомографтом. Пример выполнения способа.
Больной С. История болезни №14560, 64 лет, поступил в центр сосудистой и гибридной хирургии с жалобами на боли в правой паховой области в покое, при пальпации определяется пульсирующее образование в правой паховой области, в месте послеоперационного рубца.
С 1999 года - страдает хронической ишемией нижних конечностей в виде перемежающейся хромоты. Прогрессирование симптомов ишемии с весны 2007 года. Был обследован, по данным УЗИ выявлено подпочечная окклюзия аорты и окклюзии подвздошных артерий, 25.12.2007 г.выполнена операция: тромбэктомия из инфраренального отдела аорты, аорто-бедренное бифуркационное протезирование бифуркационным протезом "Васкутек" 16∗8∗8, с реимплантацией нижней брыжеечной артерии в протез. В июле 2008 г. при выполнении УЗИ артерий нижних конечностей выявлен стеноз дистального анастомоза. Выполнена операция: стентирование правой почечной артерии и правого дистального анастомоза аорто-бедренного шунта. Течение послеоперационного периода без осложнений. В 2009 г. рецидивировала клиника критической ишемии правой нижней конечности, по данным УЗИ был выявлен тромбоз аорто-бедренного шунта. В мае 2009 г.была выполнена операция: тромбэктомия из правой бранши бифуркационного протеза. Реконструкция дистального анастомоза справа с протезно-общебедренной надставкой синтетическим протезом. Течение послеоперационного периода с формированием лигатурного свища правого бедра.
В ноябре 2011 г. манифестировало артериальное кровотечение из свища правой паховой области, по поводу чего был госпитализирован в стационар по месту жительства, попытки механической остановки кровотечения в условиях стационара по месту жительства безрезультатны. Пациент в экстренном порядке переведен в ФГБУ ННИИПК.
При поступлении по данным УЗДС артерий нижних конечностей в области дистального анастомоза справа пульсирующая гематома объемом около 20 мл с пристеночным тромбозом. Гематома забрюшинного пространства больших размеров в области бифуркации и левой бранши протеза.
По данным артериографии: аорто-бифеморальный протез функционирует, в области дистального анастомоза справа определяется ложная аневризма с паравазальным выходом контраста, отрыв бранши протеза в области дистального анастомоза справа.
Пациент оперирован в экстренном порядке.
Интраоперационно: из рубцовых тканей выделен левый дистальный анастомоз.
Срединная релапаротомия. Выделен центральный анастомоз аорто-бедренного протеза. Выявлена аневризма проксимального анастомоза диаметром до 4 см. Парааортально в области бифуркации аорты вскрыта полость, из которой удалено до 400 мл гемолизированной крови и тканевого детрита. Через продольный разрез в области верхней трети правого бедра вскрыта пульсирующая гематома правого дистального аорто-бедренного анастомоза. Обнаружен отрыв правой бранши протеза от бедренной артерии в области переднелатеральной дуги анастомоза. Выполнено полное поперечное клампинг брюшной аорты ниже уровня почечных артерий. Выделен из рубцов и удален аорто-бедренный протез, дистальные анастомозы иссечены. Далее выделена из рубцов культя левой общей подвздошной артерии. Продольная артериотомия с эндартерэктомией из устья общей подвздошной артерии слева. Эндартерэктомия из общей подвздошной артерии. Наложен проксимальный анастомоз между брюшной аортой ниже почечных артерий и основной браншей гомографта 200 XI6 X 150 мм по типу "конец в конец". Контроль герметичности анастомоза. Формирование левого дистального анастомоза левой бранши гомографта с культей общей подвздошной артерии слева по типу "конец в конец". Контроль герметичности анастомоза. Формирование правой дистальной бранши гомографта из двух частей гомографта и выделенного, реверсированного участка большой подкожной вены справа. Правая дистальная бранша под пупартовой связкой, по прежнему каналу, проведена к выделенной бедренной артерии справа. Сформирован дистальный анастомоз правой бранши гомографта с общей бедренной артерией справа по типу "конец в конец". Проверка герметичности анастомоза. Запуск магистрального кровотока правой нижней конечности. Время окклюзии аорты составило 95 минут. На дефект общей бедренной артерии слева наложена аутовенозная заплата. В шов заплаты общей бедренной артерии слева, в ретроградном направлении, установлен интрадюсер 7Fr. Выполнена артериография подвздошных артерий слева, при которой выявлен пролонгированный стеноз наружной подвздошной артерии и окклюзия общей подвздошной артерии слева. Реканализация окклюзии общей подвздошной артерии гидрофильным проводником и баллонная предилатация общей и наружной подвздошных артерий. Далее в дистальный участок левой бранши гомографта, с переходом на общую и наружную подвздошью артерии доставлен, позиционирован и имплантирован саморасширяющийся периферический стент Sinus 8∗60mm. Стент дорасправлен баллоном. При контрольной ангиографии - удовлетворительное восстановление кровотока по подвздошным артериям слева. Удаление интрадюсера. Швы на заплату. Запуск магистрального кровотока левой нижней конечности. Пульсация артерий в пределах операционных ран бедра справа и слева удовлетворительная. Контроль гемостаза и отсутствия инородных тел. Дренирование операционных ран бедра справа и слева. Дренаж, через контраппертуру, в малый таз. Дренирование, через канал левой бранши гомографта, операционной раны левого бедра и гнойной полости парааортального пространства инфраренального отдела аорты. Послойное ушивание ран.
Послеоперационный период протекал с длительным субфибрилитетом. При контрольном МСКТ аорты и подвздошных артерий парапротезно слева в жировой клетчатке полости таза определяется осумкованное скопление жидкости аксиальными размерами 47x51 мм, плотностью до +27 ед.Х. Капсула, окружающая жидкость, равномерной толщины, в раннюю артериальную фазу не контрастируется. Аорто-подвздошно-бедренный сегмент проходим. При бактериологическом исследовании участка протеза из зоны ложной аневризмы дистального анастомоза получен рост Staphylococcus aureus.
Послеоперационные раны зажили первичным натяжением. Через 3 месяца после операции больной чувствует себя удовлетворительно, клинических и инструментальных данных, подтверждающих реинфекцию и стенозы анастомозов, не получено.
Предлагаемый способ позволяет восстановить собственное артериальное сосудистое русло резистентными к инфекции тканями и устранить инфекционный очаг в забрюшинном пространстве. Помимо этого, использование данной методики исключает сдавливание бранш импланта рубцовыми тканями, травмирование окружающих тканей при проведении гомографта в область бедренных артерий, позволяет уменьшить длину используемых имплантов, что снижает возможность их инфицирования.
Список литературы:
1. Затевахин И.И., Комраков В.Е. Инфекция в сосудистой хирургии. М.: 1998; 37-183.
2. Степаненко А.Б., Белов Ю.В., Аль-Шатарат Ю. Атипичное шунтирование у больных с инфицированными ложными аневризмами брюшной аорты. Ангиология и сосудистая хирургия, 1996; 2.
3. Beck AW, Murphy EH, Hocking JA, et al. Aortic reconstruction with femoral-popliteal vein: graft stenosis incidence, risk and reintervention. J Vasc Surg 2008 Jan; 47(1):36-43; discussion 44.
4. Coselli J.S., Koksoy C, LeMaire S.A. Management of thoracic aortic graft infections. Ann Thorac Surg 1999; 67:1990-1993.
5. Darouiche R.O. Treatment of Infections Associated with Surgicallmplants. N Engl J Med 2004; 350:1422-1429.
6. Durham J.R., Rubin J.R., Malone J.M. Management of infectedinfrainguinal bypass grafts. Reoperative Arterial Surgery. Grune &Stratton 1986; 359-373.
7. Naylor A.R., Payne D., London N.J. et al. Prosthetic patch infectionafter carotid endarterectomy. Eur J Vasc Surg 2002; 23:11.33.
8. Nevelsteen A., Lacroix H., Suy R. Autogenous reconstruction ofthe lower extremity deep veins: An alternative treatment of prosthetic infection after reconstructive surgery of aortoiliac disease. JVasc Surg 1995; 22:129.
9. CHara PJ, Hertzer NR, Beven EG, Krajewski LP. Surgical management of infected abdominal aortic grafts: review of a 25-year experience. J Vasc Surg 1986; 3:725-31.
10. Ohki Т., Veith F.J., Shaw P. et al. Increasing incidence of midtermand long-term complications after endovascular graft repair of abdominalaortic aneurysms: A note of caution based on a 9-yearexperience. Ann Surg 2001; 234:323.35.
11. Rutherford R.B. Vascular Surgery. 6th ed. Elsevier 2005; 876.
12. Criado F.J. Extrathoracic management of aortic arch syndromeBr J Surg 1982; 69:45.
13. Yashar J.J., Weyman A.K., Burnard R.J., Yashar J. Survival and limb salvage in patients with infected arterial prostheses. Am J Surg 1978; 135: 4:499-504.
14. Reilly L. Aortic graft infection: evolution in management. CardiovascSurg 2002; 10:372-377.
15. McGiffin DC, Kirklin JK. The impact of aortic valve allografts on the treatment of aortic prosthetic valve endocarditis. In: Loop FD, editor. Seminars in thoracic and cardiovascular surgery. Philadelphia: WB Saunders; 1995. p.25-31.
16. Modrall JG, Sadjadi J, AH AT, Anthony T, Welborn MB 3rd, Valentine RJ, Hynan LS, Clagett GP. Deep vein harvest: predicting need for fasciotomy. J Vasc Surg. 2004 Feb; 39(2):387-94.)
17. Castier Y, Paraskevas N, Maury JM, Karsenti A, Cerceau O, Legendre AF, Duprey A, Cerceau P, Francis F, Leseche G. Cryopreserved arterial allograft reconstruction for infected peripheral bypass.Ann Vasc Surg. 2010 Nov; 24(8):994-9. Epub 2010 Jul 3.
18. Clagett G.P. Aortic Graft Infections. In: Complicasion in vascular surgery (second edition, revised and expanded). Ed. by J.B.Towne, L.H.Hollier. Marcel Dekker, Inc. New York-Basel 2004; 317-336.
19. Bandyk D.F., Novotney M.L., Back M.R. et al. Expanded application of in situ replacement for prosthetic graft infection. J Vasc Surg 2001; 34: 411-419.]
20. A.B. Троицкий, E.P. Лысенко, Р.И. Хабазов, A.C. Азарян, О.Г. Грязнов, Е.Д. Соловьева, В.В. Козявкин, Л.Г. Кулешова. Аутовенозные реконструкции при инфекции аорто-бедренных синтетических протезов. Ангиология и сосудистая хирургия, 2008; 4.
21. Brown КЕ, Неуеr К, Rodriguez Н, Eskandari МК, Pearce WH, Morasch MD Arterial reconstruction with cryopreserved human allografts in the setting of infection: A single-center experience with midterm follow-up. J Vasc Surg. 2009; 49(3):660.
22. Christian Ruef, Jorg Debatin, Burkhardt Seifert, Wolfgang Kiowski and Marko I. Turina Paul R. Vogt, Hans-Peter Brunner-La Rocca, Thierry Carrel, Ludwig K. von Segesser, Cryopreserved arterial allograft sub the treatment of major vascular inection: a comparison with conventional surgical techniques J Thorac Cardiovasc Surg 1998; 116:965-972.
23. Yves Castier, MD,a Fady Francis, MD,a Pierre Cerceau, MD,a Mathieu Besnard, MD,a Jerome Albertin,MD,a Laurent Fouilhe, MD,a Olivier Cerceau, MD,a Pierre Albaladejo, MD,b and Guy Leseche, MD,a Clichy, Cryopreserved arterial allograft reconstruction for peripheral graft infection. J Vasc Surg 2005; 41(1):30-37.
24. Bahnini A, Ruotolo C, Koskas F, Kieffer E. In situ fresh allograft replacement of an infected aortic prosthetic graft: eighteen months' follow-up. J Vasc Surg 1991; 14:98-102.
Способ гибридного аорто-бедренного репротезирования при инфекции сосудистых имплантов, включающий использование гомографтов в качестве импланта при повторных реконструкциях аорто-бедренного сегмента, отличающийся тем, что под эндотрахеальным наркозом выполняют выделение анастомозов инфицированного аорто-бифеморального шунта, выделяют бифуркацию аорты и начальные отделы общих подвздошных артерий, далее после системной гепаринизации и пережатия артериальных сосудов, находящихся в зоне хирургического интереса, иссекают анастомозы инфицированного протеза и окружающие ткани, после чего в ортотопной позиции формируют анастомозы гомографта с аортой и общими подвздошными артериями, ретроградно через артериотомические отверстия в бедренных артериях выполняют реканализацию со стентированием подвздошных артерий пациента и после контрольной ангиографии дефекты в бедренных артериях замещают вставками из гомографта, осуществляя комбинацию реканализации собственных подвздошных артерий пациента и репротезирование инфраренального сегмента аорты гомографтом.