Лекарственные формы инсулина, обладающие быстрым усвоением
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается лекарственной формы инсулина, включающей инсулин, растворяющий агент и хелатор цинка, где лекарственная форма имеет значение рН между более чем рН 7 и рН 7,6, представляет собой прозрачный водный раствор; инъекционной лекарственной формы инсулина; способа лечения больного сахарным диабетом, включающего инъецирование больного с помощью указанной лекарственной формы. Группа изобретений обеспечивает повышенное накопление и транспорт через эпителиальные клетки по сравнению с инсулином в комбинации с НСl и указанным хелатором цинка. 4 н. и 23 з.п. ф-лы, 11 пр., 13 ил., 3 табл.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к области инъекционных лекарственных форм инсулина с быстродействующей доставкой лекарственного средства.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Общее представление о сахарном диабете
Глюкоза является моносахаридом, используемым всеми клетками организма для образования энергии и поддержания жизнедеятельности. Чтобы выжить, человеческий организм постоянно нуждается в минимальном уровне глюкозы в его крови. Основным способом образования глюкозы крови в организме является переваривание пищи. Когда человек не получает эту глюкозу при переваривании пищи, глюкоза образуется из тканевых запасов и высвобождается печенью. Уровни глюкозы в организме регулируются инсулином. Инсулин представляет собой пептидный гормон, который естественным путем секретируется поджелудочной железой. Инсулин помогает глюкозе проникать внутрь клеток организма для обеспечения жизненно важного источника энергии.
Когда здоровый человек начинает есть, поджелудочная железа обеспечивает естественный пиковый выброс инсулина, называемый первой фазой секреции инсулина. Помимо обеспечения достаточного количества инсулина для метаболизма глюкозы, появляющейся в крови при переваривании пищи, первая фаза секреции инсулина действует в качестве сигнала остановки синтеза глюкозы в печени по мере того, как происходит переваривание пищи. Поскольку печень не синтезирует глюкозу и имеется достаточное количество дополнительного инсулина для метаболизма глюкозы, образуемой при переваривании пищи, уровни глюкозы в крови здоровых индивидуумов остаются относительно постоянными, и их уровни глюкозы в крови не становятся слишком высокими.
Сахарный диабет является заболеванием, характеризуемым аномально высокими уровнями глюкозы в крови и неадекватными уровнями инсулина. Существует два основных типа сахарного диабета - Тип 1 и Тип 2. В случае сахарного диабета Типа 1 в организме не синтезируется инсулин. На ранних стадиях сахарного диабета Типа 2, хотя в поджелудочной железе синтезируется инсулин, либо в организме не синтезируется инсулин вовремя, либо клетки организма не распознают инсулин - состояние, известное под названием инсулинорезистентность.
Еще до появления любых других симптомов одним из первых проявлений сахарного диабета Типа 2 является исчезновение секреции инсулина первой фазы, индуцированной перевариванием пищи. В отсутствие секреции инсулина первой фазы в печень не поступает сигнал к прекращению синтеза глюкозы. В результате, печень продолжает продуцировать глюкозу в момент времени, когда организм начинает продуцировать дополнительную глюкозу посредством переваривания пищи. В результате, уровень глюкозы в крови пациентов с сахарным диабетом достигает слишком высоких значений после потребления пищи - состояние, известное как гипергликемия. Гипергликемия вызывает противоестественное связывание глюкозы с определенными белками в крови, препятствуя способности белков выполнять их нормальные функции сохранения целостности небольших кровеносных сосудов. В условиях возникновении гипергликемии после каждого потребления пищи малые кровеносные сосуды в конечном итоге разрушаются, и повышается их проницаемость. Отдаленные побочные эффекты гипергликемии включают слепоту, потерю функции почек, повреждение и потерю чувствительности нервов и плохую периферическую циркуляцию крови, потенциально требующую ампутацию конечностей.
В промежутке между двумя и тремя часами после потребления пищи уровень необработанной глюкозы крови при сахарном диабете становится настолько повышенным, что в поджелудочную железу поступает сигнал к секреции чрезмерно огромного количества инсулина. У пациента на ранних стадиях сахарного диабета Типа 2 поджелудочная железа все еще может отвечать на сигнал и секретировать большие количества инсулина. Однако это происходит в то время, когда переваривание пищи подходит к концу и уровни глюкозы в крови должны начать падать. Это чрезмерно большое количество инсулина влечет за собой два отрицательных эффекта. Во-первых, это предъявляет чрезмерные требования к поджелудочной железе с уже нарушенной функцией, что может привести к ее более быстрому истощению и, в конечном итоге, приводит к состоянию, когда поджелудочная железа неспособна продуцировать инсулин. Во-вторых, слишком много инсулина после переваривания пищи приводит к увеличению массы тела, что может дополнительно отягощать заболевание.
Современные методы лечения сахарного диабета и их ограничения
Поскольку у пациентов, страдающих сахарным диабетом Типа 1, не вырабатывается никакого инсулина, первичное лечение сахарного диабета Типа 1 заключается в ежедневной интенсивной терапии инсулином. Лечение сахарного диабета Типа 2, как правило, начинается с коррекции диеты и физических упражнений. Несмотря на целесообразность в течение короткого промежутка времени, лечение только лишь посредством соблюдения диеты и физических упражнений не является эффективным долгосрочным разрешением болезни для подавляющего большинства пациентов, страдающих сахарным диабетом Типа 2. Когда диета и физические упражнения больше не достаточны, лечение начинают с различных неинсулиновых пероральных лекарственных препаратов. Эти пероральные лекарственные препараты действуют путем увеличения количества инсулина, синтезируемого в поджелудочной железе, путем повышения чувствительности инсулин-чувствительных клеток, путем снижения продукции глюкозы в печени или путем какой-либо комбинации этих механизмов. Эти методы лечения ограничены в своей способности эффективно контролировать заболевание и, как правило, имеют выраженные побочные эффекты, такие как увеличение массы тела и гипертензия. Ввиду ограничений неинсулиновых методов лечения у многих пациентов, страдающих сахарным диабетом Типа 2, ухудшается самочувствие с течением времени, и, в конечном итоге, им требуется инсулиновая терапия для поддержания их метаболизма.
Инсулиновая терапия используется более 80 лет для лечения сахарного диабета. Эта терапия, как правило, заключается в назначении нескольких инъекций инсулина ежедневно. Эти инъекции состоят из применения базальной инъекции пролонгированного действия один или два раза в день и инъекции быстродействующего инсулина во время приема пищи. Хотя эта схема лечения считается эффективной, она имеет ограничения. Во-первых, пациенты, как правило, не любят сами себе вводить инъекции инсулина ввиду неудобства и боли от игл. В результате, пациенты склонны не следовать надлежащим образом назначенным схемам лечения и зачастую не должным образом проходят лечение.
Более того, инъекции инсулина не воспроизводят естественный профиль действия инсулина даже при правильном применении. В частности, естественный всплеск инсулиновой секреции первой фазы у человека, не страдающего сахарным диабетом, приводит к уровням инсулина в крови, нарастающим в пределах нескольких минут после появления в крови глюкозы из потребляемой пищи. Напротив, инъецируемый инсулин появляется в крови медленно с пиковыми уровнями инсулина, возникающими в пределах от 80 до 100 минут вслед за инъекцией простого инсулина человека.
Потенциальным решением является инъекция инсулина напрямую в вену больным сахарным диабетом непосредственно перед приемом пищи. В исследованиях внутривенных инъекций инсулина пациенты отмечали лучший контроль их глюкозы в крови в диапазоне от 3 до 6 часов после приема пищи. Однако по целому ряду медицинских причин внутривенная инъекция инсулина перед каждым приемом пищи не является практической терапией.
Одним из ключевых усовершенствований в методах лечения инсулином было введение в 1990х быстродействующих аналогов инсулина, таких как лизпро-инсулин (IL), инсулин аспарт (IA) и инсулин глулизин (IG). Однако, даже применяя быстродействующие аналоги инсулина, пиковые уровни инсулина, как правило, появлялись в диапазоне от 50 до 90 минут после инъекции. Поскольку быстродействующие аналоги инсулина не адекватно имитируют секрецию инсулина первой фазы, у больных сахарным диабетом при использовании инсулиновой терапии продолжают сохраняться неадекватные уровни инсулина, имеющиеся в начале приема пищи, и слишком много инсулина, имеющегося между приемами пищи. Эта задержка в доставке инсулина может приводить к гипергликемии в ближайшее время после начала приема пищи. Более того, избыточный инсулин между приемами пищи может приводить к аномально низкому уровню глюкозы в крови, известному как гипогликемия. Гипогликемия может приводить к потере ясности ума, спутанности сознания, повышенной частоте сердечных сокращений, чувству голода, потливости и обмороку. При очень низких уровнях глюкозы гипогликемия может привести к потере сознания, коме и даже смерти. Согласно Американской Ассоциации Диабетологов, или ADA, использующие инсулин больные сахарным диабетом имеют в среднем 1,2 серьезных гипогликемических события в год, многие из которых требуют размещения пациентов в отделение больницы скорой медицинской помощи.
Поскольку динамика доставки инсулина в кровь играет такую важную роль в общем контроле уровня глюкозы, есть существенная потребность использовать инсулин в виде инъецируемого инсулина, который достигает кровяного русла быстрее быстродействующих аналогов инсулина.
В связи с этим, объектом изобретения является предоставление композиций быстродействующего инъецируемого инсулина с оптимизированной стабильностью и быстрым началом действия.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Инъецируемые лекарственные формы инсулина с оптимизированной стабильностью и быстрым началом действия описаны в настоящем документе. Лекарственные формы могут быть для подкожного, внутрикожного или внутримышечного применения. В предпочтительном варианте осуществления изобретения лекарственные формы применяют посредством подкожной инъекции. Лекарственные формы содержат инсулин в комбинации с хелатором и растворяющим агентом, и, в некоторых случаях, с дополнительными вспомогательными веществами. В предпочтительном варианте осуществления изобретения лекарственная форма содержит инсулин человека, хелатор цинка, такой как EDTA, и растворяющий агент, такой как лимонная кислота или ее соль, такая как лимоннокислый натрий. Эти лекарственные формы быстро абсорбируются в кровоток в случае применения подкожной инъекции. Примеры демонстрируют, что можно увеличить рН до физиологических значений рН и по-прежнему обеспечить растворение и быстрое накопление инсулина.
В одном варианте осуществления изобретения инсулин представлен в виде сухого порошка в стерильной ампуле. Он быстро смешивается с растворителем, содержащим фармацевтически приемлемый носитель, такой как вода, и, в некоторых случаях, хелатор цинка, такой как EDTA, и/или растворяющий агент, такой как лимонная кислота, перед применением или в момент применения. В другом варианте осуществления изобретения инсулин, как правило, со значением рН, равным приблизительно 4, хранится в виде замороженной смеси, готовой к использованию после размораживания. В предпочтительном варианте осуществления изобретения инсулин представлен в виде водного раствора со значением рН, равным 7, который хранится при 4°С.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
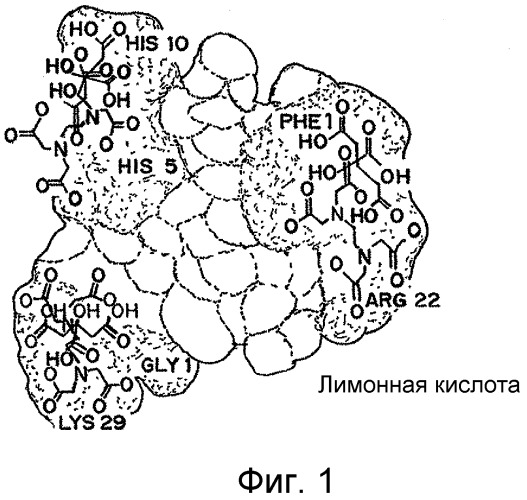
На Фигуре 1 представлено трехмерное схематическое изображение инсулина, демонстрирующее экспонированные поверхностные заряды, покрытые молекулами («растворяющими и хелатирующими агентами») соответствующего размера для маскировки заряда.
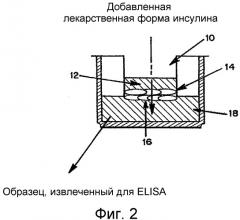
На Фигуре 2 представлено схематическое представление прибора системы Трансвелл 10, используемого для измерения абсорбции инсулина из донорной камеры 12 сквозь 4-5 слоев иммортализованных эпителиальных клеток ротовой полости 14 на 0,1 микронном фильтре 16 в приемную камеру 18.
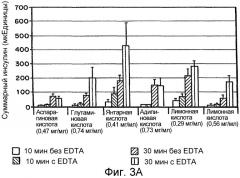
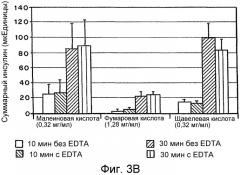
На Фигурах 3а и 3b представлены графики, сравнивающие транспорт инсулина in vitro (суммарный инсулин в микроединицах) через эпителиальные клетки ротовой полости в системе Трансвелл Фигуры 2 в присутствии и в отсутствие 0,45 мг EDTA/мл в зависимости от кислоты, выбранной в качестве растворяющего агента. EDTA использовали в постоянной концентрации, равной 0,45 мг/мл, в то время как концентрации кислот варьировали следующим образом: Фигура 3а, аспарагиновая кислота (0,47 мг/мл), глутаминовая кислота (0,74 мг/мл), янтарная кислота (0,41 мг/мл), адипиновая кислота (0,73 мг/мл) и лимонная кислота (0,29 мг/мл и 0,56 мг/мл), диапазон значений рН 3,2-3,8. Фигура 3b, малеиновая (0,32 мг/мл), фумаровая кислота (1,28 мг/мл) и щавелевая кислота (0,32 мг/мл), диапазон значений рН 2-3. Два временных периода (10 и 30 мин) были выбраны для сравнительного анализа. Результаты представлены в виде среднего плюс или минус измеренная стандартная ошибка, n=4.
На Фигурах 4а и 4b представлены графики транспорта инсулина in vitro (суммарный инсулин в микроединицах) через эпителиальные клетки ротовой полости в системе Трансвелл, показанной на Фигуре 2, сравнивая различные растворяющие агенты в присутствии и в отсутствие 0,56 мг EDTA/мл и кислоты в следующих эквимолярных (1,50×10-3 моль) концентрациях: аспарагиновая кислота (0,20 мг/мл), глутаминовая кислота (0,22 мг/мл) и лимонная кислота (0,29 мг/мл) (Фигура 4а) и лимонная кислота в концентрации 1,80 мг/мл (Фигура 4b). Два временных периода (10 и 30 мин.) были выбраны для сравнительного анализа.
На Фигуре 5 представлен график транспорта инсулина in vitro через эпителиальные клетки ротовой полости, используя систему Трансвелл Фигуры 2, для сравнения эффективности различных хелаторов. На Фигуре 5 представлен график транспорта инсулина (1 мг/мл) из раствора, содержащего глутаминовую кислоту, лимонную кислоту или HCl, к которому были добавлены различные хелаторы в одной и той же концентрации (4,84×10-3 моль), через эпителиальные клетки ротовой полости (суммарный инсулин, микромоль). Хелаторы отсутствовали (контроль) представляли собой EDTA, EGTA, DMSA, CDTA и TSC.
На Фигуре 6 представлен график фармакодинамического действия инсулина in vivo, обработанного лимонной кислотой и EDTA (12 ед.), в человеческом организме в сравнении с IL (12 ед.) и RHI (12 ед.), измеренного как средняя скорость инфузии глюкозы (GIR)/кг.
На Фигуре 7 представлен график фармакокинетического действия инсулина in vivo, обработанного лимонной кислотой и EDTA, в человеческом организме в сравнении с RHI, концентрация инсулина (микроединицы/мл) в динамике по времени (минуты). Средние значения (±SEM, n=10). Доза инсулина составляла 12 ед/субъект.
На Фигуре 8 представлен график фармакодинамики инсулина in vivo, обработанного лимонной кислотой и EDTA у 16 пациентов, страдающих сахарным диабетом Типа 2; в сравнении с RHI и IL, представляя графически глюкозу в крови (мг/дл) в динамике по времени (минуты). Используемая доза при исследовании пациента была специфичной для пациента, подобранной для каждого пациента на основании проводимой инсулиновой терапии.
На Фигуре 9А представлен график коэффициентов седиментации RHI в концентрациях 0,17, 0,51, 1,68 и 3,62 мг/мл.
На Фигуре 9В представлен график коэффициентов седиментации IL в концентрациях 0,15, 0,56, 1,75 и 3,59 мг/мл.
На Фигуре 9С представлен график коэффициентов седиментации IA в концентрациях 0,16, 0,56, 1,66 и 3,56 мг/мл.
На Фигуре 9D представлен график коэффициентов седиментации СЕ100-4 в концентрациях 0,15, 0,55, 1,72 и 3,48 мг/мл.
На Фигуре 10А представлен график распределений с(s), нормированных по отношению к загрузочной концентрации для коэффициентов седиментации RHI в концентрациях 0,18, 0,55 и 1,72 мг/мл.
На Фигуре 10В представлен график распределений с(s), нормированных по отношению к загрузочной концентрации для коэффициентов седиментации IL в концентрациях 0,17, 0,57 и 1,82 мг/мл.
На Фигуре 10С представлен график распределений с(s), нормированных по отношению к загрузочной концентрации для коэффициентов седиментации IA в концентрациях 0,19, 0,54 и 1,84 мг/мл.
На Фигуре 10D представлен график распределений с(s), нормированных по отношению к загрузочной концентрации для коэффициентов седиментации CE100-4 в концентрациях 0,18, 0,40 и 0,84 мг/мл.
На Фигуре 11 представлен график распределений с(s), нормированных по отношению к загрузочной концентрации для коэффициентов седиментации контрольного инсулина со значением рН 7 в концентрациях 0,18, 0,57, 1,74 и 3,52 мг/мл.
На Фигуре 12 представлен график среднего размера частиц инсулина (нм) в зависимости от разведения для СЕ 100-4, СЕ 100-7 и CES 100-7.
На Фигуре 13 представлен график концентрации инсулина (микроединицы/мл) методом ELISA в динамике по времени (минуты) у карликовых свиней, больных сахарным диабетом.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Лекарственные формы инсулина инъекционного человеческого инсулина, описанного в настоящем документе, применяются непосредственно до приема пищи или в конце приема пищи. В предпочтительном варианте осуществления изобретения лекарственная форма объединяет в себе рекомбинантный человеческий инсулин и специфические ингредиенты, как правило, считающиеся безопасными Управлением по контролю за лекарственными препаратами и пищевыми продуктами (FDA). Лекарственную форму создают таким образом, чтобы абсорбция в кровь проходила быстрее, чем у имеющихся в настоящий момент в продаже быстродействующих аналогов инсулина. Одним из ключевых свойств лекарственной формы инсулина является обеспечение разъединения, или разделения, состоящей из шести молекул, или гексамерной, формы инсулина до мономерной или димерной формы инсулина и удерживание его от реассоциации с образованием гексамерной формы. Считается, что предпочитая находиться в мономерной или димерной форме, эта лекарственная форма обеспечивает более быструю доставку инсулина в кровь, поскольку человеческому организму требуется инсулин в форме одной молекулы до того, как он сможет быть абсорбирован в организме для осуществления целевого биологического действия. Наибольшая часть человеческого инсулина, продаваемого для инъекции, представляет собой гексамерную форму. Это создает большие трудности для абсорбции в организме, поскольку гексамер инсулина должен сначала разделиться с образованием димеров и затем мономеров.
I. Определения
«Инсулин» в том смысле, в котором он здесь используется, относится к человеческому или не относящемуся к человеку рекомбинантному, очищенному или синтетическому инсулину или аналогам инсулина, если не указано иное.
«Человеческий инсулин» в том смысле, в котором он здесь используется, представляет собой человеческий пептидный гормон, секретируемый поджелудочной железой, либо выделенный из природного источника, либо образованный генетически измененными микроорганизмами. «Не относящийся к человеку инсулин» в том смысле, в котором он здесь используется, является тем же самым, что и человеческий инсулин, но животного происхождения как, например, свиного или коровьего.
Аналог инсулина в том смысле, в котором он здесь используется, представляет собой измененный инсулин, отличный от инсулина, секретируемого поджелудочной железой, но все же доступный для организма для выполнения тех же функций, что и инсулин природного происхождения. Посредством генетической инженерии, соответствующей ДНК может быть изменена аминокислотная последовательность инсулина для изменения ее характеристик ADME (абсорбции, распределения, метаболизма и экскреции). Примеры включают лизпро-инсулин, инсулин гларгин, инсулин аспарт, инсулин глулизин, инсулин детемир. Инсулин может быть также модифицирован химически, например, путем ацетилирования. Аналоги человеческого инсулина в том смысле, в котором они здесь используются, представляют собой измененный человеческий инсулин, который способен выполнять те же биологические функции, что и человеческий инсулин.
«Хелатор» или «хелатирующий агент» в том смысле, в котором они здесь используются, относятся к химическому соединению, которое имеет способность образовывать одну или несколько связей с ионами цинка. Связи являются, как правило, ионными или координационными связями. Хелатор может являться неорганическим или органическим соединением. Хелатный комплекс представляет собой комплекс, в котором ион металла связан с двумя или более атомами хелатирующего агента.
«Солюбилизирующий агент» в том смысле, в котором он здесь используется, представляет собой соединение, которое повышает растворимость веществ в растворителе, например, инсулина в водном растворе. Примеры солюбилизирующих агентов включают поверхностно-активные вещества (TWEENS®); растворитель, такой как этанол; мицеллообразующие соединения, такие как оксиэтиленовый моностеарат; и рН-модифицирующие агенты.
«Растворяющий агент» в том смысле, в котором он здесь используется, представляет собой кислоту или соль, которые при добавлении к инсулину и EDTA, повышают транспорт и абсорбцию инсулина относительно HCl и EDTA при тех же значениях рН при измерении методом с использованием эпителиальных клеток в планшетах системы Трансвелл, описанного в примерах ниже. HCl не является растворяющим агентом, но может быть солюбилизирующим агентом. Лимонная кислота и лимоннокислый натрий являются растворяющими агентами при измерениях данным методом. Считается, что это достигается, по крайней мере, частично, путем маскировки зарядов на инсулине, некоторые из которых экспонированы во время диссоциации из гексамера.
«Вспомогательное вещество» в том смысле, в котором оно здесь используется, представляет собой неактивное вещество, отличное от хелатора или растворяющего агента, используемое в качестве носителя для инсулина или используемое, чтобы помочь процессу, посредством которого производят продукт. В таких случаях, активное вещество растворяют или смешивают со вспомогательным веществом.
«Физиологическое значение рН» в том смысле, в котором оно здесь используется, находится в диапазоне от 6,8 до 7,6, предпочтительно от 7 до 7,5, наиболее предпочтительно приблизительно равно значению 7,4.
VIAJECT™ в том смысле, в котором он здесь используется, является торговой маркой рекомбинантного человеческого инсулина, составленного вместе с растворяющим агентом, таким как лимонная кислота, и хелатором, таким как EDTA. Viaject 25 ед/мл (СЕ 25-4) содержит 25 ед/мл простого рекомбинантного человеческого инсулина, 1,8 мг/мл лимонной кислоты, 1,8 мг/мл двунатриевой EDTA, 0,82% NaCl (изотонического) и 3 мг/мл м-крезола. Он поставляется в виде водного раствора, который хранится замороженным, или в виде набора, состоящего из двух частей, включающих в себя сухой порошок инсулина и растворитель, по крайней мере, один из которых содержит лимонную кислоту и EDTA. Значение рН как ресуспендированной смеси, так и замороженного раствора приблизительно равно значению рН 4. Viaject 100 ед/мл (СЕ 100-4) содержит 100 ед/мл простого рекомбинантного человеческого инсулина, 1,8 мг/мл лимонной кислоты, 1,8 мг/мл двунатриевой EDTA, 22 мг/мл глицерина, 3 мг/мл м-крезола. Он также поставляется либо в виде замороженного водного раствора, либо в виде набора, состоящего из двух частей, включающих в себя сухой порошковый инсулин и растворитель. Значение рН как ресуспендированной смеси, так и замороженного раствора приблизительно равно 4. Viaject 100 ед/мл (СЕ 100-7) содержит 100 ед/мл простого рекомбинантного человеческого инсулина, 1,8 мг/мл лимонной кислоты, 1,8 мг/мл двунатриевой EDTA, 22 мг/мл глицерина, 3 мг/мл м-крезола. Он поставляется в виде водного раствора, имеющего значение рН, приблизительно равное 7,4, который может храниться при 4°С. VIAject с кислыми солями (CSE 100-7) изготавливают путем добавления 1,8 мг/мл как EDTA, так и тринатриевого цитрата к воде, затем добавляя 100 ед/мл инсулина, снижая рН до 6, затем повышая рН до 7,4.
Лекарственные формы
Лекарственные формы включают инсулин, хелатор и растворяющее(ие) вещество(а) и, в некоторых случаях, один или несколько других вспомогательных веществ. В предпочтительном варианте осуществления изобретения лекарственные формы пригодны для подкожного применения и быстро абсорбируются жировой подкожной тканью. Выбор растворяющего агента и хелатора, концентрации, как растворяющего агента, так и хелатора, и значение рН, до которого доводят лекарственную форму, оказывают значительное влияние на эффективность системы. Хотя многие комбинации обладают эффективностью, предпочтительный вариант осуществления изобретения выбран по многим причинам, включая безопасность, стабильность, регуляторный профиль и степень эффективности.
В предпочтительном варианте осуществления изобретения, по крайней мере, один из ингредиентов лекарственной формы выбран для маскировки зарядов на активном веществе. Это может облегчить трансмембранный транспорт инсулина и, тем самым, ускорить как начало действия, так и увеличить биодоступность инсулина. Ингредиенты также выбирают для создания композиций, которые растворяются быстро в водной среде. Предпочтительно инсулин абсорбируется и транспортируется в плазму крови быстро, приводя к быстрому началу действия (предпочтительно, начиная в пределах приблизительно 5 минут после применения и достигая максимальных концентраций приблизительно на 15-30 минуте после применения).
Хелатор, такой как EDTA, образует хелатное соединение с цинком в инсулине, устраняя цинк из раствора инсулина. Это обусловливает принятие инсулином димерной или мономерной формы и сдерживает повторный переход в гексамерное состояние. Исследования, описанные в примерах, указывают на то, что общий размер диссоциирующего гексамера больше комплекса цинка с инсулиновым гексамером, который затем образует меньшие по размеру молекулы. Поскольку гексамеры, димеры и мономеры существуют в зависящем от концентрации равновесии, по мере того, как абсорбируются мономеры, образуется больше мономеров. Таким образом, по мере того как мономеры инсулина абсорбируются через подкожную ткань, дополнительные димеры распадаются с образованием большего количества мономеров. Полностью диссоциированная мономерная форма имеет молекулярный вес, который меньше одной шестой молекулярного веса гексамерной формы, тем самым значительно повышая как скорость, так и уровень абсорбции инсулина. В тех случаях, когда хелатор (такой как EDTA) и/или растворяющий агент (такой как лимонная кислота) образует водородную связь с инсулином, считается, что это маскирует заряд на инсулине, облегчая его трансмембранный транспорт и, следовательно, ускоряя как начало действия, так и повышая биодоступность инсулина.
Инсулин
Инсулин может быть рекомбинантным или очищенным из природного источника. Инсулин может быть человеческим или не относящимся к человеку. Предпочтительнее человеческий инсулин. В наиболее предпочтительном варианте осуществления изобретения инсулин является человеческим рекомбинантным инсулином. Рекомбинантный человеческий инсулин доступен из целого ряда источников. Инсулин также может быть инсулиновым аналогом, в основе которого лежит аминокислотная последовательность человеческого инсулина, но имеющим одно или несколько аминокислотных отличий, или химически модифицированным инсулином или аналогом инсулина.
Дозировка инсулина зависит от его биодоступности и пациента, подлежащего лечению. Инсулин, как правило, включает в себя диапазон доз, равный 1,5-100 МЕ, предпочтительно 3-50 МЕ на дозу, допустимую для человеческого организма. Как правило, инсулин поставляется в 100 МЕ ампулах.
Растворяющие агенты
Определенные кислоты, или их соли, по-видимому, маскируют заряды на инсулине, повышая накопление и транспорт, как показано на Фигуре 1. Те кислоты, которые эффективны в качестве растворяющих агентов, включают уксусную кислоту, аскорбиновую кислоту, лимонную кислоту, глутаминовую кислоту, аспарагиновую кислоту, янтарную, фумаровую, малеиновую и адипиновую кислоту относительно соляной кислоты, согласно измерениям методом с использованием системы Трансвелл, описанным в приведенных ниже примерах. Например, если активным веществом является инсулин, предпочтительным растворяющим агентом является лимонная кислота. Соляная кислота и гидроокись натрия являются предпочтительными агентами для регулирования значения рН. HCl может быть использована в комбинации с любой из лекарственных форм, но не является растворяющим агентом.
Соли кислот включают ацетат натрия, аскорбат, цитрат, глутамат, аспартат, сукцинат, фумарат, малеат и адипинат. Соли органических кислот могут быть приготовлены, используя целый ряд оснований, включая, в числе прочего, гидроокиси металлов, оксиды металлов, карбонаты и бикарбонаты металлов, амины металлов, а также аммонийные основания, такие как хлорид аммония, карбонат аммония и т.п. Пригодные металлы включают моновалентные и поливалентные ионы металлов. Иллюстративные ионы металлов включают металлы Группы 1, такие как литий, натрий и калий; металлы Группы 2, такие как барий, магний, кальций и стронций; металлоиды, такие как алюминий. Поливалентные ионы металлов могут быть пригодными для органических кислот, содержащих более одной карбоксильной группы, поскольку эти ионы могут одновременно образовывать комплекс с более чем одной карбоксильной группой.
Область значений растворяющего агента соответствует эффективному количеству лимонной кислоты в комбинации с инсулином и EDTA величиной от 9,37×10-4 М до 9,37×10-2 М лимонной кислоты.
Хелаторы
В предпочтительном варианте осуществления изобретения хелатор цинка смешивают с инсулином. Хелатор может быть ионным или неионным. Пригодные хелаторы включают этилендиаминтетрауксусную кислоту (EDTA), EGTA, альгиновую кислоту, альфа-липоевую кислоту, димеркаптоянтарную кислоту (DMSA), CDTA (1,2-диаминциклогексантетрауксусную кислоту), тринатриевый цитрат (TSC). Соляная кислота используется в сочетании с TSC для регулирования значения рН и в процессе, приводящем к образованию лимонной кислоты, которая является растворяющим агентом.
В предпочтительном варианте осуществления изобретения хелатором является EDTA. Хелатор захватывает цинк из инсулина, тем самым, способствуя образованию димерной формы инсулина, нежели гексамерной формы, и облегчая абсорбцию инсулина тканями, окружающими сайт его введения (например, слизистая оболочка или жировая ткань). Кроме того, водород хелатора может связываться с активным веществом, тем самым, способствуя маскировке заряда мономеров инсулина и облегчая трансмембранный транспорт мономеров инсулина.
Область значений хелатора соответствует эффективному количеству EDTA в комбинации с инсулином и лимонной кислотой величиной от 2,42×10-4 М до 9,68×10-2 М EDTA.
Вспомогательные вещества
Фармацевтические композиции могут быть составлены общепринятым способом, используя один или несколько физиологически приемлемых носителей, включающих вспомогательные вещества и добавки, которые облегчают переработку активных соединений в препараты, которые могут быть использованы фармацевтически. Технология приготовления лекарственных средств описана, например, в Hoover, John E., Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, Pennsylvania (1975), and Liberaian, H.A. and Lachman, L., Eds., Pharmaceutical Dosage Forms, Marcel Decker, New York, N.Y. (1980).
В предпочтительном варианте осуществления изобретения один или несколько солюбилизирующих веществ, включены в состав инсулинового вещества для активизации быстрого растворения в водной среде. Пригодные солюбилизирующие вещества включают увлажняющие вещества, такие как полисорбаты, глицерин и полоксамеры, неионные и ионные поверхностно-активные вещества, пищевые кислоты и основания (например, бикарбонат натрия), и спирты, и буферные соли для контроля значения рН.
Стабилизаторы используют для ингибирования или замедления реакций распада лекарственного средства, которые включают, как пример, окислительные реакции. Целый ряд стабилизаторов может быть использован. Пригодные стабилизаторы включают полисахариды, такие как целлюлоза и производные целлюлозы, и простые спирты, такие как глицерол; бактериостатические вещества, такие как фенол, м-крезол и метилпарабен; изотонические вещества, такие как хлорид натрия, глицерол и глюкоза; лецитины, например, такие как природные лецитины (например, лецитин яичного желтка или соевый лицитин) и синтетические или полусинтетические лецитины (например, димиристоилфосфатидилхолин, дипальмитоилфосфатидилхолин или дистеароилфосфатидилхолин; фосфатидные кислоты; фосфатидилэтаноламины; фосфатидилсерины, такие как дистеароилфосфатидилсерин, дипальмитоилфосфатидилсерин и диарахидоилфосфатидилсерин; фосфатидилглицеролы; фосфатидилинозитолы; кардиолипины; сфингомиелины. В одном примере, стабилизатор может представлять собой комбинацию глицерола, бактериостатических веществ и изотонических веществ.
II. Методы создания лекарственных форм
Инъекционная лекарственная форма содержит инсулин, хелатор и растворяющий агент. В предпочтительном варианте осуществления изобретения инъекционная лекарственная форма содержит инсулин, EDTA, лимонную кислоту, солевой раствор и/или глицерин.
В одном варианте осуществления изобретения лекарственную форму для подкожных инъекций создают смешиванием солевого раствора и глицерина, лимонной кислоты и EDTA для образования раствора и стерилизации раствора (именуемый «разбавитель»). Инсулин добавляют отдельно к стерильной воде с образованием раствора, фильтрованного, и определенное количество вносят в каждый из целого ряда отдельных стерильных флаконов для инъекций. Раствор инсулина лиофилизируют для получения порошка, и его следует хранить отдельно от разбавителя для сохранения его стабильности. Перед применением разбавитель добавляют к содержащему инсулин флакону для инъекций. После подкожной инъекции заданного количества инсулина пациенту, оставшийся раствор инсулина может быть сохранен, предпочтительно рефрижерацией.
В другом варианте осуществления изобретения инсулин объединяют с разбавителем, рН 4, фильтруют в стерильных условиях в инъекционные ампулы или картриджи для многократного использования и замораживают до использования.
В предпочтительном варианте осуществления изобретения инсулин приготавливают в виде водного раствора, при рН 7,0, в ампулах или картриджах и хранят при 4°С.
III. Методы использования лекарственных форм
Лекарственные формы могут быть введены путем подкожной или внутримышечной инъекции. Лекарственную форму создают для быстрой абсорбции и транспорта в плазму крови для системной доставки.
Лекарственные формы, содержащие инсулин в качестве активного вещества, могут быть назначены пациенту, страдающему сахарным диабетом типа 1 или типа 2 до еды или во время еды. Вследствие быстрой абсорбции композиции могут останавливать преобразование гликогена в глюкозу в печени, тем самым предотвращая гипергликемию, основную причину осложнений сахарного диабета и первый симптом сахарного диабета типа 2. В настоящее время, стандартные подкожные инъекции человеческого инсулина должны быть введены приблизительно за 30-60 минут до еды, чтобы не превышать желаемый эффект, поскольку инсулин абсорбируется слишком медленно, чтобы остановить образование глюкозы в печени. Кроме того, если о прогрессировании заболевания известно заблаговременно, то подкожные композиции инсулина способны замедлить или остановить прогрессирование сахарного диабета типа 2.
Преимущество лекарственной формы с низким значением рН в том, что она может быть смешана с BYETTA® (эксенатидом), SYMLIN® (прамлинтида ацетатом) и LANTUS® (инсулиновым аналогом пролонгированного действия), ни один из которых не может быть смешан с другими типами имеющегося в продаже инсулина вследствие разделения фаз и преципитации.
Преимущество инсулина с более высокими значениями рН в том, что он более стабилен за время хранения, нежели инсулин с более низким значением рН.
Настоящее изобретение будет в дальнейшем понятным на основе нижеперечисленных неограниченных примеров. Нижеперечисленные виды инсулина были использованы в примерах.
HUMULIN® (RHI) является рекомбинантным человеческим инсулином. Каждый миллилитр содержит 100 единиц простого рекомбинантного человеческого инсулина, 0,22% м-крезола, 1,4-1,8% глицерина, рН 7. Он имеется в