Производные хиназолина, обладающие ноотропной и антигипоксической активностью
Иллюстрации
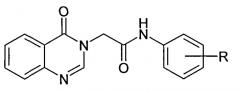
Показать всеИзобретение относится к новому средству, обладающему ноотропной и антигипоксической активностью, представляющему собой ариламиды 2-[4-оксо-3(4H)хиназолинил]уксусной кислоты общей формулы
где R=о-СН3, n-СН3 или 2,3-фенилен. Соединения на экспериментальных моделях in vivo, показали оригинальный спектр психотропного действия, превосходящий по комплексу полезных свойств препараты различных фармакологических групп - пирацетам, фенибут, фенотропил, мексидол. Соединения могут найти широкое применение при лечении больных с органическими поражениями головного мозга. 3 табл., 5 пр.
Реферат
Изобретение относится к области органической химии и медицины, а именно к новым производным хиназолина, обладающим выраженной ноотропной и антигипоксической активностью, которые могут быть использованы для лечения широко распространенных заболеваний центральной нервной системы.
В настоящее время одним из самых эффективных способов профилактики и лечения нервно-психических расстройств является психофармакотерапия. Лекарственные препараты, содержащие физиологически активные соединения, воздействующие на обмен нейромедиаторов, процессы синаптической передачи и метаболические реакции в нейронах головного мозга, способны существенным образом корригировать психическое и эмоциональное состояние, что способствует усилению адаптации к психоэмоциональным нагрузкам, масштабы которых неуклонно прогрессируют в современном индустриальном обществе. С помощью психотропных лекарственных средств, в частности ноотропов, основной характеристикой которых является активирующее влияние на интегративную деятельность мозга и восстановление нарушений высшей нервной деятельности, открывается возможность повысить способность человека к обучению, ускорить темпы образования, увеличить работоспособность [Беленичев И.Ф., Черний В.И., Колесник Ю.М. Рациональная нейропротекция. - Донецк: Изд. Заславский А.Ю., 2009. - 262 с.]. Кроме того, с появлением ноотропов впервые появилась возможность целенаправленного фармакологического воздействия на когнитивные функции (внимание, память, способность к оценке и анализу ситуации, принятию решений) и проявления психического и неврологического дефицита, формирующегося при органическом поражении головного мозга. Ноотропы облегчают деятельность клеток мозга при кислородном голодании, которое может возникнуть после инсульта, черепно-мозговой травмы, инфекционных заболеваний, интоксикаций [Незнамов Г.Г., Телешова Е.С., Сюняков С.А. Новый пептидный препарат Ноопепт у больных с психоорганическими расстройствами // Спр. поликлинич. врача. - 2007. - Т. 5. - № 2. - С. 26-35]. Людям пожилого возраста врачи рекомендуют принимать ноотропные препараты постоянно - они улучшают самочувствие, работоспособность и настроение. О чрезвычайной важности препаратов с ноотропным действием свидетельствуют данные о широком распространении их применения - по статистике ВОЗ, треть взрослого населения Европы и Японии принимает ноотропы, и их с полным основанием можно отнести к группе жизненно важных препаратов [Косарев В.В., Бабанов С.А. Клинико-фармакологические подходы к применению ноотропов при неврологических заболеваниях // Лекции для врачей. - 2010. - № 2. - С. 4-8]. В связи с этим поиск новых, более эффективных и безопасных ноотропных препаратов, обладающих сбалансированным спектром психофармакологических свойств, является актуальной проблемой современной фармакологии и фармации.
Перспективными в плане разработки новых высокоэффективных, селективных и безопасных психотропных препаратов являются производные хиназолина, структурно близкие к эндогенным пиримидиновым основаниям и их производным, обладающим широким спектром ценных психотропных свойств - ноотропных, анксиолитических и антидепрессивных [Кодониди И.П. Молекулярное конструирование и целенаправленный синтез N-замещенных производных 4-оксо-1,4-дигидропиримидина на основе тормозных нейромедиаторов // Хим. фармац. журн. - 2009. - Т. 43. - № 10. - С. 32-39].
Производные хиназолина широко распространены в живой природе, в настоящее время из низших грибов, бактерий и высших растений выделено около 150 алкалоидов хиназолинового ряда, многие из которых обладает высокой фармакологической активностью и нашли применение в медицинской практике. Наиболее известным алкалоидом хиназолинового ряда является фебрифугин (Febrifugine), выделенный из листьев и корней китайского лекарственного растения Dichroa febrifuga. Фебрифугин - известный противомалярийный препарат, он приблизительно в 100 раз более активен по сравнению с хинином, однако более токсичен. Фебрифугин оказывает также выраженное кокцидостатическое действие [Arora R., Карооr A., Gill N.S., Rana A.C. Quinazolinone: an overview // Int. Res. J. Pharmacy. - 2011. - Vol. 2. - No.12. - P. 22-28].
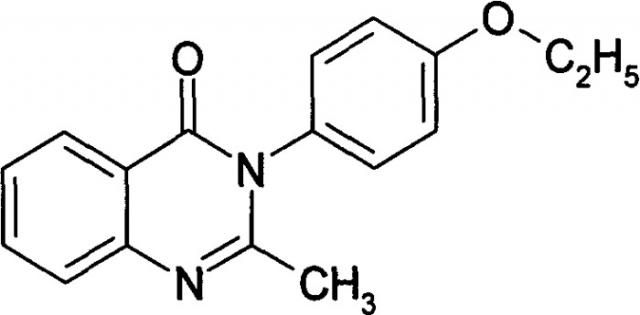
Синтетические производные хиназолина также обладают широким спектром фармакологической активности, многие из них нашли применение в медицинской практике в качестве эффективных и безопасных терапевтических и профилактических препаратов. Одним из наиболее известных препаратов хиназолиного ряда является метаквалон (Quaalude, Mandrax, Sopor), который в марте 1966 г. был одобрен правительством США как седативно-гипнотический препарат, не вызывающий привыкания:
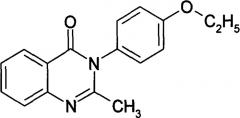
В дальнейшем были получены более эффективные аналоги метаквалона (этаквалон, меклоквалон, хлороквалон, нитрометаквалон) и современный препарат лонетил - транквилизатор с анксиолитической и седативной активностью. Лонетил показан при расстройствах сна, тревоге, психовегетативных проявлениях, невротических (неврозоподобных) расстройствах. В клинике лечения алкоголизма лонетил используют для купирования алкогольного абстинентного синдрома, а также в период ремиссии. Лечение препаратом способствует уменьшению страха, тревоги, раздражительности, нормализации ночного сна, устранению вегето-сосудистых проявлений. Устранение психопатологической симптоматики, наблюдающейся у больных алкоголизмом в период ремиссии, обуславливает снижение патологического влечения к алкоголю [Лекарственные средства в клинике алкоголизма и наркомании. Руководство для врачей / Под ред. А.Ю. Магалифа. - М.: РГМУ, 1999. - 111 с.]:
Среди других известных лекарственных препаратов хиназолинового ряда следует упомянуть специфический антагонист 5-НТ2-рецепторов кетансерин, селективный ингибитор тирозинкиназы гетифиниб, ингибитор дигидрофолат редуктазы триметриксат, диуретик хинетазон, ai-адреноблокатор празозин, анальгетическое и противовоспалительное средство дипроквалон, фунгицидный препарат альбоконазол. Однако все указанные лекарственные средства и их многочисленные структурные аналоги не обладают ноотропным или противогипоксическим действием. Несмотря на достаточно широкий спектр фармакологической активности синтетических производных хиназолина (анальгетическая, противовоспалительная, антибактериальная, противовирусная, противоопухолевая, противомалярийная, антигипертензивная, противодиабетическая активность), сведения об их влиянии на центральную нервную систему относительно немногочисленны. Известны тиадиазолилпроизводные хиназолин-4(3H)-она общей формулы
где R1 и R2 - ароматические заместители,
которые обладают психоугнетающими и противосудорожными свойствами [Jatav V., Mishra P., Kashaw S., Stables J.P. Synthesis and CNS depressant activity of some novel3-[5-substituted 1,3,4-thiadiazole-2-yl]-2-styryl quinazoline-4(3H)-ones // Eur. J. Med. Chem. - 2008. - Vol. 43. - P. 135-141].
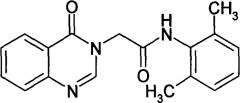
Наиболее близким по химическому строению к предлагаемым соединениям является N-(2,6-диметилфенил)-2-[4-оксо-3(4H)-хиназолинил]-ацетамид формулы:
Указанное соединение не обладает ноотропными и антигипоксическими свойствами, в спектре психофармакологических свойств этого вещества преобладают тревожно-фобические и продепрессивные эффекты [Тюренков И.Н., Озеров А.А., Солодунова Е.А., Арчакова Ю.В., Глухова Е.Г., Шматова Е.Н. Аномалия в ряду фармакологических свойств производных хиназолин-4(3H)-она, имеющих фрагменты ацетанилида в качестве заместителей // Вестник ВолгГМУ. - 2012. - Вып. 2. - С. 66-68].
Целью изобретения является получение новых производных хиназолина, обладающих сбалансированным комплексом психофармакологических свойств - ноотропных и антигипоксических.
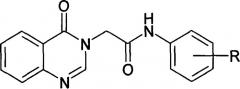
Сущность изобретения заключается в синтезе новых производных хиназолина общей формулы:
где R = o-СН3, n-СН3 или 2,3-фенилен.
Предлагаемые соединения, сочетающие в своей структуре фрагменты хиназолин-4(3H)-она и замещенного ацетанилида, обладают выраженной ноотропной и антигипоксической активностью in vivo, превосходящей активность эталонных препаратов.
Пример 1. N-(2-Метилфенил)-2-[4-оксо-3(4H)-хиназолинил]ацетамид (соединение I).
Смесь 2,0 г (13,7 ммоль) хиназолин-4(3H)-она, 4,0 г (28,9 ммоль) безводного карбоната калия и 50 мл диметилформамида перемешивают при температуре 100-105°С в течение 30 мин, добавляют 2,8 г (15,1 ммоль) 2-хлор-N-(2-метилфенил)ацетамида и перемешивают при той же температуре в течение 1 ч. Охлаждают до комнатной температуры, фильтруют, фильтрат выдерживают при температуре 0-5°С в течение 1 сут, выделившийся осадок отфильтровывают, промывают холодным диметилформамидом, водой и сушат на воздухе. Перекристаллизовывают из диметилформамида и получают 2,80 г соединения I, выход 70 %, Т.пл. 266-268°С.
Спектр ПМР (ДМСО-d6, δ, м.д.: 2,19 с (3H, CH3); 4,86 с (2H, CH2); 7,02 т (7 Гц, 1Н, Н6); 7,33-7,52 м (4Н, фенил); 7,66 д (8 Гц, 1H, H8); 7,81 т (7,5 Гц, 1H, Н7); 8,11 д (7 Гц, 1H, H5); 8,33 с (1H, H2); 9,77 с (1H, NH).
Пример 2. N-(4-Метилфенил)-2-[4-оксо-3(4H)-хиназолинил]ацетамид (соединение II).
Смесь 2,0 г (13,7 ммоль) хиназолин-4(3H)-она, 4,0 г (28,9 ммоль) безводного карбоната калия и 50 мл диметилформамида перемешивают при температуре 100-105°C в течение 30 мин, добавляют 2,8 г (15,1 ммоль) 2-хлор-N-(4-метилфенил)ацетамида и перемешивают при той же температуре в течение 1 ч. Охлаждают до комнатной температуры, фильтруют, фильтрат упаривают в вакууме, к остатку добавляют 50 мл воды, выдерживают при температуре 0-5°C в течение 1 сут, образовавшийся осадок отфильтровывают, промывают водой и сушат на воздухе. Перекристаллизовывают из смеси этиловый спирт - диметилформамид (3:1) и получают 2,29 г соединения II, выход 57%, Т.пл. 256-258°C.
Спектр ПМР (ДМСО-d6), δ, м.д.: 2,20 с (3H,CH3); 4,80 с (2H, CH2); 7,03 д (8 Гц, 2H, фенил); 7,39 д (7 Гц, 2H, фенил); 7,48 т (7,5 Гц, 1H, H6); 7,63 д (8 Гц, 1H, H8); 7,77 т (7,5 Гц, 1H, H7); 8,07 д (7 Гц, 1H, H5); 8,29 с (1H, H2); 10,31 c (1H, NH).
Пример 3. N-(1-Нафтил)-2-[4-оксо-3(4H)-хиназолинил]ацетамид (соединение III).
Смесь 2,0 г (13,7 ммоль) хиназолин-4(3H)-она, 4,0 г (28,9 ммоль) безводного карбоната калия и 100 мл диметилформамида перемешивают при температуре 100-105°C в течение 30 мин, добавляют 3,3 г (15,1 ммоль) 2-хлор-N-(1-нафтил)ацетамида перемешивают при той же температуре в течение 1 ч. Охлаждают до комнатной температуры, фильтруют, фильтрат выдерживают при температуре 0-5°C в течение 1 сут, выделившийся осадок отфильтровывают, промывают холодным диметилформамидом, водой и сушат на воздухе. Перекристаллизовывают из диметилформамида и получают 2,97 г соединения III, выход 66 %, Т.пл. 319-322°С.
Спектр ПМР (ДМСО-d6), δ, м.д.: 5,02 с (2H, CH2), 7,44-7,86 м (9H, H6, H8, нафтил), 7,91 т (7,5 Гц, 1H, H7), 8,14 д (7,5 Гц, 1H, H5), 8,4 с (1H, H2), 10,41 c (1H, NH).
Пример 4. Исследование ноотропной активности
Ноотропные свойства новых производных хиназолина изучали на моделях ассоциативного обучения, основанных на выработке условных рефлексов избегания аверсивного фактора: «условной реакции пассивного избегания» (УРПИ) и «теста экстраполяционного избавления» (ТЭИ). В первой серии экспериментов изучено влияние веществ на изменение памятного следа у животных в динамике: каждый тест выполнялся в несколько этапов - первый этап заключался в выработке рефлекса избегания аверсивного фактора, на последующих этапах выполнялась оценка обученности животных и сохранности у них памятного следа. Тест УРПИ воспроизводили через 24 ч, 3 и 7 сут после обучения, ТЭИ - через 24 ч.
Тест УРПИ традиционно применяется в психофармакологии для выявления специфической ноотропной активности веществ. Тест позволяет оценить влияние веществ на обучаемость, формирование, сохранение и воспроизведение памятного следа в норме и в условиях амнезии (чаще электросудорожного или хемоиндуцированного - скополаминового - происхождения), на различные фазы памяти при вариациях сроков введения веществ (введение до выработки рефлекса характеризует запоминание и обучаемость, сразу после выработки рефлекса - консолидацию памятного следа, перед воспроизведением рефлекса - извлечение информации из памяти, неоднократное воспроизведение рефлекса через различные интервалы времени - динамику процесса забывания). Установка для эксперимента УРПИ представляет собой два смежных отсека, один из которых большой (60×40×40 см), открытый сверху и ярко освещенный (90 лк), другой - меньшего размера (15×15×15 см), затемненный, закрытый со всех сторон, имеющий четырехугольное отверстие (8×8 см), для сообщения с большим отсеком и электродный пол. Тест выполняется в два этапа:
обучение навыку пассивного избавления и воспроизведение динамики его сохранности. Во время эксперимента тестируемое животное помещают на середину площадки освещенного отсека, хвостом к отверстию в темный отсек. В течение 3 мин за подопытным животным ведется визуальное наблюдение. При обучении навыку после каждого захода в темный отсек животному наносят электроболевое раздражение (40 В, 3 импульса по 1 с, с интервалом 0,5 с), животных, не заходящих в темную камеру за это время, из опыта исключают. На этапе обучения фиксируются показатели: латентный период первого захода в темный отсек (время от момента помещения животного в середину площадки до первого захода в темный отсек) и количество заходов в него. При проверке выработки рефлекса на втором этапе тестирования латентный период первого захода в темный отсек и количество заходов в него сравниваются с аналогичными показателями при обучении, увеличение латентного периода и уменьшение числа заходов указывают на обученность животного, сохранность в памяти информации об аверсивности темного отсека. Общее время нахождения в темном отсеке, регистрируемое при воспроизведениях навыка, также отражает сохранность памятного следа у животного - чем меньше времени животное проводит в темном отсеке, тем лучше оно помнит о нанесенном ему здесь электроболевом раздражении. Воспроизведение рефлекса выполняется аналогичным образом, однако не проводится электроболевая стимуляция животного, регистрируется латентный период первого захода в темный отсек (время от момента помещения животного в середину площадки до первого захода в темный отсек), количество заходов в него, общее время нахождения животного в темном и светлом отсеках. Проверка сохранения УРПИ осуществляется в динамике через 24 ч, 7 и 14 сут путем повторного помещения животного в освещенный отсек. Увеличение под действием соединения латентного периода захода в темный отсек, уменьшение количества заходов и времени пребывания в нем по отношению к контролю на всех этапах воспроизведения навыка избегания учитывается как положительное влияние на обучаемость и память животных, замедление угасания памятного следа в динамике и расценивается как наличие ноотропного действия.
Тест ТЭИ также широко применяется для изучения ноотропной активности фармакологических веществ. Принцип метода: тестируемое животное помещается в стеклянный аквариум прямоугольной формы размерами 39×21×25 см, заполненный на 17,5 см водой, имеющей температуру 16-18°C, под стеклянный цилиндрический колпак диаметром 9 см и высотой 18,5 см, края которого погружаются в воду на 2,5 см. В течение 3 мин ведется визуальное наблюдение за животным. Решение задачи заключается в подныривании под края колпака и избавлении, таким образом, от аверсивной водной среды. Регистрируемые показатели: латентный период (ЛП) двигательной активности (время о момента погружения в воду до начала активного плавания), время иммобилизации (животное пассивно плавает в воде со слегка поднятой головой, все четыре конечности неподвижны), количество прыжков в колпаке (активные попытки выпрыгнуть из воды), ЛП подныривания (время от момента погружения животного в воду до подныривания под края колпака). Эксперимент состоит из двух этапов: обучение навыку (выработка рефлекса избавления) и его воспроизведение через 24 ч. Животные, не решающие задачу за время наблюдения на этапе обучения, исключаются из опыта. При оценке когнитивных функций наибольшее значение имеют такие показатели как: ЛП двигательной активности, характеризующий скорость ориентировочных реакций; ЛП подныривания - показатель способности к экстраполяции (чем меньше значение показателя, тем выше скорость решения экстраполяционной задачи), сравнение показателя ЛП подныривания при обучении и воспроизведении навыка показывает степень обученности животного и состояние памяти (чем значительнее он уменьшается при воспроизведении теста, тем больше обученность животного и сохраннее памятный след). Тест также дает возможность оценить выраженность у животных поведенческой депрессии и антидепрессивные эффекты фармакологических веществ путем учета количества прыжков (активных попыток избавиться от аверсивного воздействия) и времени иммобильности (признака депрессивности). В настоящем исследовании проверка выработки и сохранности навыка экстраполяционного избавления осуществлялась в динамике - через 24 ч.
Эксперименты выполнены на белых беспородных крысах самцах (200-260 г), содержавшихся в стандартных условиях вивария при естественном свето-темновом режиме, свободном доступе к воде и полнорационному гранулированному корму (ГОСТ Р 50258-92). Исследование проведено в соответствии с ГОСТ 3 51000.3-96, ГОСТ 3 51000.4-96 и Приказом МЗ РФ № 267 от 19.06.2003 г. «Об утверждении правил лабораторной практики» (GLP). Исследуемые вещества вводили за 30 мин до обучения навыку УРПИ перорально в дозе 10 мг/кг, препараты сравнения: пирацетам - 500 мг/кг, фенибут - 25 мг/кг, фенотропил - 25 мг/кг.
Соединение III и в большей мере I и II проявили выраженное ноотропное действие, сопоставимое с фенотропилом и превосходящее фенибут и пирацетам. У животных, получавших соединения I-III, в тесте УРПИ отмечался статистически значимо больший латентный период захода в темный отсек, чем у животных контрольной группы и животных, получавших пирацетам и фенибут. У животных, получавших исследуемые вещества, в большей мере сохранялся памятный след об аверсивном воздействии, о чем свидетельствует больший латентный период захода в темный отсек через 24 ч, но в еще большей степени через 3 и 7 сут (табл. 1).
При оценке когнитивных функций в ТЭИ было установлено, что соединения I-III при выработке навыка экстраполяционного избавления на этапе первого тестирования улучшали скорость ориентировочных реакций (уменьшали латентный период подныривания при обучении) в незнакомой аверсивной среде (холодная вода). При тестировании через 24 ч животные, которым вводили соединения I-III, решали задачу экстраполяционного избавления также быстрее, чем животные контрольной группы и чем животные, которым вводились препараты сравнения: фенибут и пирацетам.
Для дополнительного подтверждения наличия ноотропных свойств у новых производных хиназолина было выполнено дополнительное исследование в условиях хемоиндуцирующего амнезирующего воздействия. На модели скополаминовой амнезии (скополамин однократно, внутрибрюшинно в дозе 15 мг/кг) ноотропные (антиамнестические) свойства проявились в еще большей степени. Так, соединения I-III в группе животных с амнезией УРПИ статистически значимо увеличивали латентный период захода в темный отсек, уменьшали количество заходов в него, проявляя таким образом антиамнестический эффект, свидетельствующий об их ноотропной активности (табл. 2). По выраженности ноотропного действия новые соединения статистически значимо превосходили пирацетам, фенибут и были сопоставимы с фенотропилом.
Пример 5. Исследование антигипоксической активности
Антигипоксическое действие новых производных хиназолина и препаратов сравнения изучалось на моделях «нормобарической гипоксии с гиперкапнией («баночная» гипоксия)» и «гемической гипоксии, вызванной нитритной интоксикацией».
«Нормобарическая гипоксия с гиперкапнией» используется для оценки антигипоксического эффектафармакологически активных веществ. Эксперимент выполняется на мышах. Методика заключается в помещении животных одинакового веса (разброс не более 2 г на группу) по одному в герметически закрываемые контейнеры объемом 200 мл. Испытуемые вещества вводят до начала эксперимента с учетом пика их действия. Регистрируется время до наступления апноэ (резервное время, время жизни в условиях гипоксии) у животного, которое фиксируется визуально. После этого животное извлекается из контейнера и реанимируется. Увеличение продолжительности жизни животных в условиях гипоксии (по сравнению с контролем) под влиянием изучаемых соединений свидетельствует о наличии у них противогипоксического эффекта.
«Гемическая гипоксия, вызванная нитритной интоксикацией» также используется для оценки противогипоксического действия соединений. Тест проводится на мышах. Эксперимент заключается в однократном подкожном введении животным в шейную область спины нитрита натрия в токсической дозе 250 мг/кг с последующей регистрацией продолжительности жизни животных. Испытуемые вещества вводят до начала эксперимента с учетом пика их действия. Увеличение продолжительности жизни животных в условиях гипоксии на фоне метгемоглобинемии (по сравнению с контролем) под влиянием изучаемых соединений свидетельствует о наличии у них противогипоксической активности.
Выявлены отчетливые противогипоксические свойства у соединений I-III (10 мг/кг, перорально за 30 мин до гипоксии), которые статистически достоверно и сопоставимо с мексидолом (100 мг/кг) и более выражение по сравнению с пирацетамом (500 мг/кг) увеличивают продолжительность жизни животных в условиях нормобарической гипоксии с гиперкапнией и при гемической гипоксии, вызванной интоксикацией нитритом натрия (табл. 3).
Таким образом, новые производные хиназолина сочетают высокую ноотропную активность с отчетливым антигипоксическим действием. По степени ноотропного и антиамнестического действия новые соединения, используемые в значительно более низких дозах, превосходят фенибут и, в еще большей степени, пирацетам, и сопоставимы с фенотропилом. По выраженности антигипоксического действия они статистически значимо превосходят пирацетам и не уступают мексидолу.
Представленные данные позволяют считать, что лекарственные средства, полученные на основе новых производных хиназолина, могут пополнить арсенал оригинальных ноотропных средств и найти широкое применение при лечении органических поражений головного мозга.
| Таблица 1 | |||||||
| Ноотропная активность новых производных хиназолина | |||||||
| Регистрируемые показатели | Значения показателей (M±m) | ||||||
| Контроль | I | II | III | Фенотропил | Фенибут | Пирацетам | |
| Влияние веществ на обучаемость и память в тесте УРПИ | |||||||
| ЛП при обучении после введения веществ | 19,2±0,95 | 24,0±4,31 | 20,2±0,60 | 13,7±0,42 | 18,1±1,6 | 24,2±2,68 | 30,2±2,84 |
| ЛП при воспроизведении через 24 ч | 127,7±12,08 | 170,0±10,0**#Δ | 176,3±14,16**#Δ | 165,2±27,25 | 169,2±12,7** | 148,0±9,4* | 140,4±12,8 |
| ЛП при воспроизведении через 3 сут | 77,7±27,36 | 154,3±21,8*** | 142,7±16,27*** | 141,3±14,4* | 140,3±26,0*** | 132,4±12,9*** | 118,0±10,4 |
| ЛП при воспроизведении через 7 сут | 53,2±17,6 | 122,0±34,22** | 129,2±10,5***Δ | 111±14,21***Δ | 127,9±23,6***Δ | 118,6±13,1***Δ | 92,6±9,2 |
| Влияние веществ на мнестическую функцию в ТЭИ | |||||||
| ЛП подныривания при обучении после введения веществ | 35,0±1,15 | 17,3±0,92***#Δ | 21,0±0,77*** | 25,2±1,87** | 22,4±2,36* | 26,2±4,0* | 31,5±3,0 |
| ЛП подныривания при воспроизведении через 24 ч | 26,0±0,73 | 7,0±0,97***#Δ | 10,7±0,56*** | 13,2±0,70**** | 11,6±1,92***Δ# | 17,4±3,3** | 16,1±1,1** |
| Обозначения: * - p<0,05; ** - p<0,01; *** - p<0,005; **** - p<0,001 - достоверность различий по сравнению с контрольной группой животных; | |||||||
| # - достоверность различий по сравнению с животными, получавшими фенибут; | |||||||
| Δ - достоверность различий по сравнению с животными, получавшими пирацетам (ранговый однофакторный анализ Крускала-Уоллиса, критерий Данна для множественных сравнений) |
| Таблица 2 | ||||||||
| Исследование ноотропной активности на модели скополаминовой амнезии | ||||||||
| Регистрируемые показатели | Значения показателей (M±m) | |||||||
| Контроль интактный | Контроль + амнезия | I + амнезия | II+ амнезия | III + амнезия | Фенотропил + амнезия | Фенибут + амнезия | Пирацетам + амнезия | |
| Этап выработки рефлекса | ||||||||
| ЛП первого захода в темный отсек | 27,6±2,4 | 26,0±2,3 | 25,1±3,6 | 30,7±7,3 | 28,6±6,9 | 32,4±3,0 | 27,4±9,6 | 34,3±8,8 |
| Количество заходов | 1,12±0,13 | 1,12±0,13 | 1,12±0,13 | 1,12±0,13 | 1,0±0 | 1,12±0,13 | 1,25±0,2 | 1,25±0,2 |
| Этап воспроизведения до введения скополамина | ||||||||
| ЛП первого захода в темный отсек | 180±0 | 180±0 | 180±0 | 180±0 | 180±0 | 180±0 | 180±0 | 180±0 |
| Количество заходов, N/n (%) | 0/8 (0) | 0/8 (0) | 0/8 (0) | 0/8 (0) | 0/8 (0) | 0/8 (0) | 0/8 (0) | 0/8 (0) |
| Этап воспроизведения после введения скополамина | ||||||||
| ЛП первого захода в темный отсек | 180±0** | 52,0±8,1 | 158,5±1,5***#Δ | 135,4±17,5**Δ | 157,9±2,1***#Δ | 147,0±26,6***#Δ | 122,1±13,6 | 69,4±11,2 |
| Количество заходов, N/n (%) | 0/8 (0) | 8/8 (100) | 1/8 (12,5)***#Δ | 2/8 (25)**Δ | 1/8; (12,5) ***#Δ | 1/8 (12,5)***#Δ | 4/8 (50) | 6/8 (75) |
| Таблица 3 | ||||||
| Исследование антигипоксической активности | ||||||
| Регистрируемые показатели | Значения показателей (M±m) | |||||
| Контроль | I | II | III | Пирацетам | Мексидол | |
| Нормобарическая гипоксия с гиперкапнией | ||||||
| Время жизни животных, с | 572,0±18,5 | 749,1±58** | 752,8±45** | 827,8±104*** | 728±69*** | 800,1±63,4** |
| Изменение в % по сравнению с контролем | - | +30,9 | +31,6 | +44,7 | +27,4 | +39,9 |
| Гемическая гипоксия | ||||||
| Время жизни животных, с | 912±62,1 | 1492±165**# | 1419±78**# | 1379±152 | 1234±88** | 1296±134* |
| Изменение в % по сравнению с контролем | - | +41,7 | +33,7 | +51,2 | +35,3 | +42,1 |
| Обозначения: * - p<0,05; ** - p<0,01; *** - p<0,005 - достоверность различий по сравнению с контрольной группой животных; | ||||||
| # - достоверность различий по сравнению с животными, получавшими пирацетам (ранговый однофакторный анализ Крускала-Уоллиса, критерий Данна для множественных сравнений) |
Средство, обладающее ноотропной и антигипоксической активностью, представляющее собой соединение общей формулы где R=о-СН3, n-СН3 или 2,3-фенилен.