Производные стерина и их синтез и применение
Иллюстрации
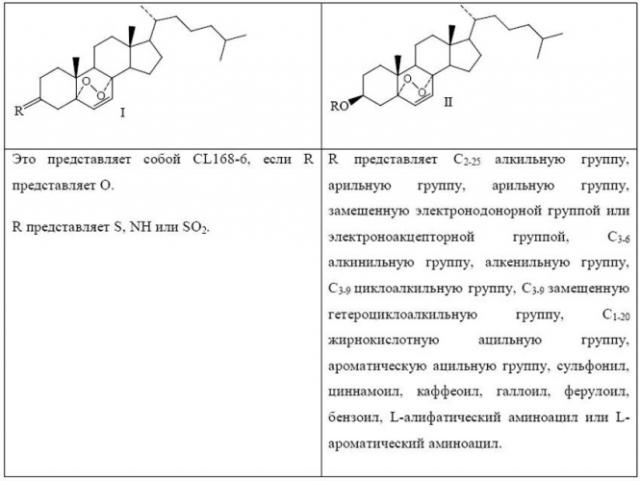
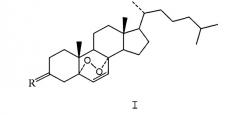
Показать всеИзобретение относится к соединению CL168, представленному общей структурной формулой I, где R представляет собой кислород. Также изобретение относится к способу получения соединения формулы I и к применению соединения формулы I при получении лекарственного средства для предупреждения и лечения опухолевых и иммунологических заболеваний. Технический результат - соединение формулы I для получения лекарственного средства для предупреждения и лечения опухолевых и иммунологических заболеваний. 4 н.п. ф-лы, 11 ил., 11 табл., 19 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к фармацевтическим соединениям в области химических и биологических наук, в частности, к противоопухолевым лекарственным средствам CL168 с общей структурной формулой I и II и их способу синтеза и применению.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Опухоль является одним из основных заболеваний, которые пагубны для человеческого здоровья, и становится вторым по летальности среди различных заболеваний. Большое количество клинических опытов доказывает, что при уничтожении опухолевых клеток химическая обработка и радиационная обработка одновременно характеризуются значительным повреждающим воздействием на нормальные клетки. Эти обработки приводят к серьезному повреждению гемопоэтической системы и нарушению иммунной функции человеческого организма и легко приводят к смерти пациентов. Все опухолевые клетки зависят от сосудов, и ангиогенез является важным этапом при росте и метастазировании опухоли. Как для первичных опухолей, так и вторичных опухолей ангиогенез возникает после того, как опухоль вырастает до диаметра более 2 мм, и затем опухоли растут быстрее и возникает метастазирование (Folkman J. what is the evidence that tumors are angiogenesis department? J Nati Cancer Inst. 1990, 82: 4-6).
В настоящее время лекарственные средства для лечения опухолей в основном могут быть разделены на три типа: цитотоксические лекарственные средства, вспомогательные лекарственные средства при радиотерапии и химиотерапии и ингибиторы ангиогенеза. В настоящее время ингибиторы ангиогенеза являются типом очень многообещающих противоопухолевых лекарственных средств.
КРАТКОЕ ОПИСАНИЕ ДАННОГО ИЗОБРЕТЕНИЯ
Соединения данного изобретения под названием CL168 представляют собой тип соединений с новыми структурными скелетами, явными активностями и специфическими противоопухолевыми мишенями, выбранные из структурных модификаций сотен природных продуктов на основании принципа отбора по модели САМ (Ribatti D, Vacca A, et al. The chick embryo chorioallantoic membrane as a model for in vivo research on anti-angiogenesis. Curr Pharm Biotechnol. 2000 Jul;l(l):73-82.) и VEGF (Gretten TF. Korangy F, et al. Molecular therapy for the treatment of hepatocellular carcinoma.Br J Cancer. 2009 Jan 13; 100(1): 19-23.). Фармакологические эксперименты показывают, что эти соединения обладают значительными противоопухолевыми эффектами, где CL 168-6 имеет противоопухолевый терапевтический индекс 49,3, и могут применяться для получения лекарственных средств для предупреждения и лечения рака, такого как рак печени, рак легких и т.д., и иммунологических заболеваний.
Одной из целей данного изобретения является обеспечение пути синтеза для получения CL168, которое представлено общей формулой I, и его промежуточных химических соединений.
Второй целью данного изобретения является обеспечение пути синтеза для получения CL168, которое представлено общей формулой П, и его промежуточных химических соединений.
Третьей целью данного изобретения является обеспечение применений CL168 общих формул I и П и их промежуточных химических соединений в исследованиях противоопухолевой активности и улучшения иммунитета.
Цели данного изобретения могут быть осуществлены при помощи следующих процедур.
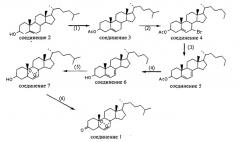
Соединение CL168, представленное общей структурной формулой I, может быть получено способом, включающим следующие этапы:
(1) растворение холестерина (холест-5-ен-3-ол), (соединение 2) в органическом растворителе для получения холестерилацетата (соединение 3) путем реакции холестерина с уксусным ангидридом при катализе катализатором при определенной температуре;
(2) растворение соединения 3 в органическом растворителе для получения 7-бромхолестен-3-олацетата (соединение 4) путем реакции соединения 3 с бромидным реагентом при катализе катализатором при определенной температуре;
(3) растворение соединения 4 в органическом растворителе для получения 7-дегидрохолестен-3-олацетата (соединение 5) путем реакции отщепления с основанием при определенной температуре;
(4) растворение соединения 5 в органическом растворителе для получения 7-дегидрохолестерина (соединение 6) путем гидролиза соединения 5 с основанием при определенной температуре;
(5) растворение соединения 6 в органическом растворителе для получения 5а,8а-эпидиокси-6-холестен-3-ола (соединение 7) путем окисления соединения 6 окислителем при определенной температуре;
(6) растворение соединения 7 в органическом растворителе для получения 5а,8а-эпидиокси-6-холестен-3-она (соединение 1, т.е. CL168-6) путем окисления соединения 7 окислителем при определенной температуре;
Уравнения реакций на вышеуказанных этапах (1)-(6) являются следующими:
Где на этапе (1) органический растворитель выбирают из группы, включающей следующие соединения, каждое из которых содержит 2-20 атомов углерода: эфир, спирт, алкан, ароматический углеводород, кетон, алкилгалогенид, амид, нитрил, сложный эфир или их смесь с различными отношениями концентраций компонентов смеси; температура составляет от -20°С до 250°°С; катализатором является протонная кислота, такая как серная кислота, или органическое основание, такое как пиридин; молярное соотношение соединения 2 к уксусному ангидриду равно 1:1 -20.
Где на этапе (2) органический растворитель выбирают из группы, включающей следующие соединения, каждое из которых содержит 2-20 атомов углерода: ароматический углеводород, алкан, эфир, кетон, алкилгалогенид, амид, нитрил, сложный эфир или их смесь с различными с различными отношениями концентраций компонентов смеси; температура составляет от -10°С до 150°С; бромидным реагентом является бромсукцинимид (NBS), бромоводород или ацетилбромид; катализатором является трифенилфосфин или источник света с длиной волны 290-800 нм; молярное соотношение соединения 3 к бромидному реагенту равно 1:1-10.
Где на этапе (3) органический растворитель выбирают из группы, включающей следующие соединения, каждое из которых содержит 2-20 атомов углерода: ароматический углеводород, алкан, эфир, кетон, алкилгалогенид, амид, нитрил, сложный эфир или их смесь с различными отношениями концентраций компонентов смеси; температура составляет от 0°С до 150°С; катализатором является органическое основание, такое как пиридин или триэтиламин; молярное соотношение соединения 4 к органическому основанию равно 1:1-10.
Где на этапе (4) органический растворитель выбирают из группы, включающей следующие соединения, каждое из которых содержит 2-20 атомов углерода: эфир, спирт, алкан, ароматический углеводород, кетон, алкилгалогенид, амид, нитрил, сложный эфир или их смесь с различными отношениями концентраций компонентов смеси; температура составляет от 0°С до 150°С; катализатором является протонная кислота, которая представлена серной кислотой, или протонное основание, которое представлено гидроксидом натрия.
Где на этапе (5) органический растворитель выбирают из группы, включающей следующие соединения, каждое из которых содержит 2-20 атомов углерода:
ароматический углеводород, алкан, эфир, кетон, алкилгалогенид, амид, нитрил, сложный эфир или их смесь с различными отношениями концентраций компонентов смеси; температура составляет от 0°С до 150°С; катализатором является эозин Y, трифенилфосфин или источник света с длиной волны 290-800 нм.
Где на этапе (6) органический растворитель выбирают из группы, включающей следующие соединения, каждое из которых содержит 2-20 атомов углерода:
ароматический углеводород, алкан, эфир, кетон, алкилгалогенид, амид, нитрил, сложный эфир или их смесь с различными отношениями концентраций компонентов смеси; температура составляет от -20°С до 100°С; серная кислота или раствор хромовой кислоты представляют собой иллюстративный окислитель.
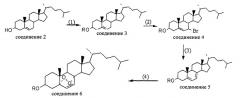
Соединение CL168, представленное общей структурной формулой II, может быть получено способом, включающим следующие этапы:
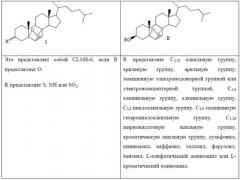
(1) растворение холестерина (соединение 2) в органическом растворителе для получения соединения 3 путем реакции холестерина с реактивом, служащим донором R (R представляет собой C2-25 алкильную группу, арильную группу, арильную группу, замещенную электронодонорной группой или электроноакцепторной группой, С3-6 алкинильную группу, алкенильную группу, С3-9 циклоалкильную группу, С3-9 замещенную гетероциклоалкильную группу, С1-20 жирнокислотную ацильную группу, ароматическую ацильную группу, сульфонил, циннамоил, каффеоил, галлоил, ферулоил, бензоил, L-алифатический аминоацил или L-ароматический аминоацил), при катализе катализатором при определенной температуре;
(2) растворение соединения 3 в органическом растворителе для получения соединения 4 путем реакции соединения 3 с бромидным реагентом при катализе катализатором при определенной температуре;
(3) растворение соединения 4 в органическом растворителе для получения соединения 5 путем реакции отщепления с основанием при определенной температуре;
(4) растворение соединения 5 в органическом растворителе для получения соединения 6 путем окисления соединения 5 окислителем при определенной температуре;
Уравнения реакции на вышеуказанных этапах (1)-(4) являются следующими:
Где на этапе (1) органический растворитель выбирают из группы, включающей следующие соединения, каждое из которых содержит 2-20 атомов углерода: эфир, спирт, алкан, ароматический углеводород, кетон, алкилгалогенид, амид, нитрил, сложный эфир или их смесь с различными отношениями концентраций компонентов смеси; температура составляет от -20°С до 250°С; катализатором является протонная кислота, такая как серная кислота, или органическое основание, такое как пиридин; молярное соотношение соединения 2 к уксусному ангидриду равно 1:1 -20;
Где на этапе (2) органический растворитель выбирают из группы, включающей следующие соединения, каждое из которых содержит 2-20 атомов углерода: ароматический углеводород, алкан, эфир, кетон, алкилгалогенид, амид, нитрил, сложный эфир или их смесь с различными отношениями концентраций компонентов смеси; температура составляет от -10°С до 150°С; бромидным реагентом является бромсукцинимид (NBS), бромоводород или ацетилбромид; катализатором является трифенилфосфин или источник света с длиной волны 290-800 нм; молярное соотношение соединения 3 к бромидному реагенту равно 1:1-10;
Где на этапе (3) органический растворитель выбирают из группы, включающей следующие соединения, каждое из которых содержит 2-20 атомов углерода: ароматический углеводород, алкан, эфир, кетон, алкилгалогенид, амид, нитрил, сложный эфир или их смесь с различными отношениями концентраций компонентов смеси; температура составляет от 0°С до 150°С; катализатором является органическое основание, которое представлено пиридином и триэтиламином; молярное соотношение соединения 4 к органическому основанию равно 1:1-10;
Где на этапе (4) органический растворитель выбирают из группы, включающей следующие соединения, каждое из которых содержит 2-20 атомов углерода: ароматический углеводород, алкан, эфир, кетон, алкилгалогенид, амид, нитрил, сложный эфир или их смесь с различными отношениями концентраций компонентов смеси; температура составляет от 0°С до 150°С; катализатором является эозин Y, трифенилфосфин или источник света с длиной волны 290-800 нм.
Полученное выше CL 168-6 (5α,8α-эпидиокси-6-холестен-3-он) обладает значительным ингибируюшим эффектом на пролиферацию клетки гепатомы человека HepG2 и клетки рака легких человека А549 in vitro;
Полученное выше CL168-6 (5α,8α-эпидиокси-6-холестен-3-он) обладает значительной ингибирующей активностью на опухолевый ангиогенез;
Полученное выше CL168-6 (5α,8α-эпидиокси-6-холестен-3-он) может эффективно ингибировать рост опухоли S180, продлевать время выживаемости мышей с опухолью и увеличивать селезеночный индекс мышей;
Полученное выше CL168-6 (5α,8α-эпидиокси-6-холестен-3-он) проявляет низкую токсичность in vivo, и LD50 мышей составляет 1479 мг/кг;
Полученное выше CL168-6 (5а,8а-эпидиокси-6-холестен-3-он) может быть изготовлено в лекарственных формах перорального, инъекционного и наружного введения и применяться для предупреждения и лечения опухоли.
Краткое описание Графических материалов
Фигура 1 иллюстрирует эффект CL168-6 на сосуды в САМ.
Фигура 2 иллюстрирует кривые выживаемости мышей.
Фигура 3 иллюстрирует опухоли мышей групп с различными дозами.
Фигура 4 иллюстрирует результаты определения VEGF крови глаза мыши.
Фигура 5 иллюстрирует результаты 24-часового определения каспазы-3, 8, 9.
Фигура 6 иллюстрирует результаты 48-часового определения каспазы-3, 8, 9.
Фигура 7 иллюстрирует стандартную кривую белка.
Фигура 8 иллюстрирует уровень экспрессии р53 (n=3).
Фигура 9 иллюстрирует уровень экспрессии bcl-2 (n=3).
Фигура 10 иллюстрирует уровень экспрессии VEGF (n=3).
Фигура 11 иллюстрирует уровень экспрессии Р21 (n=3).
Подробное описание предпочтительных вариантов осуществления
Без ограничения, некоторые примеры данного изобретения будут описаны посредством иллюстрации наже в данном документе.
Пример получения 1; синтез холестерилацетата (соединение 3)
Холестерин (11,58 г, 30,00 ммоль), толуол (60 мл), уксусный ангидрид (5,67 мл, 60,00 ммоль) и пиридин (1 мл, 12,41 ммоль) помещали в 100 мл реакционную колбу, перемешивали магнитной мешалкой, нагревали до 114°С, нагревали с обратным холодильником, и реакцию проводили до тех пор, пока не оставалось сырьевого материала. Реакционную жидкость охлаждали, дважды отмывали 2-кратным количеством раствора хлористоводородной кислоты (0,10%), дважды отмывали 2-кратным количеством насыщенного раствора хлорида натрия, дважды отмывали 2-кратным количеством дистиллированной воды, высушивали при помощи безводного сульфата натрия, затем подвергали вакуумной перегонке с выделением толуола, в конечном итоге получали белое твердое вещество (12,84 г). Выход равен 100,0%, и ЯМР спектры водорода и углерода соединения 3 являются следующими:
1Н ЯМР (500 МГц, CDCl3): 0,68 (s, 3H, Н-18), 0,86 (d, 3H, J=2 Гц, Н-26), 0,87 (d, 3H, J=2 Гц, Н-27), 0,91 (d, 3H, J=4,4 Гц, Н-21), 1,02 (s, 3H, Н-19), 2,03 (s, 3H, Н-2'), 2,32 (dd, 2Н, Н-4), 4,60 (m, 1Н, Н-3), 5,39 (t, 1H, H-6);
13C ЯМР (500 МГц, CDCl3): 36,6 (C-1), 31,9 (С-2), 74,0 (С-3), 39,7 (С-4), 140,0 (С-5), 122,7 (С-6), 28,2 (С-7), 31,8 (С-8), 50,0 (С-9), 38,1 (С-10), 21,0 (C-11), 37,0 (С-12), 42,3 (С-13), 56,1 (С-14), 24,3 (С-15), 27,8 (С-16), 56,7 (С-17), 11,9 (С-18), 19,3 (С-19), 35,8 (С-20), 18,7 (С-21), 36,2 (С-22), 23,8 (С-23), 39,5 (С-24), 28,0 (С-25), 22,6 (С-26), 22,8 (С-27), 170,6 (С-1'), 21,5 (С-2').
Пример получения 2: синтез 7-дегидрохолестен-3-олацетата (соединение 5)
Холестерилацетат (4,28 г, 10,00 ммоль), четыреххлористый углерод (30 мл) и NBS (1,78 г, 10,00 ммоль) помещали в 50 мл реакционную колбу, подвергали действию флуоресцентного света, нагревали с обратным холодильником при 74°С, и реакцию проводили до тех пор, пока не оставалось сырьевого материала. Реакционную жидкость охлаждали, подвергали фильтрации с воздушным насосом, отмывали небольшим количеством четыреххлористого углерода, подвергали вакуумной перегонке с выделением четыреххлористого углерода, в конечном итоге получали оранжево-желтую маслоподобную жидкость.
Оранжево-желтую маслоподобную жидкость добавляли к толуолу (50 мл) и 2,6-диметилпиридину (5 мл), помещали в 100 мл реакционную колбу, перемешивали магнитной мешалкой, нагревали до 114°С, нагревали с обратным холодильником, и реакцию проводили до тех пор, пока не оставалось сырьевого материала. Реакционную жидкость охлаждали, дважды отмывали 2-кратным количеством раствора хлористоводородной кислоты (0,10%), дважды отмывали 2-кратным количеством насыщенного раствора хлорида натрия, дважды отмывали 2-кратным количеством дистиллированной воды, сушили при помощи безводного сульфата натрия, затем подвергали вакуумной перегонке для выделения толуола, растворяли в абсолютном этиловом спирте, подвергали повторной кристаллизации с получением 3,54 г белого твердого вещества с выходом 85,5%. ЯМР спектры водорода и углерода соединения 5 являются следующими:
1Н ЯМР (500 МГц, CDCl3): 0,62 (s, 3H, Н-18), 0,87 (d, 3H, J=2 Гц, Н-26), 0,87 (d, 3H, J=2 Гц, Н-27), 0,94 (d, 3H, J=4,4 Гц, Н-21), 0,99 (s, 3H, Н-19), 2,04 (s, 3H, Н-2'), 2,38 (m, 1Н, Н-4а), 2,50 (m, 1H, H-4b), 4,70 (m, 1H, H-3), 5,39 (d, 1H, J=2 Гц, Н-7), 5,59 (d, 1H, J=2 Гц, Н-6)
13С ЯМР (500 МГц, CDCl3): 36,6 (C-1), 28,1 (С-2), 72,8 (С-3), 37,9 (С-4), 141,6 (С-5), 120,2 (С-6), 116,2 (С-7), 138,5 (С-8), 46,0 (С-9), 39,5 (С-10), 21,5 (C-11), 37,1 (С-12), 42,9 (С-13), 55,4 (С-14), 23,9 (С-15), 28,1 (С-16), 55,8 (С-17), 11,8 (C-18), 18,4 (C-19), 36,2 (C-20), 16,2 (C-21), 36,1 (C-22), 23,0 (C-23), 39,1 (C-24), 28,1 (C-25), 22,6 (C-26), 22,8 (C-27), 170,6 (С-1'), 21,0 (С-2').
Пример получения З: синтез 7-дегидрохолестерина (соединение 6)
7-дегидрохолестен-3-олацетат (соединение 5) (2,07 г, 5 ммоль), этанол (50 мл) и раствор гидроксида натрия (10%, 50 мл) помещали в реакционную колбу 250 мл, реакцию проводили при 80°С до тех пор, пока не оставалось сырьевого материала. Реакционную жидкость подвергали вакуумной перегонке с выделением оставшегося этанола, экстрагировали один раз однократным количеством этилацетата, промывали дистиллированной водой до нейтральности и сушили при помощи безводного сульфата натрия. После выделения этилацетата полученное в результате твердое вещество подвергали повторной кристаллизации этанолом с получением 1,85 г 5,7-диен-холестерина с выходом 96,4%. ЯМР спектр водорода соединения 6 является следующим:
1Н ЯМР (500 МГц, CDCl3): 0,62 (s, 3H, Н-18), 0,86 (d, 3H, J-2 Гц, Н-26), 0,88 (d, 3H, J=2 Гц, Н-27), 0,94 (s, 3H, Н-19), 1,22 (d, 3H, J=12 Гц, Н-21), 2,33 (dd, 1Н, H-4a), 2,49 (dd, 1H, H-4b), 3,66 (m, 1H, H-3), 4,03 (m, 1H, 3-OH), 5,39 (m, 1H, H-7), 5,68 (dd, 1H, H-6).
Пример получения 4: синтез 5α,8α-эпидиокси-6-холестен-3-ола (соединение 7)
5,7-диен-холестерин (1,15 г, приблизительно 3 ммоль), эозин Y (200 мг, приблизительно 0,31 ммоль, растворенный в спирте) и абсолютный этанол (100 мл, 10,00 ммоль) помещали в 250 мл реакционную колбу. После вдувания воздуха в реакционную жидкость последнюю подвергали действию флуоресцентного света, реакцию проводили до тех пор, пока не оставалось сырьевого материала, дистиллировали для выделения абсолютного этанола, пока не достигали определенного объема, выдерживали для кристаллизации с получением 0,94 г 5α,8α-эпидиокси-6-холестен-3-ола с выходом 75,3%.
1Н ЯМР (500 МГц, CDCl3): 0,80 (s, 3H, Н-18), 0,85 (d, 3H, J-2 Гц, Н-26), 0,88 (d, 3H, 3=2 Гц, Н-27), 0,88 (s, 3H, Н-19), 0,91 (d, 3H, J-12 Гц, Н-21), 3,97 (m, 1H, H-3), 6,23 (d, 1H, J-7 Гц, Н-7), 6,51 (d, 1H, J=7 Гц, Н-6);
13С ЯМР (500 МГц, CDCl3): 36,0 (C-1), 28,3 (С-2), 66,5 (С-3), 39,4 (С-4), 82,2 (С-5), 135,4 (С-6), 130,8 (С-7), 79,5 (С-8), 51,1 (С-9), 35,2 (С-10), 20,6 (C-11), 34,7 (С-12), 44,8 (С-13), 52,0 (С-14), 23,4 (С-15), 30,1 (С-16), 56,4 (С-17), 12,7 (С-18), 18,2 (С-19), 36,9 (С-20), 19,0 (С-21), 36,9 (С-22), 23,8 (С-23), 37,0 (С-24), 28,0 (С-25), 22,6 (С-26), 22,8 (С-27).
Пример получения 5: синтез 5а,8а-эпидиокси-6-холестен-3-она (соединение 1, CL168-6)
5α,8α-эпидиокси-6-холестен-3-ол (соединение 7) (0,62 г, приблизительно 1,5 ммоль) растворяли в ацетоне (50 мл) в 100 мл реакционной колбе, медленно добавляли по каплям раствор хромовой кислоты (1,6 ммоль) на бане со смесью воды и льда, реакцию проводили до тех пор, пока не оставалось сырьевого материала. Реакционную жидкость выливали в смесь воды и льда (600 мл), перемешивали, выдерживали в течение целой ночи и затем подвергали фильтрации с воздушным насосом. Осадок на фильтре подвергали повторной кристаллизации с этанолом с получением 0,62 г 5α,8α-эпидиокси-6-холестен-3-она с выходом 96,1%.
1Н ЯМР (500 МГц, CDCl3): 0,85 (s, 3H, Н-19), 0,88 (d, 3H, J=2 Гц, Н-26), 0,89 (d, 3H, J-2 Гц, Н-27), 0,92 (d, 3H, J-6,5 Гц, Н-21), 1,07 (s, 3H, Н-18), 3,97 (m, 1Н, H-3), 6,29 (d, 1H, J-8,5 Гц, Н-7), 6,59 (d, 1H, J-8,5 Гц, Н-6);
13С ЯМР (500 МГц, CDCl3): 36,7 (C-1), 35,3 (С-2), 207,0 (С-3), 43,6 (С-4), 83,4 (С-5), 134,2 (С-6), 131,6 (С-7), 80,0 (С-8), 51,1 (С-9), 39,4 (С-10), 20,5 (C-11), 37,3 (С-12), 44,9 (С-13), 51,4 (С-14), 23,8 (С-15), 28,2 (С-16), 56,4 (С-17), 12,8 (С-18), 18,5 (С-19), 35,2 (С-20), 17,5 (С-21), 35,9 (С-22), 23,5 (С-23), 39,3 (С-24), 28,0 (С-25), 22,5 (С-26), 22,8 (С-27).
Итоговый пример 1: оценка воздействия CL168-6 на пролиферацию клеток гепатомы человека HepG2, клеток рака легких человека А549 и клеток иммортализованных фибробластов человека NIH3T3 посредством МТТ анализа
1. Материалы
1.1 Опухолевые линии
Клетки гепатомы человека HepG2 и клетки рака легких человека А549 культивировались Институтом инфекционных заболеваний Народно-освободительной армии Китая для оценки жизнеспособности, тогда как клетки иммортализованных фибробластов человека NIH3T3 были куплены у Академии военно-медицинских наук.
1.2 Экспериментальные лекарственные средства CL168-6, полученные самостоятельно, которые имели чистоту равную или более чем 98%, оцененную при помощи жидкостной хроматографии высокого давления (HPLC), и, следовательно, соответствовали требованиям эксперимента. Порошок указанного CL168-6, который заранее герметично закупорили и хранили при 4°С, растворяли в диметилсульфоксиде (DMSO) с получением исходного раствора с концентрацией 1 мл/мг для последующего применения.
2. Способ
2.1 Культивирование клеток
Клетки гепатомы человека HepG2, клетки рака легких человека А549 и клетки NIH3T3 восстанавливали и субкультивировали в колбах для культивирования. Как только клетки достигали логарифмической фазы роста, эксперимент можно начинать. Клетки обрабатывали трипсином, отфильтрованным под высоким давлением с получением суспензии, содержащей клетки, окрашивали 3 минуты 0,4% трипановым синим и затем подсчитывались при помощи счетчика форменных элементов крови (живые клетки не были окрашены, тогда как мертвые клетки были окрашены синим). Проценты живых клеток, определенные по исключению трипанового синего все составляли до более 98%.
2.2 Эксперименты по ингибированию размножения клеток
Три типа клеток в логарифмической фазе высеяли в 96-луночные планшеты с плотностью 1×104/мл (200 мкл/лунка) и затем культивировали в течение 24 часов при 37°С в пригодном для выращивания боксе с 5% СО2. Питательную среду аспирировали и удаляли. Добавляли 200 мкл CL168-6 различной концентрации (с конечной концентрацией соответственно 10 мкг/мл, 5 мкг/мл, 2,5 мкг/мл и 0 мкг/мл, полученных с культуральной средой из 4% телячьей сыворотки в DMEM), где для каждой концентрации было 6 параллельных лунок. После культивирования в течение 24 часов и 48 часов, 100 мкл супернатанта осторожно аспирировали и удаляли, соответственно. Добавляли MTS (20 мкл/лунка) и равномерно смешивали. Смесь культивировали в течение 1 часа при 37°С в пригодном для выращивания боксе с 5% СО2. Поглощение при 492 нм определяли путем количественного иммуноферментного твердофазного анализа (ИФА). Эксперимент повторяли три раза. Степень ингибирования роста рассчитывали следующим образом. Степень ингибирования роста (%)=[(среднее значение ОП контрольной группы - среднее значение ОП группы обработки)/среднее значение ОП контрольной группы]×100%
3. Результаты
CL168-6 обладает значительным ингибирующим эффектом на пролиферацию клеток гепатомы человека HepG2 и клеток рака легких человека А549, культивируемых in vitro, и показывает зависимость от дозы; соответствующие результаты изложены в Таблице 1-1. При обработке лекарственным средством с концентрацией 2,5 мкг/мл в течение 24 часов, степень ингибирования равна 52,85% и 48,69% для клеток HepG2 и клеток А549, соответственно. Степень ингибирования будет возрастать с возрастанием концентрации лекарственного средства; если концентрация лекарственного средства равна 10 мкг/мл, степень ингибирования по отношению к вышеуказанным двум типам клеток равна до 64,39% и 62,40%, соответственно; если через 48 часов и при дозировке 2,5 мкг/мл, скорость ингибирования клеток HepG2 и А549 равна до 59,83% и 51,91%, соответственно; если концентрация равна 10 мкг/мл, степень по отношению к HepG2 и А549 равна 73,67% и 69,67%, соответственно. По сравнению с ситуацией с клетками NIH3T3 ингибирование CL168-6 по отношению к HepG2 и А549 показывает существенное различие в группах с различной концентрацией и временем обработки (p<0,05). Результаты эксперимента показали, что ингибирующий эффект CL168-6 в отношении клеток имеет хорошую селективность, и эффект положительно коррелирует с концентрацией лекарственного средства и временем лечения.
| Таблица 1-1 | ||||||
| Ингибирующий эффект CL 168-6 на размножение 3 типов клеточных линий | ||||||
| Концентрация | Степень ингибирования 24 ч, (%) | : Степень ингибирования 48 ч. (%) | ||||
| (мкг/мл) | HepG2 | A549 | NIH3T3 | HepG2 | A549 | NIH3T3 |
| 02,5 | 52,85* | 48,69* | 3,87 | 59,83* | 51,91* | 0,75 |
| 5,0 | 58,51* | 55,78* | 5,69 | 69,08* | 59,75* | 1,97 |
| 10,0 | 64,39* | 62,40* | 8,45 | 73,67* | 69,37* | 5,37 |
| Примечание: *Р<0,05 по сравнению с 0,0 мкг/мл |
4. Заключение
CL168-6 может существенно ингибировать размножение клеток гепатомы человека HepG2 и клеток рака легких человека A549.
Итоговый пример 2: оценка воздействия CL168-6 на ангиогенез опухоли посредством анализа САМ
1. Материалы
1.1 Животные
Яйца породы German Roman с зародышем (каждое весит 50-60 г, полученное из Экспериментального центра по изучению эмбрионов Китайского сельскохозяйственного университета).
1.2 Экспериментальные лекарственные средства
CL168-6, полученные самостоятельно, которые имели чистоту равную или более чем 98%, оцененную при помощи жидкостной хроматографии высокого давления (HPLC), и, следовательно, соответствовали требованиям эксперимента. Порошок указанного CL168-6 герметично закупорили и хранили при 4°С.
Сурамин предоставлен компанией SIGMA.
2. Способ
2.1 Способ получения оцениваемых образцов
Стерильную желатиновую губку, ранее изготовленную в виде диска с диаметром 5 мм при помощи дырокола, использовали как носитель образца. CL168-6 растворяли в 70% этаноле с получением раствора с концентрацией 2 мг/5 мл. Было 3 группы доз, где 5 мкл (группа с низкой дозой с объемом дозы 2 мкг/эмбрион), 10 мкл (группа со средней дозой с объемом дозы 4 мкг/эмбрион) и 20 мкл (группа с высокой дозой с объемом дозы 8 мкг/эмбрион) раствора добавляли соответственно в срезы желатиновой губки при помощи количественного переноса жидкости. Части губки сушили в стерильной окружающей среде.
2.2 Инкубирование эмбриона и процесс удаления воздушной камеры в яйце с эмбрионом
Стерилизованное яйцо помещали в инкубатор при 37°С с его воздушной камерой, направленной вверх. На 7-й день эмбрион помещали в сверхчистый ламинарный шкаф, и стерилизовали этанолом, и затем просверливали бормашиной с образованием небольшого отверстия вверху эмбриона. Яичную скорлупу и мембрану скорлупы вокруг отверстия осторожно удаляли с образованием щели приблизительно 1,2 см × 1,2 см; после определения участка добавления образца мембрану воздушной камеры осторожно прокалывали в месте разделения между камерой и желтком иголкой шприца; через отверстие прокола вводили 1-2 капли стерилизованной воды, что сделало мембрану камеры и мембрану САМ разделенными; после осторожного удаления верхнего слоя мембраны камеры пинцетом мембрана САМ в нижнем слое была открыта.
2.3 Процесс добавления образца
Носитель, содержащий лекарственное средство, помещали на область перехода мембраны САМ и мембраны желточного мешка на участок, где было меньше всего сосудов, и затем герметизировали при помощи стерилизованной прозрачной клейкой ленты с продолжением инкубирования в течение 72 часов.
2.4 Измерение сосудов
После инкубирования прозрачную клейкую ленту, запечатывающую верх воздушной камеры, осторожно удаляли при помощи пинцета; осторожно добавляли смесь метанола/ацетона (1:1, 1-2 мл); комнатная температура оставалась постоянной в течение 10 минут. Затем, мембрану САМ осторожно отслаивали и помещали на предметное стекло для наблюдения и получения фотографий. Воздействие соединения на ангиогенез оценивали путем подсчетом количества больших, средних, небольших кровеносных сосудов, иррадиированных возле носителя.
2.5 Статистическая обработка
Все данные анализировали статистически при помощи пакета программного обеспечения SPSS 11,0; сравнение данных подсчета подтверждали с помощью теста х2. Поскольку P<0,05, все данные имели статистическую значимость.
3. Результаты
Фигура 1 иллюстрирует воздействие CL 168-6 на сосуды САМ и холостой контроль.
Количества мелких сосудов трех групп доз CL168-6 сравнивали с таковым холостой группы, соответственно; для всех трех групп были обнаружены существенные различия и показана зависимость от дозы. Результаты изложены в таблице 2-1, в которой показано, что соединение обладает существенным ингибирующим эффектом на рост при ангиогенезе.
| Таблица 2-1 | ||||
| Статистическая таблица приблизительного воздействия CL168-6 на сосуды САМ с анализом сосудов [ X ¯ (число сосудов) ±s] | ||||
| Группы | Число эмбрионов | Большие сосуды | Средние сосуды | Небольшие сосуды |
| CL168-6 | 20 | 3,5±1,8 | 13,2±3,7 | 8,8±2,3** |
| (2 мкг/эмбрион) | ||||
| CL 168-6(4 мкг/эмбрион) | 20 | 3,6±1,9 | 11,2±3,2 | 6,5±2,5** |
| CL168-6 (8 мкг/эмбрион) | 20 | 2,5±2,0 | 12,6±5,6 | 4,0±2,8** |
| Сурамин (4 мкг/эмбрион) | 20 | 3,6±2,0 | 12,4±3,8 | 6,1±3,0** |
| Группа пустого контроля | 20 | 4,7±3,1 | 18,1±5,5 | 11,6±2,2 |
| Примечания: по сравнению с группой холостого контроля, *Р<0,05, **Р<0,01. |
4. Заключение
CL168-6 обладает существенным ингибирующим эффектом на опухолевый ангиогенез, и указанный эффект зависит от количества лекарственного средства.
Итоговый пример 3: противоопухолевый эффект CL168-6 в отношении асцитных мышей, несущих опухоль S180, Н22
1. Материалы
1.1 Экспериментальные животные и опухолевые линии Здоровых самок мышей Balb/C, каждую весом 18-22 г, приобрели у Центра экспериментальных животных Академии военно-медицинских наук (сертификат № SCXK-(Military)2007-004). Клетки гепатоаденомы мыши Н22 культивировали в лаборатории для оценки жизнеспособности; клетки саркомы мыши S180 были предоставлены Институтом китайской медицины из 302 больницы; асциты мышей, несущих опухоль S180, Н22, субкультивировали раз в каждые 7 дней.
1.2 Экспериментальные лекарственные средства
CL168-6, полученные самостоятельно, имели чистоту равную или более 98%, оцененную при помощи жидкостной хроматографии высокого давления (HPLC) и, следовательно, соответствовали требованиям эксперимента.
Порошок указанного CL168-6 герметично закупорили и хранили при 4°С.
Циклофосфамид для инъекции: изготовлен Shanxi Pude Pharmaceutical Co., Ltd.
2. Процесс
2.1 Разработка животных моделей
Асцитных мышей S180 и Н22, которых вакцинировали за 7 дней, умерщвляли сворачиванием шеи, из них получали асциты в стерильных условиях, соответственно; полученные асциты дважды промывали культуральной средой RPMI1640, и получали в виде суспензии 2×107/мл в стерильном физиологическом солевом растворе. Суспензию клеток S180 инокулировали подкожно в правую подмышечную ямку 40 мышей (0,1 мл/мышь) для получения моделей солидной опухоли; тогда как суспензию клеток Н22 инокулировали в брюшные полости 40 мышей (0,2 мл/мышь) обычными способами при стерильных условиях для получения моделей асцитных опухолей.
2.2 Экспериментальные группы
90 мышей случайно разделяли на 9 групп из 3 типов, где группой первого типа была группа нормального контроля, группами второго типа были группы солидной опухоли S180, включая группу положительного (циклофосфамид) контроля, группу отрицательного контроля, группу с низкой дозой и группу с высокой дозой, и группами третьего типа были группы Н22 асцитов, включая группу положительного (циклофосфамид) контроля, группу отрицательного контроля, группу с низкой дозой и группу с высокой дозой. В каждой группе было 10 мышей. Эксперимент повторяли три раза.
2.3 Введение лекарственного средства
CL168-6 получали в виде эмульсий в кукурузном масле. Группе с низкой дозой вводили парентерально дозу 16 мг/кг, группе с высокой дозой вводили парентерально дозу 32 мг/кг, группе отрицательного контроля вводили парентерально такой же объем кукурузного масла, и группе положительного контроля вводили парентерально циклофосфамидный инъекционный раствор с дозой 0,02 г/(кг в сутки). Применяемый объем инъекции составлял 0,1 мл/мышь, и инъекцию давали в виде внутрибрюшинной инъекции через день в течение 15 дней. В течение 15 дней ежедневно вели наблюдение за общей активностью, шерстью, экскрементами и т.д. мышей. Через 24 часа после последнего введения мышей, которых инокулировали подкожно S180, умерщвляли сворачиванием шеи, после чего извлекали опухоли, тимус и селезенку. После последнего введения мышей, инокулированных в брюшную полость Н22, непрерывно выкармливали общепринятым способом, взвешивали и наблюдали время выживаемости каждый день до тех пор, пока все мыши отрицательной группы не были мертвы.
2.4 Расчет степени продления выживаемости мышей
Через 24 часа после инокуляции асцитов измеряли вес и величину окружности живота мышей в группах асцитных моделей. Введение лекарственного средства и выкармливание продолжали соответственно для различных групп, вес и окружность живота измеряли ежедневно до одного дня до умерщвления. Рассчитывали увеличение веса (г) и увеличение окружности живота (см). Эксперимент начали в день инокуляции опухолью и закончили в день, когда все мыши в группе отрицательного контроля были мертвы; время смерти было записано и рассчитывали степень продления выживаемости.
Степень продления выживаемости (%)=[(среднее значение дней выживаемости группы обработки - среднее значение дней выживаемости группы отрицательного контроля)/среднее значение дней выживаемости контрольной группы]×100%
2.5 Расчет селезеночного индекса и печеночного индекса
После окончания введения всем мышам в группе солидной опухоли мышей умерщвляли и их селезенки и печени взвешивали на электронных весах. Селезеночный индекс был эквивалентен весу селезенки (мг) мышей в каждой группе, разделенной на вес мышей, тогда как печеночный индекс был эквивалентен весу печени (100 г), разделенному на вес (г) мышей.
2.6 Расчет степени ингибирования опухоли
На следующий день после отмены лекарственного средства мышей в группе отрицательного контроля с солидной опухолью взвешивали и умерщвляли сворачиванием шеи, где сыворотку собирали путем кровопускания из глаза для дальнейшего применения в последующих экспериментах. Ткани опухоли иссекали и взвешивали на электронных весах. Степень ингибирования опухоли рассчитывали следующим образом.
Степень ингибирования опухоли (%)=[(средняя масса опухоли группы отрицательного контроля - средняя масса опухоли группы обработки)/средняя масса опухоли контрольной группы]×100%
2.7 Статистическая обработка
Все данные были статистически проанализированы при помощи пакета программного обеспечения SPSS 11,0; сравнение данных подсчета подтверждали при помощи теста х2. Поскольку Р<0,05, все данные имели статистическую значимость.
3. Результаты эксперимента
3.1 Изменение массы, окружности живота и времени выживаемости мышей в группах
Как показано в Таблице 3-1, мыши в группах CL 168-6 с низкой и высокой дозой имели более длительное время выживаемости, чем в группе отрицательного контроля, и соответствующие показатели степени продления выживаемости составляли 37,11% и 51,55%, соответственно. Мыши в группе обработки имели меньшее увеличение окружности живота, чем в отрицательной группе, и нормальный рост таких обработанных мышей не был затронут указанным увеличением. Вес мышей в группе с вводимым парентерально циклофосфамидом возрастал медленно, с увеличением только на 3,42 г, тогда как мыши в нормальной группе имели увеличение веса на 6,72 г. Фигура 2 иллюстрирует статистический график времени выживаемости Н22 асцитных мышей.
Таблица 3-1
Воздействие CL168-6 на вес, окружность живота и время выживаемости мышей в различных группах (x±s)
| Таблица 3-1 | ||||
| Воздействие CL168-6 на вес, окружность живота и время выживаемости мышей в различных группах (x±s) | ||||
| Группы | Увеличение веса (г) | Увеличение окружности живота (см) | Время выживаемости (дни) | Степень продления выживаемо ста (%) |
| Группа нормального контроля | 6,76±1,56 | 0,58±0,09 | - | - |
| Группа отрицательного контроля | 4,85±1,21① | 3,17±0,33② | 9,7±2,7 | - |
| Группа циклофосфамида | 3,42±1,67②④ | 2,30±0,66②④ | 15,3±1,06④ | 57,73 |
| Группа CL168-6 с низкой дозой | 7,16±1,39④ | 2,84±0,34②③ | 13,3±1,77④ | 37,11 |
| Группа CL168-6 с высокой дозой | 5,05±1,88④ | 2,32±0,71②④ | 14,7±1,41④ | 51,55 |
| Примечания: 1. По сравнению с группой нормального контроля: ①Р<0,05, ②Р<0,01;2. По сравнению с группой отрицательного контроля: |