Новые пептиды для лечения и профилактики иммунопатологических заболеваний, включая лечение и профилактику инфекции посредством модулирования врожденного иммунитета
Иллюстрации
Показать всеИзобретение относится к области биохимии и биотехнологии и может быть использовано в фармацевтической промышленности при получении медикаментов для лечения состояний, предусматривающего подавление активности дипептидилпептидазы IV (DPPIV). Получена группа новых пептидов, обладающих свойствами ингибитора DPPIV, которые обеспечивают снижение активности фермента не менее чем на 25%. Предлагается использовать ингибиторы по изобретению в качестве средства для подавления функции DPPIV как путем их непосредственного введения, так и в составе фармацевтической композиции. 3 н. и 6 з.п. ф-лы, 1 табл., 11 ил., 5 пр.
Реферат
ПРЕДШЕСТВУЮЩИЕ ЗАЯВКИ
Для настоящей заявки испрашивается приоритет на основании Предварительных патентных заявок США 60/722,962; 60/722,958 и 60/722,959, поданных 4 октября 2005 года и озаглавленных «Новые пептиды для лечения и профилактики инфекций посредством модулирования врожденного иммунитета», которые включены в настоящую заявку в качестве ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к пептидам для лечения и профилактики иммунопатологических заболеваний, включая лечение и профилактику инфекций посредством модулирования врожденного иммунитета. В одном аспекте настоящее изобретение относится к композициям и их применениям для модулирования врожденного иммунитета. В другом аспекте изобретение предусматривает новые пептиды, обладающие эффектом снижения активности дипептидилпептидазы IV (DPPIV), а также их применения.
УРОВЕНЬ ТЕХНИКИ
Множество форм микроорганизмов, включая вирусы, бактерии, грибки и паразитов, могут вызывать заболевания. Клетки микробов отличаются от клеток животных и растений, которые не могут существовать самостоятельно в природе и существуют только как часть многоклеточных организмов. Клетки микробов могут быть патогенными или непатогенными, в зависимости, в частности, от вида микроорганизма и состояния носителя. Например, в носителе с ослабленным иммунитетом обычно безвредная бактерия может стать патогенной. Внедрение в клетки носителя является чрезвычайно важным для выживания патогенных бактерий, которые размножаются в межклеточной среде. Для организмов, которые размножаются во внеклеточном пространстве, важность внедрения бактерии в клетки носителя менее четко определена.
Резистентность микроорганизмов к лекарственным средствам остается серьезным препятствием в непрекращающихся попытках бороться с инфекцией. Например, пенициллин был эффективен при лечении Staphylococcus aureus до тех пор, пока бактерия не стала резистентной к нему. В течение второй половины XX века были разработаны новые антибиотики, такие как ванкомицин и метициллин, которые были эффективны при лечении инфекций 5. aureus. Однако в 70-х годах XX века появились резистентные к метициллину штаммы S. aureus, и с тех пор они являются источником проблем для больниц во всем мире. Позднее появились штаммы S. aureus устойчивые к ванкомицину.
В связи с возрастающей угрозой развития резистентности к противомикробным препаратам и возникновением новых инфекционных заболеваний существует постоянная необходимость разработки новых лекарственных соединений. Желательно создать препараты, которые воздействовали бы на носителя, но не на патоген, тем самым не способствуя развитию резистентности к препарату. В особенности перспективными являются препараты, которые воздействуют на носитель посредством влияния на систему врожденного иммунитета.
Защита носителя от микроорганизмов начинается с эпителиальных барьеров тела и врожденной иммунной системы и достигает высшей точки в момент развития адаптивного иммунного ответа. Врожденный иммунный ответ носителя включает несколько консервативных механизмов, которые распознают микробные инфекции и противостоят им. Элементы врожденной иммунной системы непрерывно поддерживаются на низких уровнях активности и очень быстро активизируются в момент стимуляции. Врожденный иммунный ответ начинается сразу же после появления микробного патогена в организме. Процессы, относящиеся к приобретенному иммунитету, такие как перегруппировка генов рецепторов иммуноглобулина, не являются частью врожденного иммунного ответа.
Существуют указания на то, что врожденный иммунный ответ эффективно противостоит большинству инфекций, а также способствует развитию воспалительных реакций. Известно, что воспалительные реакции, запущенные инфекцией, являются центральными этапами патогенеза заболеваний. Важная роль Toll-подобных рецепторов (TLR) во врожденном иммунном ответе была также подробно описана в литературе. TLR млекопитающих распознают законсервированные молекулы, многие из которых находятся на поверхности микробных патогенов или выделяются ими. Существует множество других механизмов, описанных не столь подробно, которые приводят в действие врожденную иммунную защиту носителя и/или способствуют ее функционированию.
Врожденная иммунная система обеспечивает целый ряд защитных механизмов, включая функцию эпителиального барьера и секрецию цитокинов и хемокинов. К настоящему времени были выделены четыре группы хемокинов, в зависимости от числа консервативных N-концевых фрагментов цистеина: С, СС, СХС, и СХ3С, где Х - это неконсервативный аминокислотный остаток. Известно, что СХС-хемокины хемотаксичны к клеткам, содержащим СХСР3-рецепторы, включая моноциты, активированные Т-клетки (Thi) и NK-клетки. Первичные человеческие эпителиальные клетки дыхательных путей и клетки линии 16-НВЕ нерегулируемо выполняют экспрессию CXCR3-рецептора и его лигандов, IP-10, I-TAC и MIG (Kelsen et al., The chemokine receptor CXCR3 and its splice variant are expressed in human airway epithelial cells. Am. J. Physiol. Lung Cell Mol. Physiol., 287:L584, 2004). Более того, CXCR3-лиганды вызывают хемотаксический ответ и реорганизацию актина в клетках 16-НВЕ (Kelsen et al., The chemokine receptor CXCR3 and its splice variant are expressed in human airway epithelial cells. Am. J. Physiol. Lung Cell Mol: Physiol., 287:L584, 2004).
Далее, трансмембранная сывороточная протеаза II типа дипептидилпептидаза IV (DPPIV), также известная как CD26 или белок, связывающий аденозиндеаминазу, является важным регулятором различных физиологических процессов, включая иммунные функции. CD26/DPPIV представляет собой гликопротеин молекулярной массой в 110 кД, расположенный на поверхности клетки, экспрессия которого происходит главным образом в зрелых тимоцитах, активированных Т-клетках, В-клетках, NK-клетках, макрофагах и эпителиальных клетках. Он выполняет по меньшей мере две функции - функцию сигнальной трансдукции и протеолитическую функцию (Morimoto С, Schlossman SF. The structure and function of CD26 in.-. The T-cell immune response. Immunol. Review. 1998, 161: 55-70.). Одна из его функций в клетке включает в себя модуляцию активности хемокинов путем отщепления дипептидов с N-конца хемокина. Модуляция NHz-концов хемокинов является очень важной не только с точки зрения связывания с их рецепторами и последующих реакций, но также с точки зрения изменения рецепторной специфичности обработанного хемокина. Активность DPPIV связывают с определенным количеством состояний, связанных с иммунитетом.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
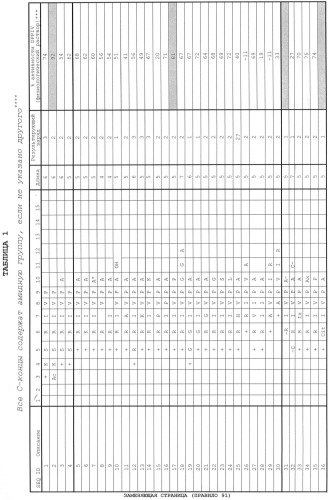
Авторы настоящего изобретения обнаружили, что пептиды, содержащие аминокислотную последовательность одного из пептидов, перечисленных и описанных в Таблице 1, или ее аналог, производную или вариант, могут усиливать врожденный иммунитет носителя. В одном аспекте иммуномодулирующие пептиды согласно настоящему изобретению не обладают антимикробным эффектом, но демонстрируют способность повышать жизнеспособность инфицированного носителя. В другом аспекте настоящее изобретение предусматривает пептиды, модулирующие активность DPPIV. В одном аспекте настоящее изобретение предусматривает пептиды, которые снижают активность DPPIV. В еще одном аспекте изобретение предусматривает пептиды, которые могут быть использованы для диагностирования, лечения или профилактики иммунопатологических заболеваний, таких как заболевания, связанные с активностью DPPIV и/или врожденным иммунитетом.
Соответственно, в одном аспекте настоящее изобретение предусматривает изолированный пептид, который включает в себя любую аминокислотную последовательность согласно Таблице 1, или ее аналог, производную или вариант, или ее очевидный химический эквивалент, или пептид, включающий в себя данный пептид. В одном варианте выполнения настоящего изобретения пептид включает в себя до 10 аминокислот, составляющих данный пептид. В качестве примера изолированный пептид может иметь модифицированный С-конец (например, амидированный С-конец) и/или модифицированный N-конец. Изолированный пептид согласно настоящему изобретению может дополнительно включать в себя аминокислотную последовательность согласно Таблице 1, модифицированную путем, по меньшей мере, одной замены D-аминокислоты. Изолированный пептид согласно настоящему изобретению может дополнительно включать модифицированный скелет, например, в котором N-конец модифицирован из амида до N-метильной группы. В одном аспекте эти модифицированные пептиды, сохраняющие иммунологическую активность исходного пептида и его очевидного химического эквивалента, который также сохраняет данную активность, включены в объем настоящего изобретения.
В другом аспекте настоящее изобретение дополнительно предусматривает агент, обладающий реакционной способностью по отношению к изолированному пептиду, который включает в себя аминокислотную последовательность согласно Таблице 1 или ее аналог, производную, или вариант. В одном варианте выполнения настоящего изобретения агент представляет собой неприродное антитело (например, поликлональное или моноклональное антитело). В одном варианте выполнения настоящего изобретения антитело создано с использованием MAPS антигена, присоединенного к пептиду согласно настоящему изобретению посредством 2 глициновых остатков, вставленных в С-конец пептида. Данная структура может быть введена животному, такому как кролик, после чего может быть получено антитело с использованием технологий, хорошо известных в данной области. В одном аспекте такие агенты могут быть помечены или использованы для маркировки пептидов согласно настоящему изобретению. В другом аспекте такие агенты могут быть использованы при выполнении способов диагностики и контроля для отслеживания агентов, способных модулировать активность пептида или для определения количества пептида.
В еще одном аспекте настоящее изобретение предусматривает изолированную молекулу нуклеиновой кислоты, кодирующую изолированный пептид, имеющий или содержащий аминокислотную последовательность согласно Таблице 1 или ее аналог, производную или вариант. Также предусматривается рекомбинантная структура нуклеиновой кислоты, которая включает молекулу нуклеиновой кислоты, функционально связанную с вектором экспрессии.
В дополнительном аспекте настоящее изобретение предусматривает, по меньшей мере, одну клетку-носитель, включающую рекомбинантную структуру нуклеиновой кислоты согласно настоящему изобретению. Также предусматривается способ производства пептида, имеющего или содержащего аминокислотную последовательность согласно Таблице 1 или ее аналог, производную, или вариант, причем способ содержит этапы, на которых: (а) культурируют по меньшей мере одну клетку-носитель в условиях, обеспечивающих возможность экспрессии пептида; и (b) извлекают пептид, по меньшей мере, из одной клетки-носителя или культурной среды такой клетки.
В еще одном аспекте настоящее изобретение предусматривает фармацевтическую композицию, которая включает в себя изолированный пептид или пептид, имеющий или содержащий аминокислотную последовательность согласно Таблице 1 или ее аналог, производную, или вариант (включая фармацевтически приемлемую соль, аддитивную соль или сложный эфир любого из перечисленных выше веществ, или полиморф), в сочетании с фармацевтически приемлемым носителем, растворителем или наполнителем.
В другом аспекте настоящее изобретение предусматривает способ лечения и/или профилактики инфекции (например, микробной инфекции) у субъекта, который предполагает введение субъекту пептида, имеющего или содержащего аминокислотную последовательность согласно Таблице 1 или ее аналог, производную или вариант, или очевидный химический эквивалент. В качестве примера, пациент может являться носителем инфекции или быть подверженным риску заражения инфекцией. В одном варианте выполнения настоящего изобретения пептид модулирует врожденный иммунитет субъекта, посредством чего осуществляют лечение и/или профилактику инфекции у субъекта. Настоящее изобретение дополнительно предусматривает способ распознавания микробной инфекции, которую можно лечить пептидом согласно настоящему изобретению. В другом аспекте настоящее изобретение предусматривает способ лечения или профилактики состояний или заболеваний, связанных с активностью DPPIV.
Примеры инфекций, которые можно лечить и/или предотвращать способом согласно настоящему изобретению включают инфекцию, вызванную бактерией (например, грам-положительной или грам-отрицательной), инфекцию, вызванную грибком, инфекцию, вызванную паразитом, и инфекцию, вызванную вирусом. В одном варианте выполнения настоящего изобретения инфекция является бактериальной (например, инфекция, вызванная Е.coli, Klebsiella pneumonidae, Pseudomonas aeruglnosa, Salmonella spp., Staphylococcus aureus, Streptococcus spp. и ванкомицин-резистентного энтерококка). В другом варианте выполнения настоящего изобретения инфекция является грибковой инфекцией (например, инфекция, вызванная плесенным грибком, дрожжевым грибком или высшим грибом). В еще одном варианте выполнения изобретения инфекция вызвана паразитом (например, одноклеточным или многоклеточным паразитом, включая Giardia duodenal is, Cryptosporidium parvum, Cyclospora cayetanensis и Toxoplasma gondii). В еще одном варианте выполнения настоящего изобретения инфекция является вирусной (например, вирусном, связанным со СПИД, птичьим гриппом, ветрянкой, обычной простудой, герпесом, гастроэнтеритом, мононуклеозом, гриппом, корью, свинкой, фарингитом, пневмонией, краснухой, атипичной пневмонией, инфекцией нижних и верхних дыхательных путей (например, респираторно-синцитиальным вирусом)).
Согласно способу в соответствии с настоящим изобретением, пептид, имеющий или содержащий аминокислотную последовательность согласно Таблице 1 или ее аналог, производную или вариант, может быть введен субъекту непосредственно (например, путем введения самого пептида) или опосредованно (например, путем введения субъекту последовательности нуклеиновой кислоты, кодирующей пептид с обеспечением возможности экспрессии пептида у субъекта). Пептид согласно настоящему изобретению (или нуклеиновая кислота, кодирующая пептид) может быть введен субъекту перорально, парентерально (например, интрадермально, внутримышечно, внутрибрюшинно, внутривенно или подкожно), трансдермально, интраназально, внутрилегочно (например, интратрахеально) и/или посредством осмотического насоса.
В другом аспекте настоящее изобретение предусматривает способ прогнозирования эффективности лечения субъекта пептидом, содержащим аминокислотную последовательность согласно Таблице 1 или ее аналог, производную или вариант, причем способ заключается в анализе диагностической пробы, взятой у субъекта, с целью определения активности дипептидилпептидазы IV (DPPIV), при этом модуляция, такая как снижение активности DPPIV, указывает на то, что лечение субъекта будет эффективным. В одном аспекте для субъекта установлено наличие состояния или заболевания, связанного с DPPIV, или имеется подозрение на наличие такого состояния или заболевания.
Дополнительные аспекты и преимущества настоящего изобретения будут подробно рассмотрены в нижеследующем описании. Следует, однако, понимать, что детальное описание и конкретные примеры, представляющие предпочтительные варианты выполнения настоящего изобретения, приведены лишь с целью иллюстрации, так как различные изменения и модификации в рамках сущности и объема настоящего изобретения станут очевидными для специалистов в данной области из данного подробного описания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Изобретение будет описано со ссылкой на фигуры, которые:
Фиг.1А и В иллюстрируют результаты эксперимента, описанного в Примере 2. % жизнеспособности = количество бактериального роста относительно контроля, представленного средой (Tris), для которого выживаемость бактерий принята за 100%, при применении соответствующих пептидов последовательности SEQ ID NO 5 и 47; Erythr. = эритромицин.
Фиг.2А-G иллюстрируют результаты эксперимента, описанного в Примере 3. На графике показаны колониеобразующие единицы на мл (КОЕ/мл) по оси Y и группа, получавшая пептид (контроль = без пептида; SEQ ID NO 1, 4, 5, 6, 45 и 47 = введение пептида, имеющего соответствующую аминокислотную последовательность) по оси X. Показано количество бактерий для отдельных мышей.
Фиг.3А и В иллюстрируют результаты эксперимента, описанного в Примере 4. На графике показаны колониеобразующие единицы на мл (КОЕ/мл) по оси Y и группа, получавшая пептид (контроль = без пептида; SEQ ID NO 1 и 5 = введение пептида, имеющего соответствующую аминокислотную последовательность) по оси X. Показано количество бактерий для отдельных мышей. ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Определения
Понятие «заболевание, связанное с DPPIV» или «состояние, связанное с DPPIV» в контексте данной заявки означает любое медицинское состояние, связанное с активностью DPPIV, и при котором модуляция этой активности может быть использована для лечения и/или профилактики или диагностирования данного состояния. Примеры таких состояний включают, не ограничиваясь, ВИЧ/СПИД, аутоиммунные состояния, такие как ревматоидный артрит, рассеянный склероз, рак (например, толстой кишки и легких), диабет и базедову болезнь.
Понятие «иммунопатологическое заболевание» означает состояние, связанное с иммунной системой субъекта, посредством либо активации, либо угнетения иммунной системы, или которое может быть вылечено, предотвращено или диагностировано посредством целенаправленного влияния на конкретный компонент иммунного ответа у субъекта, такого как врожденный иммунный ответ.
Понятие «иммунологически активный» в контексте данной заявки имеет отношение к врожденному иммунитету (например, способность модулировать врожденный иммунный ответ или его компонент у субъекта) или к способности модулировать активность DPPIV.
Понятие «модулировать» и «модулирующий» в контексте данной заявки, например, в словосочетании «модулирующий активность DPPIV или конкретный компонент ответа», подразумевает повышение или снижение активности или ответа в сравнении с уровнем активности в контроле, в норме или в сравнении с исходным уровнем активности или ответа в определенных условиях. Оно может также включать в себя поддержание уровня активности или ответа в условиях, при которых обычно происходит повышение или снижение активности пептида или ответа.
Понятие «фармацевтически приемлемые соли» относится к нетоксичным щелочным металлам, щелочноземельным металлам и солям аммония, широко используемым в фармацевтической промышленности, включая натрий, калий, литий, кальций, магний, барий, аммоний и протамин-цинковые соли, которые получают способами, хорошо известными в данной области. Понятие включает в себя также нетоксичные кислотно-аддитивные соли, которые обычно получают в результате реакции соединений согласно настоящему изобретению с подходящей органической или неорганической кислотой. Примерами солей могут служить гидрохлорид, гидробромид, сульфат, бисульфат, ацетат, оксалат, валерат, олеат, лаурат, борат, бензоат, лактат, фосфат, тозилат, цитрат, малеат, фумарат, сукцинат, тартрат, напсилат, трифторацетат и т.п.
Понятие «фармацевтически приемлемая кислотно-аддитивная соль» относится к солям, которые сохраняют биологическую эффективность и характеристики свободных оснований, и которые не являются биологически или по какой-либо другой причине неприемлемыми, и которые образованы с помощью неорганических кислот, таких как соляная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, ортофосфорная кислота и им подобные; а также с помощью органических кислот, таких как трифторуксусная кислота, уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, оксиянтарная кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфокислота, этансульфокислота, р-толуолсульфокислота, салициловая кислота и им подобные. Описание фармацевтически приемлемых кислотно-аддитивных солей как пролекарств приведено в Bundgaard, H., ed., (1985) Design of Prodrugs, Elsevier Science Publishers, Amsterdam.
Понятие «фармацевтически приемлемый сложный эфир» означает те сложные эфиры, которые при гидролизе эфирной связи сохраняют биологическую эффективность и свойства карбоновой кислоты или спирта и не становятся биологически или по какой-либо другой причине нежелательными. Описание фармацевтически приемлемых сложных эфиров как пролекарств приведено в публикации Bundgaard, H., ссылка на которую дана выше. Эти сложные эфиры обычно получают из соответствующей карбоновой кислоты и спирта. Как правило, сложный эфир получают общепринятыми методами синеза (см., например, March, Advanced Organic Chemistry, 3rd Ed., John Wiley & Sons, New York (1985) стр.1157 и список цитируемой там литературы, и Mark et al., Encyclopedia of Chemical Technology, John Wiley & Sons, New York (1980).) Спиртовая составляющая сложного эфира, как правило, содержит (i) С.2-С.12. алифатический спирт, который может или не может содержать одну или более двойные связи, и может или не может содержать разветвленные углеродные цепочки или (ii) С.7-C.12 ароматический или гетероароматический спирты. Также настоящее изобретение предусматривает применение таких соединений, которые являются сложными эфирами, описанными в данном абзаце, и в то же время представляют собой фармацевтически приемлемые кислотно-аддитивные солями согласно настоящей заявке.
Понятие «фармацевтически приемлемый амид» означает те амиды, которые при гидролизе амидной связи, сохраняют биологическую эффективность и свойства карбоновой кислоты или амина, и не становятся биологически или по какой-либо другой причине нежелательными. Описание фармацевтически приемлемых амидов как пролекарств приведено в публикации Bundgaard, Н., ссылка на которую дана выше. Эти амиды обычно получают из соответствующей карбоновой кислоты и амина. Как правило, амид получают общепринятыми методами синтеза (см., например, March, Advanced Organic Chemistry, 3rd Ed., John Wiley & Sons, New York (1985) стр.1157 и список цитируемой там литературы, и Mark et al., Encyclopedia of Chemical Technology, John Wiley & Sons, New York (1980).) Также настоящее изобретение предусматривает применение таких соединений, которые являются амидами, описанными в данном абзаце, и в то же время представляют собой фармацевтически приемлемые кислотно-аддитивные соли согласно настоящей заявке.
Понятие «фармацевтически или терапевтически приемлемый носитель» означает среду-носитель, которая не влияет на эффективность биологического воздействия активных ингредиентов и которая не оказывает токсического воздействия на носитель или пациента.
Понятие «стереоизомер» означает химическое соединение, имеющее тот же молекулярный вес, химический состав и строение, как и другое химическое вещество, но, атомы которого сгруппированы иначе. То есть, определенные одинаковые химические компоненты имеют различное расположение в пространстве и поэтому в чистом виде обладают способностью вращать плоскость поляризованного света. Однако некоторые чистые стереоизомеры могут обладать характеристикой оптического вращения, которое настолько незначительно, что его невозможно зарегистрировать, используя существующую на настоящий момент измерительную аппаратуру. Соединения согласно настоящему изобретению могут иметь один или более асимметричные атомы углерода, и поэтому могут включать различные стереоизомеры. Все иммунологически активные стереоизомеры включены в объем настоящего изобретения.
Понятие «терапевтически или фармацевтически эффективное количество», используемое применительно к соединениям согласно настоящему изобретению, означает такое количество композиции, которого достаточно для того, чтобы получить желаемый биологический результат. Таким результатом может быть уменьшение выраженности признаков, симптомов или причин заболевания, или любое другое желаемое изменение биологической системы. Например, согласно настоящему изобретению результат обычно предполагает усиление врожденного иммунного ответа, снижение активности DPPIV и/или модуляцию (такую как подавление, снижение или отсутствие стимуляции) воспалительных реакций на инфекцию или повреждение ткани.
В настоящей заявке использованы следующие сокращения для обозначения аминокислотных остатков пептидов: фенилаланин - Phe или F; лейцин - Leu или L; изолейцин - Не или I; метионин - Met или М; валин - Val или V; серин - Ser или S; пролин - Pro или Р; треонин - Thr или Т; аланин - Ala или А; тирозин - Tyr или Y; гистидин - His или Н; глутамин - Gin или Q; аспарагин -Asn или N; лизин - Lys или К; аспарагиновая кислота - Asp или D; глутаминовая кислота - Glu или Е; цистеин Cys или С; триптофан - Trp или W; аргинин - Arg или R; и глицин - Gly или G. В качестве дополнения используются сокращения: Nal для обозначения 1-нафтилаланина; Orn или О - для орнитина; Cit -для цитруллина, Hci - для цитруллина с еще одной метиленовой группой, и Vx или Valine х, где «х» означает вариацию в скелете аминокислоты, где аминокислотное соединение является уже не амидной связью, а метилиованным амином; это также относится и к другим аминокислотам с обозначением «х». Также 2,4-диаминобутириновая кислота обозначается как Dab, 2,3-диаминопропионовая кислота - как Dpr или Dapa; N-(4-аминобутил)-глицин - Nlys; гомосерин - hSer; гидроксипролин - Hyp; гидроксивалин - Val(betaOH); 3,4-дегидропролин - D-Pro; пироглутамин (пролин с С=O в кольце) - Pyr; пролин с фтористыми замещениями в кольце; 1,3-тиазолидин-4-карбоновая кислота (пролин с S в кольце); бета-(2 тиенил)-аланин - Thi; 2-аминобутановая кислота - Abu; норвалин - Nva; норлейцин - Nie; гомолейцин - Hol и альфа-аминоизобутановая кислота - Aib.
В дополнение к пептидам, состоящим только из натуральных аминокислот, данная заявка предполагает петидомиметики или аналоги пептидов. Аналоги пептида широко используются в фармацевтике в качестве непептидных препаратов, обладающих теми же свойствами, что и пептид, взятый за образец. Эти виды непептидных соединений называют «пептидными миметиками» или «пептидомиметиками» (Fauchere, J., Adv. Drug Res. 15:29 (1986); Veber и Freidinger, TINS стр.392 (1985); и Evans et al., J Med. Chern. 30:1229 (1987), которые включены в настоящую заявку в качестве ссылки). Пептидные миметики, имеющие такую же структуру, что и терапевтически применимые пептиды, могут использоваться для получения эквивалентного или усиленного терапевтического или профилактического эффекта. Обычно пептидомиметики структурно соответствуют пептиду, взятому за образец (т.е. пептиду, обладающему биологической или фармакологической активностью), такому, как натуральный пептид, связывающийся с рецептором, но имеют одну или более пептидных связей, факультативно замещенных связью, выбранной из группы, состоящей из: --CH2NH--, -CH2.S--, --CH2=CH2--, --CH=CH-- (cis и trans), --СОСН2--, --СН(ОН)СН2--, и ~-CH2SO-посредством способов, известных в данной области и дополнительно описанных в следующих источниках: Spatola, A.F. in Chemistry and Biochemistry of Amino Acids, Peptides and Proteins, B. Weinstein, eds., Marcel Dekker, New York, стр.267 (1983); Spatola, A.F., Vega Data (март 1983), Vol.1, Issue 3, PEPTIDE BACKBONE MODIFICATIONS (general review); Morley, Trends Pharm Sci (1980) стр.463-468 (general review); Hudson, D. et al., Int J Pept Prot Res 14:177 185 (1979): (-CH2NH-, CH2CH2-); Spatola et al., Life Sci 38:1243 1249 (1986): (--CH2--S); Hann J.I Chern. Soc. Perkin Trans. I 307 314 (1982): (--CH--CH-, cis и trans); Almquist et al., J Med Chern 23:1392 1398 (1980): (-СОСН2 -); Jennings-White et al., Tetrahedron Lett 23:2533 (1982): (--COCH2--); Szeike et al., европейская заявка. ЕР 45665 CA: 97:39405 (1982) (-CH (ОН) СН2.); Holladayet al., Tetrahedron Lett 24:4401 4404 (1983): (-C(ОН)СН2--); and Hruby Life Sci 31: 189 199 (1982): (--CH2--S--); каждая из этих публикаций включена в настоящую заявку в качестве ссылки. В одном аспекте непетидная связь является --CH2NH--. Такие пептидные миметики могут иметь существенные преимущества перед полипептидными вариантами выполнения, включая, например, более экономичное производство, большую химическую стабильность, усиленные фармакологические свойства (период полувыведения, всасывание, активность, эффективность и т.д.), измененную специфичность (т.е. широкий спектр биологической активности), сниженную антигенность и другие. Маркирование пептидомиметиков обычно предполагает ковалентное присоединение одного или более маркеров, непосредственно или через спейсер (например, амидную группу), к непересекающейся(имея) части(-ям) пептидомиметика, которые определяются по количественным данным о их структуре и активности и/или способом молекулярного моделирования. Такие непересекающиеся части, как правило, являются частями, которые не образуют прямых связей с макромолекулами (например, молекулами иммуноглобулиновых суперсемейств), к которым присоединяется пептидомиметик для достижения терапевтического эффекта. Дериватизация (например, маркирование) пептидомиметиков не должна заметно влиять на желаемую биологическую или фармакологическую активность пептидомиметика. Как правило, пептидомиметики связывающихся с рецепторами пептидов связываются с рецептором с высокой степенью сходства и обладают регистрируемой биологической активностью (т.е. являются агонистами или антагонистами к одному или более передаваемым рецептором фенотипичным изменениям).
Систематическая замена одной или более аминокислот согласованной последовательности на D-аминокислоту того же типа (например, D-лизин вместо L-лизина) может использоваться для создания более устойчивых пептидов. Следует понимать, что при этих заменах D-аминокислоты должна сохраняться иммунологическая активность пептида.
Описание
Как описано в настоящей заявке, авторами изобретения были выявлены новые пептиды, имеющие и/или содержащие аминокислотные последовательности, которые представлены в Таблице 1, или аналоги, производные или варианты аминокислотных последовательностей, описанных в настоящей заявке. Авторами изобретения было также показано, что пептид, имеющий или содержащий одну из аминокислотных последовательностей, представленных в Таблице 1, и амидированный С-конец, обладает терапевтической применимостью благодаря усилению врожденного иммунитета. В частности, авторами изобретения было показано, что пептид, содержащий аминокислотную последовательность согласно Таблице 1, не обладал антимикробным действием по отношению к S.aureus, но тем не менее проявлял in vivo свойство защиты от S.aureus у инфицированных мышей. Пептид усиливал ответ носителя на инфекцию, что способствовало более эффективному уничтожению бактерий и выживанию носителя. Таким образом, новые пептиды, описанные в настоящем изобретении, могут быть использованы в качестве терапевтического средства для лечения инфекционного заболевания. В другом варианте выполнения изобретения было показано, что пептиды согласно настоящему изобретению снижают активность DPPIV, которая, как было показано, связана с некоторыми иммунопатологическими заболеваниями, такими, как развитие СПИД и ВИЧ (Blazquez et al. 1992; Vanham et al. 1993; Schols et al. 1998 Oravecz et al. 1995), базедова болезнь (Eguchi et al. 1989; Nishikawa et al. 1995), и рак, такой как рак легких и толстой кишки (Stecca et al. 1997), а также диабет (Hinke et al. 2000; Marguet et al. 2000). Дополнительно было показано, что активность DPPIV как индикатора активации Т-клеток изменяется параллельно развитию нескольких аутоиммунных заболеваний, таких как ревматоидный артрит (Nakao et al., 1989) и аутоиммунный тиреоидит (Eguchi et al., 1989). Было показано, что DPPIV является маркером, который хорошо коррелирует с уровнем выраженности этих заболеваний. Более того, он был изучен как индикатор развития болезни при хроническом прогрессирующем рассеянном склерозе (Constantinescu et al., 1995). Пептиды согласно настоящему изобретению могут быть использованы для лечения таких состояний.
Пептиды согласно настоящему изобретению
Соответственно, настоящее изобретение предусматривает изолированные пептиды, имеющие или содержащие аминокислотную последовательность согласно Таблице 1 или ее иммунологически активный аналог, производную или вариант. Также предусматриваются фармацевтически приемлемые соли, кислотно-аддитивные соли и сложные эфиры пептидов, аналогов, производных и вариантов согласно настоящему изобретению, включая полученные способами, описанными в настоящей заявке, такими как консервативное замещение, модификация N-конца, С-конца и скелета, как описано в настоящей заявке. В контексте настоящей заявки «изолированный» пептид - это пептид, который не имеет натурального аналога или который был выделен, или очищен от компонентов, которые сопутствуют ему в природе. Изолированный пептид согласно настоящему изобретению может быть получен, например, с помощью экспрессии рекомбинантной нуклеиновой кислоты, кодирующей пептид, либо путем химического синтеза. Так как химически синтезированный пептид по своей природе отделен от всех компонентов, которые его сопровождают в природе, такой синтетический пептид является «изолированным».
В одном аспекте изолированный пептид согласно настоящему изобретению содержит аминокислотную последовательность, имеющую формулу "X1X2P" (SEQ ID NO 55), где X1 выбрана из группы, состоящей из К, Н, R, S, Т, О, Cit, Hci, Dab, Dpr и соединений, основанных на глицине, с замещением основных функциональных групп на N-конце (например, Nlys), hSer, Val(betaOH); или в другом варианте выполнения изобретения выбрана из группы, состоящей из K, R, S, О и Cit; или в другом варианте выполнения изобретения выбрана из группы, состоящей из K, R и S; или является R; и где Х2 выбрана из группы, состоящей из V, I, K, Р и Н. В одном варианте выполнения изобретения изолированный пептид согласно изобретению имеет последовательность SEQ ID NO 55. В другом аспекте это пептид, включающий в себя до 10 аминокислот, содержащий аминокислотную последовательность SEQ ID NO 55. В одном варианте выполнения изобретения изолированный пептид с последовательностью SEQ ID NO 55 содержит последовательности SEQ ID NO 8, 9, 26, 39, 40, 41 и 45-53 или является изолированным пептидом, включающим в себя до 10 аминокислот, содержащим указанные последовательности. В другом варианте выполнения изобретения изолированный пептид, содержащий последовательность SEQ ID NO 55, содержит последовательность SEQ ID NO 44, включающую в себя до 13 аминокислот.
В другом варианте выполнения изобретения предусматривается изолированный пептид, содержащий формулу "X1X2X3P" (SEQ ID NO 56), где X1 выбрана из группы, состоящей из K, Н, R, S, Т, О, Cit, Hci, Dab, Dpr или соединений на основе глицина с замещением основных функциональных групп на N-конце (например, Nlys), hSer, Val(betaOH); или в другом варианте выполнения изобретения выбрана из группы, состоящей из K, Н, R, S, Т и О; или в другом варианте выполнения изобретения из K, Н, R, S и Т; или в другом варианте выполнения изобретения из K, Н, R, S и О; или в другом варианте выполнения изобретения из R, Н, K и S; и где Х2 выбрана из группы, состоящей из A, I, L, V, K, Р, G, Н, R, S, О, Dab, Dpr, Cit, Hci, Abu, Nva, Nie, и где X2 может быть N-метилированной; или в другом варианте выполнения изобретения выбрана из группы, состоящей из А, I, L, V, K, Р, G, Н и R, где она может быть N-метилированной; и где Х3 выбрана из группы, состоящей из I, V, Р, в которой в одном из вариантов выполнения изобретения Х3 не является N-метилированной. В одном варианте выполнения изобретения изолированный пептид может представлять собой аминокислотную последовательность, включающую в себя до 10 аминокислот, содержащую SEQ ID NO 56, включая последовательности SEQ ID NO 1, 3-7, 10-16, 18, 21-25, 27, 28, 31-39, 42, 43 или 47; или изолированный пептид, включающий в себя до 11 аминокислот, содержащий SEQ ID NO 54. Однако в одном варианте выполнения изобретения, когда SEQ ID NO 56 является гексамером, пептид не имеет последовательность SEQ ID NO 2, или в одном варианте выполнения изобретения, когда он является пентамером, он не имеет последовательность SEQ ID NO 17. В одном из вариантов выполнения изобретения изолированный пептид согласно изобретению не содержит пептид, включающий последовательности SEQ ID NO 2 или 17.
В другом варианте выполнения изобретения предусмотрен изолированный пептид, содержащий пептид, содержащий последовательность SEQ ID NO 56 в форме пентамера или гексамера. В одном варианте выполнения изобретения указанный пептид обладает иммунологической активностью.
В одном варианте выполнения изобретения изолированный пептид согласно изобретению содержит пептид, содержащий формулу «aX1X2X3P» (SEQ ID NO 57), где X1, X2 и Х2 определяются как для последовательности SEQ ID NO 56, и где «а» выбрана из группы, состояще