Презентируемый в salmonella enterica n-гликан из c. jejuni и его производные
Иллюстрации
Показать всеНастоящее изобретение относится к генетически модифицированной бактерии Salmonella enterica, которые содержат, по меньшей мере, один оперон pgl из Campylobacter jejuni или его функциональное производное и относится к презентации, по меньшей мере, одного N-гликана из Campylobacter jejuni или производного этого N-гликана на их клеточной поверхности. В бактерии один или несколько генов для биосинтеза бациллозамина инактивированы мутацией и/или частичной или полной делецией генов pglD, E, F, G. Изобретение раскрывает способ получения генетически модифицированной бактерии Salmonella enterica. Изобретение направлено на применение модифицированной бактерии в фармакологических композициях медицинского и ветеринарного назначения, а также на способы лечения и/или профилактики инфекций Campylobacter и необязательно Salmonella. Использование изобретения обеспечивает безопасность и эффективность профилактики и лечения инфекции у людей и животных, в частности домашнего скота и домашней птицы. 9 н. и 9 з.п. ф-лы, 4 ил., 1 табл., 6 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к Salmonella enterica, содержащей, по меньшей мере, один оперон pgl из Campylobacter jejuni или его функциональное производное и относится к презентированию, по меньшей мере, одного N-гликана из Campylobacter jejuni или производного этого N-гликана на ее клеточной поверхности. Кроме того, изобретение направлено на медицинские применения, фармакологические композиции, пищевые и кормовые добавки, а также на способы лечения и/или профилактики инфекций Campylobacter, в частности вызываемых С.jejuni, С.lari, С.coli, С.upsaliensis, и С.fetus, и необязательно инфекций Salmonella и на способы получения этих штаммов Salmonella.
Предшествующий уровень техники
Campylobacter jejuni (С.jejuni) - это пищевой патоген, который является основной причиной острого гастроэнтерита в развивающихся странах. Его обычными хозяевами является домашний скот, в частности куры и коровы. Инфекции С.jejuni также ассоциированы с несколькими длительными последствиями, наиболее тяжелыми из которых являются аутоиммунные заболевания, синдром Миллера-Фишера и синдром Гийена-Барре. Они вызываются антителами млекопитающего-хозяина против структуры на поверхности патогена, имитирующей ганглиозиоды млекопитающих, которые затем также атакует собственные ганглиозиды хозяина. Данная молекулярная мимикрия является одной из причин, почему не существует эффективных вакцин против С.jejuni, так как данная мимикрия исключает применение в качестве вакцин ослабленных или убитых клеток С.jejuni.
В патенте США 2007/065461 описывается вакцина состоящая, по меньшей мере, из одного капсулированного полисахарида (англ. capsular polysaccharide, CPS) из С.jejuni функционально связанного in vitro с белком-носителем. Инъекция данного конъюгата в мышь и человекообразных обезьян защищает от последующего интраназального заражения С.jejuni. Получение данной вакцины требует выделения и очистки CPS, a также химического связывания с белком носителем и дополнительных стадий очистки.
Poly et al. (Infection and Immunity, 75:3425-3433, 2008) описывает тестируемые в настоящее время в качестве вакцинных кандидатов штаммы С.jejuni, потерявшие структуры, имитирующие ганглиозиды.
Ранее гликозилирование считалось специфическим феноменом эукариот, но позднее было показано, что оно широко распространено как в домене Archaea так и в домене Eubacteria. Бактериальные О- и N-связи образуются с более широким спектром сахаров, чем спектр наблюдаемый в эукариотических гликопротеинах. Гликозидное N-гликозилирование белков в прокариотах впервые было показано в С.jejuni (Szymanski et al., Molecular Microbiology 32:1022-1030, 1999). Механизм гликозилирования С.jejuni был описан и даже был успешно перенесен в Е.coli, в которых было продемонстрировано успешное N-гликозилирование белков (Wacker et al., Science, 298:1790-1793, 2002). Генный локус С.jejuni, называемый pgl (для гликозилирования белков) участвует в гликозилировании множества белков. Его мутационный сайленсинг приводит к потере иммуногенности во множестве белков.
В заявке на патент США 2006/0165728 A1 идентифицирован специфический и сильноиммуногенный гептасахарид, который является общим, по меньшей мере, для нескольких видов Campylobacter и множества штаммов, которые являются важными в качестве человеческих и ветеринарных патогенов. Гептасахарид имеет следующую формулу (I):
GalNAc-a1,4-GalNAc-a1,4-[Glc-β-1,3]GalNAc-a1,4-Gal-NAc-a1,4-GalNAc-a1,3-Bac,
где Вас (также известный как бациллозамин) является 2,4-диацетамидо-2,4,6-тридезокси-D-глюкопиранозой, GalNAc является N-ацетил-галактозамином, a Glc является глюкозой. Данная гликанная составляющая является компонентом множества гликопротеинов. В С.jejuni N-гликан важен для взаимодействия С.jejuni с клетками-хозяина. Мутации в механизме гликозилирования приводят к уменьшению колонизации в кишечных трактах у мышей. Кроме того, предложены фармацевтические композиции, содержащие либо (i) указанный гептасахарид или его конъюгат, либо (ii) антитело, направленное против указанного гептасахарида, для применения при вакцинации скота, особенно домашней птицы.
Род Salmonella является членом семейства Enterobacteriaceae. Род состоит из грамотрицательных бацилл, которые являются факультативными анаэробами и жгутиконосцами (подвижными). Они обладают тремя основными антигенами, «Н» или флагеллярный антиген, «О» или соматический антиген (часть ЛПС-составляющей) и «Vi» или капсульный антиген (называемый «K» в других Enterobacteriaceae}. Salmonellae также обладают ЛПС-эндотоксином, характерным для грамотрицательных бактерий. ЛПС состоит из трех доменов: части липида А, также известной как эндотоксин, заякоривающей ЛПС во внешней мембране с помощью своих жирнокислотных цепей. Данная часть соединена через внутренний кор, состоящее из гептоз и KDO (3-дезокси-D-маннооктулозоновой кислоты) с внешним кором, содержащим гексозы и N-ацетилгексозы. Присоединенное к последней глюкозе внешнего кора является полимерной O-антигенной областью. Данная область состоит из от 16 до >100 повторов олигосахаридной структуры, содержащей от четырех до шести моносахаридов. Эндотоксичная часть липида А вызывает лихорадку и может активировать комплемент, кинин и факторы свертывания крови.
Какое-то время штаммы Salmonella привлекали интерес для получения и презентации бактериальных иммуногенов. Например, гены, кодирующие ферменты для биосинтеза O-антигена Shigella были интегрированы в геном вакцинного штамма aroA Salmonella enterica серовар Typhimurium, который затем продуцировал гибридный ЛПС (Fait et al., Microbial Pathogenesis 20:11-30, 1996). Также кластеры, необходимые для биосинтеза O-антигена Salmonella dysenteriae были клонированы в стабильный экспрессирующий вектор, которые затем были перенесены в вакцинный штамм от брюшного тифа Ту21а. Полученный в результате штамм продуцировал гибридный ЛПС и индуцировал иммунитет против заражения S. dysenteriae (DE Qui Xu et al., Vaccine 25:6167-6175, 2007).
Патент США 6,399,074 В1 раскрывает живую ослабленную вакцину с Salmonella для защиты птиц против инфекции птичьими патогенными грамотрицательными микробами. Вакцина является рекомбинантным штаммом Salmonella, экспрессирующим O-антиген птичьего патогенного грамотрицательного микроба, такого как Е.coli O78, который является патогенным для домашней птицы. Рекомбинантный штамм Salmonella не экспрессирует O-антиген Salmonella из-за мутации в полимеразе O-антигена rfz (по новой генной номенклатуре wzy).
В свете представленного выше уровня техники задача настоящего изобретения заключается в обеспечении эффективной и безопасной, простой при массовом производстве, обладающей длительным действием и дешевой вакцинной композиции для профилактики и/или лечения инфекций Campylobacter у людей и животных, в частности у домашнего скота, в частности у домашней птицы.
Эта задача решается путем обеспечения в первом аспекте Salmonella enterica, которая содержит, по меньшей мере, один оперон pgl из Campylobacter jejuni или его функциональное производное и презентирует на поверхности клетки, по меньшей мере, один N-гликан из Campylobacter jejuni или производное данного N-гликана.
Полезный для настоящего изобретения штамм Salmonella может быть любым штаммом, который является или может быть достаточно ослабленным для того, чтобы его можно было вводить в живом и/или мертвом виде людям и/или животным не вызывая патологию. Предпочтительные штаммы Salmonella и штаммы Salmonella enterica выбраны из группы состоящей из Salmonella Typhimurium, enteriditis, heidelberg, gallinorum, hadar, agona, kentucky, typhi и infantis, более предпочтительно из штаммов Salmonella enterica серовара Typhimurium. Salmonella Typhimurium особенно полезна для целей вакцинации, потому что ее геномная последовательность полностью охарактеризована и множество исследований на животных подтверждают ее безопасное применение в медицине.
Термин «оперон pgl» при использовании в данном документе относится к любому физиологически активному кластеру генов N-гликозилирования у С.jejuni, способных к N-гликозилированию гомологичных или гетерологичных структур, продуцируемых штаммом Salmonella по изобретению. Оперон pgl в С.jejuni кодирует все ферменты, необходимые для синтеза гептасахарида N-гликана из С.jejuni для его транспорта через внутреннюю мембрану и для переноса на белки. PglD, E, F кодируют ферменты, участвующие в биосинтезе бациллозамина, PglC переносит фосфорилированный бациллозамин на ундекапринилфосфат, a PglA, H и J добавляют остатки GalNAc. Разветвленная Glc прикрепляется с помощью PglI. Перенос законченного гептасахарида осуществляется PglK, а олигосахаридтрансфераза PglB переносит N-гликан на белок.
Функциональное производное оперона pgl является кластером генов, полученных из любого оперона pgl из С.jejuni имеющего делеции, мутации и/или замены нуклеотида(ов) или целых генов, но все еще способным продуцировать связывающийся олиго- или полисахарид, который может быть связан с гомологичными или гетерологичными структурами, продуцируемыми штаммом Salmonella по изобретению. Один или несколько оперонов pgl или их производных могут быть интегрированы в хромосому штамма Salmonella или их/они могут быть введены как часть, по меньшей мере, одной плазмиды. Хромосомная интеграция является предпочтительной, потому что она более стабильна по сравнению с плазмидными векторами, потеря которых происходит в ходе культивирования. Следует отметить, что штамм Salmonella по изобретению может содержать больше чем один оперон pgl или его производное, продуцирующий один или несколько N-гликанов или его производных. В действительности предпочтительно, когда штамм по изобретению имеет больше чем один тип оперона pgl, дающий в результате больше чем одну N-гликанную структуру, что может быть преимуществом, поскольку вызывает более разнообразный иммунный ответ в человеке или животном против различных штаммов С.jejuni.
Также следует отметить, что уровень экспрессии N-гликана из С.jejuni необязательно может быть регулирован путем применения различных промоторов выше оперона pgl, включая, без ограничения перечисленным, промоторы генов рибосомальных белков, например, spc или rpsm, а также промоторы из генов, кодирующих устойчивость к антибиотикам, подобных bla или похожих, а предпочтительно сильные промоторы. Данный тип регуляции доступен для кодируемых плазмидами или интегрированных в геном оперонов pgl. Более того, стабильность плазмид необязательно может быть усилена путем включения незаменимых генов в плазмиду с одновременным удалением этих генов в геноме штамма Salmonella по изобретению. Предпочтительные мишени охватывают, например, гены кодирующие tRNA-трансферазы, подобные CysS.
В предпочтительном воплощении, штамм Salmonella по изобретению является штаммом содержащим, по меньшей мере, один оперон pgl, в котором один или несколько генов для биосинтеза бациллозамина инактивированы мутацией или частичной или полной делецией, предпочтительно частичной и/или полной делецией генов D, Е, F, G. В наиболее предпочтительном воплощении гены pglE, F и G оперона pgl полностью удалены, а ген pglD частично удален, например, когда открытая рамка считывания (ORF) pglD заканчивается после 270 пар оснований (полноразмерная ORF содержит 612 пар оснований).
В другом предпочтительном воплощении инактивирован ген pglB оперона pgl, что означает, что соответствующая олигосахарилтрансфераза В либо не экспрессируется, либо, по меньшей мере, ферментативно инактивирована. Продукт гена pglB переносит N-гликан на специфический полипептидный акцепторный сайт дополнительно описанный ниже. Инактивация трансферазы приводит к тому, что N-гликан или производное N-гликана исключительно связаны с ядром липида А акцептора O-антигена в Salmonella.
В наиболее предпочтительном воплощении производное pgl является производным, в котором один или несколько генов для биосинтеза бациллозамина, pglD, Е, F, G, и переноса инактивированы, и ген pglB инактивирован тоже. Данное воплощение приводит к обмену GlcNac на бациллозамин, приводящий к увеличению его презентации на клетке, а также к переносу модифицированного гептасахарида на ядро липида А вместо полипептидных акцепторов.
По меньшей мере, один N-гликан из С.jejuni или производное этого N-гликана может быть любым N-гликаном, продуцируемым опероном pgl из Campylobacter jejuni или его функциональным производным. Конечно, предпочтительно, если N-гликан все еще является иммуногенным, т.е. вызывает иммунный ответ, специфичный для С.jejuni.
В предпочтительном воплощении, N-гликан является гептасахаридом формулы (I) как описано выше, т.е. GalNAc-a1,4-GalNAc-a1,4-[Glc-β-1,3]GalNAc-a1,4-Gal-NAc-a1,4-GalNAc-a1,3-Bac, где Вас (также известный как бациллозамин) является 2,4-диацетамидо-2,4,6-тридезокси-D-глюкопиранозой.
Предпочтительный оперон pgl, в котором гены для биосинтеза бациллозамина инактивированы, а предпочтительней в основном или полностью удалены, синтезирует производное N-гликана, т.е. полисахарид формулы (II), а именно GalNAc-a1,4-GalNAc-a1,4-[Glc-β-1,3]GalNAc-a1,4-Gal-NAc-a1,4-GalNAc-a1,3-GlcNAc.
Удивительно, но производное N-гликана формулы (II) в больших, чем N-гликан формулы (I) количествах презентируется на поверхности клеток штаммов Salmonella настоящего изобретения и также является иммуногенным. Это экспериментально подтверждается в разделе примеров ниже.
В предпочтительном воплощении, N-гликаны или производное(ые) полученные, по меньшей мере, из одного оперона pgl или его производного могут быть связаны, по меньшей мере, с одним гомологичным или гетерологичным полипептидом Salmonella, который в конечном итоге переносится и презентируется на клеточной поверхности. Предпочтительно, если, по меньшей мере, один N-гликан или производное N-гликана связаны с полипептидом, содержащим, по меньшей мере, один консенсусный сиквон N-Z-S/T (см. Nita-Lazar M et al., Glycobiology. 2005; 15(4):361-7), предпочтительно D/E-X-N-Z-S/T (SEQ ID NO:1), где X и Z могут быть любой природной аминокислотой за исключением Pro (см. Kowarik et al. EMBO J. 2006; 25(9):1957-66).
Полипептид, связанный с N-гликаном (производным) может быть любым типом полипептида, таким как чистый полипептид (только аминокислоты) или посттрансляционно модифицированный полипептид, например, полипептид, связанный с липидом.
Предпочтительно, если гетерологичные полипептиды, используемые в качестве носителей N-гликана(ов) (производных), содержат сигнальную последовательность MKKILLSVLTTFVAWLAAC (SEQ ID NO:2), направляющую N-связанный конъюгат к внешней мембране клетки и в которых мотив LAAC (SEQ ID NO:3) используется для ацилирования остатка цистеина, который заякоривает полипептид во внешней мембране (см. также Kowarik et al., EMBO J. May 3; 25(9):1957-66, 2006).
В наиболее предпочтительном воплощении, по меньшей мере, один N-гликан или его производное возникшее вследствие функционирования, по меньшей мере, одного оперона pgl или его производного, связан с ядром липида А из Salmonella или с функциональным эквивалентом его производного. Ядро липида А из Salmonella представляет собой олигосахаридную структуру состоящую из гексоз, N-ацетилгексоз, гептоз и KDO (5-деокси-D-манно-октулозоновой кислоты), связанную через два глюкозамина с шестью цепями жирных кислот, заякоривающих структуру во внешней мембране бактерии. Функциональный эквивалент производного ядра липида А является производным, способным принять один или несколько гликанов или их производных и презентировать их на поверхности клеток. Следует отметить, что в данном случае N-гликан или его производное не N-связаны потому что структурный липид А из Salmonella не является полипептидом. Предпочтительно если N-гликан связан с GIcII в ядре липида А или его функционального производного.
Предпочтительно, если, по меньшей мере, один N-гликан или его производное занимает место боковых цепей O-антигена в ЛПС (линополисахаридах). Внешнее и внутреннее ядро липида А из Salmonella остается неизмененным, если биосинтез O-антигена прерывается мутацией wbaP. Затем N-гликан переносится лигазой O-антигена WaaL и связывается с остатком GIcII олигосахаридной структуры внешнего ядра липида А.
Предпочтительно и крайне важно для применения в медицине, чтобы штамм Salmonella по изобретению не вызывал патогенных эффектов при введении животному или человеку в живой или инактивированной форме. Специалист знает много путей ослабления вирулентных видов Salmonella мутацией. Предпочтительные мутации для ослабления штаммов Salmonella для применения в настоящем изобретении выбраны из группы состоящей из pab, pur, aro, aroA, asd, dap, nadA, pncB, galE, pmi, fur, rpsL, ompR, htrA, hemA, cdt, cya, crp, phoP, phoQ, rfc, рохА и galU. Может присутствовать одна или несколько этих мутаций. Мутации aroA, cya и/или crp являются более предпочтительными.
Гены биосинтеза O-антигена из Salmonella кластеризованы в локус rfb гипервариабельной области ДНК хромосомы Salmonella. Частичная или полная инактивация была связана с ослаблением штаммов Salmonella. С другой стороны, O-антиген также является важной антигенной детерминантой для индукции иммунитета в хозяине.
В особенно предпочтительном воплощении штамм Salmonella по настоящему изобретению ослаблен частичной или полной инактивацией экспрессии O-антигена, предпочтительно одной или несколькими мутациями и/или делениями в генном кластере rfb, более предпочтительно в гене wbaP, при этом наиболее предпочтительной является делеция гена wbaP.
Понятно, что при использовании в данном документе термины «локус rfb» и «ген wbaP» предназначены для охвата любого соответствующего локуса и гена в любом штамме Salmonella, который способен экспрессировать O-антиген или связанные антигены.
Продукт гена wbaP является фосфогалактозилтрансферазой, которая начинает биосинтез O-антигена путем добавления фосфогалактозы к ундекапренилфосфату. Его инактивация/удаление приводит к полной отмене биосинтеза O-антигена, сахарный продукт которого конкурирует с N-гликаном(ами) (производными) из С.jejuni за переносчик липидов ундекапренилфосфат и за перенос лигазой WaaL. N-гликозилирование, индуцированное локусом pgl, и зависимый от wzy синтез O-антигена в бактерии являются гомологичными процессами. Было обнаружено, что лигаза WaaL O-антигена из Salmonella имеет нестрогую субстратную специфичность и что она может перенести N-гликан из С.jejuni на ядро липида А из Salmonella.
Таким образом, в наиболее предпочтительном воплощении штамм Salmonella по изобретению является мутированным в гене wbaP, что приводит к инактивации фермента фосфогалактозилтрансферазы. Следует отметить, что данный тип инактивации O-антигена не был описан ранее для целей вакцинации, и превосходит известные в настоящее время негативные мутанты O-антигена, потому что является генетически определенным и позволяет увеличить количество N-гликанов (производных) из С.jejuni, присутствующих на поверхности клеток штаммов Salmonella.
Поэтому, и в качестве независимого изобретения, настоящее изобретение также относится к штамму Salmonella с мутированным, предпочтительно делегированным и, таким образом, инактивированным геном wbaP, который является полезным для вакцинных применений штаммов Salmonella как таковых, а также применений штаммов Salmonella в качестве носителей гетерологичных антигенов, предпочтительно гликозилированных, более предпочтительно N-гликозилированных антигенов.
В наиболее предпочтительном воплощении изобретение направленно на Salmonella enterica, предпочтителен на серовар typhimurium, который
(a) содержит
(i), по меньшей мере, один оперон pgl из Campylobacter jejuni или его функциональное производное, предпочтительно, по меньшей мере, один оперон pgl, в котором инактивированы один или несколько генов для биосинтеза бациллозамина, и
(ii) мутации и/или делеции в гене wbaP, приводящие к полной инактивации биосинтеза O-антигена,
(b) и презентирует, по меньшей мере, один N-гликан из Campylobacter jejuni или производное такого N-гликана, предпочтительно (I) GalNAc-a1,4-GalNAc-a1,4-[Glc-β-1,3]GalNAc-а1,4-Gal-NAc-а1,4-GalNAc-а1,3-2,4-диацетамидо-2,4,6-тридеокси-D-глюкопиранозу и/или (II) GalNAc-a1,4-GalNAc-a1,4-[Glc-β-1,3]GalNAc-a1,4-Gal-NAc-a1,4-GalNAc-a1,3-GlcNAc на поверхности своей клетки.
Описанные выше штаммы Salmonella по изобретению являются сильно иммуногенными и вызывают иммунный ответ против инфекций С.jejuni. Более того, полученные один раз они могут легко быть репродуцированы и серийно произведены. В качестве дополнительного преимущества введение их животному или человеку обеспечивает иммунитет против инфекций С.jejuni и Salmonella. Они могут быть введены в виде инактивированной или живой вакцин, живых вакцин, позволяющих длительное культивирование и устойчивый иммунный стимул в хозяине, а также полные иммунные ответы без адъювантов.
Следовательно, настоящее изобретение также относится к применению в медицине живых или инактивированных штаммов Salmonella по настоящему изобретению в частности для приготовления лекарственного средства, предпочтительно вакцины.
Предпочтительно, если лекарственное средство полезно для профилактики и/или лечения инфекций Campylobacter jejuni и необязательно Salmonella, предпочтительно инфекций домашнего скота, более предпочтительно крупного рогатого скота и домашней птицы, наиболее предпочтительно домашней птицы, такой как куры, индейки, гуси и утки.
Третий аспект настоящего изобретения относится к фармацевтической композиции, пищевому продукту или корму (добавке), содержащим инактивированную или живую Salmonella enterica по настоящему изобретению и физиологически приемлемый наполнитель.
Например, фармацевтическая композиция настоящего изобретения может быть получена выращиванием в среднем или большом масштабе штаммов Salmonella по изобретению содержащих, по меньшей мере, либо один кодируемый плазмидой, либо интегрированный в хромосому оперон pgl или его производное. Эти Salmonella могут быть использованы напрямую или могут входить в состав средства, предназначенного для конкретной цели - человека или животного и к конкретному пути введения. Фармацевтические композиции, содержащие живую Salmonella, являются предпочтительными по очевидным причинам.
В ином случае, изобретение относится к пищевому продукту или корму для людей или животных, предпочтительно для домашнего скота, более предпочтительно для домашней птицы, содержащему инактивированную или живую Salmonella enterica по настоящему изобретению и физиологически приемлемый наполнитель и/или продукт питания. Например, такой корм будет значительно сокращать колонизацию С.jejuni в стаях домашней птицы и, следовательно, уменьшать шанс инфицирования человека С.jejuni, а также инфицирования через зараженное мясо Salmonella.
Четвертый аспект настоящего изобретения направлен на способ лечения и/или профилактики инфекций С.jejuni и необязательно Salmonella, содержащему введение Salmonella enterica, фармацевтической композиции, продукта питания или корма по настоящему изобретению человеку или животному нуждающемуся в этом, в физиологически активном количестве.
Для терапевтического и/или профилактического применения фармацевтическая композиция по изобретению может быть введена в любой традиционной лекарственной форме в любой традиционной манере. Пути введения включают, без ограничения перечисленным, внутривенный, внутримышечный, подкожный, интраназальный, внутрисиновиальный, инфузицей, подъязычный, трансдермальный (чрескожный), пероральный (например, искусственное питание через зонд), местный и ингаляцией. Предпочтительными режимами введения являются пероральный, внутривенный и интраназальный, из них интраназальный наиболее предпочтителен.
Salmonella по изобретению может быть введена отдельно или в комбинации с адъювантами, которые повышают стабильность и/или иммуногенность бактерий, облегчают введение фармацевтических композиций содержащих их, обеспечивают повышенное растворение или дисперсию, увеличивают репродуктивную активность обеспечивают вспомогательную активность, и т.п. включая другие активные ингредиенты.
Фармацевтические лекарственные формы с Salmonella описанные в данном документе включают фармацевтически приемлемые носители и/или адъюванты, известные специалисту в данной области. Эти носители и адъюванты включают, например, ионообменники, окись алюминия, стеарат алюминия, лецитин, белки сыворотки, буферные вещества, воду, соли, электролиты, вещества на основе целлюлозы, желатин, воду, вазелин, животный или растительный жир, минеральное или синтетическое масло, физиологический раствор, декстрозу или другие сахаридные и гликолевые соединения, такие как этиленгликоль, пропиленгликоль или полиэтиленгликоль, антиоксиданты, лактат и т.п. Предпочтительные лекарственные формы включают таблетки, капсулы, растворы, суспензии, эмульсии, реконструируемые порошки и трансдермальные пластыри. Способы для приготовления лекарственных форм хорошо известны, см., например, Н. С. Ansel and N. G. Popovish, Pharmaceutical Dosage Forms and Drug Delivery Systems, 5th ed., Lea and Febiger (1990) and, in particular, Pastoret et al., Veterinary Vaccinology, Elsevier March 1999). Уровни дозировок и требования широко известны в данной области и могут быть выбраны обычным специалистом в данной области из доступных способов и методов, подходящих для конкретного пациента. Специалист поймет, что в зависимости от конкретных факторов могут потребоваться более низкие или более высокие дозы. Например, конкретные дозы и схемы лечения будут зависеть от факторов, таких как общий профиль здоровья пациента (человека или животного), тяжесть и течение расстройства у пациента, и предрасположенность к нему, и от решения лечащего врача или ветеринара.
В предпочтительном воплощении для пероральной вакцинации схема состоит из введения Salmonella, содержащих оперон pgl или его производное либо в плазмиде, либо интегрированный в хромосому, на 1 или 2 день после вылупления цыплят в количестве около 106 КОЕ (колониеобразующих единиц) на цыпленка с повторным введением (буст) на 14 или 21 день после вылупления таким же количеством бактерий. Эти два введения обеспечат достаточное стимулирование иммунной системы для того, чтобы выстроить ответ против N-гликана из С.jejuni или его производных, а также против белков Salmonella для обеспечения защиты от позднейшей колонизации у кур. Альтернативой для вакцинации кур является внутривенная инъекция инактивированных, например, инактивированных нагреванием или формалином бактерий на 1 или 2 день после вылупления и повторное введение на 14 или 21 день. Как еще один вариант, цыплята также могут быть вакцинированы всего лишь единожды в более поздней временной точке вплоть до 3 недельного возраста либо внутривенно термоинактивированными или формалининактивированными бактериями, либо внутрижелудочно живыми бактериями.
Не в последнюю очередь, настоящее изобретение касается способа для получения Salmonella enterica в соответствии с изобретением содержащим стадию(ии)
(i) введения в Salmonella enterica предпочтительно, по меньшей мере, одним плазмидным вектором или геномной интеграцией, по меньшей мере, одного оперона pgl из С.jejuni или его функционального производного, предпочтительно, по меньшей мере, одного оперона pgl, в котором один или несколько, а предпочтительнее все гены для биосинтеза бациллозамина инактивированы, и
(ii) предпочтительно введения мутаций и/или делеций в ген wbaP, приводящих к полной инактивации биосинтеза O-антигена.
Далее настоящее изобретение будет дополнительно иллюстрировано со ссылкой на конкретные воплощения и эксперименты, которые не должны быть истолкованы как ограничивающие объем притязаний изобретения, представленного приложенной формулой изобретения.
Чертежи
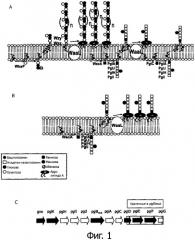
Фиг.1 является схематическим изображением дисплея N-гликана из С.jejuni, на S. enterica sv. Typhimurium.
А) показан перенос N-гликана из С.jejuni на ядро липида А из S. Typhimurium в штамме, продуцирующем O-антиген и имеющем оперон pglmut («mut» означает, что PglB инактивирован 2-мя точечными мутациями);
B) показан штамм S. Typhimurium ΔwbaP без какого-либо O-антигена и имеющий оперон pgl3mut, в котором гены для биосинтеза бациллозамина удалены;
C) иллюстрирует делеции в опероне pgl3mut.
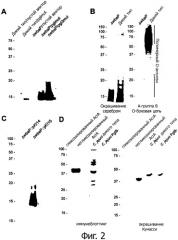
На фиг.2 продемонстрирован дисплей N-гликана из С.jejuni на S. enterica sv. Typhimurium
A) показан иммуноблоттинг с антителами, связывающими N-гликан из С.jejuni после ДСН-ПААГ обработанных протеинкиназой К цельных экстрактов клеток штаммов S. Typhimurium дикого типа и ΔwbaP, несущих указанные плазмиды, и демонстрирующий дисплей N-гликана из С.jejuni на ядре липида А в S. Typhimurium.
B) представляет собой ДСН-ПААГ, окрашенный серебром (левая панель) и иммуноблоттинг с антителами, связывающими группу В O-антигена Salmonella (правая панель) после ДСН-ПААГ обработанных протеинкиназой К цельных экстрактов клеток штаммов S. Typhimurium дикого типа и ΔwbaP. Фигура подтверждает отсутствие полимерного 0-антигена в штамме ΔwbaP.
C) показан иммуноблоттинг с антителами, связывающими N-гликан из С.jejuni после ДСН-ПААГ штамма S. Typhimurium ΔwbaP с интегрированным пустым вектором (контролем) или интегрированным опероном pgl3mut и подтверждает экспрессию N-гликана из С.jejuni на ядре липида A S. Typhimurium ΔwbaP с интегрированным опероном pgl3mut.
D) в левой панели изображен иммуноблоттинг с сывороткой из мыши, инфицированной внутривенно термоинактивированными S. Typhimurium ΔwbaP, воспроизводящими N-гликан из С.jejuni с GlcNac на восстанавливающем конце и кодируемый pgl3mut. Распознавание клеток С.jejuni дикого типа, но не С.jejuni 81-176pglB является очевидным. В правой панели показан окрашенный Кумасси гель ДСН-ПААГ образцов, использованных в иммуноблоттинг-анализе мышиных сывороток.
На фиг.3 представлены in vitro тесты, использованные для демонстрации ослабления S. Typhimurium ΔwbaP
А) показана повышенная чувствительность S. Typhimurium ΔwbaP к компонентам человеческой сыворотки: опосредованный комплементом цитолиз устойчивого к канамицину серовара Typhimurium штамма дикого типа, М939, отрицательного по O-антигену ΔwbaP::cat (SKI11) и комплементированный мутант ΔwbaP::pK19 (SKI33) тестировали инкубацией смеси 1:1:1 Salmonella дикого типа, ΔwbaP и ΔwbaP::pK19 (SKI33) в течение указанных временных точек вместе с 20% человеческой сывороткой или с 20% термоинактивированной человеческой сывороткой. Выживаемость была проанализирована путем рассевания на дифференцирующих средах.
B) отображен результат экспериментальных условий А), но с отличием, заключающемся в применении термоинактивированной сыворотки. Выживаемость ни одного из штаммов не изменилась.
C) иллюстрирует дефект S. Typhimurium ΔwbaP при перемещении плаванием по сравнению с S. Typhimurium дикого типа и неподвижным штаммом fliGHI:Tn10.
На фиг.4 продемонстрирована пониженная способность к колонизации для S. Typhimurium ΔwbaP в эксперименте с совместной инфекцией с S. Typhimurium дикого типа.
A) графически представлены конкурентные индексы (CI; (мутант/дикий тип) на выходе/ (мутант/дикий тип) на входе) серовара Typhimurium ΔwbaP (SK112) и дикого типа, определенные на 1-3 дни после инфекции в экскрементах и на 4 день после инфекции в содержимом слепой кишки, демонстрирующие уменьшенную способность к колонизации S. Typhimurium ΔwbaP по сравнению с диким типом.
B) CI в брызжеечных лимфоузлах (mLN), селезенке и печени на 4 день после инфекции.
Примеры
Бактериальные штаммы и условия роста
Сводка по бактериальным штаммам, которые использованы в экспериментах, перечисленных в примерах, приведена в таблице 1. Бактерии выращивали в среде Лурия-Бертани (LB) (10 г/л Бакто-триптона, 5 г/л Бакто-дрожжевого экстракта, 5 г/л NaCl). Чашки с LB-агаром были дополнены 1,5% (масс./об.) агаром. Антибиотики использовали в следующих конечных концентрациях: ампициллин (amp) 100 мкг/мл, канамицин (kan) 50 мкг/мл, хлорамфеникол (cam) 25 мкг/мл, стрептомицин (strep) 50 мкг/мл, тетрациклин (tet) 10 мкг/мл.
Пример 1. Дисплей N-гликана из C.jejuni на ядре липида A Salmonella enterica sv. Typhimurium.
Wzy-зависимый биосинтез 0-антигена и биосинтез N-гликана из С.jejuni являются гомологичными процессами (Feldman et al., Proc. Natl. Acad. Sci. USA.; 102(8):3016-21, 2005), которые оба начинаются со сборки олигосахаридной структуры на ундекапренилпирофосфатном линкере. Гомология двух путей, а также нестрогая субстратная специфичность лигазы O-антигена WaaL из S. enterica sv. Typhimurium (Fait et al., Microbial Pathogenesis 20:11-30, 1996; De Qui Xu et al., Vaccine 25:6167-6175, 2007) были исследованы на предмет возможности объединения путей для дисплея N-гликана из С.jejuni на ядре липида А из Salmonella.
Плазмиду, содержащую оперон pglmut из C.jejuni с инактивированным PglB (pACYCpglmut; Wacker et al 2002) вводили в штамм Salmonella enterica serovar Typhimurium электропорацией. В качестве отрицательного контроля применяли соответствующий пустой вектор pACYC184.
Гликонъюгаты трансформантов тестировали на предмет дисплея N-гликана из С.jejuni с помощью ДСН-ПААГ и последующего иммуноблоттинга с антисывороткой к N-гликану С.jejuni (Amber 2008). Образцы были приготовлены следующим образом: Эквивалент 2 OD600/мл растущих в лог-фазе культур S. enterica sv Typhimurium содержащих либо pACYC184, либо pACYpglmut осаждали при 16000 g в течение 2 минут и отбрасывали надосадочную жидкость. Клетки ресуспендировали в 100 мкл буфера Лэммли для образцов (0,065 М Tris-HCl рН 6,8, 2% ДСН (масс./об.), 5% β-меркаптоэтанол (об./об.), 10% глицерин (об./об.), 0,05% бромфеноловый синий (масс./об.)) и лизировали в течение 5 мин. при 95°С. После охлаждения до комнатной температуры, добавляли протеиназу К (Gibco/Life Technologies) (конечная концентрация 0,4 мг/мл) инкубировали 1 час при 60°С до внесения равных количеств на 15% полиакриламидный гель с додецилсульфатом натрия (ДСН-ПААГ) и проводили гель-электрофорез. Для обнаружения N-гликана из С.jejuni применяли кроличью поликлональную антисыворотку, связывающую N-гликан из С.jejuni (S. Amber, PhD.-thesis, ETH Zurich, Department of Biological Science. Zurich, 2008). Визуализацию сигналов проводили HRP-конъюгатом козьих антител, связывающих кроличьи IgG (Santa Cruz) и ECL (Amersham), как рекомендовано производителем.
N-гликан из С.jejuni можно было обнаружить на ядре липида A S. enterica sv. Typhimurium, когда в клетках присутствовала pACYCpglmut (фиг.2А дорожка 2), но не в случае, когда в клетки вводили пустой вектор (фиг.2А дорожка 1). Это говорит о том, что WaaL из S. enterica sv Typhimurium переносит N-гликан из С.jejuni с ундекапренилпирофосфата на ядро липида А.
Пример 2. Конструирование делеции wbaP в Salmonella enterica sv Typhimurium и повышенное воспроизведение N-гликана из С.jejuni в негативном по O-антигену штамме
Предполагалось, что делеция биосинтеза O-антигена ликвидирует конкуренцию между путем биосинтеза O-антигена и биосинтезом N-гликана из С.jejuni за переносчик липидов ундекапренилфосфат.
Конструирование делеционного мутанта S. Typhimurium дикого типа SL1344 с делецией wbaP проводили, как описано (Datsenko and Wanner, PNAS USA 97(12):6640-5, 2000). Были синтезированы праймеры RfbP H1P1 (последовательности см. в таблице 1) и RfbP H2P2, которые отжигаются на матричной ДНК из плазмиды pKD3, несущей ген устойчивости к хлорамфениколу, фланкированный сайтами FRT (мишень, распознаваемая FLP). Праймеры также содержат от 40 до 45 дополнительных нуклеотидов, соответствующих областям непосредственно выше и ниже гена wbaP. Их применяли для амплификации генной кассеты для делеции в рамке считывания wbaP, как описано (Datsenko and Wanner, см. выше). После индукции арабинозой экспрессии λ Red рекомбиназы из плазмиды pKD46 в штамме SL1344 S. Typhimurium дикого типа происходит замена гена-мишени на кассету с хлорамфениколом, полученную из ПЦР-продукта, введенного электропорацией, путем рекомбинации. Трансформанты отбирали рассеванием на чашках с хлорамфениколом при 37°С в течение ночи, а наличие гена cat в правильной позиции в геноме подтверждали с помощью ПЦР. Полученный клон с устойчивостью к хлорамфениколу (wbaP::cat) назвали SKI11. Удаление кассеты устойчивости к хлорамфениколу было возможно при использовании рСР20, кодирующей FLP-рекомбиназу, которая распознает фланкирующие FRT-области, полученный в результате клон назвали SKI12 после проверки с помощью ПЦР (также см. Hg, Endt et al., Inf. Immun., 77, 2568, June 2009).
Фенотипический анализ гликоконъюгатов полученного штамма осуществляли с помощью ДСН-ПААГ с последующим окрашиванием гликоконъюгатов серебром. Для ДСН-ПААГ, образцы готовили следующим способом: Эквивалент 2 OD600/мл растущих в логарифмической фазе культур S. Typhimurium дикого типа или S. Typhimurium ΔwbaP (SK112) осаждали при 16000 g в течение 2 минут и отбрасывали надосадочную жидкость. Клетки ресуспендировали в 100 мкл буфера Лэммли для образцов (0,065 М Tris-HCl pH 6,8, 2% ДСН (масс./об.), 5% β-меркаптоэтанол (об./об.), 10% глицерин (об./об.), 0,05% бромфеноловый синий (масс./об.)) и лизировали в течение 5 мин. при 95°С. После охлаждения до комнатной температуры, добавляли протеиназу К (Gibco/Life Technologies) (конечная концентрация 0,4 мг/мл) инкубировали 1 час при 60°С до внесения равных количеств на 12% полиакриламидный гель с додецилсульфатом натрия (ДСН-ПААГ) м проводили гель-электрофорез. Для обнаружения O-антигена в S. Typhimurium применяли O-антисыворотку связывающую факторы 1, 4, 5, 12 группы В Salmonella (Difco). Визуализацию сигналов проводили HRP-конъюгатом козьих антител, связывающих кроличьи IgG (Santa Cruz) и ECL (Amersham), как рекомендовано производителем. Для окрашивания применяли метод Tsai and Frasch (Tsai and Frasch, Anal. Biochem. 119(1):115-9, 1982).
Делеция гена, кодирующего фосфогалактозилтрансферазу WbaP в S. enterica дикого типа, приводит к отмене биосинтеза O-антигена, как видно на фиг.2В. ДСН-ПААГ с последующим окрашиванием глюкоконъюгатов серебром, а также ДСН-ПААГ с последующим иммуноблотинг