Рекомбинантная плазмидная днк pyp2, кодирующая ферментативно-активную часть полипептида липазы, белка пищеварительного тракта пчелиной огневки
Иллюстрации
Показать всеИзобретение относится к биотехнологии, а именно к рекомбинантной плазмидной ДНК, кодирующей ферментативно-активную часть полипептида липазы, белка пищеварительного тракта пчелиной огневки длиной в 504 аминокислотных остатков. Рекомбинантная плазмидная ДНК содержит BamHI/HindIII - фрагмента ДНК плазмиды pQE30; BamHI/HindIII - фрагмента гена Yp2 Galleria mellonella, кодирующего ферментативно-активную часть полипептида липазы, белка пищеварительного тракта пчелиной огневки; в качестве генетического маркера ген bla в-лактамазы; нуклеотидную последовательность, кодирующую полигистидиновый тракт в рамке считывания гена Yp2. Изобретение может быть использовано для создания препарата-деструктора загрязнений, содержащих твердые алканы. 4 ил., 2 табл., 2 пр.
Реферат
Изобретение относится к биотехнологии, в частности к генетической инженерии, и представляет собой сконструированную "in vitro" рекомбинантную плазмидную ДНК, содержащую фрагмент гена Yp2 Galleria mellonella (ПЧЕЛИНАЯ ОГНЕВКА), кодирующий ферментативно-активную часть полипептида липазы, белка пищеварительного тракта пчелиной огневки длиной в 504 а.о. Конструкция обеспечивает в клетках бактерий Е.coli биосинтез полипептида в виде фрагмента липазы с полигистидиновым (6*His) трактом для аффинной очистки, обладающего липазной активностью для полного, либо частичного расщепления молекул твердых алканов. Этот очищенный с помощью аффинной хроматографии рекомбинантный белок может быть использован в качестве препарата-деструктора загрязнений, содержащих твердые алканы.
Липаза Galleria mellonella это водорастворимый белок, кодируемый геном Yp2, представляет собой протеин с молекулярной массой 60 кДа.
Этот белок обладает липазной активностью, которой катализирует гидролиз нерастворимых эстеров-липидных субстратов, помогая переваривать, растворять и фракционировать жиры, в том числе твердые алканы.
Основными продуцентами липаз являются штаммы грибов Rhizopus [АС СССР 1726513 А1, опубл. 15.04.92], Fusarium [P. Rapp. Production, regulation and some properties of lipase activity from Fusarium oxysporum f. sp.vasinfectum. // Enzyme and Microbial Technology. - 1995. - V.17. - P.832-838.], некоторые дрожжи (Jarrowia) [АС СССР 1454852 A1, опубл. 30.01.89].
Однако такие липазы обладают низкой активностью в отношении твердых парафинов, гудронов.
Известен способ выделения из восковой моли препарата липаз (патент РФ №2038086, МПК A61K 35/04, опубл. 27.06.1998 г.), являющихся ферментами насекомого, которые расщепляют воск на более простые соединения. Для этого личинки восковой моли, собранные в пчелином улье, растирают и высушивают методом Виллштаттера, затем проводят экстракцию липаз из полученного порошка эмульгирующей смесью, содержащей 50% глицерина и 1,5% карбокселя, затем липазы осаждают ацетоном и подвергают лиофилизации.
Недостатком этого способов является использование большого количества личинок, которые необходимо культивировать, что достаточно трудоемко и дорогостояще.
Неизвестны способы получения липазы Galleria mellonella микробиологическим синтезом, показывающим его биохимическую активность.
Наиболее близким техническим решением (прототипом) является плазмида pZ-ura3d4-hp4d-LIP2, полученная на основе вектора pUC19 и содержащая дефектный маркер ura3d4, способствующий отбору клонов с множественной интеграцией вектора в хромосому, участки для негомологичной интеграции Zeta, различные транскрипционные элементы, в том числе сильный синтетический конститутивный промотор hp4d, и ген липазы Yarrowia lipolytica LIP2 (патент РФ №2355754, МПК C12N 15/55, опубл. 20.05.2012 г.). Повышенная копийность гена LIP2 и его измененная регуляция обусловливают способность заявляемого штамма накапливать более высокие количества липазы, штамм Yarrowia lipolytica Polf ауксотрофный по лейцину комплементировали с помощью интегративного вектора pNB268 (ATCC 69355) и затем трансформировали интегративной плазмидой pZ-ura3d4-hp4d-LIP2.
Однако данная плазмида продуцирует липазу, обладающую низкой активностью в отношении твердых парафинов, гудронов.
Техническим результатом заявляемого изобретения является получение рекомбинантной плазмидной ДНК, обеспечивающей экспрессию фрагмента гена Yp2 Galleria mellonella, кодирующий ферментативно-активную часть полипептида липазы, белка пищеварительного тракта пчелиной огневки длиной в 504 а.о., в составе бактериального плазмидного вектора, кодирующего 6*His-мишень для аффинной очистки белка. Конструкция должна обеспечивать более высокий уровень биосинтеза рекомбинантной липазы Galleria mellonella в клетках E. coli и уровень очистки с использованием 6*His-мишени не менее 95-98% рекомбинантного белка.
Поставленный технический результат достигается путем конструирования рекомбинантной плазмидной ДНК pYP2, кодирующей IPTG- индуцируемый биосинтез полипептида, обладающего липазной активностью, в клетках E. coli в виде белка (504 а.о.) с молекулярной массой: 60 кДа, с 6*His на N-конце для аффинной очистки.
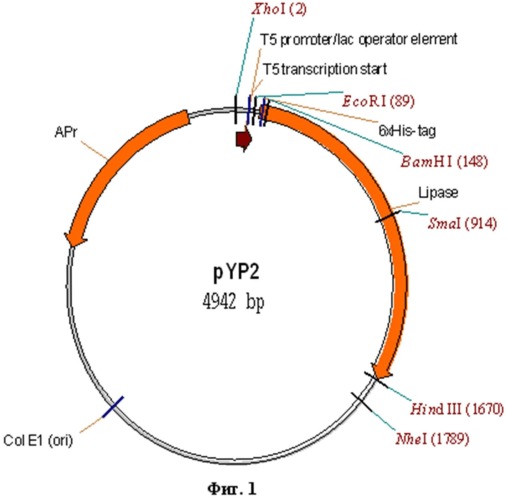
Рекомбинантная плазмидная ДНК pYP2, кодирующая ферментативно-активную часть полипептида липазы, белка пищеварительного тракта пчелиной огневки длинной в 504 аминокислотных остатков, характеризующаяся тем, что имеет молекулярную массу 3,212 мегадальтон (4,942 т. п. о.); состоит из BamHI/HindIII - фрагмента ДНК плазмиды pQE30 (3,424 т. п. о.) [1] и BamHI/HindIII - фрагмента гена Yp2 Galleria mellonella, кодирующего ферментативно-активную часть полипептида липазы, белка пищеварительного тракта пчелиной огневки (1,551 т. п. о.), представленного на фиг.2, при этом содержит в качестве генетического маркера ген bla β-лактамазы, определяющий устойчивость трансформированных плазмидой pYP2 клеток к ампициллину; нуклеотидную последовательность, кодирующую полигистидиновый тракт в рамке считывания гена Yp2, состоящий из 6 молекул аминокислоты гистидина, для последующей очистки с помощью аффинной хроматографии на сорбенте Ni-NTA-агароза; уникальные сайты узнавания рестрикционными эндонуклеазами, имеющие следующие координаты: XhoI - 2; EcoRI - 89; BamHI - 148; SmaI - 914; HindIII - 1670; NheI - 1789.
ПЕРЕЧЕНЬ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг.1. Физическая карта рекомбинантной плазмиды pYP2.
Фиг.2. Нуклеотидная последовательность гена Yp2, с аффинной мишенью 6xHis.
Фиг.3. Аминокислотная последовательность рекомбинантного белка липазы гена Yp2, с аффинной мишенью 6xHis.
Фиг.4. Электрофореграмма лизатов клеток Е. coli (штамм TG-1), трансформированных плазмидой pYP2, синтезирующих рекомбинантный белок липазы гена Yp2, с аффинной мишенью 6xHis (дорожка 1); штамма реципиента (дорожка 3); рекомбинантный белок липазы гена Yp2, с аффинной мишенью 6xHis, очищенного аффинной хроматографией на Ni-NTA-агарозе (дорожка 2).
Изобретение иллюстрируется следующими примерами.
Пример 1. Конструирование рекомбинантной плазмидной ДНК pYP2.
10 мкг ДНК из реакционной смеси после проведения полимеразной цепной реакции (праймеры: cacggatccaggagagtctctgcaatac и aataagcttttaagaggagctattcatag) с кДНК, полученной в реакции обратной транскрипции со статистической затравкой с тотальной матричной РНК, клеток Galleria mellonella в соответствии с методикой, описанной в работе [2], обрабатывают рестриктазами BamHI и HinIII и из полученного гидролизата выделяют в 4% полиакриламидном геле фрагмент длиной 1,510 т.п.о.
10 мкг плазмидной ДНК pQE30 обрабатывают рестриктазами BamHI и HinIII в соответствии с методикой, описанной в работе [1], и из полученного гидролизата выделяют в 4% полиакриламидном геле векторный фрагмент длиной 3,424 т.п.о.
Концы полученного фрагмента и вектора соединяют при помощи лигазной реакции в 30 мкл буфера для лигирования. 5-10 мкл реакционной смеси используют для трансформации компетентных клеток TG-1 [3] (supE thi-1 Δ(lac-proAB) Δ(mcrB-hsdSM)5(rK- mK-) [F′ traD36 proAB lacIqZΔM15]) стандартным методом [2]. Трансформанты высевают на LB-агар, содержащий 100 мкг/мл ампициллина. Из выросших клонов выделяют плазмидную ДНК pYP2 и анализируют ее путем обработки набором эндонуклеаз рестрикции SmaI, HinIII, BamHI с последующим электрофоретическим анализом длин рестрикционных фрагментов в 4% полиакриламидном геле. Из 10 проанализированных клонов 10 показали нужный набор рестрикционных фрагментов. Целевая плазмида pYP2 содержит уникальные сайты узнавания рестрикционными эндонуклеазами, имеющие следующие координаты:
XhoI - 2; EcoRI - 89; BamHI - 148; SmaI - 914; HindIII - 1670; NheI - 1789.
Окончательную структуру рекомбинантной ДНК pYP2 подтверждают определением нуклеотидной последовательности в районе встроенного фрагмента, содержащего фрагмент гена YP2 (1,551 т.п.о.) (BamHI и HinIII фрагмент длиной 1,510 т.п.о., полученный в ПЦР, плюс последовательность, входившую в состав плазмиды pQE30, кодирующую аффинную мишень 6xHis) (Фиг.2).
Экспрессию целевого гена YP2 проверяют по наличию рекомбинантного белка 60 килодальтон (фиг.3. - аминокислотная последовательность рекомбинантного белка липазы гена Yp2, с аффинной мишенью 6xHis), выделяемого с помощью аффинной хроматографии на Ni-NTA-агарозе, после индукции IPTG трансформированной целевой плазмидой pYP2 клеток Е.coli TG-1 (Фиг.4).
Таким образом, заявляемое техническое решение позволяет получить экспрессирующую плазмидную ДНК pYP2, кодирующую ферментативно-активную часть полипептида липазы, белка пищеварительного тракта пчелиной огневки длиной в 504 а.о.
Трансформированная этой плазмидой широко известная культура клеток Е.coli TG-1 [3] при индукции IPTG осуществляет биосинтез полипептида размером 60 килодальтон, состоящего из фрагмента белка, обладающего липазной активностью, и с 6*His на N-конце для аффинной очистки. Этот рекомбинантный белок после аффинной хроматографии (не менее 95-98% рекомбинантного белка) может быть использован в качестве препарата-деструктора загрязнений, содержащих твердые алканы.
Пример 2. Результаты оценки возможности использования рекомбинантного белка в качестве деструктора твердых алканов.
За основу взят препарат для очистки почвы и воды от нефти и нефтепродуктов производства ЗАО «Биоойл» (Патент РФ №RU 2337069), в который добавляли фермент, продуцируемый заявляемой конструкцией. Проведен эксперимент по оценке степени влияния добавления Е.coli (TG1) со встроенной рекомбинантной плазмидной ДНК pYP2 к препарату для очистки почвы и воды от нефти и нефтепродуктов. В качестве загрязнителя была взята предварительно полученная фракция парафинов газового конденсата (состав фракции представлен в таблице 1) в количестве 5% (0,5 г/10 мл) в жидкой питательной среде с постоянным поддержанием концентрации ИПТГ 2 ммоль (добавление ИПТГ каждые 48 часов). Температура проведения эксперимента 35 градусов Цельсия. Количество нефтепродуктов в водной среде определяли через 5 суток с помощью ИК-спектрометрического метода измерения (ГОСТ Р 51797-2001).
| Таблица 1 | ||||||||||
| Процентное содержание предельных углеводородов в выбранной фракции газового конденсата | ||||||||||
| Номер фракции | Длина цепи предельных углеводородов | |||||||||
| С15 | С16 | С17 | С18 | С19 | С20 | С21 | С22 | С23 | ||
| O1-5 | 0,016 | 0,077 | 0,21 | 0,461 | 1,198 | 3,392 | 9,264 | 17,173 | 20,832 | |
| Номер фракции | Длина цепи предельных углеводородов | |||||||||
| С24 | С25 | С26 | С27 | С28 | С29 | С30 | С31 | С32 | C33 | |
| О1-5 | 17,828 | 12,316 | 7,078 | 4,562 | 2,378 | 1,602 | 0,953 | 0,499 | 0,113 | 0,048 |
| Таблица 2 | ||||
| Содержание нефтепродуктов в жидкой питательной среде после (г/л) | ||||
| Контроль | Препарат для очистки почвы и воды от нефти и нефтепродуктов | |||
| +Е.coli (TG1) | +Е.coli (TG1-pYP2) | |||
| Содержание нефтепродуктов | 49,6±1,68 | 25±2 | 24,8±1,44 | 14,6±1,52 |
В результате было показано, что совместное культивирование препарата для очистки почвы и воды от нефти и нефтепродуктов с Е.coli (TG1) со встроенной рекомбинантной плазмидной ДНК pYP2 позволяет увеличить объем деградации выбранной фракции парафинов газового конденсата (таблица 2) до 70,6% (35 г/л). Добавление Е.coli (TG1) без встроенной плазмидной ДНК не влияет на степень деструкции выбранной фракции парафинов газового конденсата. Объем деградации в этом случае составляет 50% (24,8 г/л).
ИСТОЧНИКИ ИНФОРМАЦИИ
1. The QIAexpressionist. Hilden: QIA GEN, Summer 1992. P.70.
2. Маниатис Т., Фрич, Сэмбук Дж. (1984) Молекулярное клонирование. Пер. с англ., М., Мир. С 241.
3. Sambrook J. Molecular cloning: a laboratory manual. Vol.3 / J. Sambrook, D.W. Russell. - 3rd ed. - New York: Cold Spring Harbor Laboratory, 2001. - xxvii, P.15.1-18.136 (various pagings): ill. - Incl. bibl. ref. and index. - ISBN 978-087969577-4, страница A3.9.
Рекомбинантная плазмидная ДНК pYP2, кодирующая ферментативно-активную часть полипептида липазы, белка пищеварительного тракта пчелиной огневки длиной в 504 аминокислотных остатков, характеризующаяся тем, что имеет молекулярную массу 3,212 мегадальтон (4,942 т.п.о.), состоит из BamHI/HindIII - фрагмента ДНК плазмиды pQE30 (3,424 т.п.о.) и BamHI/HindIII - фрагмента гена Yp2 Galleria mellonella, кодирующего ферментативно-активную часть полипептида липазы, белка пищеварительного тракта пчелиной огневки (1,551 т.п.о.), представленного на фиг.2, при этом содержит в качестве генетического маркера ген bla в-лактамазы, определяющий устойчивость трансформированных плазмидой pYP2 клеток к ампициллину; нуклеотидную последовательность, кодирующую полигистидиновый тракт в рамке считывания гена Yp2, состоящий из 6 молекул аминокислоты гистидина, для последующей очистки с помощью аффинной хроматографии на сорбенте Ni-NTA-агароза; уникальные сайты узнавания рестрикционными эндонуклеазами, имеющие следующие координаты: Xhol - 2; EcoRI - 89; BamHI - 148; SmaI - 914; HindIII - 1670; NheI - 1789.