Рекомбинантная плазмидная днк pci-ub-polyepi, содержащая эпитопы опухоль-ассоциированных антигенов для колоректального рака, и способ ее применения для стимуляции специфического противоопухолевого иммунного ответа против клеток колоректального рака
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к созданию рекомбинантных плазмид, обеспечивающих экспрессию полиэпитопных опухоль-ассоциированных антигенов в дендритных клетках, способных стимулировать специфические цитотоксические клетки, и может быть использовано в медицине. Рекомбинантная плазмидная ДНК pCI-UB-POLYEPI содержит 11 эпитопов опухоль-ассоциированных антигенов колоректального рака, имеет размер 6 355 п.н. и экспрессирует следующую аминокислотную последовательность: DYKDDDDK-LLGVGTFVV-ADRIW-GLKAGVIAV-AAYARY-VLAFGLLLA-ADRIW-YQLDPKFITSI-AAYARY-IMIGVLVGV-ADRIW-YLSGADLNL-AAYARY-CGIQNSVSA-AAYARY-LLLLTVLTV-ADRIW-QYIKANSKFIGITEL-ANIY-SIINFEKL-ARY-SASFDGWATVSVIAL-ARY-SERVRTYWIIIELKHKARE-ARY-IQNDTGFYTLHVIKSDLVNEE. Сконструированной плазмидной ДНК pCI-UB-POLYEPI трансфицируют зрелые дендритные клетки, полученные добавлением к незрелым дендритным клеткам провоспалительного цитокина ФНО-α, таким образом активируя их. Затем активированные дендритные клетки культивируют совместно с мононуклеарными клетками периферической крови больных колоректальным раком для генерации антиген-специфических противоопухолевых цитотоксических клеток. Изобретение позволяет эффективно генерировать антигенспецифические цитотоксические клетки с противоопухолевой активностью in vitro, необходимые для иммунного ответа по T-хелпер 1 типу на антигены колоректального рака. 2 н.п .ф-лы, 1 ил., 4 пр.
Реферат
Изобретение относится к биотехнологии, белковой инженерии и медицине, конкректно - к созданию рекомбинантных плазмид, обеспечивающих экспрессию полиэпитопных опухоль-ассоциированных антигенов в дендритных клетках, способных стимулировать специфические T-хелперы и цитотоксические T-лимфоциты.
Опухоль может быть представлена широким спектром антигенов. Некоторые антигены представлены у всех опухолей определенного типа, а некоторые антигены уникальны и могут быть обнаружены только у данного пациента.
Существует много путей включения антигенов в состав антигенной вакцины.
- Белки или фрагменты белков опухолевых клеток непосредственно вводятся в организм в качестве вакцины.
- В организм вводится генетический материал, кодирующий эти протеины (ДНК- и РНК-вакцины).
- В качестве «средства доставки» антигена в организм пациента может быть использован вирус. Вирусы, используемые подобным образом, называют «вирусными векторами» и не обладают никакими инфекционными свойствами. Эти вирусы в лабораторных условиях инфицируют клетки организма человека и становятся носителями на своей поверхности опухолевых антигенов. Вирус способен инфицировать только небольшое количество клеток организма - достаточное для генерации иммунного ответа, но недостаточное для того, чтобы вызвать заболевание.
- С помощью методов генной инженерии можно также использовать вирусы для выработки цитокинов или встраивать протеины в поверхность вируса, что способствует активации иммунокомпетентных клеток. Таким образом, модифицированные вирусы можно вводить в организм пациента самостоятельно или в комбинации с вакциной для усиления генерации иммунного ответа.
- Иногда в качестве антигенов в вакцине используют антитела. Пациенту вводят антитела к опухолевым антигенам, затем B-лимфоциты вырабатывают антитела к этим антителам, которые также распознают опухолевые клетки. Это так называемые «антиидиотипические вакцины», отличающиеся от пассивного лечения антителами.
Описан способ генерации антиген-специфических противоопухолевых цитотоксических клеток, взятый за прототип, при котором ДК получали из мононуклеарных клеток (МНК) периферической крови больных раком желудочно-кишечного тракта путем культивирования МНК, обогащенных фракцией моноцитов, в течение 7 дней в присутствии IL-4 (1000 ед/мл) и GM-CSF (1000 ед/мл). Затем в культуру полученных дендритных клеток (ДК) добавляли СЕА (пептид) в концентрации 40 мкг/мл и 3 мкг/мл β2-макроглобулина, инкубировали в течение 4 ч при 20°C. Далее пептиднагруженные ДК облучали (55 Gy) и ссаживали в соотношении 1:20 с аутологичными цитотоксическими лимфоцитами. Цитотоксичность оценивали стандартным методом по высвобождению 51Cr-метки из погибших клеток линий колоректального рака человека. Гибель опухолевых клеток (линии HT29, WiDr, KM12LM) не превышала 16% (Matsuda К., Tsunoda Т., Tanaka Н., Umano Y., Tanimura Н., Nukaya I., Takesako К., Yamaue H. Enhancement of cytotoxic T-lymphocyte responses in patients with gastrointestinal malignancies following vaccination with CEA peptide-pulsed dendritic cells. // Cancer Immunol. Immunther. - 2004. - №53. - P.609-616.).
Недостатком данного подхода является длительный срок культивирования дендритных клеток (7 дней), для которого требуется использование большого количества рекомбинантных цитокинов (ГМ-КСФ, ИЛ-4), а также использование дополнительных белков (β2-макроглобулина), что ведет к значительному удорожанию технологии. Использованные аллогенные опухолевые клетки несут чужеродные антигены, на которые возможно и формируется ответ, при этом остается не известным, будут ли таким образом активированные клетки проявлять цитотоксическую активность против собственных опухолевых антигенов и клеток соответственно. Используется опухоль-ассоциированный белок CEA, который может в разной степени экспрессироваться на опухолевых клетках. Кроме того, эффективность цитотоксичности клеток, достигнутая в прототипе не превышает 16%.
Задачей настоящего изобретения является создание конструкции полиэпитопных иммуногенов, включающей эпитопы опухоль-ассоциированных антигенов для колоректального рака, и способа ее использования для стимуляции специфического противоопухолевого иммунного ответа против клеток колоректального рака.
Поставленная задача решается путем конструирования рекомбинантной плазмидной ДНК pCI-UB-POLYEPI, несущей ген искусственного полиэпитопного белка под контролем CMV промотора, и трансфекцией ее в аутологичные дендритные клетки для обеспечения экспрессии полиэпитопных опухоль-ассоциированных антигенов и стимуляции специфических цитотоксических клеток.
Сущность предлагаемого изобретения заключается в следующем. Получена рекомбинантная плазмидная ДНК pCI-UB-POLYEPI, содержащая 11 эпитопов опухоль-ассоциированных антигенов колоректального рака. Этой полиэпитопной конструкцией трансфецируют зрелые аутологичные дендритные клетки. Затем pCI-UB-POLYEPI-трансфецированные ДК культивируют с аутологичными мононуклеарными клетками периферической крови больных колоректальным раком. Зрелые ДК получают путем добавления к незрелым ДК провоспалительного цитокина ФНО-α.
Техническим результатом изобретения является создание полиэпитопной конструкции, трансфекцией которой в ДК достигается эффективная стимуляция специфических цитотоксических лимфоцитов против клеток колоректального рака.
Принципиальным отличием разработанного способа от прототипа является использование для активации ДК полиэпитопной конструкции, включающей эпитопы опухоль-ассоциированных антигенов для колоректального рака, а также применение протоколов активации и созревания ДК, что также сокращает стадию получения зрелых антиген-трансфецированных ДК до 6 суток.
Предлагаемое изобретение повышает эффективность генерации цитотоксических клеток, а также позволяет сократить сроки сокультивирования ДК и МНК, что в итоге приводит к снижению стоимости способа.
Изобретение осуществляется следующим образом.
Для лучшего понимания сущности предлагаемого изобретения ниже следуют примеры его осуществления.
Пример 1. Получение рекомбинантной плазмиды pCI-UB.
Плазмида pCI-UB содержит убиквитин, небольшой консервативный белок, влияющий на клеточную локализацию присоединенного к нему белка. Убиквитин направляет присоединенный к нему белок в протеасому. Фрагмент ДНК, кодирующий убиквитин, получили с помощью ПЦР геномной ДНК человека. Использовали олигонуклеотиды, содержащие сайты узнавания эндонуклеазами Xhol и EcoRI. Полученный амплификационный фрагмент ДНК клонировали в вектор pCI-neo. В результате клонирования получили плазмиду pCI-UB, нуклеотидную последовательность полученной конструкции проверяли с помощью секвенирования.
Пример 2. Дизайн и получение опухолевого полиэпитопа.
Для конструирования полиэпитопного белка проводили анализ аминокислотных последовательностей выбранных белков (табл.1) использовали компьютерное предсказание и анализ существующих экспериментальных данных.
Таблица 1.
Для предсказания MHC-I эпитопов использовали пpoграммы (SYFPEITHI; http://www.syfpeithi.de; ProPredl; ; NetMHC-3.0 ). Отбирали эпитопы имеющие максимальный рейтинг для аллелей HLA-A*02, а также имеющие свидетельства экспериментальной валидации в литературе (если таковые имелись). При этом приоритет отдавался экспериментальным данным. Для предсказания MHC-II эпитопов использовали программу (EpiTOP; http://www.pharmfac.net/EpiTOP/). Отбирали эпитопы, имеющие общий максимальный рейтинг для аллелей DRB1-01, 04, 07, 13, 15.
В конструкцию также был введен вспомогательный T-клеточный эпитоп из дифтерийно-столбнячного анатоксина (QYIKANSKFIGITEL (TT), 830-844 аминокислоты tetanus toxoid), неспецифично усиливающий ответ CD8+T-лимфоцитов. Ранние работы показали, что ARY N-терминальные аминокислоты, фланкирующие каждый эпитоп значительно увеличивают аффинность к TAP транспортеру, и что стимулирует более выраженный ответ CD8+T-лимфоцитов. Эти последовательности также использовали для разделения эпитопов в полиэпитопной конструкции. Каждый эпитоп требует протеолиза в специфическом сайте выше его N-конца для эффективной транслокации, лишние аминокислоты могут удаляться аминопептидазами. Таким образом, в отсутствии рационального дизайна конструкции соседние эпитопы могут быть нарушены. Дизайн конструкции включает разделение эпитопов AAY спейсерной последовательностью, которая является мишенью для протеасомного расщепления. DYKDDDDK введен в полиэпитопную конструкцию для удобства мониторинга экспрессии полиэпитопного белка. Этот пептид не маскируется в разных положениях при введении в рекомбинантные белки и может быть эффективно выявлен с помощью моноклонального антитела. В полиэпитопную конструкцию был введен также CTL-пептид из овальбумина (SIINFEKL) для осуществления контроля иммунизации. Дизайн и аминокислотная последовательность разработанного нами полиэпитопного белка приведена на рис.1 и 2 соответственно. Для получения искусственного гена, кодирующего полиэпитопный белок, его аминокислотная последовательность была подвергнута обратной трансляции с учетом частоты встречаемости кодонов у человека, для клонирования на 5′-конец был добавлен сайт EcoRI, на 3′-конец был добавлен сайт XbaI, содержащий стоп-кодон в рамке. Ген был синтезирован методом ПЦР с перекрывающимися олигонуклеотидами (длиной 70-80 н.о.) и клонирован в плазмиду pMTL22 по сайтам EcoRI и XbaI. Нуклеотидная последовательность полученных клонов проверялась секвенированием по Сенгеру. В результате были отобраны клоны с нужной последовательностью нуклеотидов. В результате получили плазмидную ДНК pMTL22-POLYEPI.
MUC4-1-EpCAM-1-EpCAM-2-EpCAM-3-CEA-1-CEA-2-CEA-3-MUC1-TT-OVA-MUC4-2- EpCAM-4-CEA-4
Рис.1. Схематическая структура полиэпитопного белка.
DYKDDDDK-LLGVGTFW-ADRM-GLKAGVIAV-AAMEY-VLAFGLLLA-ADRIW-
YQLDPKFITSI-
AAYARY-IMIGVLVGV-ADRTW-YLSGADLNL-AAYARY-CGIQNSVSA-AAYARY-
LLLLTVLTV-ADRM-QYIKANSKFGIGITEL-ANIY-SINFEKL-ARY-
SASFDGWATVSVIAL-ARY-SERVRTYWIIIELKHKARE-ARY-
IQNDTGFYTLHVIKSDLVNEE
Рис.2. Аминокислотная последовательность полиэпитопного белка. Жирным шрифтом выделены опухоль-специфичные эпитопы, подчеркиванием вспомогательные мотивы для процессинга.
Пример 3. Получение рекомбинантной плазмиды pCI-UB-POLYEPI Плазмидные ДНК pCI-UB и pMTL22-POLYEPI подвергали гидролизу эндонуклеазами рестрикции EcoRI и XbaI последовательно с промежуточным переосаждением ДНК изопропанолом. Рестриктные фрагменты ДНК, полученные при гидролизе pMTL22-POLYEPI, разделялись в агарозном 1% геле с помощью гель-электрофореза. Вырезали полоску геля, содержащую фрагмент ДНК, кодирующий полиэпитоп. Элюировали ДНК из геля методом сорбции ДНК на силики. Гидролизованную ДНК pCI-UB экстрагировали фенол-хлороформной смесью и последующим переосаждением изопропанолом. Далее проводили лигирование полученных фрагментов ДНК с последующей трансформацией клеток E.coli штамма XLBlue лигазной смесью. Отбирались клоны, содержащие полиэпитоп. Нуклеотидная последовательность полученных клонов проверялась секвенированием по Сенгеру.
Пример 4. Получение дендритных клеток, трансфецированных плазмидой pCI-UB-POLYEPI
Выделенная из периферической крови больных колоректальным раком прилипающая фракция мононуклеарных клеток культивируется в концентрации 1 млн/мл в полной среде содержащей 10% эмбриональной телячьей сыворотки, 2 мМ L-глютамина, 10 мМ HEPES, 5×10-5 мМ 2-меркаптоэтанола, 80 мкг/мл гентамицина, 100 мкг/мл ампициллина в атмосфере 5% CO2 при 37°C с добавлением рчГМ-КСФ (50 нг/мл) и рчИЛ-4 (100 нг/мл). Через 96 часов культивирования к полученным незрелым ДК добавляется для созревания вносится рчФНО-α в дозе 25 нг/мл. Через 24 часа культивирования проводили процедуру магнитной трансфекции зрелых дендритных клеток с помощью реактивов фирмы «Рrоmokine», протокол проведения основывался на предложенной производителем схеме. Спустя 24 часа осуществляли совместное культивирование трансфецированных дендритных клеток и неприлипшей фракцией мононуклеарных клеток в соотношении 1:10/ Через 96 часов проводили тест на цитотоксичность культуры мононуклеарных клеток против аутологичных опухолевых клеток.
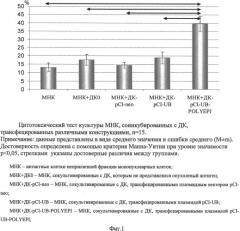
Для определения модуляции цитотоксической активности T-лимфоцитов с помощью полученных ДК оценивали гибель опухолевых клеток в цитотоксическом тесте. Для этого к мононуклеарным клеткам больного, которые предварительно сокультивировали с трансфецированными плазмидами ДК, добавляли аутологичные опухолевые клетки. Цитотоксичность оценивали по увеличению содержания внутриклеточного фермента лактатдегидрогеназы в кондиционной среде в результате гибели опухолевых клеток. Показано достоверное повышение значения цитотоксичности, что служит показателем активации противоопухолевых цитотоксических клеток, необходимых для уничтожения опухолевых клеток (фиг.1).
Совместное культивирование МНК с ДК, трансфецированных рекомбинантной полиэпитопной плазмидой pCI-UB-POLYEPI, является эффективным способом генерации специфических цитотоксических клеток мононуклеарного происхождения у больных колоректальным раком, что проявляется в усилении их цитотоксического противоопухолевого ответа. Таким образом, в результате проведенных исследований разработан способ стимуляции противоопухолевого цитотоксического иммунного ответа с помощью аутологичных дендритных клеток, трансфецированных полиэпитопной рекомбинантной плазмидой, обеспечивающей экспрессию полиэпитопных опухоль-ассоциированных антигенов для колоректального рака в дендритных клетках и стимуляции специфических цитотоксических клеток.
1. Рекомбинантная плазмидная ДНК pCI-UB-POLYEPI содержит 11 эпитопов опухоль-ассоциированных антигенов колоректального рака, имеет размер 6 355 п.н. и экспрессирует следующую аминокислотную последовательность:DYKDDDDK-LLGVGTFVV-ADRIW-GLKAGVIAV-AAYARY-VLAFGLLLA-ADRIW-YQLDPKFITSI-AAYARY-IMIGVLVGV-ADRIW-YLSGADLNL-AAYARY-CGIQNSVSA-AAYARY-LLLLTVLTV-ADRIW-QYIKANSKFIGITEL-ANIY-SIINFEKL-ARY-SASFDGWATVSVIAL-ARY-SERVRTYWIIIELKHKARE-ARY-IQNDTGFYTLHVIKSDLVNEE;рекомбинантная плазмида pCI-UB-POLYEPI содержит CMV энхансер (5251-5910 п.н.), CMV промотор (5919-6001), Т7 промотор (6317-6336 п.н.), убиквитин (1-229), также содержит уникальные сайты рестрикции EcoRI (233), XbaI(891), NotI (908), BamHI (3164), NdeI (5638), SacI (5980), XhoI (6342).
2. Способ генерации антиген-специфических противоопухолевых цитотоксических клеток, заключающийся в совместном культивировании мононуклеарных клеток (МНК) периферической крови больных колоректальным раком с дендритными клетками (ДК), активированными опухолевыми антигенами, отличающийся тем, что для культивирования используют зрелые ДК, полученные добавлением к незрелым ДК провоспалительного цитокина ФНО-α, активированные путем трансфекции в них рекомбинантной плазмидной ДНК pCI-UB-POLYEPI, заявленной в п.1.