Нетранскрибируемый плазмидный вектор pbl-t для клонирования сложных геномных последовательностей и многомодульной сборки генно-инженерных конструкций (варианты), и набор, содержащий указанный вектор
Иллюстрации
Показать всеИзобретение относится к биотехнологии и генной инженерии. Нетранскрибируемый плазмидный вектор состоит из гена маркера селекции с промотором и терминатором, области инициации репликации и полилинкера, содержащего 15 или более уникальных гексануклеотидных сайтов расщепления эндонуклеазами рестрикции, 3 или более октануклеотидных сайтов расщепления эндонуклеазами рестрикции и два сайта узнавания Xcml, расположенные в центре области полилинкера в противоположной ориентации и образующие при расщеплении указанной рестриктазой непарные выступающие одиночные остатки дезокситимидина на 3′-концах цепей ДНК. Предложена также линеаризованная форма нетранскрибируемого вектора. Предложен также набор, содержащий нетранскрибируемый плазмидный вектор или нетранскрибируемый линейный вектор, лигазу и инструкцию по применению набора. Изобретение позволяет получить векторы, обеспечивающие возможность прямого клонирования ПЦР-продуктов, клонирования GC- AT-богатых последовательностей, модульной сборки генетических конструкций. 3 н. и 6 з.п. ф-лы, 6 ил., 4 табл., 10 пр.
Реферат
Область техники
Изобретение относится к области биотехнологии и генной инженерии, а именно к технологии молекулярного клонирования фрагментов ДНК, точнее к методам получения транскрипционно неактивных плазмидных векторов и их производных.
Предшествующий уровень техники
Впервые гибридная (вариант - рекомбинантная) ДНК была получена в 1972 году [Jackson, D.A., R.H. Symons, et al. (1972). "Biochemical method for inserting new genetic information into DNA of Simian Virus 40: circular SV40 DNA molecules containing lambda phage genes and the galactose operon of Escherichia coli." Proc Natl Acad Sci USA 69(10):2904-2909.], векторные плазмиды с селективным маркером (геном устойчивости к антибиотику) применены в 1973 [Cohen, S. N. and А. С.Chang (1973). "Recircularization and autonomous replication of a sheared R-factor DNA segment in Escherichia coli transformants." Proc Natl Acad Sci USA 70(5):1293-1297; Cohen, S. N., A.C. Chang, et al. (1973). "Construction of biologically functional bacterial plasmids in vitro." Proc Natl Acad Sci USA 70(11):3240-3244].
Первый многофункциональный вектор, несущий гены устойчивости к ампициллину и тетрациклину, область инициации репликации, (ориджин) и генетический элемент ограничения копийности (ROP) получен в 1977 [Bolivar, F., R.L. Rodriguez, et al. (1977). "Construction and characterization of new cloning vehicles. II. A multipurpose cloning system." Gene 2(2):95-113].
Векторные системы на основе бактериофага М13 и плазмиды pBR322 (система pUC18/19) [Messing, J., В. Gronenbom, et al. (1977). "Filamentous coliphage М13 as a cloning vehicle: insertion of a HindII fragment of the lac regulatory region in М13 replicative form in vitro." Proc Natl Acad Sci USA 74(9):3642-3646.; Norrander, J., T. Kempe, et al. (1983). "Construction of improved М13 vectors using oligodeoxynucleotide-directed mutagenesis." Gene 26(1):101-106.; Yanisch-Perron, С., J. Vieira, et al. (1985). "Improved М13 phage cloning vectors and host strains: nucleotide sequences of the M13mp18 and pUC19 vectors." Gene 33(1):103-119.] получили широкое распространение с начала 80-х гг. Свойства плазмидных и линейных фаговых векторов сочетают гибридные конструкции - фагмиды, содержащие, кроме плазмидных последовательностей, межгенный участок одноцепочечного нитевидного фага f1, ответственный за репликацию фага. Среди них pD4 [Dotto GP, Horiuchi K, Replication of a plasmid containing two origins of bacteriophage f1, Journal of Molecular Biology, Volume 153, Issue 1, 25 November 1981, Pages 169-176], pEMBL [L Dente, G Cesareni, and R Cortese. pEMBL: a new family of single stranded plasmids. Nucleic Acids Res. 1983 March 25; 11(6):1645-1655], pKUN9, pKUN19 [Peeters BP, Schoenmakers JG, Konings RN. Plasmid pKUN9, a versatile vector for the selective packaging of both DNA strands into single-stranded DNA-containing phage-like particles. Gene. 1986; 41(1):39-46]. Наибольшее распространение получили серия фагмидных векторов pGEM-Zf ("Promega") и серия векторов pBluescript ("Stratagene"), характеризующиеся стандартными чертами фагмидных векторов, отличающиеся организацией полилинкера и генами устойчивости к антибиотикам. Общим ограничением использования векторов на основе плазмид, бактериофага М13 и фагмид является их емкость - предельный размер клонируемой вставки, поэтому для клонирования крупных (свыше 20 т.п.н.) фрагментов ДНК используются другие системы. Однако клонирование столь протяженных фрагментов ДНК требуется для решения узкой задачи - создания геномных библиотек, в остальных приложениях (работы с библиотеками кДНК, создания конструкций для экспрессии чужеродных генов и т.д.) преимущественно работа ведется с фрагментами ДНК, не превышающими 15 т.п.н.
Высококопийные векторы небольшого размера часто используются для прямого клонирования продуктов полимеразной цепной реакции (ПЦР) для целей последующего секвенирования. Большинство современных систем быстрого клонирования продуктов полимеразной цепной реакции основаны на лигировании ПНР-продуктов с выступающим непарным 3' дезоксиаденозиновым остатком, образующимся у большинства молекул ДНК в ходе ПЦР, и линеаризованного вектора с непарными выступающими нуклеотидными остатками 3'Т, реже 3'U и 3'I. Примерами таких систем являются pCR2001, pCR.II, рТОРО ТА (Invitrogen, США); pKRX (ATCC, США); pSC-A (Stratagene, США); рТА12 (Invitrogen, США), pGEM-T (Promega, США), pT7Blue (Novagen, США). Наибольшее распространение получили системы pGEM-T и pGEM-T Easy (Promega, США), в России также доступен функциональный аналог pGEM-T Easy - PAL-TA (Евроген, Россия).
Перечисленные векторы, являясь производными векторов PUC18/19 и фагмид семейства pGEM, обладают следующими особенностями: содержат системы транскрипции селективного маркера LacZ для проведения бело-голубого скрининга, а также в ряде случаев регуляторные последовательности бактериофагов для получения одноцепочечной ДНК и/или регуляторные последовательности для бесклеточной транскрипции и трансляции. Эти особенности, удобные для большинства приложений, ограничивают их применение для клонирования "сложных" последовательностей ДНК.
Так, стандартные векторы принципиально не подходят для клонирования некоторых участков геномной ДНК высших эукариот. В частности, проблемными для клонирования в традиционных системах являются последовательности со сложной структурой - содержащие протяженные GC или AT тракты, повторяющиеся или палиндромные последовательности, а также последовательности с выраженными функциональными особенностями - регуляторные участки и токсичные для Е.coli открытые рамки считывания (ОРС) белков.
Наличие негативной селекции сложных последовательностей иллюстрируется проблемами при клонировании библиотек ДНК некоторых патогенов с высоким содержанием AT [Gardner, M.J. (2001). "A status report on the sequencing and annotation of the P.falciparum genome." Mol Biochem Parasitol 118(2):133-138; Gardner, M.J., N. Hall, et al. (2002). "Genome sequence of the human malaria parasite Plasmodium falciparum" Nature 419(6906):498-511; Rocha, Е. P. and A. Danchin (2002). "Base composition bias might result from competition for metabolic resources." Trends Genet 18(6):291-294; Vaughan, A., S. Y. Chiu, et al. (2008). "Assessment and improvement of the Plasmodium yoelii yoelii genome annotation through comparative analysis." Bioinformatics 24(13):i383-389] и выбыванием значительного количества (1600 ОРС) длинных и содержащих много повторов ОРС из масштабного протеомного исследования библиотеки MGS (Mammalian Gene Collection NIH) [Temple, G., D. S. Gerhard, et al. (2009). "The completion of the Mammalian Gene Collection (MGC)." Genome Res 19(12):2324-2333]. При применении типичных векторных систем для клонирования описана негативная селекция против ОРС, а также регуляторных элементов [Adhya, S. and M. Gottesman (1982). "Promoter occlusion: transcription through a promoter may inhibit its activity." Cell 29(3):939-944], повторов [Bowater, R.P. and R.D. Wells (2001). "The intrinsically unstable life of DNA triplet repeats associated with human hereditary disorders." Prog Nucleic Acid Res Mol Biol 66:159-202], поли-Т трактов [Kiyama, R. and M. Oishi (1994). "Instability of plasmid DNA maintenance caused by transcription of poly(dT)-containing sequences in Escherichia coli." Gene 150(1):57-61.], показано, что активные промоторные последовательности во вставке могут запускать транскрипцию структурных областей вектора и интерферировать как с репликацией плазмиды [Stueber, D. and H. Bujard (1982). "Transcription from efficient promoters can interfere with plasmid replication and diminish expression of plasmid specified genes." EMBO J 1(11):1399-1404], так и с экспрессией селективного маркера [Adhya, S. and M. Gottesman (1982). "Promoter occlusion: transcription through a promoter may inhibit its activity." Cell 29(3):939-944].
Распространенная система селекции трансформантов по нарушению рамки считывания гена LacZ, известная как "бело-голубой скрининг" [Gronenbom, В. and J. Messing (1978). "Methylation of single-stranded DNA in vitro introduces new restriction endonuclease cleavage sites." Nature 272(5651):375-377], обладает рядом неустранимых недостатков, среди которых:
1. высокая частота ложнопозитивных клонов с нарушением рамки считывания гена LacZ вследствие спонтанных точечных мутаций,
2. высокая стоимость и нестабильность субстрата (X-Gal),
3. избирательность ориентации (не выживают трансформанты с токсичным продуктом экспрессии клонируемой последовательности, направленным по ходу гена LacZ, т.е. при клонировании ПЦР-продуктов вероятность получения позитивного клона снижается вдвое).
Наличие системы бело-голубого скрининга вызывает высокий уровень транскрипции/трансляции области вставки, что ведет к отрицательной селекции вставок с ОРС, транскрибирующиеся вставки с тандемными тринуклеотидными повторами и полиТ-тракты также подвергаются отрицательной селекции. Для того чтобы уйти от недостатков системы бело-голубой селекции при клонировании «сложных» последовательностей, разработан ряд «transcription free» систем, лишенных транскрипции (LacZ, Т7), что увеличивает стабильность вставки. Например, коммерчески доступные вектора pSMART (Lucigen Corporation, США, US7723103) и pSPARK (Canvax Biotech, Испания).
Распространенные векторные системы для прямого клонирования ПЦР-продуктов, такие как pCR2001, pCR.II, рТОРО ТА (Invitrogen, Carlsbad, Calif.); pKRX (ATCC, Rockville, Md.); pSC-A (Stratagene, La Jolla, Calif.); pTA12 vector (Invitrogen), pGEM-T (Promega, Madison, Wis.), pT7Blue (Novagen, Madison, Wis.) не применимы для клонирования «сложных» и токсичных последовательностей и модульной сборки генетических конструкций.
Ближайшие аналоги настоящего изобретения - «нетранскрибируемые» векторы pSMART (Lucigen Corporation, США) и pSPARK (Canvax Biotech, Испания) имеют ряд существенных недостатков. Так, векторы семейства pSMART содержат выступающие 3'G нуклеотиды, что делает невозможным прямое клонирование продуктов ПЦР. При использовании этих векторов необходимо проводить ПЦР при помощи специальных дорогостоящих и низкопроцессивных полимераз с корректирующей активностью, а затем проводить стадию нематричного присоединения 3' нуклеотида («тейлинга») с добавлением стандартной полимеразы и избытка dCTP.
Другой важный недостаток векторов pSMART и pSPARK - малый размер и неудачный дизайн полилинкера (MCS, multiple cloning site), что делает практически невозможной сборку модульных генетических конструкций (длинных ОРС, ОРС гибридных белков, кассет с регуляторными элементами). MCS существующих "нетранскрибируемых" векторов и большинства стандартных векторов содержат не более 15 сайтов узнавания эндонуклеаз рестрикции II типа, преимущественно узнающих гексануклеотидные палиндромные последовательности.
Необходимым условием для возможности использования в молекулярном клонировании закодированных в MCS сайтов узнавания эндонуклеаз рестрикции является их уникальность, т.е. эти сайты не должны встречаться в остальной последовательности вектора, а также (при сборке модульных конструкций) в последовательности вставки (модуля). Чем больше длина соединяемых модулей ДНК, тем выше вероятность того, что в последовательности будет содержаться палиндром, узнающийся эндонуклеазой рестрикции. Так, при случайном распределении сайтов определенный тетрануклеотид будет встречаться 1 раз на каждые 44 (256) нуклеотидов, гексануклеотид - 1 раз на 46 нуклеотидов (4096), октануклеотид - 1 раз на 48 (114688). Таким образом, наличие нескольких октануклеотидных сайтов в MCS вектора позволяет практически гарантировать возможность сборки модульной конструкции по уникальным сайтам узнавания рестриктаз.
В полилинкерах вышеперечисленных векторов октануклеотидные сайты узнавания либо вовсе не представлены, либо представлено не более двух октануклеотидных сайтов (pGEM - NotI, SbfI; pSMART - SwaI, pSPARK - PmeI, NotI, причем содержащиеся в MCS transcription-free векторов сайты эндонуклеаз, расщепляющих ДНК с образованием «тупых» концов, SwaI и PmeI, неудобны для клонирования).
Для сборки модульных конструкций описан ряд специализированных систем, требующих либо проведения мультиплексного дотирования (Interxon Corporation, US 20090226976 A1, US 20090170727 A1), либо последовательной сборки без возможности извлечения модуля и инсерции дополнительного модуля между ранее вставленными (US 20090123973 A1), либо система в целом предназначена для решения узкой задачи и требует последовательного применения нескольких векторов (например, трансфер-векторы и вектор для экспрессии антител US 20050176099 A1, Schering Corporation).
Для быстрого клонирования продуктов полимеразной цепной реакции за счет выступающих на 5' концах амплифицированных фрагментов ДНК дезоксиаденозиновых остатков широко применяются так называемые Т-векторы - линеаризованные плазмидные векторы с выступающими 3' дезокситимидиновыми остатками [Zhou MY, Gomez-Sanchez CE. Universal ТА cloning. Curr Issues Mol Biol. 2000; Jan; 2(1):1-7. Review. PubMed PMID: 11464915]. Существует два метода их получения: 1). первый основан на расщеплении эндонуклеазой рестрикции с образованием ровных («тупых») концов с последующим присоединением 3'Т при помощи ДНК полимеразы [Holton ТА, Graham MW. A simple and efficient method for direct cloning of PCR products using ddT-tailed vectors. Nucleic Acids Res. 1991 Mar 11; 19(5):1156; Marchuk D, Drumm M, Saulino A, Collins FS. Construction of T-vectors, a rapid and general system for direct cloning of unmodified PCR products. Nucleic Acids Res. 1991 Mar 11; 19(5):1154; Papp T, Kirchner S, Diener U, Jafari M, Golka A, Schiffman D. Cloning of PCR fragments with a modified M13mp18 T-vector. Trends Genet. 1995 May; 11(5):169), 2). Второй метод основан на обработке плазмидного вектора ступенчато щепящей эндонуклеазой с образованием 3'Т концов, например, описано использование ферментов XcmI [Cha J, Bishai W, Chandrasegaran S. New vectors for direct cloning of PCR products. Gene. 1993 Dec 22; 136(1-2):369-70; Kwak JH, Kim MY. Construction of T-vector for direct cloning and expression of cloned genes in Escherichia coli. Anal Biochem. 1995 Jun 10; 228(1):178-80; Borovkov AY, Rivkin MI. XcmI-containing vector for direct cloning of PCR products. Biotechniques. 1997 May; 22(5):812-4; de Vries E. pUCPCR1. A vector for direct cloning of PCR products in a double XcmI restriction site offering compatible single 3'-overhanging T residues. Mol Biotechnol. 1998 Dec; 10(3):273-4], а также ферментов AspEI/Eam1105I/AhdI [Ichihara Y, Kurosawa Y. Construction of new T vectors for direct cloning of PCR products. Gene. 1993 Aug 16; 130(1):153-4; Ido E, Hayami M. Construction of T-tailed vectors derived from a pUC plasmid: a rapid system for direct cloning of unmodified PCR products. Biosci Biotechnol Biochem. 1997 Oct; 61(10):1766-7; Jeung JU, Cho SK, Shim KS, Ok SH, Lim DS, Shin JS. Construction of two pGEM-7Zf(+) phagemid T-tail vectors using AhdI-restriction endonuclease sites for direct cloning of PCR products. Plasmid. 2002 Sep; 48(2):160-3].
Технической задачей, решаемой авторами настоящего изобретения, являлась разработка эффективных «нетранскрибируемых» векторов, обеспечивающих возможность:
1. прямого клонирования ПЦР-продуктов;
2. клонирования «сложных» GC- AT- богатых последовательностей (часто встречающихся в геномах патогенных микроорганизмов или в регуляторных областях генома эукариот), а также токсичных для бактерий открытых рамок считывания полипептидов;
3. модульной сборки генетических конструкций (в частности, сборки кассет для экспрессии эукариотических генов, сборки ДНК-конструкций для генной терапии).
Технический результат достигался созданием нетранскрибируемого линейного вектора малого размера (т.е. менее 4 т.п.о.), содержащего ген маркера селекции с промотором и терминатором, область инициации репликации, полилинкер, содержащий 15 или более уникальных гексануклеотидных сайтов расщепления эндонуклеазами рестрикции, 3 или более октануклеотидных сайтов и непарные выступающие одиночные остатки дезокситимидина на 3'-концах цепей ДНК для клонирования продуктов ПЦР.
Термин «линейный Т-вектор» означает линеаризованную плазмидную ДНК с выступающими 3' дезокситимидиновыми остатками, образующую после лигирования вставки кольцевую плазмиду, содержащую все необходимые генетические элементы для репликации в бактериальной клетке и экспрессии гена селективного маркера, например, такие, как ориджин репликации и ген устойчивости к антибиотику с промотором, соответственно, а также протяженный полилинкер, содержащий уникальные сайты узнавания эндонуклеазами рестрикции, при этом указанный полилинкер содержит сайты узнавания октануклеотидных эндонуклеаз рестрикции, расщепляющих ДНК с образованием «липких» концов.
Конкретными примерами генетических элементов, необходимых для репликации в бактериальной клетке согласно настоящему изобретению, являются ориджины репликации высококойпийных плазмид pUC, pBR и подобные им. Использование ориджина pUC является наиболее предпочтительным.
Конкретными примерами генетических элементов, необходимых для экспрессии гена селективного маркера согласно настоящему изобретению, являются ген бета-лактамазы (amp), обеспечивающий усточивость к ампилиллину, ген хлорамфениколацетилтрансферазы (cat), обеспечивающий усточивость к хлорамфениколу, гены монооксигеназ (tet), обеспечивающие усточивость к тетрациклину, ген неомицинфосфотрансферазы II (kan), обеспечивающий усточивость к канамицину, но не ограничиваются ими.
Конкретными примерами гексануклеотидных эндонуклеаз рестрикции, сайты узнавания которых присутствуют в полилинкере, являются XhoI, PstI, EcoRI, NcoI, SacI, BspEI, SalI, AatII, NdeI, XbaI, XmaI, PvuI, PsiI, BamHI, NheI, но не ограничиваются ими. Конкретными примерами октануклеотидных эндонуклеаз рестрикции, сайты узнавания которых присутствуют в полилинкере, являются AbsI, AscI и NotI, но не ограничиваются ими.
Предпочтительным вариантом реализации настоящего изобретения является Т-вектор pBL-T, представляющей собой линеаризованную плазмиду, размером 2032 п.о. с выступающими 3' дезокситимидиновыми остатками, который соедржит фрагмент длиной 100 п.о., представляющий собой протяженный полилинкер, фрагмент плазмиды pUC18 (+) длиной 1932 п.о., содержащийо область инициации репликации плазмиды, и ген бета-лактамазы с промотором и терминатором. Схема вектора с указанием координат функциональных элементов представлена на Фиг.2.
Полная нуклеотидная последовательность линейного Т-вектора (pBL-T) представлена в Перечне последовательностей под номером SEQ ID NO:1.
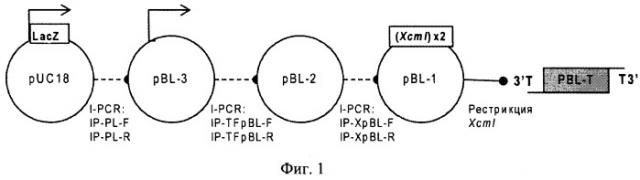
Вектор может быть получен с использованием стандартных методов генной инженерии, плазмиды pUC18 (ЕР 0316378) и химически синтезированных олигонуклеотидов [Sambrook J, Fritsch EF, Maniatis T. Molecular Cloning. 2nd ed. New York, NY: Cold Spring Harbor Laboratory Press; 1989]. Например, линейный Т-вектор может быть получен методом ПЦР, а также рестрикцией плазмиды-предшественника, несущей кассету, состоящую из тандема расположенных на обеих комплементарных цепях ДНК сайтов узнавания эндонуклеаз рестрикции, расщепляющих ДНК с образованием неспаренных 3' дезокситимидиновых нуклеотидов. Согласно данному изобретению конкретным примером такой эндонуклеазы является, но не ограничивается им, эндонуклеаза XcmI. Схема получения линейного Т-вектора (pBL-T) согласно настоящему изобретению представлена на Фиг.1. Схема соответствующей кольцевой плазмиды-предшественника pBL-1 представлена на Фиг.5. Полная нуклеотидная последовательность плазмиды предшественника (pBL-1), содержащей два сайта узнавания XcmI, расположенные в центре области полилинкера в противоположной ориентации и образующие при расщеплении указанной рестриктазой непарные выступающие одиночные остатки дезокситимидина на 3'-концах цепей ДНК, представлена в Перечне последовательностей под номером SEQ ID NO:2.
Разработанное семейство векторов pBL-T сочетает полезные свойства «нетранскрибируемых» векторов для клонирования сложных GC- и AT- богатых последовательностей, позволяет вести прямое клонирование ПЦР продуктов и обладает удобным протяженным полилинкером для обеспечения удобства сборки модульных конструкций. Векторы pBL могут применяться для рутинного клонирования при отсутствии необходимости в проведении бело-голубого скрининга в виду очень высокой эффективности клонирования.
Данный Т-вектор пригоден для лигирования с ПЦР-продуктами, полученными с помощью методов, хорошо известных специалисту в данной области техники с использованием термостабильной ДНК-полимеразы Taq или смесей полимераз, в состав которых входит ДНК-полимераза Taq.
Лигирование вставки и Т-вектора проводят широко известными методами, например, с использованием фермента ДНК-лигазы фага Т4. Полученной смесью продуктов лигирования можно трансформировать бактериальную клетку, предпочтительно бактерию, принадлежащей к роду Escherichia, восприимчивую к подобной трансформации указанной плазмидой. Выбор конкретной клетки не является критическим, поскольку методология и приемы трансформации хорошо известны специалисту в данной области техники.
Основные свойства pBL-1 в сравнении с ближайшими аналогами суммированы в Таблице 1.
| Таблица 1 | ||||
| pGEM-T, PAL-TA | pSPARK | pSMART | pBL-1 | |
| Размер | 3 т.п.о. | 3 т.п.о. | 1,8 т.п.о. | 2 т.п.о. |
| Прямое клонирование ПЦР-продуктов | Возможно | Только после проведения дополнительных модификаций 3' концов ПЦР продукта | Возможно | |
| Клонирование «сложных» GC-богатых последовательностей | Ограничено | Возможно | ||
| Клонирование токсичных ОРС | Ограничено | Возможно | ||
| Сборка модульных генетических конструкций | Ограничена | Ограничена | Затруднена | Возможно |
Один из вариантов воплощения настоящего изобретения обеспечивает набор для клонирования одного или нескольких полинуклеотидов. В дополнение к вектору согласно настоящего изобретения указанный набор содержит инструкцию, информирующую пользователя о том, каким образом используется указанный набор. Также дополнительными компонентами, обычно присутствющими в указанном наборе, являются ДНК полимераза без корректирующей активности, недискриминирующая ДНК полимераза или терминальная дезоксинуклеотидилтрансфераза и один или несколько компонентов, выбранных их лигазы, киназы, ДНК полимеразы с корректирующей активностью, одна или несколько пар праймеров для секвенирования, одна или несколько пар праймеров для амплификации, компетентные клетки, дезоксинуклеотидтрифосфаты, дидезоксинуклеотидтрифосфаты, аналоги нуклеотидов и реакционные буферы, пригодные для осуществления любой из стадий модификации и клонирования полинуклеотидов.
Особенности полученного Т-вектора и результаты его практического применения приведены на следующих Фигурах.
Краткое описание Фигур:
На Фигуре 1 показана схема последовательного получения плазмид pBL-3, PEL-2, pBL-1 и Т-вектора pBL-T. Обозначения:
LacZ - ген N-концевого фрагмента бета-галактозидазы Е.coli. Стрелкой обозначен промотер гена LacZ; (XcmI)х2 - блок сайтов узнавания эндонуклеазы рестрикции XcmI; пунктирной линией обозначены стадии ПЦР, под линией указаны названия праймеров для инвертированного ПЦР.
На Фигуре 2 показана карта линейного вектора pBL-T. Используются следующие обозначения: Amp (bla) - ген β-лактамазы, обеспечивающий устойчивость к ампициллину; bla promoter - промотер гена β-лактамазы; pUC ori - участок инициации репликации; SQ Blanf primer, SQ primer - сайты отжига праймеров для секвенирования области вставки и полилинкера. Стрелками указаны направления транскрипции генов. Курсивом выделены сайты узнавания эндонуклеаз рестрикции, в скобках указаны номера нуклеотидов в точках разрезания. Звездочками обозначены неспаренные 3'Т нуклеотиды.
На Фигуре 3 показана карта плазмиды pBL-3. Используются следующие обозначения: Amp (bla) - ген β-лактамазы, обеспечивающий устойчивость к ампициллину; bla promoter - промотер гена β-лактамазы; pUC ori - участок инициации репликации; SQ Blanf primer, SQ primer - сайты отжига праймеров для секвенирования области вставки и полилинкера. Стрелками указаны направления транскрипции генов. Курсивом выделены сайты узнавания эндонуклеаз рестрикции, в скобках указаны номера нуклеотидов в точках разрезания.
На Фигуре 4 показана карта плазмиды pBL-2. Используются следующие обозначения: Amp (bla) - ген β-лактамазы, обеспечивающий устойчивость к ампициллину; bla promoter - промотер гена β-лактамазы; pUC ori - участок инициации репликации; SQ Blanf primer, SQ primer - сайты отжига праймеров для секвенирования области вставки и полилинкера. Стрелками указаны направления транскрипции генов. Курсивом выделены сайты узнавания эндонуклеаз рестрикции, в скобках указаны номера нуклеотидов в точках разрезания.
На Фигуре 5 показана карта плазмиды pBL-1. Используются следующие обозначения: Amp (bla) - ген β-лактамазы, обеспечивающий устойчивость к ампициллину; bla promoter - промотер гена β-лактамазы; pUC ori - участок инициации репликации; MCS - полилинкер; pUC18 fragment - фрагмент гомологичный pUC18; SQ Blanf primer, SQ primer - сайты отжига праймеров для секвенирования области вставки полилинкера. Стрелками указаны направления транскрипции генов. Курсивом выделены сайты узнавания эндонуклеаз рестрикции, в скобках указаны номера нуклеотидов в точках разрезания.
На Фигуре 6 показана электрофореграмма вектора pBL-1, линеаризованного эндонуклеазой рестрикции XcmI с образованием pBL-T. Разделение проведено в 1%-ном агарозном геле, визуализация окрашиванием бромистым этидием (цвета инвертированы).
Обозначения: 2U; 0,3U; 0,09U; 0,03U - продукты рестрикции 1 мкг плазмиды pBL-1 2U; 0,3U; 0,09U и 0,03U единицами активности XcmI, соответственно. Pink - контрольная рестрикционная смесь, в которую не вносили фермент. Объем реакции 50 мкл, инкубация 16 ч. при 37°С. Pk - не инкубировавшаяся при при 37°С плазмида. М - маркер размера. Размер полос маркера указан в п.о. Положение pBL-T и pBL-1 указано стрелкой.
Настоящее изобретение будет более подробно описано ниже со ссылкой на следующие не ограничивающие настоящее изобретение Примеры.
Пример 1 Получение плазмиды pBL-3
Для изменения участка клонирования и удаления ОРС бета-галактозидазы был проведен сайт-направленный мутагенез плазмиды pUC18 методом инвертированной ПЦР с использованием праймеров IP-PL-F (SEQ ID NO:3) и IP-PL-R (SEQ ID NO:4).
Сайт-направленный мутагенез методом инвертированной ПЦР проводили по [Michael P. Weiner, Tim Gackstetter, Gina L. Costa, John C. Bauer, and Keith A. Kretz. Site-directed Mutagenesis using PCR in Molecular Biology: Current Innovations and Future Trends. Eds. A.M. Griffin and H.G.Griffin. ISBN 1-898486-01-8 1995 Horizon Scientific Press, PO Box 1, Wymondham, Norfolk, U.K.] с модификациями
Каждый праймерный олигонуклеотид фосфорилировали отдельно. Реакцию проводили в буфере Трис-HCl, рН 7,5, содержащем 10 мМ MgCl2, 50 мМ дитиотреитола, 1 мМ АТФ и 100 пМ олигонуклеотида, 1 ед. полинуклеотидкиназы фага Т4 (Сибэнзим, Россия) в течение 30 минут при 37°С. После окончания реакции фермент инактивировали при 65°С 10 мин. Затем реакционную смесь использовали для проведения инвертированной ПЦР в количестве 20 пМ на реакцию. ПЦР проводили с использованием набора реактивов "Encyclo PCR kit" (ЗАО Евроген, Россия) по инструкции производителя. ПЦР проводили по следующей схеме: 1 цикл: 4 мин. 94°С, 2 мин. 50°С, 2 мин. 72°С; затем 11 циклов 1 мин. - 94°С, 1 мин. - 55°С, 2 мин. 72°С. После чего разводили вдвое однократным буфером эндонуклеазы DpnI добавляли эндонуклеазу DpnI (10 U) и инкубировали при 37°С 30 мин., затем вносили полимеразу Pfu (2.5U) и переносили на 72°С и инкубировали еще 30 мин. Полученную смесь очищали, используя набор "Wizard SV Gel and PCR Clean-Up System" («Promega», CHIA) по протоколу производителя. После чего проводили лидирование очищенного продукта инвертированной ПЦР с использованием ДНК-лигазы фага Т4 и стандартного буферного раствора (Fermentas, Литва) в течение 1 часа при комнатной температуре. Полученной лигазной смесью трансформировали клетки Е.coli штамма ТОР10 (Invitrogen, США), с генотипом: F- mcrA Δ(mrr-hsdRMS-mcrBC) φ80lacZΔM15 ΔlacX74 nupG recA1 araD139 Δ(ara-leu)7697 galE15 galK16 rpsL(StrR) endA1. Для этого к 100 мкл замороженной суспензии клеток Е.coli добавляли 5 мкл лигазной смеси, инкубировали на льду 30 минут для сорбции плазмидной ДНК, нагревали до 42 С на 60 секунд и инкубировали на льду 5 минут. После чего добавляли 800 мкл питательного бульона SOC и инкубировали при 37°С 60 минут. После инкубации переносили суспензию на чашку Петри с твердой агаризованной средой, содержащей ампициллин в концентрации 100 мкг/мл агара, и помещали в термостат на 37 С 18 часов.
Колонии Е.coli, отобранные в результате бело-голубого скрининга (целевые клоны были лишены гена галактозидазы и поэтому давали белые колонии), анализировали методом ПЦР с клонов, с использованием праймерных олигонуклеотидов к конститутивным элементам последовательностей исходной и мутантной плазмид олигонуклеотидов SQ-BlaN-F (SEQ ID NO:5) и M13Rev (SEQ ID NO:6).
4 клона наращивали в 5 мл питательного бульона 2xYT-Amp и выделяли плазмидную ДНК при помощи набора GeneJET Plasmid Miniprep Kit (Fermentas, Литва) по протоколу производителя. Для полученных генетических конструкций определяли нуклеотидную последовательность методом ПЦР-секвенирования с использованием олигонуклеотидов SQ-BlaN-F (SEQ ID NO:5) и M13Rev (SEQ ID NO:6). Последовательность полученной плазмиды pBL-3 представлена в Перечне последовательностей под номером SEQ ID NO:7.
Пример 2 Получение «нетранскрибируемой» плазмиды pBL-2
Для удаления pLac промотора был проведен сайт-направленный мутагенез плазмиды pBL-3 методом инвертированной ПЦР с использованием праймеров IP-TFpBL-F (SEQ ID NO:8) и IP-TFpBL-R (SEQ ID NO:9).
Сайт-направленный мутагенез методом инвертированной ПЦР проводили как написано в примере 1. Для полученных генетических конструкций определяли нуклеотидную последовательность методом ПЦР-секвенирования с использованием олигонуклеотидов SQ-BlaN-F (SEQ ID NO:5) и SQprimer (SEQ ID NO:10). Последовательность полученной плазмиды pBL-2 представлена в Перечне последовательностей под номером SEQ ID NO:11.
Пример 3 Получение плазмиды pBL-1
Для введения кассеты, содержащей два сайта узнавания эндонуклеазы XcmI, расположенные в противоположной ориентации, провели сайт-направленный мутагенез плазмиды pBL-2 методом инвертированной ПЦР с использованием праймеров IP-XpBL-F (SEQ ID NO:12) и IP-XpBL-R (SEQ ID NO:13). Сайт-направленный мутагенез методом инвертированной ПЦР проводили как написано в примере 1. Для полученных генетических конструкций определяли нуклеотидную последовательность методом ПЦР-секвенирования с использованием олигонуклеотидов SQ-BlaN-F (SEQ ID NO:5) и SQprimer (SEQ ID NO:10). Последовательность полученной плазмиды pBL-1 представлена в Перечне последовательностей под номером SEQ ID NO:2
Пример 4. Препаративпое получение линейного вектора PBL-T
Аликвоту компетентных клеток (100 мкл) Е.coli штамма ТОРЮ (Invitrogen, США), трансформировали 50 пг плазмидной ДНК pBL-1, как описано в примере 1, и высевали на 2xYT-агар с ампициллином (50 мкг/мл). Отбирали колонии Е.coli с типичным фенотипом штамма ТОР10 и подращивали в течение 18 часов в 5 мл среды 2xYT с ампициллином (50 мкг/мл), проверяли наличие плазмиды минипрепаративным выделением пДНК (как описано в Примере 1 и создавали музей штамма E.coli ТОР10/pBL-1, добавляя к 1 мл аликвотам культуры глицерин до 15% с последующей заморозкой пробирок в жидком азоте. Для препаративного получения pBL-1 в две пробирки, содержащие по 5 мл среды 2xYT с ампициллином бактериологической петлей сеяли колонии штамма Е.coli TOP10/pBL-1, выращенные на агаризованной среде из музея штамма Е.coli TOP10/pBL-1. Пробирки помещали в термостат и инкубировали в течение 14-16 ч. при 37°С при перемешивании 260 об/мин. Затем выращенный посевной материал пересевали в соотношении 1:250 в две колбы, содержащие по 250 мл среды Terrific Broth (12 г/л триптона, 24 г/л дрожжевого экстракта, 4 мл/л глицерина, 0,017 М калия дигидрофосфата, 0,072 М калия гидрофосфата) и 50 мкг/мл ампициллина. Колбы помещали в термостат и инкубировали 48 ч. при 37°С при перемешивании 260 об/мин. Отделение биомассы от культуральной жидкости проводили центрифугированием, среднее количество биомассы составляло 10 г/л, содержание плазмиды - 30,5 мг/л.
Выделяли сверхскрученную плазмидную ДНК щелочным лизисом, для этого осадок биомассы ресуспендировали в буферном растворе (0,05 М Трис-HCl, 0,01 М ЭДТА-Na, 0,05 М глюкозы, рН 8,0) в соотношении 10 мл раствора на 1 г биомассы, затем производили лизис клеток путем добавления равного объема раствора 1% додецилсульфата натрия и 0,2 М NaOH, и перемешивали суспензию покачиванием в течение 5 мин. Добавляли половинный объем нейтрализующего раствора, содержащего 3 М ацетата калия в 11% уксусной кислоте, и перемешивали суспензию покачиванием до получения равномерной взвеси белых хлопьев. Образовавшийся осадок отделяли фильтрованием через полиамидную ткань с ячейками 100 мкм и последующим центрифугированием в течение 10 мин при ускорении 12000 м/с2. Производили концентрирование неочищенного раствора плазмидной ДНК pBL-1 до объема 15 мл ультрафильтрацией с использованием картриджа с кассетой VIVAFLOW (размер пор 500 кДа, Sartorius Stedim, Германия).
Хроматографическую очистку сверхскрученной плазмидной ДНК проводили с использованием жидкостного хроматографа AKTApurifier (GE Healthcare), длина волны - 254 нм.
Для отделения примесей РНК от плазмидной ДНК проводили гель-фильтрацию с использованием сорбента Sepharose 6 Fast flow (GE Healthcare). На колонку, предварительно уравновешенную буфером А (2,1 М (NH4)2SO4, 10 мМ ЭДТА, 100 мМ Трис-HCl, рН 7,5) наносили пробу ДНК, собирали фракцию, соответствующую первому пику, поглощающему на 254 нм (эта фракция содержит кольцевую ДНК).
Для отделения открытой кольцевой и линейной форм плазмидной ДНК проводили псевдоаффинную хроматографию с использованием сорбента PlasmidSelect Xtra (GE Healthcare). На колонку, уравновешенную буфером В (2 М (NH4)2SO4, 10 мМ ЭДТА, 100 мМ Трис-HCl, рН 7,5) наносили пробу ДНК после гель-фильтрации, затем, изменив направление потока через колонку, производили десорбцию суперспирализованной кольцевой ДНК буфером С (0,3 М NaCl, 1,7 М (NH4)2SO4, 10 мМ ЭДТА, 100 мМ Трис-HCl, рН 7,5), собирали фракцию, соответствующую первому пику, поглощающему на 254 нм (эта фракция содержит суперспирализованную кольцевую ДНК).
Для окончательной очистки и концентрирования сверхскрученной плазмидной ДНК производили анионообменную хроматографию с использованием сорбента SOURCE 30 Q (GE Healthcare). Перед нанесением на колонку раствор пДНК после псевдоаффинной хроматографии разбавляли двумя объемами воды очищенной, затем наносили на колонку, уравновешенную буфером D (0,4 М NaCl, 10 мМ ЭДТА, 100 мМ Трис-HCl, рН 7,5), изменив направление потока через колонку, производили десорбцию очищенной кольцевой ДНК буфером Е (1,0 М NaCl, 10 мМ ЭДТА, 100 мМ Трис-HCl, рН 7,5), собирали фракцию, соответствующую первому пику, поглощающему на 254.
Полученный раствор сверхскрученной пДНК pBL-1 обессоливали ультрафильтрацией с помощью одноразовых ультрафильтрационных пробирок VIVASPIN 6 (размер пор 5 кДа, Sartorius Stedim, Германия). Измеряли концентрацию пДНК в полученном растворе при помощи спектрофотометрии, раствор разделяли на аликвоты по 5 мг пДНК и хранили при -20°С.
Линеаризацию плазмиды pBL-1 проводили при помощи эндонуклеазы ферментом XcmI (New England Biolabs) по методике производителя. Экспериментально на небольших аликвотах плазмиды pBL-1 подбирали оптимальное соотношение фермента и субстрата, приводящее к распаду более 95% плазмиды. Результаты определения соотношения приведены на Фиг.6, видимое отсутствие сверхскрученной пДНК зафиксировано для соотношения составившее 0,3 ЕД фермента XcmI на 1 мкг плазмиды.
Очистку полученного линейного вектора pBL-T проводили анионообменной хроматографией. Образец расщепленной рестриктазой XcmI ДНК (50 мкг) был нанесен без разбавления на колонку MonoQ (GE Healthcare), уравновешенную раствором А (0,1 М Трис-HCl, 0,4 М натрия хлорида, 10 мМ ЭДТА). После промывки колонки 10 мл раствора А, вели градиентную элюцию ДНК концентрацией хлорида натрия, профиль градиента 0-100% буфера В (0,1 М Трис-HCl, 1 М натрия хлорида, 10 мМ ЭДТА) за 60 мин при скорости потока 0,5 мл/мин. Основной пик, соответствующий линейной пДНК, элюировали при концентрации хлорида натрия около 760 мМ. Собранный основной пик обессоливали ультрафильтрацией, как указано выше, определяли концентрацию пДНК спектрофотометрически, разделяли раствор на аликвоты, содержащие по 100 нг пДНК, высушивали в вакуумной центрифуге и хранили закрытые пробирки при -20°С.
Пример 5 Эффективность клонирования открытых рамок считывания в нетранскрибируемый Т-вектор pBL-T
Для определения эффективности клонирования открытых рамок считывания (ОРС) использовали ОРС кДНК гена дигидрофолатредуктазы мыши (DHFR, NM_000791.3), полученную методом ПЦР с праймеров AD-DHFR-F (SEQ ID NO:14) и AD-DHFR-R (SEQ ID NO:15) при использовании в качестве матрицы плазмиды pOptiVec (Invitrogen, США).
Продукт ПЦР, соответствующий полной ОРС DHFR, очищали из агарозного геля как описано в примере 1. Очищенный продукт лигировали с 50 нг линейного Т-вектора pBL-T, или 50 нг коммерчески доступного транскрибируемого Т-вектора с системой бело-голубой селекции pAL-TA (Евроген) (Т-1) или с 50 нг стандартного плазмидного вектора pUC18, линеаризованного эндонуклеазой рестрикции SmaI с образованием "тупых" концов молекулы. Во всех случаях использовали молярное соотношение вставки и вектора 3:1, объем лигирования 30 мкл, фермент для лигирования - ДНК-лигаза фага Т4 (Fermentas, Литва). Лигирование вели в течение 16 часов при температуре 14°С.
Полученные смеси добавляли к компетентным клеткам штамма ТОР10 и вели трансформацию, как описано в Примере 1, после чего переносили суспензию трансформированных бактерий на две чашки Петри (100 мкл и 900 мкл) с агаризованной средой 2xYT, содержащей ампициллин в концентрации 100 мкг/мл, ИПТГ и X-Gal и помещали чашки в термостат на 37 С 18 часов.
Полученные данные о числе клонов представлены в Таблице 2.
| Таблица 2. | |||
| Эффективность лигирования ОРС с Т-векторами pBL-T, pUC18 и Т1. | |||
| Наличие ДНК "вставки" в лигазной смеси | pBL-T, КОЕ* | pUC18 - SmaI, число КОЕ/"белых" КОЕ | Т-1, число КОЕ/"белых" КОЕ |
| - | 1 | 27/0 | 0/0 |
| + | 42 | 63/3 | 3/3 |
| * колониеобразующая единица |
Для 4-х колоний трансформантов, полученных при помощи вектора pBL-T, нарастили и выделили плазмиды и провели секвенирование области вставки. Установили, что все плазмиды содержат вставку; ориентация вставки в двух случаях была "прямой" и в двух случаях "обратной". Вектор pBL-T обеспечивал наибольшее число позитивных клонов, содержащих вставку ОРС, среди всех исследованных.
Пример 6. Эффективность клонирования в нетранскрибируемый Т-вектор pBL-T GC-богатых фрагментов ДНК.
Для определения эффективности клонирования GC богатых фрагментов использовали fr5EF - участок промоторной области фактора элонгации трансляции 1 китайского хомяка и frEBVTR - участок терминального повтора вируса Эппштейн-Барр.
Участок промоторной области фактора элонгации трансляции 1 китайского. хомяка - fr5EF - получали методом ПЦР при помощи набора Encyclo (Евроген, Россия) по инструкции производителя. Использовали синтетические ол