Способ получения биосовместимого покрытия на стоматологических имплантатах
Иллюстрации
Показать всеИзобретение относится к электролитическим методам обработки поверхности металлических материалов и может быть использован в стоматологическом протезировании. Способ заключается в получении биосовместимого покрытия на стоматологических имплантатах, выполненных из титана и его сплавов, включающий помещение изделий в водный раствор электролита, содержащий гидроксид калия и наноструктурный гидроксиаиатит в виде водного коллоидного раствора, возбуждение на поверхности изделий микродуговых разрядов, при этом оксидирование обрабатываемых изделий осуществляют в химически стойкой непроводящей ванне; в раствор электролита помещают одновременно две партии обрабатываемых изделий, предварительно закрепив изделия одной партии к клеммам для обрабатываемых деталей, изделия другой партии - к клеммам вспомогательного электрода; а электролит дополнительно содержит гидроксид натрия, гидрофосфат натрия, натриевое жидкое стекло, метасиликат натрия, в следующих соотношениях, из расчета массы сухого вещества в граммах на литр состава: гидроксид калия КОН - 2, гидроксида натрия NaOH - 1, гидрофосфата натрия Na2HРО4×12H2О - 5, жидкое стекло nNa2O·mSiO2 (М=3,2) - 5, метасиликат натрия Na2SiO3×9H2O - 8, нанодисперсный гидроксиапатит - 0,5÷5, причем отклонения от указанных концентраций компонентов электролита не превышают ±10%. 1 табл., 4 ил., 1 пр.
Реферат
Изобретение относится к электролитическим методам обработки поверхности металлических материалов, в частности к технологии получения биосовместимых покрытий на имплантатах, выполненных из титана и его сплавов для стоматологического протезирования.
Биосовместимость и биоактивность имплантатов из титана или титановых сплавов, предназначенных для использования в различных областях медицины: стоматологии, ортопедии, травматологии, достигается за счет формирования на их поверхности биоактивного покрытия, сходного с составом костной ткани и с высокоразвитой структурой поверхности. Перспективным материалом для создания биоактивных кальций-фосфатных покрытий, которые наносят на основу из титана и его сплавов, является гидроксиапатит, применение которого улучшает способность интеграции имплантата в костную ткань живого организма.
Поэтому наибольший интерес представляют способы формирования биосовместимых функциональных покрытий на имплантатах, основанные на электрохимическом оксидировании титановых сплавов в кальций-фосфатных электролитах с кислой средой [1], в кальций-фосфатных электролитах с широким диапазоном значений водородного показателя и импульсным напряжением до 1000 В [2], в стандартных электролитах в присутствии биоактивного вещества - гидроксиапатита или кальций-фосфатных соединений [3].
Наиболее близким по своим признакам, принятым за прототип, является способ получения покрытий на изделиях, выполненных из титана и его сплавов. [4] Способ включает помещение изделий в водный раствор электролита, содержащего 2 мас.% гидроксида калия и 0,5 мас.% наноструктурного гидроксиапатита в виде водного коллоидного раствора, возбуждение на поверхности изделий микродуговых разрядов. Способ позволяет получить развитую поверхностную структуру покрытия с высокими механическими свойствами и заданным элементным составом, близким к составу костной ткани. Недостатком указанного способа является недостаточная химическая чистота покрытия, что обусловлено возможностью попадания в состав покрытия продуктов коррозии металлического вспомогательного электрода, в качестве которого может выступать электролитическая ванна.
Из уровня техники известно, что нержавеющие стали, используемые для изготовления электролитических ванн и вспомогательных электродов, подвержены влиянию химической и электрохимической коррозии [5] так же, как и углеродистые стали, только в меньшей степени. Следствием коррозии оборудования является попадание ионов металла и нерастворимых соединений в электролит. При формировании функциональных покрытий методом микродугового оксидирования, содержащиеся в электролите растворенные вещества и дисперсные частицы внедряются в покрытие, полностью или частично вступая в химические реакции и изменяя его фазовый и элементный состав [6]. В большинстве областей применения не является критичным наличие остаточных примесей в составе покрытия. Напротив, химический состав поверхности изделий для имплантации в медицине имеет решающее значение для последующих процессов восстановления поврежденных тканей, приживления имплантата и комплексной реакций организма на инородный объект [7, 8]
В основу изобретения положена задача повышения химической чистоты и биоактивности биосовместимого покрытия, имеющего состав, близкий к составу натуральной кости по соотношению кальций/фосфор.
Технический результат:
- предотвращение попадания в состав покрытия примесей металлов от вспомогательного электрода, в качестве которого может быть использована электролитическая ванна, что обеспечивает химическую чистоту биосовместимого покрытия на имплантатах, выполненных из титана и его сплавов;
- формирование покрытия, содержащего ионы кремния, что способствует улучшенной пролиферации остеобластов и росту внеклеточного матрикса, ускоренной минерализации костной ткани [9, 10].
Задачу решает предложенный способ получения покрытий на изделиях, выполненных из титана и его сплавов, включающий помещение изделий в водный раствор электролита, содержащий гидроксид калия и наноструктурный гидроксиапатит в виде водного коллоидного раствора, возбуждение на поверхности изделий микродуговых разрядов, в который внесены следующие новые признаки:
- оксидирование обрабатываемых изделий осуществляют в химически стойкой непроводящей ванне без участия вспомогательного электрода;
в раствор электролита помещают одновременно две партии обрабатываемых изделий, предварительно закрепив изделия одной партии к клеммам для обрабатываемой детали, изделия другой партии- к клеммам вспомогательного электрода;
- электролит дополнительно содержит гидроксид натрия, гидрофосфат натрия, натриевое жидкое стекло, метасиликат натрия, в следующих соотношениях, из расчета массы сухого вещества в граммах на литр состава:
гидроксид калия КОН - 2,
гидроксида натрия NaOH - 1,
гидрофосфата натрия Na2HPO4×12H2O - 5,
жидкое стекло nNa2O·mSiO2 (М=3,2) - 5,
метасиликат натрия Na2SiO3×9H2O - 8,
наноструктурный гидроксиапатит - 0,5-5, причем отклонения от указанных концентраций компонентов электролита не должны превышать ±10%.
Указанные признаки, обеспечивающие возможность оксидирования одновременно двух партий изделий, когда каждая партия во время ее обработки одновременно выступает в роли вспомогательного электрода для другой партии, позволяют исключить из электрохимической системы процесса оксидирования вспомогательный электрод, роль которого может играть металлическая ванна. Что предотвращает попадание в электролит, а далее и в покрытие, продуктов химической и электрохимической коррозии - таких ионов металлов из состава легированных сталей, как никель, хром и другие, относящихся к токсичным веществам.
Кроме того, обеспечивается равномерное формирование биосовместимого покрытия на всей поверхности изделий обеих партий.
При проведении микродугового оксидирования в мягком анодно-катодном режиме, который используется в предлагаемом способе, выполняется равенство средних значений анодного и катодного токов, проходящих через цепь «обрабатываемая деталь - вспомогательный электрод», в результате чего существует эквивалентность ролей образца и вспомогательного электрода, которые поочередно выступают то анодом, то катодом при смене полярности напряжения. Это позволяет исключить вспомогательный электрод, заменив его на партию изделий, аналогичную обрабатываемой. Форма падения напряжения на обрабатываемых изделиях в этом случае будет являться суперпозицией напряжений на «анодно-включенных» и «катодно-включенных» деталях. Средняя плотность тока рекомендуется в пределах от 8 до 12 А/дм2.
Использование дополнительных веществ в составе электролита преследует несколько целей. Так, добавление гидроксида натрия способствует стабилизации процесса формирования оксидного слоя на титане, позволяет расширить диапазон электрических параметров процесса и времени обработки. Кремний-содержащие, силикат натрия и жидкое стекло, способствуют введению в состав покрытия оксида кремния, который в силу его низкой температуры плавления выступает связующим компонентом в покрытии по аналогии с керамическими материалами. Помимо этого, соединения кремния являются активаторами регенерации соединительной ткани в организме, показаны при лечении остеохондроза, артрита и артроза. С учетом частичной резорбции поверхностных слоев покрытия в процессе функционирования имплантата, выход кремния в окружающую ткань будет способствовать скорейшему заживлению раны и интеграции имплантата в организме. Гидрофосфат натрия способствует образованию крупных пор в покрытии, увеличивает его толщину. Кроме того, предлагаемое сочетание компонентов электролита позволяет снизить концентрацию наноструктурного гидроксиапатита, являющегося дорогостоящим компонентом.
Концентрации компонентов электролита играют решающую роль в обеспечении качества получаемого покрытия. На основании экспериментальных исследований отклонения от указанных значений концентрации компонентов электролита были ограничены значением±10%. Так, например, уменьшение содержания силиката натрия на 1/3 приводит к ухудшению износоустойчивости покрытия в четыре раза, а аналогичное уменьшение концентрации гидроксида калия снижает износоустойчивость в семь раз. Уменьшение концентрации фосфата натрия и гидроксида натрия приводит к увеличению содержания титана в покрытии, прирост веса покрытия в процентах снижается, практически, эквивалентно. Также эквивилентно с увеличением концентрации ГАП увеличивается содержание кальций-фосфатных соединений в покрытии, но износоустойчивость покрытия падает с двойной скоростью. Таким образом, отклонения концентраций компонентов электролита не позволяют достичь заявленный результат - получение биосовместимого покрытия, имеющего состав, близкий к составу натуральной кости по соотношению кальций/фосфор.
Предлагаемое изобретение иллюстрируется чертежами, приведенными на фигурах:
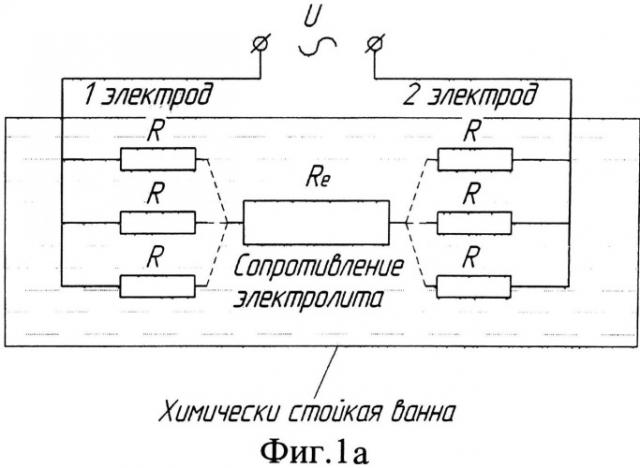
Фиг.1а. Электрическая схема подключения оксидируемых заготовок к источнику тока в предложенном режиме.
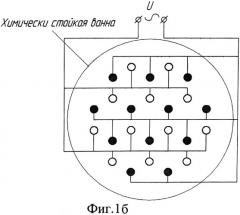
Фиг.1б. Вариант расположения заготовок в химической ванне.
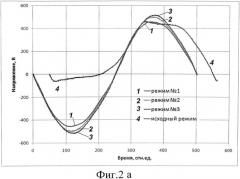
Фиг.2а. Осциллограмма зависимости величины напряжения от времени при использовании предложенного способа и способа с применением вспомогательного электрода, зафиксированная на 10-й минуте обработки.
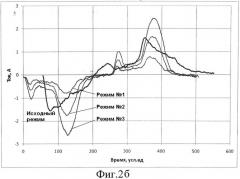
Фиг.2б. Осциллограмма зависимости величины тока от времени при использовании предложенного способа и способа с применением вспомогательного электрода, зафиксированная на 10-й минуте обработки Пример.
В качестве модели имплантата были взяты образцы титанового сплава ВТ 1-0 в ультрамелкозернистом состоянии в виде таблеток о20 мм с площадью поверхности каждого образца 7,3 см2, которые проходили предварительную механическую очистку поверхности и отмывку в органическом растворителе и дистиллированной воде.
Химически стойкую непроводящую ванну заполняли электролитом следующего состава: 2 г/л гидроксида калия КОН, 1 г/л гидроксида натрия NaOH; 5 г/л гидрофосфата натрия Na2HPO4×12H2O; 5 г/л жидкого стекла nNa2O·mSiO2 (М=3,2); 8 г/л метасиликата натрия Na2SiO3×9H2O; коллоидный раствор наноструктурного гидроксиапатита - 1,5 г/л из расчета сухого вещества и дистиллированная вода - остальное.
Закрепляли один образец к клемме для обрабатываемой детали, другой - к клемме вспомогательного электрода и помещали в электролит.
Микродуговое оксидирование по предложенному способу проводили для трех различных плотностей тока, а также проводили обработку по стандартному способу, где в роли вспомогательного электрода использовали ванну из нержавеющей стали. Процесс проводили в течении 30 минут. Затем образцы извлекали из ванны и отмывали в дистиллированной воде при 60°С от остатков электролита с применением ультразвуковой ванны.
Покрытие всей поверхности каждого образца, обработанного по предложенному способу, было идентичным по толщине, внешнему виду и элементному составу.
В таблице 1 приведены некоторые параметры процесса и характеристики полученного покрытия.
| Таблица 1 | |||||||
| Сравнительные параметры процессов оксидирования и некоторые характеристики полученных покрытий. | |||||||
| Режим (Время обработки 30 минут) | Амплитуда напряжения к окончанию процесса Uамп, В | Средний ток процесса Iср, А/образец (расчет по осциллограмме) | Содержание основных элементов на поверхности покрытия, %Ат (EDS-анализ) | Соотношение Са:Р в покрытии | |||
| Si | Са | Р | Ti | ||||
| №1 | 470 | 0,3 | 17,3 | 4,9 | 2,4 | 16,9 | 2,1 |
| №2 | 510 | 0,5 | 16,8 | 5,8 | 3,5 | 15,5 | 1,7 |
| №3 | 530 | 0,8 | 17,2 | 8,8 | 5,5 | 10,8 | 1,6 |
| Исходный | 480* | 0,5* | 17,6 | 7,7 | 5,1 | 11,5 | 1,5 |
| *В качестве амплитудного напряжения и среднего тока для стандартного |
режима взято значение для анодной полуволны Ua амп и Iа ср.
Как видно из приведенной таблицы, наилучшее сочетание свойств покрытия получено при проведении предложенного способа по режиму №3, где соотношение Са:Р в покрытии близко к требуемому, и при этом содержится достаточное количество кремния и наименьшее количество титана.
При нанесении покрытия на партии образцов, состоящие из двух и более штук, образцы в пределах партии соединяются параллельно, как и в способах с применением вспомогательного электрода. Электрическая схема электролитической ячейки для такого случая показана на Фиг.1-а: отдельные образцы обозначены как сопротивление с номиналом R, имеющим нелинейную вольт-амперную характеристику. При расположении партий с большим количеством образцов в электролитической ванне желательно соблюдать чередование образцов от разных партий, как это показано на Фиг.1-б.
Таким образом, при реализации предложенного способа, поставленная задача получения биосовместимого покрытия повышенной химической чистоты и биоактивности достигнута. Полученное покрытие имеет состав, близкий к составу натуральной кости по соотношению кальций/фосфор и достаточное количество кремния, способствующего активации процессов интеграции имплантата в кость, при этом исключена возможность попадания в покрытие продуктов химической и электрохимической коррозии, относящихся к токсичным веществам, за счет исключения из процесса вспомогательного электрода.
СПИСОК ЛИТЕРАТУРЫ
1. Патент РФ №2159094 (С1) Опубл. 20.11.2000 / Способ нанесения покрытия на имплантат из титана и его сплавов // Карлов А.В., Шахов В.П., Игнатов В.П., Верещагин В.И.
2. Патент РФ №2206642 (С2) Опубл. 31.01.2000 / Способ модифицирования поверхности медицинских изделий (варианты) // Мамаев А.И., Мамаева В.А., Выборнова С.Н.
3. Патент РФ №2194536 (С2). Опубл. 20.12.2002 / Способ формирования биоактивного покрытия на имплантат // Клименов В.А., Шепель В.М., Ботаева Л.Б., Трофимов В.В., Федчишин О.В.
4. Патент РФ №2363775 (С1). Опубл. 10.08.2009 / Способ получения покрытий на изделиях, выполненных из титана и его сплавов // Ковалева М.Г., Колобов Ю.Р., Сирота В.В., Храмов Г.В.
5. Туфанов Д.Г. Коррозионная стойкость нержавеющих сталей, сплавов и чистых металлов. - М.: Металлургия, 1990. - 319 с.
6. Иванов М.Б. Исследование коррозионной стойкости микродуговых кальций-фосфатных покрытий на титане ВТ1-0 в биологических средах. / Иванов М.Б., Лазебная М.А., Колобов Ю.Р., Храмов Г.В., Волковняк Н.Н., Колобова Е.Г. // Нано- и микросистемная техника. - 2011. - №4. - С.31-37.
7. Р.Х.Камалов. Сравнительный анализ структуры поверхности и ее химического состава у разных систем дентальных имплантатов и их влияние на уровень сенсибилизации организма. / Р.Х. Камалов, А.Н. Лихота, В.В. Коваленко, Е.В. Горобец, Н.И. Кинчур, В.А. Тиньков, Е.В. Розова. // Клиническая стоматология. - 2011. - №2.
8. Immunologic mechanisms in hypersensitivity reactions to metal ions: an overview. / L. Budinger, M. Hertl // Allergy. - 2000. - №55. - C.108-115.
9. N. Patel, S.M. Best, W. Bonfield et al. A comparative study on the in vivo behavior of hydroxyapatite and silicon substituted hydroxyapatite granules. Journal of materials science: Materials in medicine 13 (2002), p.1199-1206.
10. N. Patel et al. In vivo assessment of hydroxyapatite and silicate-substituted hydroxyapatite granules using an ovine defect model. Journal of materials science: Materials in medicine 16 (2005), p.429-440.
Способ получения биосовместимого покрытия на стоматологических имплантатах, выполненных из титана и его сплавов, включающий помещение изделий в водный раствор электролита, содержащий гидроксид калия и наноструктурный гидроксиапатит в виде водного коллоидного раствора, возбуждение на поверхности изделий микродуговых разрядов, отличающийся тем, что оксидирование обрабатываемых изделий осуществляют в химически стойкой непроводящей ванне; в раствор электролита помещают одновременно две партии обрабатываемых изделий, предварительно закрепив изделия одной партии к клеммам для обрабатываемых деталей, изделия другой партии - к клеммам вспомогательного электрода; а электролит дополнительно содержит гидроксид натрия, гидрофосфат натрия, натриевое жидкое стекло, метасиликат натрия, в следующих соотношениях, из расчета массы сухого вещества, грамм на литр состава:гидроксид калия KOH 2гидроксида натрия NaOH 1гидрофосфата натрия Na2HPO4·12H2O 5жидкое стекло nNa2O·mSiO2 (М=3,2) 5
| метасиликат натрия Na2SiO3·9H2O | 8 |