Способ получения биологически активной субстанции из крови кур для активации пролиферации недифференцированных клеток костного мозга человека
Иллюстрации
Показать всеИзобретение относится к медицине и клеточной биотехнологии. Для получения биологически активной субстанции после электростимуляции куриных голов в режиме 100-120 В, силой тока 3-5 А в течение 3-5 секунд осуществляют забор и инкубацию крови. Затем отделяют сыворотку. Выделяют из нее полипептидную фракцию с молекулярной массой 150-170 кДа. Полученную пептидную фракцию лиофилизируют и стерилизуют путем облучения в линейном ускорителе электронов с дозой 28-32 кГр. Технический результат заключается в сохранении способности недифференцированных клеток костного мозга к дифференцировке в организме пациента за счет исключения ингибирующего влияния стимулирующего пролиферацию агента, повышении скорости пролиферации недифференцированных клеток костного мозга человека, снижении осложнений, обусловленных иммуногенностью стимулирующего пролиферацию агента, при использовании полученного с помощью предложенного способа средства; а также в удешевлении, упрощении способа за счет использования доступного сырья. Изобретение может быть использовано для получения средства, обеспечивающего стимуляцию пролиферации недифференцированных клеток костного мозга человека, которое может найти применение при лечении онкогематологических и аутоиммунных заболеваний. 2 табл., 3 ил.
Реферат
Изобретение относится к медицине, клеточной биотехнологии, может быть использовано для получения средства, обеспечивающего стимуляцию пролиферации недифференцированных клеток костного мозга человека, которое, в свою очередь, может найти применение при лечении онкогематологических и аутоиммунных заболеваний.
Известно, что недифференцированные клетки костного мозга (в основном имеющие маркеры CD34+CD133+Lin-), введенные больному после культивирования в условиях ex vivo, способствуют восстановлению поврежденной ткани и оказывают терапевтический эффект на больной орган (И.А. Демидова и соавт. Аллогенная трансплантация гемопоэтических стволовых клеток в режимах пониженной интенсивности у больных гемобластозами. Терапевтический архив. - N7. - С.48-52, 2007; Herzog EL, Van Arnam J, Hu B, Krause DS. Threshold of lung injury required for the appearance of marrow-derived lung epithelia. Stem Cells 2006;24:1986-1992.; Coraux C, Nawrocki-Raby B, Hinnrasky J, Kileztky C, Gaillard D, Dani C, Puchelle E. Embryonic stem cells generate airway epithelial tissue. Am J Respir Cell Mol Biol 2005; 32:87-92.).
Однако количество этих клеток в костном мозге человека не превышает 0,15-0,5%. Исходя из вышеизложенного, становится понятным, что стимуляция пролиферации недифференцированных клеток костного мозга в условиях ex vivo, способных к последующей дифференцировке в организме пациента весьма актуальна.
Известен способ повышения пролиферации недифференцированных клеток костного мозга (патент RU №2360965), основанный на использовании смесей, содержащих цитокины, которые стимулируют пролиферацию клеток, и ингибиторы, подавляющие их дифференцировку, как равнозначные агенты стимуляции роста клеток.
Использование ингибиторов в указанном способе является существенным недостатком, т.к. в последующем они могут влиять на жизнеспособность и дифференцировку клеток в условиях in vivo. Кроме того, в этом способе не удается достигнуть больших скоростей роста клеток.
Известно также, что введение в организм модификаторов, в частности, нативной гиалуронидазы (Гильдберг Е.Д. и соавт. Бюл. эксп. биол. И медицины, 2007, №12, с.652-656.; патент RU №2330674) или иммобилизированной на низкомолекулярном полиэтиленгликоле гиалуронидазы (патент RU №2442601) может стимулировать пролиферацию недифференцированных клеток костного мозга.
Недостатками указанных средств для стимуляции пролиферации недифференцированных клеток костного мозга являются побочные эффекты и осложнения, связанные с иммуногенностью гиалуронидазы, представляющей собой вещество белковой природы.
В доступной литературе нами не найдено сведений о средствах для повышения пролиферации недифференцированных клеток костного мозга человека, созданных на основе сыворотки крови.
Задачей данного изобретения было получение биологически активной субстанции из сыворотки крови кур для стимуляции пролиферации недифференцированных клеток костного мозга человека ex vivo.
Расширение арсенала источников, из которых может быть получена биологически активная субстанция, с привлечением доступного сырья способствует ее удешевлению.
Технический результат заключается в сохранении способности недифференцированных клеток костного мозга к дифференцировке в организме пациента за счет исключения ингибирующего влияния стимулирующего пролиферацию агента, повышении скорости пролиферации недифференцированных клеток костного мозга человека, снижении осложнений, обусловленных иммуногенностью стимулирующего пролиферацию агента, при использовании полученного с помощью предложенного способа средства; а также в удешевлении, упрощении способа за счет использования доступного сырья.
Нами установлено, что микрофильтрация электрошоковой сыворотки крови кур через мембрану с диаметром отверстий 800 нм позволяет выделить из нее пептидную фракцию, обеспечивающую стимуляцию (активацию) пролиферации недифференцированных клеток костного мозга человека (стволовых клеток).
Сущность изобретения состоит в следующем.
Для получения биологически активной субстанции из крови кур, обеспечивающей активацию пролиферации недифференцированных клеток костного мозга человека проводят электростимуляцию голов кур в режиме 100-120 В, 3-5 А, в течение 3-5 секунд, после чего осуществляют забор и инкубацию крови. Затем отделяют сыворотку. Выделяют из нее пептидную фракцию с молекулярной массой 150-170 кДа. Полученную пептидную фракцию лиофилизируют и стерилизуют путем облучения в линейном ускорителе электронов (ЛУЭ) с дозой 28-32 кГр.
Способ осуществляется следующим образом.
Для получения биологически активной фракции используют кровь кур.
Проводят электростимуляцию их голов в режиме 100-120 В, 3-5 А, в течение 3-5 секунд.
После чего кровь собирают самотеком в полиэтиленовые флаконы после перерезки сонных артерий и вен. Собранную кровь инкубируют при температуре 4-8°С в течение 18-24 часов, а затем отсасывают сыворотку и центрифугируют при 10000 об/мин в течение 3-5 мин.
Далее для выделения из сыворотки пептидной фракции с молекулярной массой 150-170 кДа полученную сыворотку подвергают микрофильтрации.
Микрофильтрация может быть проведена с использованием, например, отечественной установки «УФА» (фирмы «Эмбора») через мембрану с диаметром отверстий 800 нм.
Лиофилизацию проводят способом мягкой сушки, при котором полученную пептидную фракцию замораживают, а потом помещают в вакуумную камеру, где и происходит возгонка жидкости. Далее проводят ее стерилизацию путем облучения в линейном ускорителе электронов (ЛУЭ), например «Электроника 10-10», с дозой 28-32 кГр.
В результате получают биологически активную субстанцию с молекулярной массой 150-170 кДа.
Приводим конкретный пример получения биологически активной субстанции из крови кур для активации пролиферации недифференцированных клеток костного мозга человека.
Для получения сыворотки использовали кровь 1500 кур во время их планового забоя на птицефабрике сразу после перерезки артерий. Перед забором крови проводили электростимуляцию их голов в режиме 110 В, 4 А, в течение 4 секунд.
Кровь собирали в пластиковые емкости и затем инкубировали при низкой температуре 6°C в течение 24 часов, отсасывали сыворотку и центрифугировали при 10000 об/мин в течение 4 мин. Далее для выделения пептидной фракции с молекулярной массой 150-170 кДа полученную сыворотку подвергали микрофильтрации. Микрофильтрацию проводили с использованием отечественной установки «УФА» (фирмы «Эмбора») через мембрану с диаметром отверстий 800 нм.
Затем проводили лиофилизацию полученной пептидной фракции способом мягкой сушки, при котором ее замораживали, а потом помещали в вакуумную камеру. Далее стерилизовали в режиме 30 кГр путем облучения на ЛУЭ, например «Электроника 10-10».
В результате получили биологически активную субстанцию с молекулярной массой 150-170 кДа. Полученную таким образом субстанцию хранили при температуре 4-8°C.
Для доказательства возможности реализации заявленного назначения и достижения указанного технического результата приводим следующие данные.
Нами были проведены следующие экспериментальные исследования.
В работе были использованы недифференцированнные клетки костного мозга, выделенные из образцов костного мозга (КМ) здоровых доноров.
КМ доноров, в объеме 3-5 мл, помещали в стерильные пластиковые пробирки («Corning»), содержащие 1 мл среды RPMI и 300 ЕД гепарина с соблюдением правил асептики. После забора образцы хранили при комнатной температуре и использовали для дальнейшего анализа в течение последующих 24 часов. Мононуклеарная фракция (МНФ) выделялась на градиенте плотности Фикол 1077.
За основу метода был взят МТТ-анализ (Mosmann Т. J. Immunol. Meth., 55-63, 1965.) по методике лаборатории онкогематологии и иммунологии госпиталя Свободного Университета Амстердама (Veerman AJP, 1990; Kaspers GJL, 1993), которая была модифицирована в лаборатории регуляции кроветворения ФГУ ФНКЦ ДГОИ Минздравсоцразвития России (Астрелина Т.А. и соавт. Гематология и трансфузиология, Т.47, №4, стр.3-7, 2002).
Недифференцированные клетки костного мозга ресуспендировали до концентрации 2×106/мл в полной среде. Суспензию клеток в соответствии со схемой проведения теста по 80 мкл равномерно распределяли по лункам 96-луночной планшеты, содержащим различные разведения тестируемых пептидных фракций в объеме 20 мкл с дублированием каждого образца, а также по ряду лунок с 20 мкл среды RPMI (контроль жизнеспособности).
Лунки «бланк» содержали по 20 мкл неполной среды RPMI и 80 мкл полной среды.
Использовалось 6 концентраций пептидов с 4-кратным шагом разведения. Каждый образец дублировали. В таблице 1 представлена шкала используемых концентраций пептидной фракции, полученной по предложенн
| Таблица 1 | ||||||
| Препарат | Концентрации биологически активной субстанции | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | |
| Биологически активная субстанция | 1 мг/мл | 0,2 мг/мл | 0.04 мг/мл | 0,008 мг/мл | 0,0016 мг/мл | 0,00032 мг/мл |
Планшеты инкубировали во влажном инкубаторе с 5%-ным содержанием CO2 в течение 4 суток при температуре 37°C.
По окончании инкубации в каждую лунку планшета добавляли по 10 мкл раствора МТТ (3-[4,5-dimethilthiazol-2-yl]-2,5-diphenyl tetrazolium bromide), разведенный 0,9% NaCl до концентрации 5 мг/мл. После встряхивания планшет на платошейкере проводили инкубацию в течение 6 часов во влажном инкубаторе с 5%-ным содержанием CO2 при температуре 37°C.
Кристаллы формазана, образовавшиеся по окончании инкубации, растворяли добавлением 100 мкл изопропанола с 2N HCl (Isopropyl alcohol, ICN). Содержимое каждой лунки тщательно перемешивали.
Определяли оптическую плотность опытных и контрольных образцов на ридере (Microplate Reader, model 550, Bio-Rad) при длине волны 550 нм.
ОПОЛ - оптическая плотность опытных лунок, ОПКЛ - оптическая плотность контрольных лунок. В качестве ОПОЛ брали среднее арифметическое оптических плотностей 14 дублей каждой концентрации полученной пептидной фракции, а в качестве ОПКЛ - среднее арифметическое оптической плотности лунок, содержащих среду с недифференцированными клетками костного мозга человека без указанной полипептидной фракции. Затем строили график зависимости выживаемости от концентрации пептидной фракции.
Колониеобразующую активность определяли культивированием в течение 14 суток в метилцеллюлозе (готовая среда, содержащая фактор роста «MethoCult4338, StemCellTeynologies, Canada) с подсчетом KOE-mix>, КОЕ-ГМ, КОЕ-М, КОЕ-Э.
Эффективность клонировании (ЭК) определяли как общее число КОЕ на 1×10 эксплантированных клеток костного мозга.
Для определения абсолютного количества гемопоэтических предшественников в 1 мл костного мозга, полученные величины эффективности клонирования умножали на число миелокариоцитов в 1 мл костного мозга.
Статистическая обработка полученных результатов
По результатам МТТ-теста проводили статистический анализ значений оптической плотности раствора. Было выявлено, что распределение этих величин в исследуемом поле не соответствует критериям параметрического анализа и для оценки средних значений использовалась величина медиана. Для определения достоверности различий между группами применяли непараметрический критерий Манна-Уитни.
Статистическая компьютерная обработка полученного материала проводилась в программах Microsoft Excel, Statistica 6.0. Различия считались статистически значимыми при p<0.05.
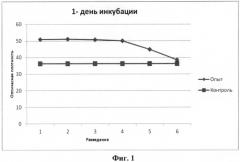
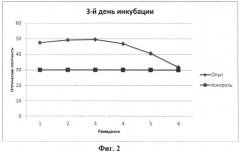
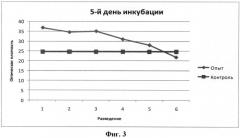
Результаты, представленные на фигурах 1-3, свидетельствуют о том, что полученная пептидная фракция стимулирует пролиферацию недифференцированных клеток костного мозга.
Так уже в первый день инкубации (фиг.1), оптическая плотность в опытных образцах (с пептидами) была достоверно выше (p<0.05), чем в контрольных (без пептидов) в среднем на 38%.
На 3-й день инкубации (фиг.2) оптическая плотность в опытных образцах соответствовала показателям 1-го дня исследования, в тоже время этот показатель в контрольной группе заметно снизился. Оптическая разница между опытной и контрольной группами в среднем составила 67% (p<0,01). Последний факт свидетельствует, что полученная биологически активная субстанция сыворотки крови не только повышает пролиферацию недифференцированных клеток костного мозга, но и защищает их от гибели.
На 5-й день (фиг.3) исследования оптическая плотность, как в опытных образцах, так и контрольных заметно снизилась. Такой результат ожидаем и естественен, т.к. исследования проводились не на «ростовой», а на «тестовой» среде. Однако, в опытных образцах оптическая плотность была достоверно выше (p<0,01), чем в контрольных в среднем на 70%.
Статистически достоверный эффект (p<0,05) наблюдается при высоких концентраций (0,008-1,00 мг/мл), а наиболее значимый (p<0,01) на 3 сутки исследования (фиг.3).
Колониеобразующую активность тестируемой биологически активной субстанции сыворотки крови, полученной по предложенному способу, определяли культивированием в течение 14 суток.
Результаты, касающиеся влияния субстанции на пролиферацию клеток костного мозга, которые представленны в таблице 2, свидетельствуют о существенном и достоверном увеличении клеток костного мозга в опытном исследовании. Наиболее значимые значения касаются КОЕ-Г (+62,5%), КОЕ-М (+83,3%) и КОЕ-Г (+87,5).
| Таблица 2 | ||||||
| Влияние субстанции на пролиферацию клеток костного мозга | ||||||
| Вид колоний | Количество без пептидов | Количество с пептидами | % | |||
| Большие колонии | Малые + кластеры | Большие колонии | Малые + кластеры | Большие колонии | Малые + кластеры | |
| KOE-mix | 17 | 11 | 24 | 11,5 | +41,2 | +4,5 |
| КОЕ-ГМ | 11,5 | 11 | 16 | 9 | +39,1 | -8,2 |
| КОЕ-Г | 8 | 9,5 | 13 | 9 | +62,5 | -5,2 |
| КОЕ-М | 6 | 7 | 11 | 6,5 | +833 | -7,1 |
| КОЕ-Э | 8 | 11,5 | 15 | 9 | +87,5 | -21,7 |
Полученные результаты свидетельствуют о том, что исследуемая фракция повышает не только пролиферацию недифференцированных клеток костного мозга, но и их выживаемость (то есть обеспечивает их защиту). Наиболее значимый эффект был достигнут при концентрациях полученной нами биологически активной субстанции - от 0,008 до 1,0 мг/мл.
Таким образом, предложенный способ позволяет получить биологически активную субстанцию из крови кур, которая обеспечивает большую скорость пролиферации недифференцированных клеток костного мозга человека.
При этом сохраняется способность недифференцированных клеток костного мозга к дифференцировке в организме пациента, поскольку исключено ингибирующее влияние стимулирующего пролиферацию агента.
Кроме этого, предлагаемый нами способ практически исключает возможность возникновения каких-либо аллергических осложнений, т.к. пептиды не обладают иммуногенностью (И.П. Ашмарин, Нейрохимия. М., 1996 г).
Предлагаемый способ предполагает использование доступного сырья: технология заготовки куриного мяса предполагает удаление крови, которая может быть в нем использована.
Способ получения биологически активной субстанции из крови кур для активации пролиферации недифференцированных клеток костного мозга человека, в котором перед забором крови кур проводят электростимуляцию их голов в режиме 100-120 В, 3-5 А, в течение 3-5 с, после чего осуществляют забор и инкубацию крови, отделяют сыворотку, выделяют из нее пептидную фракцию с молекулярной массой 150-170 кДа, которую лиофилизируют и стерилизуют путем облучения в линейном ускорителе электронов с дозой 28-32 кГр.