Способ диагностики вируса инфекционного некроза поджелудочной железы лососевых методом полимеразной цепной реакции
Иллюстрации
Показать всеИзобретение относится к области молекулярной биологии и ветеринарии и предназначено для диагностики вируса инфекционного некроза поджелудочной железы лососевых. Осуществляют два раунда полимеразной цепной реакции с праймерами B37-B853r и B123-B320r для выявления фрагмента сегмента В, кодирующего РНК-зависимую РНК-полимеразу вируса инфекционного некроза поджелудочной железы с последующим электрофоретическим определением размера амплифицируемого фрагмента нуклеотидной последовательности. По наличию на электрофореграмме фрагментов длиной 860 и/или 240 пн в исследуемом образце диагностируют вирус инфекционного некроза поджелудочной железы лососевых. Предлагаемое изобретение применимо в диагностических исследованиях в научно-исследовательских институтах, ветеринарных лабораториях, рыбоводческих хозяйствах. 2 ил., 3 табл., 3 пр.
Реферат
Предлагаемое изобретение относится к области биотехнологии, молекулярно-генетической диагностики вирусных болезней животных, научных исследований в ветеринарии и молекулярной биологии.
Инфекционный некроз поджелудочной железы (Infectious pancreatic necrosis virus, IPNV) - высококонтагиозная вирусная болезнь, поражающая молодь культивируемых лососевых и некоторых видов рыб других семейств, обитающих как в пресной, так и в морской воде. Вирус инфекционного некроза поджелудочной железы наносит существенный экономический ущерб рыбоводческим хозяйствам РФ.
В комплексе мероприятий по оздоровлению хозяйств от вируса инфекционного некроза поджелудочной железы ведущее место принадлежит диагностике. Отсутствие коммерчески доступных диагностикумов на отечественном рынке вызвало необходимость создания тест - системы для идентификации IPNV методом полимеразной цепной реакции.
В настоящее время совершенствование методов диагностики IPNV крайне необходимо поскольку традиционные методы выделения вируса в культурах клеток не всегда позволяют идентифицировать вирус и занимают длительное время.
Принцип ПЦР заключается в многократном увеличении (амплификации) определенного участка ДНК выявляемого объекта путем его копирования с помощью фермента ДНК-полимеразы и специфических праймеров. Поскольку геном IPNV представлен двухцепочечной молекулой РНК в виде двух сегментов А и В, предварительно - перед постановкой ПЦР-РНК переводят в кДНК благодаря ферменту обратной транскриптазе. Специфические праймеры (прямой и обратный) ограничивают определенный фрагмент нуклеотидной последовательности таким образом, что элонгация новой цепи кДНК при обратной транскрипции и последующей амплификации в ПЦР происходит только между ними. Основными параметрами эффективного прохождения реакции амплификации, обеспечивающими специфичность и чувствительность, являются правильный выбор области генома идентифицируемого агента, структура и температурный режим отжига олигонуклеотидных праймеров.
Известны способы выявления фрагмента генома вируса инфекционного некроза поджелудочной железы лососевых методом ПЦР с использованием праймеров к сегменту А [1].
Также описан способ выявления РНК вируса инфекционного некроза поджелудочной железы методом «гнездовой» ПЦР (nested-PCR) с праймерами к сегменту А, которые имеют следующую структуру:
1 5'-CCAAACCAACAGGTCCTATCCTAC-3' (внешний прямой)
2 5'-TGATGCCGTTGTTCTCATCAGCTG-3' (внешний обратный)
3 5'-GAAGGAGATGACATGTGCTACACC-3' (внутренний прямой праймер с биотинилированной меткой на 5'-конце)
4 5'-GAGAGATGTGTTTGCCACCATCTC-3' (внутренний обратный)
Фрагмент, полученный в первом раунде ПЦР, служит матрицей во втором раунде ПЦР. Во втором раунде используется два меченых праймера: один имеет биотинилированную метку на 5'-конце, другой содержит радиоактивную метку 32P. Разделение ампликонов проходит с использованием магнитных частиц с последующей детекцией уровня радиоактивного излучения [2].
Известные способы выявления фрагментов генома вируса инфекционного некроза поджелудочной железы не лишены недостатков: использование радиоактивной метки требует соблюдения специальных мер безопасности и лицензирования лаборатории, в способе, предложенном K. Williams et al., амплифицируется фрагмент гена VP2, характерный для всех бирнавирусов, что не исключает возможность ложноположительных результатов. Описанные в литературе праймеры подобраны к генам сегмента А. В то же время установлено, что изоляты IPNV, выделенные из разных географических мест, отличаются высоким генетическим разнообразием, главным образом, обусловленным вариабельностью генов, кодируемых именно сегментом А. В этой связи высока вероятность того, что праймеры к сегменту А могут не подойти к вновь изолированным вирусам с измененным генотипом. В первую очередь это касается изолятов из водоемов тех регионов, где исследование на присутствие IPNV ранее не проводилось.
Для идентификации возбудителя методом ПЦР целесообразно использовать праймеры к наиболее консервативной области генома. В случае IPNV это может быть сегмент В, кодирующий ключевой фермент репликации вирусного генома РНК-зависимую РНК-полимеразу.
В задачу исследований входило - разработка эффективного способа обнаружения фрагменов генома вируса инфекционного некроза поджелудочной железы лососевых методом гнездовой ПЦР с использованием 4 специфических олигонуклеотидных праймеров.
Первоочередной задачей было конструирование четырех специфических праймеров к IPNV, которые являются главным компонентом ПЦР и обеспечивают ее специфичность и чувствительность.
Для выбора праймеров был использован сегмент В - в то время как в публикациях преимущественно описаны праймеры к сегменту А. При конструировании праймеров и оценке их специфичности использовали нуклеотидные последовательности и программу BLAST, доступные в Интернете на сайте NCBI Предложенный способ заключается в следующем: с помощью компьютерной программы DNASTAR (Lasergene Co., США) на основании программы, предоставленной в базах данных Интернет ресурсов GenBank(CLUA), по генотипам вируса инфекционного некроза поджелудочной железы выбирают рефернс - последовательность NC_001916 штамма Jasper. Праймеры проверяют на отсутствие гомологии с последовательностями других вирусов и генома человека программой BLAST с помощью веб-ресурса Национального центра биотехнологической информации (http://www.ncbi.nlm.nih.gov/). На основании проведенного компьютерного анализа была подобрано 2 пары праймеров: внешние B37 и B853r и внутренние B123 и B320r.
| Название | 5'--3' | длина |
| B37 | ACG TTG GTG GCA CCC GAC АТА С | 22 |
| B123 | TGT CGG АСА ТСТ ТСА ACT CAC С | 22 |
| B320r | CAG TCG AGGCAG AGCGGC АТС | 21 |
| B853r | GTG ТСТ ССТ TTGGTT TTGCCT ATG | 24 |
Синтез разработанных олигонуклеотидных праймеров заказывается в коммерческом сервисном центре.
Четыре праймера к сегменту В были подобраны таким образом, что позволяют применить технику гнездовой и полугнездовой ПЦР, а также могут быть использованы для секвенирования.
Праймеры имеют следующую характеристику: комлементарность выбранной области гена сегмента В, отсутствие самокомлементарных участков внутри каждого праймера и между прямым и обратным, фланкируют область фрагментов гена В размером 860 пн и ≈240 пн, соответственно. Синтез разработанных олигонуклеотидных праймеров заказывается в коммерческом сервисном центре.
Пример 1
Амплификация специфических фрагментов кДНК вируса инфекционного некроза поджелудочной железы лососевых с помощью разработанных праймеров для диагностики болезни.
В процессе проведения практических экспериментов подбирают оптимальные условия прохождения полимеразной цепной реакции с разработанными праймерами.
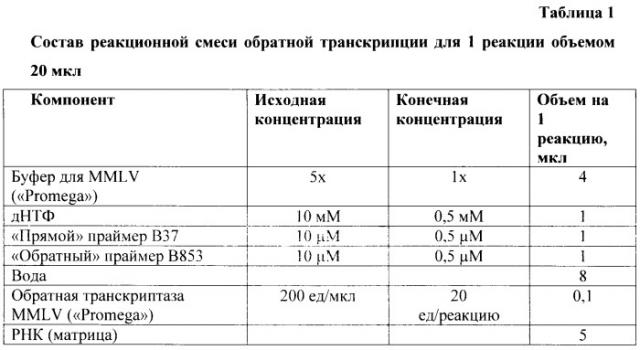
Предварительно проводят реакцию обратной транскрипции с парой внешних праймеров. Реакция обратной транскрипции проходит при 42° в течение 45 минут, затем полученную кДНК прогревают при 95° в течение 3 минут и используют для постановки ПЦР. Состав реакционной смеси указан в таблице 1. В качестве положительного контроля на стадии обратной транскрипции и ПЦР используют эталонные штаммы IPN (предоставлен доктором E. Neuvonen, Ветеринарный институт, Хельсинки, Финляндия. Предварительно штамм был испытан методом ИФА), в качестве отрицательного - воду или среду для культур клеток (например, Игла MEM).
Полимеразную цепную реакцию проводят в объеме реакционной смеси 25 мкл на 1 пробу ДНК.
Состав реакционной смеси представлен в таблице 2. Температурно-временной режим проведения реакции для амплификатора «Терцик» («ДНК-технология», Россия) представлен в таблице 3. Условия амплификации и реакционной смеси для первого и второго раунда одинаковые.
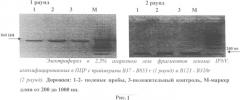
После проведения реакции амплификации продукты ПЦР анализируют методом электрофоретического разделения в 2% агарозном геле с добавлением бромистого этидия.
В процессе ПЦР были получены продукты амплификации кДНК вируса инфекционного некроза поджелудочной железы размером около 860 пн в первом раунде ПЦР и 240 пн во втором раунде ПЦР, что подтверждалось во всех экспериментах. Электрофореграмма результатов ПЦР представлена на рис.1. При учете результатов ПЦР в первую очередь оценивали контрольные образцы. В электрофоретической дорожке с положительным контрольным образцом (K+) присутствовала светящаяся полоса на уровне соответствующем фрагменту длиной 860 или 240 пн (в первом и втором раунде, соответственно; оценивали по маркеру М).
Опытные пробы оценивали по наличию в соответствующей дорожке специфической полосы, которая в положительных образцах располагалась на том же уровне, что и полоса в положительной контрольной пробе. В отрицательных пробах полоса отсутствовала (рис.2).
Пример 2
Определение чувствительности реакции амплификации с использованием разработанных специфических олигонуклеотидных праймеров.
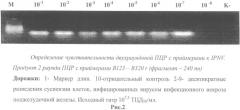
Анализировали десятикратные разведения инфицированной IPNV суспензии клеток с исходным титром 7,5 lg ТЦД50/мл. (107,5 ТЦД50/мл).
При проведении «гнездовой» ПЦР последним разведением, в котором обнаруживалась специфическая полоса, было разведение 10-7, что соответствует 0,5 lg ТЦД50/мл или ~3 ТЦД50/мл. Электрофореграмма результатов ПЦР представлена на Рисунке 2.
Пример 3
Определение специфичности реакции амплификации с использованием разработанных специфических олигонуклеотидных праймеров.
Специфичность праймеров проверяли на образцах вируса инфекционного некроза гемопоэтической ткани, вируса инфекционного некроза поджелудочной железы и вируса геморрагической септицемии лососевых. Специфическая полоса была выявлена только в случае наличия в пробе вируса инфекционного некроза поджелудочной железы.
Предложенный вариант апробирован с положительным результатом и регулярной воспроизводимостью в 2010-2011 годах на 500 пробах, полученных из гомогената внутренних органов рыб, поступивших из хозяйств Московской, Рязанской областей и республики Карелия, а также инфицированных клеточных культур.
Предлагаемое изобретение найдет применение в диагностических исследованиях в научно- исследовательских институтах, ветеринарных лабораториях, рыбоводческих хозяйствах.
Литература
1. Wiliams K., Blake S., Sweeney A., Singer J.T., Nicholson B.L. // Multiplex Reverse transcriptase PCR assay for simultaneous detection of three fish viruses // J of clinical microbiology. - 1999. - V.37 (№12). - Р.4139-4141.
2. Rimstad E., Homes E., Olsvik O., Hyllseth B. // Identification of a double-stranded RNA virus by using polymerase chain reaction and magnetic separation of the synthesized DNA segments // J of clinical microbiology - 1990 -. V.28 (№10). - Р.2275-2278.
Сущность изобретения поясняется таблицами и рисунками, в которых отображается следующая информация:
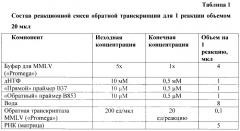
| Таблица 2 | |||
| Состав реакционной смеси для проведения ПЦР для 1 реакции объемом 25 мкл | |||
| Компоненты ПЦР | Исходная концентрация | Конечная концентрация | Объем на 1 реакцию |
| ПЦР-смесь 2 red | 2,5 х | 1х | 10 мкл |
| дНТФ | 10 µМ | 0,2 µМ | 0,5 мкл |
| «Прямой» праймер B37(B123)* | 10 µМ | 0,2 µМ | 0,5 мкл |
| «Обратный» праймер B853 (B320)* | 10 µМ | 0,2 µМ | 0,5 мкл |
| Вода | 8,5 мкл | ||
| кДНК (матрица) | 5 мкл | ||
| * в скобках указаны праймеры для второго раунда ПЦР |
| Таблица 3 | ||||
| Температурно-временной режим проведения ПЦР (прибор «Терцик», Россия) | ||||
| Описание стадии | Температура, °С | Длительность, сек. | Кол-во циклов | |
| 1 | Предварительное нагревание прибора «пауза» | 94 | - | - |
| 2 | Черничная денатурация ДНК | 95 | 120 | 1 |
| 3 | Денатурация ДНК | 95 | 20 | 3 |
| 4 | Гибридизация праймеров со специфическими участками | 50 | 20 | |
| 5 | Синтез комплементарных цепей | 72 | 50 | |
| 6 | Денатурация ДНК | 95 | 20 | 30 |
| 7 | Гибридизация праймеров со специфическими участками | 58 | 20 | |
| 8 | Синтез комплементарных цепей | 72 | 50 | |
| 9 | Конечный синтез комп-х цепей | 72 | 120 | 1 |
| 10 | Хранение | 10 | - | - |
Способ диагностики вируса инфекционного некроза поджелудочной железы лососевых методом полимеразной цепной реакции, при котором используют два прямых и два обратных олигонуклеотидных праймера для выявления фрагмента сегмента B, кодирующего РНК-зависимую РНК-полимеразу вируса инфекционного некроза поджелудочной железы следующей структуры - B37: ACGTTGGTGGCACCCGACATAC, B123: TGTCGGACATCTTCAACTCACC, B320r: CAGTCGAGGCAGAGCGGCATC, B853r: GTGTCTCCTTTGGTTTTGCCTATG, с электрофоретическим определением размера амплифицируемого фрагмента нуклеотидной последовательности, где по наличию на электрофореграмме фрагментов длиной 860 и/или 240 пн в исследуемом образце диагностируют вирус инфекционного некроза поджелудочной железы лососевых.