Низкомолекулярные модуляторы активности trp-p8
Иллюстрации
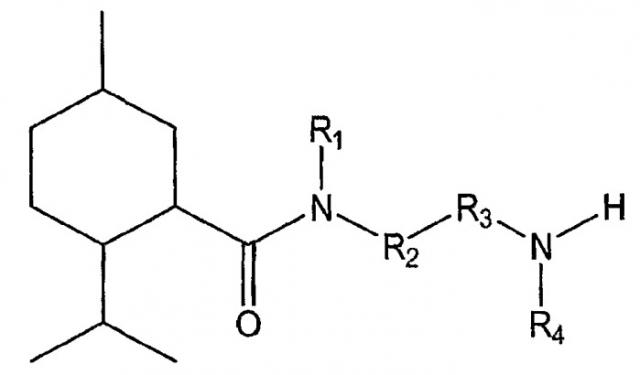
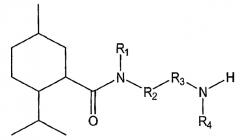
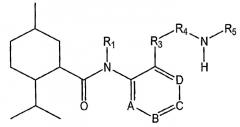
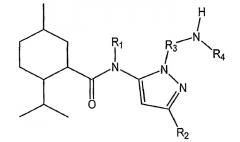
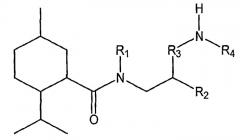
Показать всеНастоящее изобретение относится к области органической химии, а именно к соединению формулы I или его фармацевтически приемлемой соли, где R1 представляет собой Н или R1 и R2 вместе с группой азота могут образовывать где А, В, С и D независимо выбирают из группы, состоящей из CR1a и N; где, по меньшей мере, один из А, В, С и D представляет собой CR1a; где R1a выбирают из группы, состоящей из Н, -ORi, -SRii, -S(O)Riii, -C(O)NRvRvi и CF3, где Ri выбран из группы, состоящей из метила, этила, пропила, гидроксиэтила, гидроксипропила, 2-оксо-2-фенилэтила, бутила, ацетонитрила и бензила; Rii, Riii и Riv представляет собой метил; Rv и Rvi независимо выбраны из группы, состоящей из Н, метила, этила, гидроксиэтила, гидроксипропила, диэтиламиноэтила, фенила, пиридинила, метоксиэтила, гидроксиэтоксиэтила, бензила, фенилэтила, 2-гидрокси-1-гидроксиметил-2-фенилэтила и карбамоилметила, или Rv и Rvi вместе образуют морфолин или сложный этиловый эфир пиперазина; R2 выбирают из группы, состоящей из фенила, нафтила, пиразолила и С1-С8алкиленфенила; R3 представляет собой C1-С8алкилен; R4 выбирают из группы, состоящей из Н, C1-С8алкила и -C=NH(NH2). Также изобретение относится к соединениям формул I-A, I-B, I-C, I-D, I-E, значения радикалов которых указаны в формуле изобретения; к способу лечения указанных патологических состояний, к фармацевтической композиции на основе указанных соединений, к способу идентификации агониста Trp-p8 и конкретным соединениям. Технический результат: получены новые соединения, полезные в качестве модуляторов Trp-p8. 12 н. и 13 з.п. ф-лы, 19 ил., 8 табл., 17 пр.
I I-A
I-B I-C
I-D I-E
Реферат
Перекрестная ссылка на родственную заявку
Настоящая заявка заявляет преимущество приоритета временной заявки на патент США № 60/773435, зарегистрированной 15 февраля 2006 года, содержание которой включено в настоящий документ в качестве ссылки.
Уровень техники
Настоящее изобретение относится в целом к областям клеточной биологии, биохимии и органической химии. Более конкретно настоящее изобретение предусматривает низкомолекулярные модуляторы активности Trp-p8, которые включают в себя агонисты Trp-p8 и антагонисты Trp-p8, а также композиции, содержащие низкомолекулярные модуляторы Trp-p8. Также предусматриваются способы идентифицирования и характеризации новых низкомолекулярных модуляторов Trp-p8, а также способов модулирования медиируемого Trp-p8 притока катионов и/или апоптоза в клетке и связанные с ними способы лечения заболеваний, связанных с экспрессированием, активированием и/или переносом сигналов Trp-p8. Примеры заболеваний, которые соответствующим образом можно лечить с помощью композиций и способов по настоящему изобретению, включают в себя раковые заболевания, такие как раковые заболевания легких, груди, толстой кишки и/или простаты.
Уровень техники
Карцинома простаты представляет собой наиболее распространенное раковое заболевание, диагностируемое у мужчин в Соединенных Штатах, и дает второй по величине процент смертности от рака, уступая только аденокарциноме легких. Parker et al., CA Cancer J. Clin. 46:5-27 (1996). Хотя является возможным эффективное лечение рака простаты, ограниченного данным органом, имеются очень ограниченные возможности лечения метастатического заболевания. Таким образом, очень важно найти новые пути для диагностики заболевания на очень ранней стадии и пристально отслеживать как развитие, так и лечение заболевания, а также разрабатывать новые терапевтические подходы. Для достижения этого является важным понять молекулярные механизмы развития рака простаты и идентифицировать новые биохимические маркеры для диагностики и развития заболевания.
К настоящему времени имеется очень немного доступных простата-специфичных маркеров. Наиболее известные и хорошо характеризуемые маркеры с показанным диагностическим значением для рака простаты представляют собой белки, кислотная фосфатаза простаты (PAP), простата-специфичный антиген (PSA) и простата-специфичный мембранный антиген (PSMA). Каждый из этих белков стал также целью для новых иммунотерапевтических подходов к лечению заболеваний. Horoszewicz et al., Anticancer Res. 7:927-935 (1987); Barren et al., Prostate 30:65-68 (1997); Murphy et al., Prostate 33:281-285 (1997); Murphy et al., Prostate 26:164-168 (1995); Rochon et al., Prostate 25:219-223 (1995); Correale et al., J. Immunol 161:3186-3194 (1998); и Murphy et al., Prostate 38:73-78(1999).
Сообщается, что белок катионных каналов, обозначаемый по-разному, Trp-p8 (переходной потенциал рецептора-p8), TRPM8 и CMR1 (рецептор 1 холода и ментола), предпочтительно экспрессируется в простате. Клонирование полноразмерной кДНК Trp-p8 человека показывает транскрипт, соответствующий полипептиду из 1104 аминокислот, разделяющий гомологию с семейством trp кальциевых каналов. Clapham et al., Nature Reviews 2:387-396 (2001) и Clapham et al., IUPHAR Compendium, TRP Channels (2002). Trp-p8 показывают особенно высокую гомологию с геном TRPC7 человека - путативным белком каналов Ca2+ семейства trp, который сильно экспрессируется в тканях мозга. Nagamine et al., Genomics 54:124-131 (1998). Trp-p8 также показывает значительную гомологию с меластатином человека, другим белком, родственным семейству Trp, экспрессируемым в меланоцитах и являющимся, как предполагается, геном супрессора опухоли. Duncan et al., Cancer Res. 58:1515-1520(1998) и Hunter et al., Genomics 54:116-123 (1998). Возможно, наибольший интерес представляет собой то наблюдение, что ген Trp-p8 видимо экспрессируется при широком спектре неопластических повреждений, вне простаты, в дополнение к простате. Tsavaler et al., Cancer Res. 69(9):3760-9 (2001).
Суперсемейство Trp содержит более 20 родственных белков катионных каналов, которые участвуют в процессах, включающих в себя сенсорную функцию, от сенсорной физиологии до вазорелаксации и фертильности мужчин. Дефекты в каналах Trp связаны с изменениями в контроле роста и подавлении опухолей. Хотя все белки Trp представляют собой кальциевые каналы, они значительно различаются по своей селективности и способу активирования. Члены суперсемейства Trp разделяют значительную гомологию последовательностей и предсказанное структурное подобие, такое как размер предсказанных трансмембранных сегментов.
Trp-p8 сверхэкспрессируются при ряде раковых заболеваний, включая простату, грудь, легкие и толстую кишку, в то время как в нормальных тканях он в основном экспрессируется в простате человека [Tsavaler et al., смотри выше] и в ганглиях дорсальных корешков (DRG), (Dendreon, неопубликованное наблюдение). Fuessel et al. сообщают, что Trp-p8 представляет собой в высшей степени простата-специфичный и ассоциируемый с карциномой простаты ген, таким образом, квалифицируя его как потенциальную мишень для специфичной терапии. International J. of Oncology 23:221-228 (2003). Среди других видов ортологи Trp-p8 четко экспрессируются в подмножестве нейронов DRG и тригеминальных ганглий (TG) у крыс [McKemy et al., Nature 416(6876}:52-8 (2002)], а также у мышей [Peier et al., Cell 108(5):705-15 (2002)]. Таким образом, Trp-p8 представляет собой маркер, экспрессируемый для множества опухолей, со значительным потенциалом использования при диагностике заболевания и мониторинге развития заболевания во время лечения, а также в качестве жизнеспособной мишени для терапии рака.
Связь Trp-p8 с раковыми заболеваниями простаты, легких, груди и толстой кишки и важная роль различных ионных каналов, которую они играют в жизненных функциях клеток, говорят о том, что канал Trp-p8 может иметь значительную функцию при передаче сигналов и/или пролиферации раковых клеток. Модулирование активности Trp-p8, посредством либо активирования с помощью агониста, либо ингибирования с помощью антагониста, при физиологической температуре может быть ценным в качестве терапевтического средства для манипулирования клетками, экспрессирующими Trp-p8, конкретным образом. Смотри, например, заявку на патент США № 10/923413.
Соответственно, в данной области остается необходимость в низкомолекулярных модуляторах активности Trp-p8, в композициях, содержащих один или несколько низкомолекулярных модуляторов Trp-p8, и в способах идентифицирования и использования малых молекул для модулирования активности Trp-p8 в клетке и для лечения заболевания, связанного с аберрантным экспрессированием Trp-p8.
Сущность изобретения
Настоящее изобретение удовлетворяет эти и другие родственные потребности посредством создания низкомолекулярных модуляторов активности Trp-p8, включая агонисты Trp-p8 и антагонисты Trp-p8, а также композиций, содержащих такие модуляторы Trp-p8, и способов идентифицирования и использования модуляторов Trp-p8. В определенных вариантах осуществления соединения по настоящему изобретению связываются и активируют Trp-p8 и/или стимулируют приток катионов, включая, но не ограничиваясь этим, приток кальция, в клетке, где приток катионов коррелирует с токсичностью, индуцируемой модуляторами Trp-p8. Таким образом, в этих и других вариантах осуществления агонисты Trp-p8 по настоящему изобретению являются эффективными при ингибировании роста и/или индуцировании апоптоза и/или некроза в клетках, экспрессирующих Trp-p8. В альтернативных вариантах осуществления предусматриваются антагонисты Trp-p8, которые являются эффективными при уменьшении базальной активности Trp-p8 в клетке, таким образом, уменьшая выживаемость клеток, экспрессирующих Trp-p8. Преимущественно по этой причине агонисты и антагонисты по настоящему изобретению могут использоваться для лечения заболеваний, включая, но не ограничиваясь этим, раковые заболевания груди, легких, толстой кишки и/или простаты, которые связываются с экспрессированием Trp-p8.
Один или несколько модуляторов Trp-p8 могут приготавливаться в виде композиции, включая фармацевтические композиции, содержащей один или несколько фармацевтически приемлемых носителей или наполнителей и/или одно или несколько дополнительных терапевтических соединений. Такие композиции найдут применения в способах лечения одного или нескольких заболеваний, связанных с экспрессированием Trp-p8.
Таким образом, в одном из вариантов осуществления настоящее изобретение предусматривает низкомолекулярные модуляторы Trp-p8 и их производные, где малые молекулы включают в себя соединения следующей формулы I:
где R1 выбирают из H, алкила, гетероалкила, арилалкила и арила, или R1 и R2 вместе с группой азота могут образовывать циклическую или гетероциклическую группу, самое большее, из 25 атомов;
R2 выбирают из арила и арилалкила;
R3 выбирают из алкила, гетероалкила и арилалкила;
R4 выбирают из H, алкила, гетероалкила и арилалкила; и
R3 и R4 вместе с группой азота образуют алифатический амин.
В родственных вариантах осуществления настоящее изобретение предусматривает низкомолекулярные модуляторы Trp-p8 и их производные, где малые молекулы включают в себя соединения следующей формулы I-A:
где A, B, C и D независимо выбирают из CR2 и N; где, по меньшей мере, один из A, B, C и D представляет собой CR2; где R2 представляет собой остаток, выбранный из H, алкила, гетероалкила, арила, галогена и арилалкила, R6O- и R6S-, где R6 представляет собой алкил; где, когда два соседних из A, B, C и D представляют собой CR2, два R2 могут объединяться с образованием единой арильной, циклоалкильной или гетероциклоалкильной группы; и
R1 выбирают из H, алкила, гетероалкила, арила и арилалкила;
R3 выбирают из алкила, гетероалкила, арила, арилалкила, -NR7C(O)-, -C(O)NR7-, -O-, -S-, -S(O)-, -S(O)2- и -NR7-, где R7 представляет собой остаток, выбранный из H, алкила, гетероалкила, арила и арилалкила;
R4 выбирают из -C(O)R8-, алкила, арилалкила и гетероалкила, где R8 выбирают из алкила и гетероалкила;
R5 выбирают из H, алкила, гетероалкила и арилалкила; и
R4 и R5 вместе с группой азота образуют алифатический амин.
В определенных примерных соединениях формулы I-A R1 представляет собой H; R7 представляет собой H; R8 содержит 2, 3 или 4 атома углерода; R4 выбирают из пропионила, этила, бутирила, гидроксипропионила и 3-гидроксибутирила; R5 выбирают из H и метила; R6 содержит 1, 2, 3, 4, 5 или 6 атомов углерода; и/или R2 выбирают из метокси, метилсульфанила, фенила и H.
Здесь иллюстрируются соединения формулы I-A, включающие группу, выбранную из 2-(2-аминопропиониламино)-4-метоксифенила, N-(2-аминоэтил)-2-амино-5-метилсульфанилфенила, 1-(2-аминоэтокси)нафталин-2-ила, 2-(2-аминоэтиламино)-4-метилсульфанилфенила, N-(2-аминоэтил)-5-метоксибензамида, 2-(2-аминобутириламино)-4-метоксифенила, 2-(2-амино-3-гидроксипропиониламино)-4-метоксифенила, 3-(2-аминоэтиламино)нафталин-2-ила, N-(2-аминоэтил)-2-аминобензамида, 2-(2-амино-3-гидроксипропиониламино)-4-метоксифенила, 2-(2-аминоацетиламино)фенила, 2-(2-амино-3-гидроксибутириламино)-4-метоксифениламида и 2-(2-аминоацетиламино)-4-метоксифенила.
В альтернативных родственных вариантах осуществления настоящее изобретение предусматривает низкомолекулярные модуляторы Trp-p8 и их производные, где малые молекулы включают в себя соединения следующей формулы I-B:
где R1 выбирают из H, алкила, гетероалкила, арила и арилалкила;
R2 выбирают из арила, алкила, гетероалкила и арилалкила;
R3 выбирают из алкила, гетероалкила и арилалкила;
R4 выбирают из H, алкила, гетероалкила и арилалкила; и
R3 и R4 вместе с группой азота образуют алифатический амин.
В определенных примерных соединениях формулы I-B R1 представляет собой H; R3 выбирают из метилена, этилена, пропилена и бутилена; R4 выбирают из H и метила; и/или R2 выбирают из фенила, фурана, метилпиррола, метилбензоата, аминофенила, гидроксифенила, цианофенила и метоксифенила.
Здесь иллюстрируются соединения формулы I-B, включающие группу, выбранную из 2-(2-аминоэтил)-5-фуран-2-ил-2H-пиразол-3-ила, 2-(2-аминопропил)-5-фенил-2H-пиразол-3-ила, 2-(2-аминоэтил)-5-фенил-2H-пиразол-3-ила, 2-(2-аминоэтил)-5-(1-метил-1H-пиррол-2-ил)-2H-пиразол-3-ила, 2-(2-аминопропил)-5-фенил-2H-пиразол-3-ила, 2-(2-аминоэтил)-5-(4-аминофенил)-2H-пиразол-3-ила, 2-(2-аминоэтил)-5-(4-гидроксифенил)-2H-пиразол-3-ила, 2-(2-метиламиноэтил)-5-фенил-2H-пиразол-3-ила, 2-(2-аминопропил)-5-фенил-2H-пиразол-3-ила, 2-(2-аминоэтил)-5-(3-цианофенил)-2H-пиразол-3-ила, 2-(2-аминоэтил)-5-(3-метоксифенил)-2H-пиразол-3-ила, метилового эфира 4-{1-(2-аминоэтил)-1H-пиразол-3-ил}-бензойной кислоты, 2-(2-аминоэтил)-5-(3-аминофенил)-2H-пиразол-3-ила и 2-(2-аминоэтил)-5-(3-гидроксифенил)-2H-пиразол-3-ила.
В других родственных вариантах осуществления настоящее изобретение предусматривает низкомолекулярные модуляторы Trp-p8 и их производные, где малые молекулы включают в себя соединения следующей формулы I-C:
где R1 выбирают из H, алкила, гетероалкила, арила и арилалкила;
R2 выбирают из арила и арилалкила;
R3 выбирают из алкила, гетероалкила, арилалкила, -NHC(O)R5-, -OR5- и -NHR5-, где R5 представляет собой алкил или гетероалкил;
R4 выбирают из H, алкила, гетероалкила и арилалкила; и
R3 и R4 вместе с группой азота образуют алифатический амин.
В определенных примерных соединениях формулы I-C R1 представляет собой H; R2 представляет собой фенил; R5 выбирают из метилена, этилена, пропилена и бутилена; R3 выбирают из пропиониламино, этокси, пропокси и этиламино; и/или R4 выбирают из H и метила.
Здесь иллюстрируются соединения формулы I-C, включающие группу, выбранную из 2-(2-аминопропиониламино)-2-фенилэтила, 2-(2-аминоэтокси)-2-фенилэтила, 2-(2-аминоэтокси)-2-фенилэтила, 2-(3-аминопропокси)-2-фенилэтила, 2-(2-диметиламиноэтокси)-2-фенилэтила и 2-(2-аминоэтиламино)-2-фенилэтила.
В других родственных вариантах осуществления настоящее изобретение предусматривает низкомолекулярные модуляторы Trp-p8 и их производные, где малые молекулы включают в себя соединения следующей формулы I-D:
где R1 выбирают из H, алкила, гетероалкила, арила и арилалкила;
R2 выбирают из арила и арилалкила;
R3 выбирают из алкила, гетероалкила и арилалкила;
R4 выбирают из H, алкила, гетероалкила и арилалкила; и
R3 и R4 вместе с группой азота образуют алифатический амин.
В определенных примерных соединениях формулы I-D R1 представляет собой H; R2 выбирают из фенила и фениламино; R3 выбирают из метилена, этилена, пропилена, бутилена, метиламино, этиламино, пропиламино, бутиламино и ацетила; и/или R4 выбирают из H и метила.
Здесь иллюстрируются соединения формулы I-D, включающие группу, выбранную из 2-[2-(2-аминоэтиламино)фенил]этила, 2-(2-аминометилфенил)этила и 2-[(2-аминоацетил)фениламино]этила.
В других родственных вариантах осуществления настоящее изобретение предусматривает низкомолекулярные модуляторы Trp-p8 и их производные, где малые молекулы включают в себя соединения следующей формулы I-E:
где A, B, C и D независимо выбирают из CR1 и N; где, по меньшей мере, один из A, B, C и D представляет собой CR1; где R1 выбирают из H, алкила, гетероалкила, арила, арилалкила и галогена; где, когда два соседних из A, B, C и D представляют собой CR1, два R1 могут объединяться с образованием единой арильной, циклоалкильной или гетероциклоалкильной группы;
R2 выбирают из алкила, гетероалкила и арилалкила;
R3 выбирают из H, алкила, гетероалкила и арилалкила; и
R2 и R3 вместе с группой азота образуют алифатический амин.
В определенных примерных соединениях формулы I-E
(i) R1 представляет собой H или -ORi, и Ri выбирают из метила, гидроксиметила, этила, гидроксиэтила, пропила, гидроксипропила, бутила, гидроксибутила, ацетонитрила, фенила, фенилметокси, фенилэтокси, фенилпропокси, фенилбутокси и бензила;
(ii) R1 представляет собой -SRii, и при этом Rii выбирают из метила, гидроксиметила, этила, гидроксиэтила, пропила, гидроксипропила, бутила, гидроксибутила, ацетонитрила, фенила, фенилметокси, фенилэтокси, фенилпропокси, фенилбутокси и бензила;
(iii) R1 представляет собой -S(O)Riii, и при этом Riii выбирают из метила, гидроксиметила, этила, гидроксиэтила, пропила, гидроксипропила, бутила, гидроксибутила, ацетонитрила, фенила, фенилметокси, фенилэтокси, фенилпропокси, фенилбутокси и бензила;
(iv) R1 представляет собой -S(O)2Riv, и при этом Riv выбирают из метила, гидроксиметила, этила, гидроксиэтила, пропила, гидроксипропила, бутила, гидроксибутила, ацетонитрила, фенила, фенилметокси, фенилэтокси, фенилпропокси, фенилбутокси и бензила;
(v) R1 представляет собой -C(O)NRvRvi, и при этом Rv и Rvi независимо выбирают из H, метила, гидроксиметила, этила, гидроксиэтила, пропила, гидроксипропила, бутила, гидроксибутила, диэтиламиноэтила, фенила, пиридинила, метоксиэтила, гидроксиэтоксиэтила, бензила, метилфенила, фенилэтила, гидроксигидроксиметилфенилэтила, карбамоилметила и гидроксиметил гидроксиэтила;
(vi) R1 представляет собой -C(O)NRvRvi, и при этом Rv и Rvi вместе образуют морфолин, пиперазин, сложный этиловый эфир пиперазина;
(vii) R2 выбирают из метилена, этилена, пропилена и бутилена;
(viii) R2 представляет собой этилен, и R3 представляет собой H; и
(ix) R1 представляет собой CF3 или галоген.
Здесь иллюстрируются соединения формулы I-E, включающие группу, выбранную из 3-(2-аминоэтил)-5-метокси-1,3-дигидробензоимидазол-2-она, 3-(2-аминоэтил)-5-(3-гидроксипропокси)-1,3-дигидробензоимидазол-2-она, 3-(2-аминоэтил)-5-этокси-1,3-дигидробензоимидазол-2-она, 3-(2-аминоэтил)-5-метансульфонил-1,3-дигидробензоимидазол-2-она, 3-(2-аминоэтил)-5-(2-гидроксиэтокси)-1,3-дигидробензоимидазол-2-она, амида 3-(2-аминоэтил)-2-оксо-2,3-дигидро-1H-бензоимидазол-5-карбоновой кислоты, 3-(2-аминоэтил)-5-метилсульфанил-1,3-дигидробензоимидазол-2-она, 3-(2-аминоэтил)-5-метансульфинил-1,3-дигидробензоимидазол-2-она, (2-диэтиламиноэтил)амида 3-(2-аминоэтил)-2-оксо-2,3-дигидро-1H-бензоимидазол-5-карбоновой кислоты, 3-(2-аминопропил)-2,3-дигидробензоимидазол-2-она, [3-(2-аминоэтил)-2-оксо-2,3-дигидро-1H-бензоимидазол-5-илокси]ацетонитрила, этиламида 3-(2-аминоэтил)-2-оксо-2,3-дигидро-1H-бензоимидазол-5-карбоновой кислоты, пиридин-3-иламида 3-(2-аминоэтил)-2-оксо-2,3-дигидро-1H-бензоимидазол-5-карбоновой кислоты, (2-метоксиэтил)амида 3-(2-аминоэтил)-2-оксо-2,3-дигидро-1H-бензоимидазол-5-карбоновой кислоты, 1-(2-аминоэтил)-1,3-дигидробензоимидазол-2-она, 1-(2-аминоэтил)-1,3-дигидронафто[2,3-d]имидазол-2-она, (2-гидроксиэтил)амида 3-(2-аминоэтил)-2-оксо-2,3-дигидро-1H-бензоимидазол-5-карбоновой кислоты, 3-(2-аминоэтил)-5-пропокси-1,3-дигидробензоимидазол-2-она, 3-(2-аминоэтил)-1,3-дигидроимидазо[4,5-c]пиридин-2-она, (2-диэтиламиноэтил)амида 3-(2-аминоэтил)-2-оксо-2,3-дигидро-1H-бензоимидазол-4-карбоновой кислоты, пиридин-4-иламида 3-(2-аминоэтил)-2-оксо-2,3-дигидро-1H-бензоимидазол-5-карбоновой кислоты, 3-(2-аминоэтил)-1,3-дигидроимидазо[4,5-b]пиридин-2-она, 1-(3-аминопропил)-1,3-дигидробензоимидазол-2-она, фениламида 3-(2-аминоэтил)-2-оксо-2,3-дигидро-1H-бензоимидазол-5-карбоновой кислоты, [2-(2-гидроксиэтокси)этил]амида 3-(2-аминоэтил)-2-оксо-2,3-дигидро-1H-бензоимидазол-5-карбоновой кислоты, 1-(2-аминоэтил)-5-трифторметил-1,3-дигидробензоимидазол-2-она, 1-(2-аминоэтил)-1,3-дигидроимидазо[4,5-c]пиридин-2-она, бензиламида 3-(2-аминоэтил)-2-оксо-2,3-дигидро-1H-бензоимидазол-5-карбоновой кислоты, 3-(2-аминоэтил)-5-(морфолин-4-карбонил)-1,3-дигидробензоимидазол-2-она, 3-(2-аминоэтил)-5-(2-оксо-2-фенилэтокси)-1,3-дигидробензоимидазол-2-она, 3-(2-метиламиноэтил)-1,3-дигидробензоимидазол-2-она, 3-(2-аминоэтил)-5-бутокси-1,3-дигидробензоимидазол-2-она, метилфениламида 3-(2-аминоэтил)-2-оксо-2,3-дигидро-1H-бензоимидазол-5-карбоновой кислоты, этилового эфира 4-[3-(2-аминоэтил)-2-оксо-2,3-дигидро-1H-бензоимидазол-5-карбонил]пиперазин-1-карбоновой кислоты, диэтиламида 3-(2-аминоэтил)-2-оксо-2,3-дигидро-1H-бензоимидазол-5-карбоновой кислоты, фенэтиламида 3-(2-аминоэтил)-2-оксо-2,3-дигидро-1H-бензоимидазол-5-карбоновой кислоты, (2-гидрокси-1-гидроксиметил-2-фенилэтил)амида 3-(2-аминоэтил)-2-оксо-2,3-дигидро-1H-бензоимидазол-5-карбоновой кислоты, карбамоилметиламида 3-(2-аминоэтил)-2-оксо-2,3-дигидро-1H-бензоимидазол-5-карбоновой кислоты, (2-гидрокси-1-гидроксиметилэтил)амида 3-(2-аминоэтил)-2-оксо-2,3-дигидро-1H-бензоимидазол-5-карбоновой кислоты, N-{2-[2-оксо-2,3-дигидробензоимидазол-1-ил]этил}гуанидина, 3-(2-аминоэтил)-5-бензилокси-1,3-дигидробензоимидазол-2-она и 1-(4-аминобутил)-1,3-дигидробензоимидазол-2-она. В одном из таких вариантов осуществления предусматривается соединение 3-(2-аминоэтил)-1-(2-изопропил-5-метилциклогексанкарбонил)-5-метокси-1,3-дигидробензоимидазол-2-она.
Другие аспекты настоящего изобретения предусматривают композиции, включающие в себя фармацевтические композиции, содержащие один или несколько низкомолекулярных модуляторов Trp-p8 формулы I, формулы I-A, формулы I-B, формулы I-C, формулы I-D и формулы I-E в сочетании с фармацевтически приемлемым наполнителем, носителем и/или разбавителем. Здесь в примерах приводятся конкретные агонисты и антагонисты Trp-p8 формулы I, формулы I-A, формулы I-B, формулы I-C, формулы I-D и формулы I-E; способы синтеза примерных агонистов и антагонистов Trp-p8 формулы I, формулы I-A, формулы I-B, формулы I-C, формулы I-D и формулы I-E; и данные EC50 демонстрируют эффективность in vitro и специфичную активность каждого из описанных агонистов и антагонистов Trp-p8 формулы I, формулы I-A, формулы I-B, формулы I-C, формулы I-D и формулы I-E.
В других аспектах композиции по настоящему изобретению содержат одно или несколько соединений формулы I, формулы I-A, формулы I-B, формулы I-C, формулы I-D и/или формулы I-E, приготовленных вместе с одним или несколькими терапевтическими агентами против рака. Альтернативно композиции по настоящему изобретению содержат соединение формулы I, формулы I-A, формулы I-B, формулы I-C, формулы I-D и/или формулы I-E, независимо приготовленное, вместе с одним или несколькими терапевтическими агентами против рака. То есть одно или несколько соединений формулы I, формулы I-A, формулы I-B, формулы I-C, формулы I-D и/или формулы I-E и терапевтический агент против рака приготавливаются отдельно.
Соответствующие терапевтические агенты против рака включают в себя, но не ограничиваясь этим, антимитотические агенты, включая, но не ограничиваясь этим, паклитаксель, винкристин и этопозид; алкилирующие агенты, включая, но не ограничиваясь этим, мехлорэтамин, циклофосфамид и кармустин; антиметаболиты, включая, но не ограничиваясь этим, метотрексат, гемцитабин, лометрексол, 5-фторурацил и 6-меркаптопурин; цитотоксичные антибиотики, включая, но не ограничиваясь этим, доксорубицин, даунорубицин, блеомицин, митомицин C и стрептозоцин; агенты на основе платины, включая, но не ограничиваясь этим, цисплатин и карбоплатин; гормональные агенты, включая, но не ограничиваясь этим, антиэстрогены, такие как тамоксифен и диэтилстильбестрол а также антиандрогены, такие как флутамид; агенты против ангиогенеза и ингибиторы фарнезилтрансферазы.
В определенных аспектах соединения формулы I, формулы I-A, формулы I-B, формулы I-C, формулы I-D и/или формулы I-E вводятся в сочетании с терапевтическими агентами против рака, которые сами по себе являются неэффективными при модулировании активности Trp-p8 в клетках, экспрессирующих Trp-p8. Неожиданно эти типы сочетанной терапии приводят к повышению эффективности по сравнению с использованием одного только соединения формулы I, формулы I-A, формулы I-B, формулы I-C, формулы I-D и/или формулы I-E.
В других аспектах соединения формулы I, формулы I-A, формулы I-B, формулы I-C, формулы I-D и/или формулы I-E вводятся в сочетании с одним или несколькими дополнительными модуляторами (модулятором) Trp-p8, включая, но не ограничиваясь этим, соединение формулы I, формулы I-A, формулы I-B, формулы I-C, формулы I-D и/или формулы I-E.
В некоторых из этих вариантов осуществления предусматриваются низкомолекулярные антагонисты низкомолекулярных агонистов Trp-p8, представленные здесь. Таким образом, в определенных вариантах осуществления предусматриваются низкомолекулярные антагонисты Trp-p8 формулы I, формулы I-A, формулы I-B, формулы I-C, формулы I-D и/или формулы I-E и их производные для одного или нескольких агонистов Trp-p8 формулы I, формулы I-A, формулы I-B, формулы I-C, формулы I-D и формулы I-E.
Дополнительные варианты осуществления по настоящему изобретению предусматривают способы уменьшения выживаемости клеток и/или ингибирования роста клеток, способы стимулирования притока катионов и способы индуцирования апоптоза и/или некроза в клетках, экспрессирующих Trp-p8. Примеры таких способов включают в себя стадию контактирования клеток с соединением формулы I, формулы I-A, формулы I-B, формулы I-C, формулы I-D и/или формулы I-E при концентрации и в течение времени, необходимых для уменьшения выживаемости клеток и/или ингибирования роста клеток, для повышения внутриклеточного уровня кальция и/или для индуцирования апоптоза и/или некроза клеток.
В других вариантах осуществления настоящее изобретение предусматривает способы лечения заболевания у млекопитающих, чаще всего людей, посредством введения одного или нескольких соединений и/или композиций по настоящему изобретению. В определенных аспектах способы включают в себя введение композиции, содержащей сочетание соединения формулы I, формулы I-A, формулы I-B, формулы I-C, формулы I-D и/или формулы I-E с одним или несколькими терапевтическими агентами против рака, доставляемой способом с одновременным введением, например, как единый препарат. В некоторых других аспектах способы по настоящему изобретению включают в себя сочетанную терапию, где соединение формулы I, формулы I-A, формулы I-B, формулы I-C, формулы I-D и/или формулы I-E вводится сначала в одном препарате, а затем терапевтический агент против рака в отдельном препарате. Способы также включают в себя способ, когда сначала терапевтический агент против рака доставляется в одном препарате, а затем соединение формулы I, формулы I-A, формулы I-B, формулы I-C, формулы I-D и/или формулы I-E в отдельном препарате.
Терапевтические способы по настоящему изобретению являются особенно эффективными при лечении раковых заболеваний, связанных с экспрессией Trp-p8, включая, но не ограничиваясь этим, определенные раковые заболевания толстой кишки, легких, груди и простаты.
Рассмотренные выше и дополнительные особенности настоящего изобретения и способ их получения станут ясны, и настоящее изобретение будет понято лучше посредством ссылок на следующее далее более подробное описание, взятое в сочетании с прилагаемыми фигурами.
Краткое описание фигур
Фиг.1A-1B представляют собой графики, изображающие примерный анализ выживаемости с помощью АТФ, пригодный для исследования и характеризации низкомолекулярных модуляторов Trp-p8 по настоящему изобретению. В предварительном анализе (фиг.1A) соединения исследуют при 1 мкМ и специфичную гибель клеток CHO, экспрессирующих Trp-p8 (CHO/Trp-p8), измеряют при 37°C. В следующем далее анализе (фиг.1B) соединения исследуют при различных концентрациях и гибель клеток CHO, экспрессирующих Trp-p8 (CHO/Trp-p8), измеряют при 37°C. Значение EC50 получают из графика выживаемости клеток как функции концентрации.
Фиг.2A-2C представляют собой графики, изображающие индуцируемое модуляторами Trp-p8 увеличение уровня внутриклеточного кальция, как определятся с помощью анализа потоков кальция, осуществляемого при 37°C. Фиг.2A представляет собой положительный контроль, демонстрирующий, что клетки CHO и CHO/Trp-p8 реагируют сходным образом на 2 мкМ иономицина при 37°C, при анализе потока кальция. Фиг.2B представляет собой отрицательный контроль, демонстрирующий, что парентальные клетки CHO, которые не экспрессируют эндогенного или экзогенного Trp-p8, не реагируют на агонисты Trp-p8 при концентрации 10 мкМ. Фиг.2C демонстрирует, что агонист Trp-p8 индуцирует специфичную, концентрационно-зависимую реакцию в клетках CHO/Trp-p8 при 37°C.
Фиг.3 представляют собой данные графиков проточной цитометрии, демонстрирующих, что агонист Trp-p8 способен специфично индуцировать апоптоз в экспрессирующих Trp-p8 клетках CHO при 37°C зависимым от дозы образом.
Фиг.4 представляет собой график, изображающий примерные результаты первичного скрининга антагонистов Trp-p8 с использованием анализа выживаемости с помощью АТФ, описанного здесь, с клетками CHO/Trp-p8 при 37°C. Клетки CHO/Trp-p8 экспонируют для соединения, при различных концентрациях, в 1% ДМСО или 1% ДМСО в сочетании с токсичной концентрацией агониста Trp-p8. Выживаемость клеток измеряют после 24-26 часов при 37°C с использованием анализа АТФ. Соединения, которые защищают клетки от токсичного воздействия агониста Trp-p8, классифицируются как антагонисты Trp-p8 (соединения A-B). Неактивное соединение (соединение C) не имеет защитного воздействия и показано здесь для цели иллюстрации анализа.
Фиг.5 представляет собой график, изображающий скрининг и характеризацию антагонистов Trp-p8, осуществляемую посредством анализа потоков кальция при 37°C. Клетки CHO/Trp-p8 нагружают индикаторным красителем на кальций Fura-2, и увеличение уровня внутриклеточного кальция в ответ на соединения определяют с помощью увеличения флуоресценции. Клетки CHO/Trp-p8, нагруженные красителем Fura-2, экспонируют для 1% ДМСО или антагониста, при различных концентрациях, в 1% ДМСО при 37°C. Через три минуты к клеткам добавляют агонист. Когда клетки экспонируются для эффективной концентрации антагониста, их способность реагировать на агонист значительно понижается или совсем пропадает.
Фиг.6A-6B представляют собой графики, изображающие результаты для примерных животных моделей, пригодных для исследования, и характеризуют низкомолекулярные модуляторы Trp-p8 по настоящему изобретению. Мышам делают инъекцию подкожно с клетками CHO/Trp-p8, что приводит к образованию твердой опухоли. Длина (наибольший размер) и ширина (размер, перпендикулярный к ней и находящийся в той же плоскости, что и длина) каждой опухоли измеряются с помощью раздвижного калибра, и объем опухоли аппроксимируют с помощью формулы для объема эллипсоида: 0,52*L*W2. Когда средний объем опухоли достигает приблизительно 100 мм3, мышей разбивают на группы случайным образом. На фиг.6A мыши вводится одна доза либо исследуемого соединения как препарата на водной основе, либо носителя самого по себе с помощью перорального желудочного зонда. На фиг.6B мышам несколько раз дозируют либо исследуемое соединение как препарат на водной основе, либо носитель сам по себе с помощью перорального желудочного зонда. Затем опухоли последовательно измеряют в указанные дни. Данные представляют как средние объемы опухоли ± стандартная ошибка.
Фиг.7 представляет собой график, изображающий концентрации в плазме нескольких соединений, как функцию времени и дозы, для мыши после введения посредством одной внутрибрюшинной инъекции. Все соединения растворяют в препарате на водной основе и вводят при сравнимых уровнях дозирования. Кровь собирают в указанные моменты времени и анализируют на уровни лекарственных средств.
Фиг.8A-8B представляют собой графики, изображающие эффективность, демонстрируемую несколькими соединениями на модели мышей с привитыми опухолями, экспрессирующими Trp-p8. Мышам делают инъекцию подкожно клетками CHO/Trp-p8, в результате чего образуются твердые опухоли. Длину (L; наибольший размер) и ширину (W; размер, перпендикулярный длине и находящийся в той же плоскости) каждой опухоли измеряют с помощью раздвижного калибра и объем опухоли аппроксимируют с помощью формулы для объема эллипсоида: 0,52*L*W2. Когда средний объем опухоли достигает приблизительно 100 мм3, мыши произвольным образом делятся на группы, и им вводят либо соединение как препарат на водной основе, либо носитель сам по себе с помощью внутрибрюшинной инъекции в указанные дни. Все соединения вводятся при сравнимых уровнях дозирования. Опухоли последовательно измеряют в указанные дни. Данные представлены как средние объемы опухоли ± стандартная ошибка.
Фиг.9A и 9B представляют собой графики, изображающие концентрацию в плазме нескольких соединений, как функцию времени и дозы, у крыс (фиг.9A) и собак (фиг.9B) после одной пероральной дозы. Все соединения растворяют в препарате на водной основе и вводят при сравнимых уровнях дозировки с помощью перорального желудочного зонда. Кровь собирают в указанные моменты времени и анализируют на уровни лекарственных средств.
Фиг.10A и 10B представляют собой графики, изображающие эффективность, демонстрируемую несколькими соединениями на модели с привитыми опухолями мышей, экспрессирующими Trp-p8. Мышам делают подкожную инъекцию клеток CHO/Trp-p8, что приводит к образованию твердых опухолей. Длину (L; наибольший размер) и ширину (W; размер, перпендикулярный длине и находящийся в той же плоскости) каждой опухоли измеряют с помощью раздвижного калибра и объем опухоли аппроксимируют с помощью формулы для объема эллипсоида: 0,52*L*W2. Когда средний объем опухоли достигает приблизительно 100 мм3, мыши произвольным образом делятся на группы и им вводят либо одну дозу соединения как препарата на водной основе, либо носитель сам по себе с помощью перорального желудочного зонда. Затем опухоли последовательно измеряют в указанные дни. Данные представляют как средние объемы опухоли ± стандартная ошибка.
Фиг.11 представляет собой график, изображающий отсутствие эффективности, демонстрируемое примерным соединением на модели с привитыми опухолями мышей, где отсутствует экспрессия Trp-p8. Мышам делают подкожную инъекцию клеток CHO-K1, где нет Trp-p8, что приводит к образованию твердых опухолей. Длину (L; наибольший размер) и ширину (W; размер, перпендикулярный длине и находящийся в той же плоскости) каждой опухоли измеряют с помощью раздвижного калибра, и объем опухоли аппроксимируют с помощью формулы для объема эллипсоида: 0,52*L*W2. Когда средний объем опухоли достигает приблизительно 50 мм3, мыши произвольным образом делятся на группы и им вводят либо одну дозу соединения как препарата на водной основе, либо носитель с помощью перорального желудочного зонда. Затем опухоли последовательно измеряют в указанные дни. Данные представляют как средний объем опухоли ± стандартная ошибка.
Фиг.12 представляет собой график, изображающий эффективность, демонстрируемую примерным соединением на модели с привитыми опухолями мышей, экспрессирующими Trp-p8. Модель опухоли LuCaP получают от Robert L. Vassella, Ph.D., Professor of Urology in University of Washington's School of Medicine. Длину (L; наибольший размер) и ширину (W; размер, перпендикулярный длине и находящийся в той же самой плоскости) каждой опухоли измеряют с помощью раздвижного калибра и объем опухоли аппроксимируют с помощью формулы для объема эллипсоида: 0,52*L*W2. Когда средний объем опухоли достигает приблизительно 150 мм3, мышам вводят соединение как препарат на водной основе с помощью внутрибрюшинной инъекции, ежедневно в течение 5 дней. Затем опухоли последовательно измеряют в указанные дни. Данные представляют как средний объем опухоли ± стандартная ошибка.
SEQ ID NO: 1 представляет собой последовательность нуклеотидов кДНК Trp-p8 человека (GenBank Accession No. AY090109).
SEQ ID NO: 2 представляет собой последовательность аминокислот, кодируемую последовательностью нуклеотидов SEQ ID NO: 1 (GenBank Accession No. NP_076985).
Подробное описание изобретения
Настоящее изобретение основывается на обнаружении того, что определенные низкомолекулярные модуляторы Trp-p8, включая агонисты активности Trp-p8, способны ингибировать рост и/или индуцировать апоптоз и/или некроз в клетках, которые экспрессируют Trp-p8. Не имея желания ограничиваться каким-либо конкретным режимом действия, предполагается, что медиируемое агонистом Trp-p8 активирование рецептора Trp-p8 существенно увеличивает приток катионов, который коррелирует с клеточной токсичностью. Кроме того, предполагается, что антагонисты Trp-p8 могут ингибировать базальный уровень активности и/или индуцированную нативными лигандами активность эндогенного Trp-p8, активирование которого впоследствии приводит к уменьшению роста или к гиб