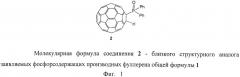
Фосфорсодержащие производные фуллерена c60 и способ их получения
Иллюстрации
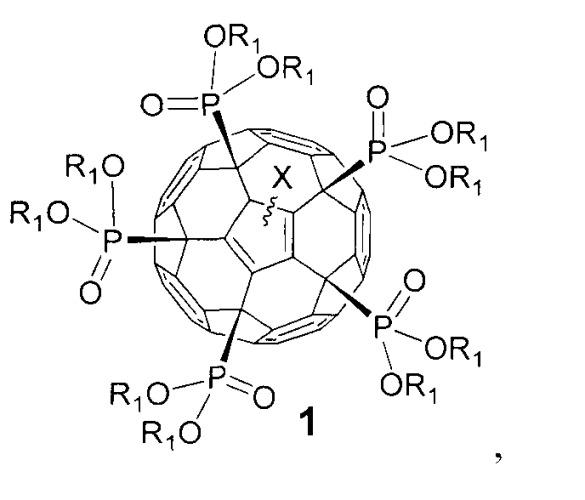
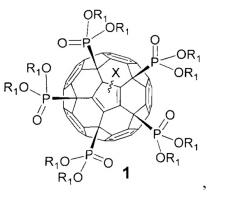
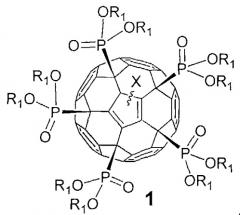
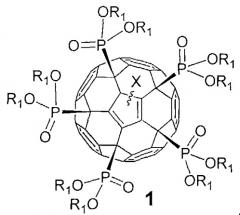
Показать всеИзобретение относится к фуллеренам формулы 1 и способам их получения, которые могут использоваться в химической промышленности и солнечной энергетике,
где Х означает:
атом водорода или алкильный (CnH2n+1; n=1-20) радикал,
где R1 означает:
атом водорода, алкильный (CnH2n+1; n=1-20), алкенильный (CnH2n-1; n=1-20) или алкинильный радикал (СnН2n-3; n=1-20);
остаток алкилгалогенида -(СН2)nНаl (Hal=F, Cl, Вr, I), простого эфира -(CH2)nOR'1 или -(СН2СН2O)nR'1, для которых n=0-20, a R'1 - это атомы водорода или линейные или разветвленные алкильные (CmH2m+1; n=1-20), алкенильные (CmH2m-1; n=1-20) или алкинильные радикалы (СmН2m-3, n=1-20).
Предложенный способ заключается в том, что проводят реакцию Арбузова, в которую с соответствующими органическими фосфитами вводится хлорид фуллерена С60Сl6. Предложены новые фуррелены, пригодные для использования в органических солнечных батареях, а также новый эффективный способ их получения. 2 н.п. ф-лы, 20 ил., 6 пр.
Реферат
Изобретение относится к химической и фармацевтической отраслям промышленности и касается химической функционализации фуллерена C60, а именно, разработки способа получения нового класса фосфорсодержащих производных фуллерена C60. Изобретение может найти применение в биомедицинских исследованиях и в фармакологии, а также в органической фотовольтаике при разработке перспективных светопреобразующих материалов для органических солнечных батарей.
Фуллерены были открыты в 1985 году при масс-спектрометрическом анализе продуктов лазерного испарения графита [1 - W. Kroto, J.R. Heath, S.C. O'Brien, R.F. Curl, RE. Smalley. C60: Buckminsterfullerene, Nature, 318, 162-163 (1985)]. После разработки методов получения фуллеренов в макроколичествах путем электродугового испарения графита [2 - W. Krätchmer, L.D. Lamb, К. Fostiropoulos, D.R. Huffman. C60: a new form of carbon. Nature, 347, 354-358 (1990)] или при неполном сгорании углеводородов [3- Н. Murayama, S. Tomonoh, J.M. Alford, M.E. Karpuk. Fullerene production in tons and more: From science to industry. Full. Nanotub. Carbon Nanostruct., 12, 1-9 (2004)] и эффективных методов разделения фуллеренов [4 - К. Nagata, Е. Dejima. Y. Kikuchi, М. Hashiguchi. Kilogram-scale [60]fullerene separation from a fullerene mixture: Selective complexation of fullerenes with 1,8-diazabicyclo[5.4.0]undec-7-ene (DBU). Chem. Lett., 34, 178-179 (2005)] низший фуллерен C60 высокой чистоты стал доступен в килограммовых количествах по цене менее 15€/г [5 - http://www.neotechproduct.ru/str6.php?lang=rus].
В результате многолетних исследований фуллеренов и их производных среди них были обнаружены соединения, обладающие ценными свойствами, которые могут найти практическое применение. Так, производные фуллеренов C60 и C70 являются перспективными материалами для органических солнечных батарей, к.п.д. которых достигает 7-8% [6 - Y. Liang, Z. Xu, J. Xia, S.-T. Tsai, Y. Wu, G. Li, C. Ray, L.Yu, For the Bright Future-Bulk Heterojunction Polymer Solar Cells with Power Conversion Efficiency of 7.4%. Adv. Mater. 22, 1-4, (2010)], а также незаменимыми компонентами полевых транзисторов [7 - T.D. Anthopoulos, С.Tanase et al. Ambipolar Organic Field-Effect Transistors Based on a Solution-Processed Methanofullerene. Adv. Mater., 16, 2174 (2004)]. Кроме того, некоторые производные фуллеренов могут найти применение в качестве в у тсокотемпературных сверхпроводников [8 - M.J. Rosseinsky. Recent developments in the chemistry and physics of metal fullerides. Chem. Mater., 10, 2665-2685 (1998)], протонных проводников [9 - R. Maruyama. Electrochemical mass-flow control of hydrogen using a fullerene-based proton conductor. Electrochemica Acta, 48, 85-89 (2002)], материалов нелинейной оптики [10 - L. W. Tutt, A. Kost. Optical limiting performance of C60 and C70 solutions. Nature, 356, 225-226 (1992)] и др.
Одна из наиболее важных перспектив практического применения соединений фуллеренов - их использование в медицинских исследованиях. На сегодняшний день уже известны водорастворимые производные фуллеренов, в основном содержащие ионогенные группы - аминные [11 - О. Troshina, P. Troshin, A. Peregudov, V. Kozlovski, R. Lyubovskaya. Photoaddition of N-Substituted Piperazines to C6o: An Efficient Approach to the Synthesis of Water-Soluble Fullerene Derivatives. Chem. Eur. Journal, 12, 5569-5577 (2006)] и карбоксильные [12 - M. Brettereich, A. Hirsch. A highly water-soluble dendro[60]fullerene. Tetrahedron Letters, 39, 2731-2734 (1998); 13-0. Troshina, P. Troshin, A. Peregudov, V. Kozlovskiy, J. Balzarini, R. Lyubovskaya. Chlorofullerene C60Cl6: a precursor for straightforward preparation of highly water-soluble polycarboxylic fullerene derivatives active against HIV. Org. Biomol. Chem., 5. 2783-2791 (2007)], являющиеся потенциальными противовирусными (в т.ч. анти-ВИЧ) [14 - S. Wilson in «Perspectives of Fullerene Nanotechnology», E. Osawa Ed. 2001, Kluver Academ; 15 - Патент РФ №RU 2236852 C1 «Средство для ингибирования репродукции оболочечных вирусов, способ его получения, фармацевтическая композиция и способ ингибирования вирусных инфекций», ЗАО "Деско", директор Л.Д. Раснецов] и нейрозащитными препаратами [16 - A. Lin, S. Fang, S. Lin, С.Chou, Т. Luh, L. Ho. Local carboxyfullerene protects cortical infarction in rat brain. NeuroScience Research, 43, 317-321 (2002)]. Некоторые производные фуллеренов показали высокую противоопухолевую активность в условиях фотодинамической [17 - Y. Tabata, Т. Ishii, Т. Aoyama, R. Oki, Y. Hirano, О. Ogawa, Y. Ikada in «Perspectives of Fullerene Nanotechnology», E. Osawa (Ed.) 2001, Kluver Academ. Publ., Dordrecht-Boston-London.; 18 - Андреев С.M. Лаптев В.П. Панферова Н.Г. Романова В.С., Петров В.В. Овчинников А.Е., Патент РФ RU 2005140680 А «Фармацевтическая композиция для фотодинамической тграпии и способ лечения онкологического заболевания с ее использованием»] и химической [19 - К. YASUHIKO, О. KENK, IDEAL STAR INC, патент JP2005053904 (А) «Fullerene and anticancer therapeutic agent»; 20 - Заявка на патент №PST/RU2007/000337. 2007 «Полифункциональные аминокислотные производные фуллерена C60, содержащие биологически активные группировки, пептиды или белки, способы их получения (варианты), применение их в качестве доноров монооксида азота и в качестве вазодилататоров, а также способ ингибирования процесса метастазирования» Котельников А.И., Романова B.C., Богданов Г.Н., Коновалова Н.П., Котельникова Р.А., Файнгольд И.И., Фрог Е.С., Писаренко О.И., Бубнов Ю.Н., Давыдов М.И., Алдошин С.М.]
терапии раковых опухолей. Таким образом, из всего сказанного выше можно сделать вывод о большой практической ценности производных фуллерена.
Задачей изобретения является расширение круга полифункциональных органических производных фуллеренов. Поставленная задача решается новым классом фосфорсодержащих производных фуллеренов общей формулы 1, а именно:
где в общей формуле 1 X означает, но не ограничивается:
- атом водорода (-Н), присоединенный к углеродному каркасу, или
- линейный или разветвленный алкильный (CnH2n+1; n=1-20) радикал, присоединенный к фуллереновому каркасу;
где в общей формуле 1 R1 описывается, но не ограничивается нижеследующими определениями:
- атом водорода (-Н), линейный или разветвленный алкильный (CnH2n+1; n=1-20), алкенильный (CnH2n-1; n=1-20) или алкинильный радикал (CnH2n-3; n=1-20);
- остаток алкилгалогенида -(CH2)nHal (Hal=F, Cl, Br, I), алифатического спирта -(СН2)nOH, простого эфира -(CH2)nOR'1 или -(CH2CH2O)nR'1, тиола -(CH2)nSH, карбоновой кислоты -(СН2)nCOOH, сложного эфира -(CH2)nCOOR'1 или амида -(CH2)nCONR'1R'2, для которых n=0-20, а R'1 и R'2 - это атомы водорода или линейные или разветвленные алкильные (CmH2m+1; n=1-20), алкенильные (CmH2m-1; n=1-20) или алкинильные радикалы (CmH2m-3; n=1-20);
- замещенный или незамещенный насыщенный (CnH2n-3; n=3-10) или ненасыщенный (CnH2n-5; n=5-10, CnH2n-7; n=5-10, CnH2n-9; n=8-10) циклический фрагмент;
- фенильный радикал состава C6H5-kYk, где k=0-5, а Y является заместителем в бензольном ядре и представляет собой атом водорода, карбоксильную группу (СООН), сложноэфирную группу (COOR1), амидную группу (CONR1R2), нитрогруппу (NO2), атом галогена (F, Cl, Br, I), гидроксильную группу ОН, фрагмент простого эфира -OR1, незамещенную (-NH2), однократно замещенную (-NHR1) или двукратно замещенную (-NR1R2) аминогруппу, углеводородный радикал С1-С30, арильный или какой-либо другой заместитель, хорошо известный и используемый в химии ароматических соединений ряда бензола;
- нафтильный радикал состава C10H7-kYk, где k=0-7, а Y является заместителем в нафталиновой системе и представляет собой атом водорода, карбоксильную группу (СООН), сложноэфирную группу (COOR1), амидную группу (CONR1R2), нитрогруппу (NO2), атом галогена (F, Cl, Br, I), гидроксильную группу ОН, фрагмент простого эфира -OR1, незамещенную (-NH2), однократно замещенную (-NHR1) или двукратно замещенную (-NR1R2) аминогруппу, углеводородный радикал C1-C30 или какой-либо другой заместитель, хорошо известный и используемый в химии ароматических соединений ряда нафталина;
- пятичленный ароматический гетероциклический радикал состава C4H3-kYk, где k=0-3, Z=O, S, NR1, NR1R2+, SiR1R2, a Y является заместителем в гетероциклической системе и представляет собой атом водорода, карбоксильную группу (СООН), сложноэфирную группу (COOR1), амидную группу (CONR1R2), нитрогруппу (NO2), атом галогена (F, Cl, Br, I), гидроксильную группу ОН, фрагмент простого эфира -OR1, незамещенную (-NH2), однократно замещенную (-NHR1) или двукратно замещенную (-NR1R2) аминогруппу, углеводородный радикал С1-С30, арильный или какой-либо другой заместитель, хорошо известный и используемый в химии пятичленных гетероароматических соединений;
- пятичленный ароматический гетероциклический радикал состава C3H2-kYkZ1Z2, где k=0-2, Z1 и Z2 могут быть одинаковыми или разными фрагментами из числа О, S, N-, NR1, NR1R2+, SiR1-, SiR1R2, а Y является заместителем в гетероциклической системе и представляет собой атом водорода, карбоксильную группу (СООН), сложноэфирную группу (COOR1), амидную группу (CONR1R2), нитрогруппу (NO2), атом галогена (F, Cl, Br, I), гидроксильную группу ОН, фрагмент простого эфира -OR1, незамещенную (-NH2), однократно замещенную (-NHR1) или двукратно замещенную (-NR1R2) аминогруппу, углеводородный радикал С1-С30, арильный или какой-либо другой заместитель, хорошо известный и используемый в химии пятичленных гетероароматических соединений;
- шестичленный ароматический гетероциклический радикал состава C5H4-kYkZ, где k=0-4, Z=N, NR1+, Р, O+, S+ а Y является заместителем в гетероциклической системе и представляет собой атом водорода, карбоксильную группу (СООН), сложноэфирную группу (COOR1), амидную группу (CONR1R2), нитрогруппу (NO2), атом галогена (F, Cl, Br, I), гидроксильную группу ОН, фрагмент простого эфира -OR1, незамещенную (-NH2), однократно замещенную (-NHR1) или двукратно замещенную (-NR1R2) аминогруппу, углеводородный радикал С1-С30, арильный или какой-либо другой заместитель, хорошо известный и используемый в химии шестичленных гетероароматических соединений;
- шестичленный ароматический гетероциклический радикал состава C4H3-kYkZ1Z2, где k=0-3, Z1 и Z2 могут быть одинаковыми или разными фрагментами из числа N, NR1+, Р, O+, S+, а Y является заместителем в гетероциклической системе и представляет собой атом водорода, карбоксильную группу (СООН), сложноэфирную группу (COOR1), амидную группу (CONR1R2), нитрогруппу (NO2), атом галогена (F, Cl, Br, I), гидроксильную группу ОН, фрагмент простого эфира -OR1, незамещенную (-NH2), однократно замещенную (-NHR1) или двукратно замещенную (-NR1R2) аминогруппу, углеводородный радикал С1-С30, арильный или какой-либо другой заместитель, хорошо известный и используемый в химии шестичленных гетероароматических соединений;
- шестичленный ароматический гетероциклический радикал состава C3H2-kYkZ1Z2Z3, где k=0-3, Z1, Z2 и Z3 могут быть одинаковыми или разными фрагментами из числа N, NR1+, Р, O+, S+, а Y является заместителем в гетероциклической системе и представляет собой атом водорода, карбоксильную группу (СООН), сложноэфирную группу (COOR1), амидную группу (CONR1R2), нитрогруппу (NO2), атом галогена (F, Cl, Br, I), гидроксильную группу ОН, фрагмент простого эфира -OR1, незамещенную (-NH2), однократно замещенную (-NHR1) или двукратно замещенную (-NR1R2) аминогруппу, углеводородный радикал C1-С30, арильный или какой-либо другой заместитель, хорошо известный и используемый в химии шестичленных гетероароматических соединений;
Кроме того поставленная задача решается способом получения фосфорсодержащих производных фуллеренов формулы 1.
Сущность заявляемого изобретения заключается в следующем.
Заявляемые фосфорсодержащие производные фуллеренов, описывающиеся общей формулой 1, являются новым, ранее неизвестным классом соединений фуллеренов. Предполагается, что эти производные фуллеренов найдут применение в фармакологических и медицинских исследованиях в качестве биосовместимой формы фуллерена, которая может проявлять антибактериальную [21 - Т. Mashino, D. Nishikawa, К. Takanashi, N. Usui, Т. Yamori, М. Seki, Т. Endo, М. Mochizuki. Bioorg. Med. Chem. Lett., 13, 4395-4397 (2003)], противовирусную [22 - Т. Mashino, К. Shimotohno, N. Ikegami, D. Nishikawa, K. Okuda, K. Takahashi, S. Nakamura, M. Mochizuki. Bioorg. Med. Chem. Lett., 15, 1107-1109 (2005)], противораковую [23 - V.P. Gubskaya, L.S. Berezhnaya, A.T. Qubaidullin, I.I. Faingold, R.A. Kotelnikova, N.P. Konovalova, V.I. Morozov, LA. Litvinov, LA. Nuretdinov. Org. Biomol. Chem., 5, 976-981 (2007)] и другие типы биологических активностей. В то же время, перспективным может быть их использование в органической фотовольтаике в качестве светопреобразующих материалов для органических солнечных батарей.
Наиболее близкими структурными аналогами заявляемых фосфорсодержащих производных фуллерена являются описанные ранее соединения общей формулы C60[P(O)R'R'']H, например, соединение 2 [24 - Н. Isobe, A. Chen, N. Solin, Е. Nakamura. Org. Lett., 7, 5633-5635 (2005)], а также смеси соединений общей формулы C60(HP(O)(OR')2)n (n=1-12) с неустановленными составом и строением [25 - К. Kyoji, Japanese Patent "Method for producing chemically modified fullerene", №2010037277A от 03.08.2008].
Имеется ряд принципиальных отличий заявляемых соединений общей формулы 1 от известных ранее аналогов. Во-первых, соединения общей формулы 1 имеют четко установленную структуру с пятью фрагментами P(O)(OR1)2, присоединенными к фуллереновому каркасу вокруг одного пятичленного цикла. Во-вторых, в структуре 1 реализуется циклопентадиенильный мотив присоединения аддендов к каркасу фуллерена C60, а не мотивы [1,2]-присоединения по [6,6]-связи фуллеренового каркаса, как в C60[P(O)R'R'']H [24] или рандемизованного полиприсоединения, как в C60(HP(O)(OR')2)n (n=1-12) [25]. В-третьих, соединения общей формулы 1 содержат в своей структуре дополнительный адденд X, которого нет в формулах известных аналогов.
Наиболее сильно отличаются способы синтеза соединений. Так, соединения общей формулы C60[P(O)R'R'']H получают по реакции фуллерена С60 с фосфиноксидами HP(O)R'R'', используя в качестве растворителей смеси 20% диметилсульфоксида или 20% гексаметилфосфорамида с хлорбензолом. Реакция протекает с достаточно высокими выходами (30-60%), но ее существенными недостатками являются длительность протекания (от 6 до 96 часов) и необходимость использования канцерогенного растворителя - гексаметилфосфорамида. Соединения общей формулы C60(HP(O)(OR')2)n (n=1-12) получают при взаимодействии фуллерена С60 с диалкилфосфонатами HP(O)(OR')2 в присутствии гидрида лития в качестве основания. Образующиеся соединения являются сложными смесями продуктов с неустановленными составом и строением.
Прототипом заявляемого способа получения фосфорсодержащих производных фуллерена является известная в органической химии реакция Арбузова - взаимодействие алкилгалогенидов с алкилфосфитами (Фиг.2) [26 - Арбузов А. Е. ЖРФХО, 38, 687 (1906)]. Данная реакция приводит к образованию фосфонатов, т.е. соединений с одной или несколькими группами P(O)(OR1)2.
Заявляемый способ получения фосфорсодержащих производных фуллерена общей формулы 1 основан на взаимодействии алкилгалогенидов с тризамещенными фосфитами в условиях реакции Арбузова. Принципиальным отличием данного изобретения является использование в качестве галогенида гексахлорфуллерена C60Cl6 (Фиг.3). Реакция хлорфуллерена C60Cl6 с фосфитами протекает при комнатной температуре в присутствии небольшого избытка фосфита при перемешивании раствора реагентов в толуоле.
К преимуществам заявляемого метода получения фосфорсодержащих производных фуллерена общей формулы 1 можно отнести быстроту протекания реакции (от 30 секунд до 10 минут) и высокие выходы продуктов (от 60% до 99%).
Разработанный подход позволяет получать самые разнообразные производные фуллеренов. Отдельные примеры синтезированных соединений представлены на Фиг.4. Выделение продуктов реакции осуществляется с помощью колоночной хроматографии на силикагеле с использованием в качестве элюента смесей толуола с этанолом. Таким способом были получены соединения 1a-1d (Примеры 1-4). В отдельных случаях чистый продукт (96-99%) можно получить сразу после прибавления реагента без использования хроматографической очистки.
Было обнаружено, что соединение 1а хорошо растворяется в воде непосредственно после выделения из синтеза. Водные растворы этого 1а оказались стабильны при хранении их в обычных условиях в течение полугода. При хранении соединения 1а в виде сухого порошка в течение нескольких месяцев оно теряет способность растворяться в воде, что связано, по-видимому, с протекающей кристаллизацией препарата. Заметим, что спектральными методами и хроматографическим анализом (ВЭЖХ) было доказано, что вещество не претерпевает изменений при хранении его в виде сухого порошка и водного раствора. Аналогичным образом была доказана идентичность молекулярного состава растворимой и нерастворимой в воде форм вещества.
Соединение 1е было получено в результате гидролиза фосфонатных групп фосфорсодержащего производного 1а. Гидролиз был проведен по стандартной методике гидролиза эфиров фосфоновых кислот. По реакции 1а с триметилсилилбромидом (TMSBr) был получен соответствующий триметилсилиловый эфир, который был разрушен раствором фторида цезия с образованием кислотного соединения 1е. Как само соединение 1е, так и его соли со щелочными металлами обладают высокой растворимостью в воде (Пример 5).
Состав и строение полученных соединений были доказаны с использованием комплекса физико-химических методов исследования: спектроскопии ЯМР на ядрах 1Н, 31Р и 13С, двумерной корреляционной спектроскопии, масс-спектрометрии, ИК-спектроскопии, оптической спектроскопии поглощения и элементного анализа. Кроме того, при перекристаллизации соединения 1а из гексана удалось получить монокристаллы, что позволило установить структуру соединения 1а методом рентгеноструктурногэ анализа. Чистота соединений подтверждена с использованием высокоэффективной жидкостной хроматографии. Обсуждение всех полученных спектральных и аналитических данных не представляется возможным в рамках данной заявки. Поэтому приводятся данные для наиболее типичных соединений.
Спектр 31Р ЯМР соединения 1а, приведенный на Фиг.6, содержит три сигнала с соотношением интенсивностей 2:2:1, что подтверждает предложенную Cs-симметричную структуру соединения. На Фиг.7 изображен спектр ЯМР 13С соединения 1а. Этот спектр полностью согласуется с молекулярной структурой соединения 1а. Спектр ЯМР 1Н соединения 1а, приведенный на Фиг.5, имеет довольно сложную структуру из-за частичного наложения сигналов от трех типов симметрически неэквивалентных P(O)(OEt)2 групп. Однако наблюдаемые интегральные интенсивности сигналов в целом соответствует предложенной структуре. Высокая чистота полученного препарата 1а подтверждается хроматограммой, приведенной на Фиг.8.
На Фиг.9, Фиг.10 и Фиг.11 изображены спектры ЯМР соединения 1b. Спектр ЯМР на ядрах 31Р соединения 1b содержит три сигнала, аналогично спектру ЯМР 31Р соединения 1а. Спектр ЯМР 1Н соединения 1b оказался сложным для интерпретации, однако, он содержит сигналы, интегральная интенсивность которых удовлетворяет предложенной структуре. Таким образом, спектры ЯМР на ядрах 31Р, 13С и 1Н подтверждают предложенную Cs-симметричную структуру соединения 1b.
Спектры ЯМР 1Н, 31Р и 13С соединения 1с, изображенные на Фиг.12, Фиг.13 и Фиг.14, подтверждают предложенное молекулярное строение.
На Фиг.15, Фиг.16 и Фиг.17 приведены спектры ЯМР 1Н, 31Р и 13С соединения 1d, подтверждающие его Cs-симметричную структуру.
Спектры ЯМР на ядрах 1Н, 31C и 13P соединения 1е, изображенные на Фиг.18, Фиг.19 и Фиг.20, соответствуют предложенной структуре. В спектре ЯМР 1H соединения 1е обнаружен всего один синглет, соответствующий атому водорода, присоединенному к фуллереновому каркасу.
Заявляемое изобретение иллюстрируется, но никак не ограничивается, следующими примерами:
Пример 1. Синтез соединения 1а
Хлорфуллерен C60Cl6 (500 мг, 0,5 ммоль) растворяли в атмосфере аргона в 200 мл свежеперегнанного толуола. К раствору в токе аргона добавляли избыток триэтилфосфита (1,5 мл, 8,7 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 20 минут. Степень протекания реакции контролировали с помощью тонкослойной хроматографии на пластинке с силикагелем. Выделение продуктов реакции осуществляли с помощью колоночной хроматографии на силикагеле с использованием в качестве элюентов смесей толуола с этанолом. Выход аналитически чистого (99+%) продукта составил 669 мг (95% от теории).
1Н ЯМР (500 МГц, CDCl3, δ, м.д): 1.30 (m, 6Н), 1.35 (м, 24Н), 4.25 (м, 2Н), 4.37 (м, 18Н).
31Р ЯМР (500 МГц, CDCl3, δ, м.д): 15.88 (м,2Р), 16.07 (уш.с, 2Р), 21.03 (м, 1Р).
13С ЯМР (500 МГц, CDCl3, δ, м.д): 16.53, 16.57, 16.62, 16.66, 16.72, 22.55, 22.64, 25.28, 29.05, 31.57, 34.67, 54.63, 56.90, 58.04, 63.84, 64.13, 64.19, 64.27, 64.45, 64.51, 138.60, 143.26, 143.35, 143.93, 143.98, 144.39, 144.49, 144.84, 144.89, 145.43, 145.71, 146.24, 146.55, 146.65, 146.86, 146.95, 148.05, 148.13, 148.20, 148.28, 148.36, 148.63, 148.67, 148.91, 148.90, 150.69, 150.78.
Пример 2. Синтез соединения 1b.
Соединение 1b получали аналогично соединению 1а. Выход аналитически чистого (99+%) продукта составил 574 мг (68% от теории).
1Н ЯМР (500 МГц, CDCl3, δ, м.д): 0.91 (м, 30Н), 1.39 (м, 20Н), 1.73 (м, 20Н), 4.35 (м, 20Н), 5.70 (с, 1Н).
31Р ЯМР (500 МГц, CDCl3, δ, м.д): 15.50 (м, 2Р), 15.85 (м, 2Р), 20.53 (м, 1Р).
13С ЯМР (500 МГц, CDCl3, δ, м.д): 13.65, 13.73, 13.75, 18.68, 18.72, 29.69, 32.62, 32.65, 32.79, 32.92, 54.72, 57.62, 57.76, 58.15, 58.93, 59.18, 60.33, 67.95, 68.08, 68.14, 68.20, 68.30, 68.37, 138.72, 143.11, 143.13, 143.30, 143.84, 143.89, 144.34, 144.38, 144.48, 144.76, 144.85, 145.44, 145.53, 146.66, 146.86, 146.96, 148.04, 148.11, 148.23, 148.29, 148.34, 148.62, 148.64, 148.82, 149.03, 149.33.
Пример 3. Синтез соединения 1с.
Соединение 1 с получали аналогично соединению 1а. Выход аналитически чистого (99+%) продукта составил 542 мг (70% от теории).
1Н ЯМР (500 МГц, CD3OD:CS2 (1:1), δ, м.д): 1.26 (м, 10Н), 1.32 (м, 14Н), 1.37 (м, 14Н), 1.43 (м, 20Н), 1.48 (д, 7Н), 1.50 (д, 7Н), 5.01 (м, 4Н), 5.09 (м, 4Н), 5.18 (м, 2Н).
31Р ЯМР (500 МГц, CD3OD:CS2 (1:1), δ, м.д): 13.79 (д, 2Р), 14.89 (м, 2Р), 17.99 (с, 1P).
13С ЯМР (500 МГц, CD3OD:CS2 (1:1), δ, м.д): 23.37, 23.42, 23.55, 23.60, 23.65, 23.79, 23.82, 23.91, 24.04, 29.63, 57.30, 58.30, 58.43, 59.50. 59.65, 60.86, 69.68, 70.10, 72.44, 73.38, 73.60, 73.66, 73.74, 73.93, 73.99, 142.98, 143.36, 143.78, 143.93, 144.29, 144.68, 144.75, 144.83, 145.60, 145.93, 146.76, 146.95, 147.04, 148.04, 148.09, 148.29, 148.37, 148.62, 149.0, 149.09, 149.35, 149.68, 150.79.
Пример 4. Синтез соединения 1d.
Соединение 1d получали аналогично соединению 1а. Выход аналитически чистого (99+%) продукта составил 596 мг (68% от теории).
1Н ЯМР (500 МГц, CDCl3, δ, м.д): 3.81 (м, 20Н), 4.58 (м, 20Н).
31Р ЯМР (500 МГц, CDCl3, δ, м.д): 16.05 (м, 2Р), 16.28 (м, 2Р), 21.03 (м, 1Р).
13С ЯМР (500 МГц, CDCl3, δ, м.д): 43.04, 43.09, 43.17, 43.22, 43.28, 43.32, 43.50, 43.54, 54.52, 56.77, 57.47, 57.91, 58.63, 58.90, 60.07, 67.54, 67.59, 67.88, 67.90, 67.95, 68.0, 68.11, 68.17, 138.70, 142.96, 143.50, 143.52, 143.99, 144.16, 144.20, 144.43, 144.51, 144.62, 145.12, 145.37, 146.65, 146.88, 146.96, 147.41, 147.79, 148.23, 148.30, 148.38, 148.47, 148.84, 148.87, 149.09, 149.95.
Пример 5. Синтез соединения 1е.
Соединение 1а (200 мг, 0,14 ммоль) растворяли в атмосфере аргона в 60 мл хлороформа, высушенного над фосфорным ангидридом. К раствору в токе аргона добавляли избыток триметилсилилбромида (1,2 мл, 7,5 ммоль). Реакционную смесь кипятили в течение 24 часов. Степень протекания реакции контролировали с помощью высокоэффективной жидкостной хроматографии. Полученный триметилсилиловый эфир гидролизовали смесью метанола (40 мл) с водой (20 мл). Продукт реакции экстрагировали этилацетатом, органический слой сушили над сульфатом натрия, растворитель отгоняли на роторном испарителе. Выход продукта 1е составил 148 мг (94% от теории).
1Н ЯМР (500 МГц, CD3OD, δ, м.д): 4.62 (с, 1H).
31Р ЯМР (500 МГц, CD3OD, δ, м.д): 10.88 (м, 4Р), 16.57 (с, 1Р).
13С ЯМР (500 МГц, CD3OD, δ, м.д): 52.54, 52.67, 52.83, 52.97, 56.84, 57.54, 59.03, 59.90, 60.67, 61.55, 138.55, 143.32, 143.95, 144.37, 144.91, 145.04, 145.18, 145.64, 146.30, 146.32, 146.53, 146.59, 147.94, 148.09, 148.25, 148.47, 148.54, 148.80, 148.91, 149.06, 149.49, 151.10.
Пример 6. Синтез соединений 1f-1i.
Соединения 1f-1i были получены аналогично соединениям 1a-1d, методики для которых представлены выше.
1. Фосфорсодержащие производные фуллеренов общей формулы 1, а именно где в общей формуле 1 Х означает:- атом водорода (-Н), присоединенный к углеродному каркасу, или- линейный или разветвленный алкильный (CnH2n+1; n=1-20) радикал, присоединенный к фуллереновому каркасу;где в общей формуле 1 R1 означает:- атом водорода (-Н), линейный или разветвленный алкильный (CnH2n+1; n=1-20), алкенильный (CnH2n-1; n=1-20) или алкинильный радикал (CnH2n-3; n=1-20);- остаток алкилгалогенида -(CH2)nHal (Hal=F, C1, Br, I), простого эфира -(CH2)nOR'1 или -(CH2CH2O)nR'1, для которых n=0-20, a R'1 - это атомы водорода или линейные или разветвленные алкильные (CmH2m+1; n=1-20), алкенильные (CmH2m-1; n=l-20) или алкинильные радикалы (CmH2m-3; n=1-20).
2. Способ получения фосфорсодержащих производных фуллеренов, охарактеризованных в п.1, по реакции Арбузова, отличающийся тем, что в реакции с соответствующими органическими фосфитами вводится хлорид фуллерена C60Cl6.