Способ детекции белков в амилоидном состоянии и набор для детекции белков в амилоидном состоянии
Иллюстрации
Показать всеИзобретение относится к области молекулярной биологии и медицинской диагностики. Предложен способ детекции белков в амилоидном состоянии, в котором получают образец лизата культуры дрожжей или ткани млекопитающего, добавляют к образцу ионный детергент, концентрируют белки в амилоидной форме на ацетатцеллюлозной мембране и детектируют их с использованием аптамеров, их конъюгатов или антител, специфичных к амилоидной форме белков. Также предложен набор для детекции белков в амилоидном состоянии. Изобретение может быть использовано в медицине для диагностики амилоидозов. 2 н. и 7 з. п. ф-лы, 6 ил., 7 пр.
Реферат
Область техники
Настоящее изобретение относится к молекулярной биологии и медицинской диагностике, в частности к способу диагностики амилоидозов, основанном на детекции амилоидов, в том числе их инфекционных вариантов - прионов, в биологических жидкостях животных и человека.
Предшествующий уровень техники
Амилоиды - это нерастворимые белковые агрегаты, имеющие фибриллярную структуру, и устойчивые к действию протеаз. Амилоидные фибриллы представляют собой линейные полимеры, состоящие из нековалентно связанных между собой молекул белка. Эти полимеры образуются за счет присоединения белковых мономеров к их концам; при этом процесс роста сопровождается обогащением присоединяемых мономеров β-слоями, которые располагаются перпендикулярно оси полимеров, связанной с конформационной перестройкой с формированием специфичной "кросс-β" структуры. Для амилоидов характерно взаимодействие с некоторыми красителями, прежде всего, с конго красным и тиофлавином Т (Chiti F., Dobson C.M. 2006. Protein misfolding, functional amyloid, and human disease. Annu. Rev. Biochem. 75, 333-366).
Классификация амилоидозов сложна и неоднозначна: выделяют системные амилоидозы (поражаются многие органы) и орган-специфичные амилоидозы, первичные амилоидозы (накопление амилоидов приводит к заболеванию) и вторичные (накопление амилоидов обусловлено каким-то другим заболеванием). Наконец, амилоидозы разделяют на неинфекционные и инфекционные (прионные) (Sipe J.D., Cohen A.S. 2000. History of the amyloid fibril. J. Struct. Biol. 130, 88-98).
Интерес к химической и физической природе амилоидов обусловлен, в первую очередь, их связью с обширной группой заболеваний человека и животных. Эти заболевания объединяют под общим названием амилоидозы. Некоторые из этих заболеваний, обусловленные особой разновидностью амилоидов, называемых прионами, трансмиссивны. Прионные амилоиды описаны не только у млекопитающих, но и у низших эукариот, у которых они выступают в роли нехромосомно наследуемых детерминант.
Инфекционный прионный белок животных, названный PrPSc, представляет собой особую конформационно-измененную изоформу клеточного белка PrPC, отличающуюся от него по своей пространственной структуре. Инфекционная форма белка PrPSc, попадая в организм извне или спонтанно в нем возникая, способна стимулировать превращение нормальной формы PrPC в патогенную аномальную форму PrPSc посредством белок-белковых взаимодействий. Таким образом обеспечивается автокаталитическое поддержание прионной изоформы белка (Prusmer, S.B., Scott, M.R., DeArmond,S.J., Cohen,F.E. (1998) Prion protein biology. Cell, 93, 337-348). К числу наиболее известных заболеваний животных этого типа относят так называемое «коровье бешенство».
К числу наиболее известных заболеваний человека, связанных с образованием амилоидов, относят амилоидозы центральной нервной системы (болезни Крейтцфельдта-Якоба, Альцгеймера, Паркинсона, Гентингтона), а также сахарный диабет типа 2 и некоторые формы спиноцеребральной атаксии и катаракты (Галкин А.П., Миронова Л.Н., Журавлева Г.А., Инге-Вечтомов С.Г. Генетика (2006) 42, №11, 1558-1570).
Доступные в настоящее время методы диагностики прионных заболеваний основаны на исследовании инфекционности образцов тканей заболевшей особи или на иммунодетекции патогенной формы белка PrP. Первый метод потенциально может быть весьма чувствительным, однако его недостатком является длительное время, проходящее между инокуляцией инфекционного материала подопытному животному и развитием у него заболевания. Возможности детекции патогенной формы белка могут быть ограничены ее низким содержанием в тканях и жидкостях (кровь, моча, лимфа, слюна).
Получены моноклинальные антитела, различающие патогенную и нормальную формы белка PrP (Korth, С., Stierii, В., Streit, P., Moser, M., Schaller, О., Fisher, R., Schultz-Schaeffer, W., Kretzschmar, H., Raeber, A., Braun, U., Ehrensperger, F., Homemann, S., Glockshuber, R., Riek, R., Billeter, M., Wuthrich, K. and Oesch, B. (1997) Prion PrPSc-specific epitope defined by a monoclonal antibody. Nature, 390, 74-77; O'Nuallain, В., Wetzel, R. (2002) Conformational Abs recognizing a generic amyloid fibril epitope. Proc. Natl. Acad. Sci. USA, 99, 1485-1490). Тем не менее, практикуемые ныне методы диагностики основаны на исследовании аутопсийных образцов тканей мозга.
В последнее время появились попытки разработать новые методы диагностики прионных заболеваний, основанные на иных принципах. Один из таких подходов основан на способности прионных белков переходить в патогенную форму in vitro. В подобных экспериментах смешивают в пробирке белок, находящийся в прионном состоянии, с его неприонным вариантом и наблюдают превращение нормального белка в прионную форму. Как мы уже отмечали выше, такое превращение проходит эффективно для белка Sup35 дрожжей, но не для белка PrP млекопитающих. Был разработан способ увеличения скорости превращения белка PrP в прионную форму. Этот метод основан на периодическом ультразвуковом дроблении прионных агрегатов (Saborio, G.P., Permanne, В. and Soto, С. (2001) Sensitive detection of pathological prion protein by cyclic amplification of protein misfolding. Nature, 411, 810-813).
Многообещающей альтернативой существующим подходам для диагностики прионных заболеваний, а также для создания принципиально новых препаратов с возможным терапевтическим действием является процедура конструирования и селективного отбора коротких олигонуклеотидов (аптамеров) ДНК-ового или РНК-ового происхождения из огромного набора исходной смеси химически синтезированных фрагментов со случайной последовательностью ("SELEX" - Systematic Evolution of Ligands by Exponential enrichment), Klug S.J., Famulok M. (1994) All you wanted to know about SELEX. Molecular Biology Reports, 20, 97-107).
Так в патентной заявке РСТ W02006138676 описаны группа полинуклеотидов (аптамеров), обладающих способностью к связыванию с белком PrP, и способ детекции белка PrP с использованием указанных аптамеров.
Однако до сих пор не существует метода определения концентрации патогенного прионного белка в биологических жидкостях и тканях (кроме мозга) больных животных вследствие его очень маленьких количеств. Одной из основных проблем создания метода выявления патогенного прионного белка является концентрирование прионного белка до детектируемых количеств.
Описание изобретения
Целью настоящего изобретения является создание быстрого, эффективного и надежного способа детектирования белков в амилоидном состоянии.
В результате тщательного исследования авторами настоящего изобретения был разработан способ детекции белков в амилоидном состоянии, в котором получают образец лизата культуры дрожжей, ткани или биологической жидкости млекопитающего, концентрируют белки в амилоидной форме на ацетатцеллюлозной мембране и детектируют их с использованием аптамеров или антител. Размер пор мембраны выбирается таким, чтобы задерживать прионные полимеры, но пропускать все остальные вещества с более низкой молекулярной массой.
Достоинствами и преимуществами настоящего изобретения являются простота, доступность, экономичность, возможность быстрого и одновременного анализа большого количества образцов и высокая чувствительность способа за счет неограниченной возможности концентрирования белков в амилоидном состоянии за счет пропускания неограниченного количества тестируемого образца через мембрану.
Таким образом, настоящее изобретение предоставляет способ неинвазивной диагностики белков в амилоидном состоянии в биологических жидкостях млекопитающего, в частности человека, аналогов которому в настоящее время нет.
Для детекции белков в амилоидном состоянии могут быть использованы аптамеры и антитела, специфичные к белкам в амилоидном состоянии.
Так, например, ранее авторы настоящего изобретения в результате тщательного скрининга отобрали аптамеры, обладающие способностью эффективно и специфически связываться с белком Sup35 дрожжей S. cerevisiae в фибриллярном амилоидном состоянии и не связываться с его мономерной формой, показана возможность использования указанных аптамеров для детектирования прионных форм белков млекопитающих, в частности белка PrP, в инфекционном материале животных, а также полиглутаминовых белков, например Q70, являющегося аналогом белка гентингтина, и разработан способ детектирования указанных прионных форм белков с использованием указанных аптамеров (российская патентная заявка 2010125875).
Таким образом, целью настоящего изобретения является предоставление способа детекции белков в амилоидном состоянии, в котором получают образец лизата культуры дрожжей или ткани млекопитающего или образец биологической жидкости млекопитающего, добавляют к образцу ионный детергент, концентрируют белки в амилоидной форме на ацетатцеллюлозной мембране и детектируют их с использованием аптамеров или антител.
Также целью настоящего изобретения является предоставление описанного выше способа, в котором биологической жидкостью является кровь, лимфа, слюна или моча млекопитающего.
Также целью настоящего изобретения является предоставление описанного выше способа, в котором указанным детергентом является натрий лауроилсаркозин (саркозил).
Также целью настоящего изобретения является предоставление описанного выше способа, в котором концентрирование белков в амилоидной форме на ацетатцеллюлозной мембране осуществляют пропусканием образца лизата через ацетатцеллюлозную мембрану.
Также целью настоящего изобретения является предоставление описанного выше способа, в котором используют ацетатцеллюлозную мембрану с размером пор 0,1-0,4 мкм.
Также целью настоящего изобретения является предоставление описанного выше способа, в котором детектирование белков в амилоидном состоянии, адсорбированных на ацетатцеллюлозной мембране, осуществляют с использованием аптамеров, их конъюгатов или антител, специфических к белкам в амилоидном состоянии.
Также целью настоящего изобретения является предоставление описанного выше способа, в котором указанный конъюгат содержит метку, узнаваемую антителами.
Также целью настоящего изобретения является предоставление набора для детекции белков в амилоидном состоянии, содержащего ацетатцеллюлозную мембрану; ионный детергент; аптамер, его конъюгат и/или антитело, специфичные к амилоидной форме белков; и инструкцию по применению набора в соответствии с описанным выше способом.
Также целью настоящего изобретения является предоставление описанного выше набора, в котором ацетатцеллюлозная мембрана имеет размер пор 0,1-0,4 мкм.
Также целью настоящего изобретения является предоставление описанного выше набора, в котором указанным детергентом является натрий лауроилсаркозин (саркозил).
Более детально настоящее изобретение описано ниже.
Подробное описание настоящего изобретения
Концентрирование белков в амилоидном состоянии в способе согласно настоящему изобретению осуществляют путем пропускания тестируемого образца через мембрану. Размер пор мембраны выбирается таким, чтобы задерживать прионные полимеры, но пропускать все остальные вещества с более низкой молекулярной массой. Авторами настоящего изобретения было показано, что предпочтительно использование ацетатцеллюлозной мембраны с размером пор 0,1-0,4 мкм, наиболее предпочтительно 0,2 мкм.
Образцом культуры ткани млекопитающего может быть как необработанный лизат клеток, так и лизат, предварительно обработанный с целью его очистки от белков, не образующих амилоиды, для уменьшения фона неспецифического связывания аптамера с такими белками из изучаемого образца. Однако способ согласно настоящему изобретению является достаточно эффективным и обладает высокой чувствительностью за счет возможности неограниченного концентрирования при отсутствии необходимости очистки от белков, не образующих амилоиды, так что предварительная обработка лизата перед пропусканием через мембрану не является обязательной.
Исследуемыми образцами также могут быть растворы веществ, выделенных из биологических жидкостей или тканей животного или человека, в том числе предназначенные для производства лекарственных препаратов, биологических добавок или косметических средств.
Исследуемыми образцами также могут быть биологические жидкости млекопитающего, в частности человека. Биологические жидкости, которые могут быть использованы в способе согласно настоящему изобретению, включают кровь, лимфу, слюну, мочу, но не ограничиваются ими.
Возможность пропускания неограниченного количества тестируемого образца через мембрану предоставляет неограниченные возможности концентрирования белков в амилоидном состоянии на указанной мембране, что обеспечивает высокую чувствительность способа детекции согласно настоящему изобретению и предоставляет возможность анализа биологических жидкостей с очень малыми количествам PrPSc. Таким образом, настоящее изобретение предоставляет способ неинвазивной диагностики белков в амилоидном состоянии в биологических жидкостях млекопитающего, в частности человека, аналогов которому в настоящее время нет.
Тестирование наличия в образцах белков в амилоидном состоянии, сорбированных на мембране, проводят с использованием аптамеров или антител, специфичных к белкам в амилоидном состоянии.
Термин "аптамер", используемый в настоящем изобретении, означает одноцепочечный олигонуклеотид, обладающий способностью к связыванию с другой молекулой (молекулой-мишенью) и образованию с ней относительно устойчивого комплекса. При этом такое связывание происходит не за счет стандартного связывания между парами оснований по Уотсону-Крику за счет водородных связей, а за счет других типов нековалентных связей. Такие типы связей включают нековалентные водородные связи, электростатическое взаимодействие, связывание по Ван дер Вальсу, гидрофобные взаимодействия или их комбинации. При этом такой аптамер связывается с целевой молекулой с гораздо более высокой аффиностью, чем с остальными молекулами, присутствующими в образце.
Способы конструирования и определения характеристик связывания аптамеров с целевыми молекулами хорошо известны из уровня техники (см., например, Lorsch and Szostak (1996) или патенты США №5,582,981, 5,595,877, 5,637,459). Сами аптамеры могут быть получены любым известным методом, включая химический синтез, методы рекомбинантных ДНК, с использованием стандартных методов очистки. Также термин «аптамер» относится и к вторичным аптамерам, содержащим так называемую «консенсусную» последовательность, полученную путем анализа двух или нескольких аптамеров, связывающихся с одной и той же целевой молекулой. Как правило, длина аптамера может варьироваться от 10 до 40 или более нуклеотидов, необходимых для связывания с целевой молекулой.
Аптамеры содержат нуклеотидную последовательность, определяющую специфичность связывания с целевой молекулой, но при этом также могут содержать участки, фланкирующие эту последовательность, которые необходимы, например, для амплификации всего аптамера методом ПЦР, или содержат сайты эндонуклеаз рестрикции для лигирования аптамера в плазмиды, клонирования и т.п. Такие фланкирующие последовательности обычно содержат от 10 до 30 нуклеотидов, при этом часть из этих нуклеотидов может иметь случайный состав.
Также аптамеры согласно настоящему изобретению могут содержать различные ковалентно связанные функциональные модификации и дополнительные лиганды, необходимые для детектирования связывания аптамера с целевой молекулой, например флуоресцентные красители, биотин или различные ферменты, активность которых легко детектировать (пероксидазы, люциферазы, щелочной фосфатазы и подобные им). Такие модифицированные аптамеры могут быть получены стандартными методами, хорошо известными специалистам в данной области техники, например, в ходе твердофазного синтеза олигонуклеотидов или в растворе с использованием фосфотриэфирного метода.
Примером аптамеров, специфически связывающихся с белками в амилоидном состоянии, являются аптамеры S1-S4, содержащие нуклеотидные последовательности, выбранные из группы, состоящей из последовательностей, приведенных в Перечне последовательностей под номерами SEQ ID NO:1-4, полученные авторами настоящего изобретения ранее с использованием процедуры SELEX (Systematic Evolution ofLigands by Exponential enrichment) и описанные в российской патентной заявке 2010125875. Аптамер S4 (SEQ ID NO:4) является предпочтительным. Указанные олигонуклеотиды обладают способностью связываться с белками, образующими амилоиды, с высокой специфичностью и эффективностью. Также указанные олигонуклеотиды могут быть использованы для детектирования белков, образующих амилоиды, в частности, прионных белков.
Для детектирования связывания олигонуклеотидов (аптамеров) согласно настоящему изобретению с белками, образующими амилоиды, могут использоваться любые методы, известные специалистам в данной области техники. Могут быть применены методы с использованием радиоактивных изотопов, когда для связывания с целевой молекулой используются радиоактивно меченные олигонуклеотиды, например 32Р-меченные олигонуклеотиды, а степень связывания определяют после отмывки образца по остаточной радиоактивности. Могут быть использованы методы количественной ПЦР, например ПЦР в реальном времени, когда определяют количество олигонуклеотидов, связавшихся с целевой молекулой и оставшихся в составе комплекса аптамер - целевая молекула, после денатурации такого комплекса.
Также могут быть использованы функциональные модификации олигонуклеотидов (аптамеров) или дополнительные лиганды, необходимые для детектирования связывания аптамера с целевой молекулой, например флуоресцентные красители, например карбоксифлуоресцеин (FAM), биотин или различные ферменты, активность которых легко детектировать (пероксидазы, люциферазы, щелочной фосфатазы и подобные им). В случае использования биотинилированного производного олигонуклеотида используют пероксидазу, люциферазу и щелочную фосфатазу слитую со стрептовидином или авидином, при этом стрептовидин и авидин связывается с биотином, а пероксидазу, щелочную фосфатазу и люциферазу используют для детектирования связывания.
Также могут быть использованы конъюгаты аптамера с меткой, например FAM, а в качестве молекулы, позволяющей детектировать связывание указанного аптамера с амилоидами, используют антитела к такой метке.
Один из вариантов воплощения настоящего изобретения предоставляет набор для детекции белков в амилоидном состоянии, содержащий ацетатцеллюлозную мембрану; ионный детергент; аптамер, его конъюгат и/или антитело, специфичные к амилоидной форме белков; и инструкцию по применению набора в соответствии со способом согласно настоящему изобретению. Ацетатцеллюлозная мембрана в указанном наборе имеет размер пор 0,1-0,4 мкм, предпочтительно 0,2 мкм. Наиболее предпочтительным ионным детергентом является натрий лауроилсаркозин (саркозил).
Краткое описание рисунков
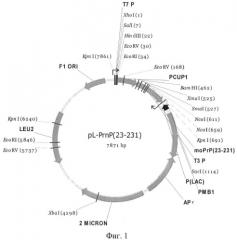
На Фиг.1 приведена карта плазмиды pL-prnP.
На Фиг.2 приведена карта плазмиды pL-moPnP.
На Фиг.3 показаны результаты сравнительного анализа адсорбции белков лизатов дрожжей при прохождении растворов через ацетатцеллюлозную или нитроцеллюлозную мембрану. Белки окрашивали неспецифическим красителем Понсо.
На Фиг.4 показано влияние детергентов SDS и саркозила на эффективность адсорбции амилоидов PrP на ацетатцеллюлозную мембрану. В первой точке исходный лизат разведен в 10 раз, в каждой следующей - последовательные разведения в 4 раза.
На Фиг.5 приведены результаты анализа специфичности связывания аптамера S4 с амилоидами прионного белка (PrP), образованными его укороченной (90-231) или полноразмерной (23-231) формами. В первой точке исходный лизат разведен в 10 раз, в каждой следующей - последовательные разведения в 4 раза.
На Фиг.6 показано влияние присутствия ДНК и РНК на специфичность связывания аптамеров с амилоидным прионным белком. «+» - образцы, обработанные ферментами ДНКазой и РНКазой; «-» - образцы, не обработанные этими ферментами. В первой точке исходный лизат разведен в 10 раз, в каждой следующей - последовательные разведения в 4 раза.
Примеры
Настоящее изобретение будет более подробно описано ниже со ссылкой на следующие не ограничивающие настоящее изобретение Примеры.
Пример 1. Конструирование экспрессионной плазмиды для получения полноразмерного белка мыши PrP (23-231) и его укороченного варианта PrP (90-231).
Многокопийная плазмида pL-PrnP, содержащая последовательность полноразмерного гена PrnP(23-231) мыши, кодирующую аминокислоты с 23 по 231, под контролем промотора CUP1 была создана на основе вектора pRS425 (Christianson T.W., Sikorski R.S., Dante M., Shero J.H., Hieter P. Multifunctional yeast high-copy-number shuttle vectors // Gene. 1992. 110, P.119-122). Плазмида была получена в два этапа: последовательность промотора CUP1 из плазмиды pRS316CG [Liu J.J., Lindquist S. Oligopeptide-repeat expansions modulate "protein-only" inheritance in yeast // Nature. 1999. Vol.400. P.573-576] была встроена в вектор pRS425 по сайтам XhoI-BamHI. Затем в полученную конструкцию по сайтам BamHI и SacI была встроена последовательность гена PrnP (23-231) мыши. Последовательность, кодирующую фрагмент белка PrP мыши с 23 по 231 аминокислоту, амплифицировали методом ПЦР с использованием в качестве матрицы плазмиды pcDNA3-l-3F4 (Narwa R. & Harris DA. Prion proteins carrying pathogenic mutations are resistant to phospholipase cleavage of their glycolipid anchors // Biochemistry. 1999. 38(27) P: 8770-7), содержащей ген РrnР мыши, модифицированный для распознавания моноклональными антителами 3F4, и праймеров PrnP (23-231) BamHI-F (SEQ ID NO:5) и PrnP SacI-R (SEQ ID NO:6). Использовали термостабильную полимеразу Pfu «Силекс M» (Россия).
Была использована следующая программа для амплификации фрагментов мышиного гена PrnP: 94°С в течение 2 минут; 2 цикла 94°С в течение 40 секунд, 49°С в течение 40 секунд; 72°С в течение 40 секунд; 24 цикла 94°С в течение 40 секунд, 60°С в течение 40 секунд; 72°С в течение 40 секунд; и в конце 72°С в течение 5 минут.
Правильность последовательности нуклеотидов в полученной плазмиде проверяли секвенированием с использованием стандартных праймеров 21M13F (SEQ ID NO: 7) и 29M13R (SEQ ID NO:8). Карта полученной плазмиды pL-PrnP показана на Фиг.1.
Многокопийная плазмида pL-moPrP (90-231), содержащая последовательность гена PrnP (90-231) мыши, кодирующую аминокислоты с 90 по 231, под контролем промотора GPD была создана на основе вектора pRS425 (Christianson T.W., Sikorski R.S., Dante M., Shero J.H., Hieter P. Multifunctional yeast high-copy-number shuttle vectors // Gene. 1992. 110, P.119-122). Плазмида была сконструирована путем замещения фрагмента BamHI-Sad, содержащего PrP(90-231)-GFP (1,2 т.п.н.), из плазмиды PGPD-PrP-GFP(LEU2) [Рубель А.А., Сайфитдинова А.Ф., Лада А.Г., Нижников А.А., Инге-Вечтомов С.Г., Галкин А.П. Дрожжевой шаперон Hsp104 регулирует экспрессию генов на посттранскрипционном уровне // Мол. биол. 2008. Т.42. №1. С.123-130], на фрагмент SacII-SacI, содержащий последовательность PrP (90-231). Последовательность, кодирующую фрагмент белка PrP мыши с 90 по 231 аминокислоту, амплифицировали методом ПЦР с использованием в качестве матрицы плазмиду pcDNA3-1-3F4 (Рубель А.А., Сайфитдинова А.Ф., Лада А.Г., Нижников А.А., Инге-Вечтомов С.Г., Галкин А.П. Дрожжевой шаперон Hsp104 регулирует экспрессию генов на посттранскрипционном уровне // Мол. биол. - 2008. - Т.42. - №1. - С.123-130) и праймеров PmP (90-231)BamHI-F (SEQ ID NO:9) и PmP SacI-R (SEQ ID NO:6). Использовали программу для амплификации, описанную выше. Правильность последовательности нуклеотидов в полученной плазмиде также определяли, как описано выше. Карта полученной плазмиды pL-moPrP показана на Фиг.2.
Пример 2. Трансформация дрожжей Saccharomyces cerevisiae и получение лизатов, содержащих белок PrP.
В качестве модели использовали штамм 74-D694ΔRNQ1 [psi-] MATa ade1-14 his3Δ200 leu3-112 trp1-289 ura3-52 rnq1::HIS3 дрожжей Saccharomyces cerevisiae (Salnikova, A.B., Kryndushkin D.S., Smimov V.N., Kushnirov V.V., Ter-Avanesyan M.D. Nonsense suppression in yeast cells overproducing Sup35 (eRF3) is caused by its non-heritable amyloids // J Biol Chem. 2005, 280, P.8808-8812).
В этом штамме дрожжей экспрессировали плазмиду, содержащую последовательности, кодирующие PrP 23-231 или PrP 90-231, или в качестве отрицательного контроля плазмиду PRS425, на основе которой были созданы указанные плазмиды.
Для трансформации дрожжей использовали стандартный протокол (Gietz, R.D., Schiesti, R.Н., Willems, А.R., and Woods, R.A. (1995) Yeast 11, 355-360).
Пример 3. Получение лизатов, содержащих белок PrP
Культуру дрожжей растили в 10 мл минимальной среды с соответствующими добавками (аденин, урацил, необходимые аминокислоты и, по необходимости, сульфат меди в качестве индуктора) до стационарной фазы. Клетки собирали центрифугированием, ресуспендировали в 5 мл дистиллированной воды, разливали по 1 мл в пробирки "Эппендорф" и осаждали центрифугированием, в результате чего в каждой пробирке находилось 50-100 мкл клеток. Далее клетки замораживали и хранили на -70°С. Для получения лизата размораживали одну пробирку, добавляли 3-кратный объем стеклянных бус, 100 мкл трис-солевого буфера TBS (30 мМ Tris-HCl pH 7,4,150 мМ NaCl), содержащего 10 мМ ЭДТА, 10 мМ фенилметилсульфонил флуорида (PMSF), 1 мМ дитиотреитола (ДТТ) и коктейля ингибиторов протеаз (Complete®, Roche Applied Science), в количестве, рекомендованном протоколом изготовителя. Клеточный дебрис отделяли центрифугированием при 1500 g в течение 4-х минут и осветленный лизат, содержащий полимеры белка PrP, расфасовывали по пробиркам.
Пример 4. Концентрирование белков на мембранах
Ацетатцеллюлозную мембрану (0,2 мкм, Whatman GmbH OE66) смачивали дистиллированной водой и помещали в ячейку вакуумного дот-блоттера БиоРад. Лизаты клеток дрожжей, содержащие белок PrP, разводили до нужной концентрации в буфере TBS с ионным детергентом, делали последовательные разведения этих растворов тем же буфером и вносили в ячейки блоттера по 50 мкл полученных растворов лизатов. С помощью вакуумного (водоструйного) насоса растворы прокачивали через мембрану. Затем в эти ячейки добавляли по 100 мкл буфера TBS с ионным детергентом (SDS - додецилсульфат натрия или саркозил - лаурилсаркозинат натрия), инкубировали 10 минут, после чего буфер удаляли и промывали ячейки еще 2 раза по 100 мкл аналогичным буфером, затем 2 раза по 100 мкл буфером TBS без детергента. После этого мембрану окрашивали раствором красителя Понсо-С для оценки количества белка осевшего на мембране. Для сравнения лизаты дрожжей аналогичным образом пропускали через нитроцеллюлозную мембрану (0,45 мкм, Macherey-Nagel, Германия), адсорбирующую белки. На Фиг.3 показано, что основная масса белков лизатов дрожжей хорошо адсорбируется на нитроцеллюлозной мембране и легко проходит через ацетатцеллюлозу даже при небольших разведениях лизатов.
Пример 5. Изучение связывания аптамеров и антител с белком PrP.
Мембрану инкубировали в течение часа в растворе казеина (4 мг/мл) в TBS буфере, рН 7.4 с 0,05% Твина-20. После этого мембрану погружали в раствор меченого аптамера или антител к прионному белку. Аптамер, меченный флуоресцентной меткой FAM, в количестве 8 пикограмм разводили в 0,5 мл 5 мМ фосфатного буфера (PBS) рН 6,0, содержащем 0,05% Твина-20 и 200 мМ мочевины. Аптамер подвергали денатурации путем кипячения полученного раствора на водяной бане в течение 5 минут. Затем раствор охлаждали при комнатной температуре в течение 5 минут, выдерживали еще 30 минут при комнатной температуре и далее разводили в 8 мл того же фосфатного буфера, содержащего 0,4% казеина. Антитела разводили в буфере TBS рН 7.4 с 0,05% Твина-20 и 4 мг/мл казеина. После часовой инкубации при комнатной температуре мембрану ополаскивали два раза дистиллированной водой и обрабатывали следующим раствором. В случае антител - раствором вторичных антител, конъюгированных с пероксидазой в том же буфере. В случае аптамеров - вторым раствором служили антитела к FAM в буфере TBS. Далее после часовой инкубации с антителами к FAM и однократной промывки мембраны к мембране приливали раствор вторичных антител в TBS. После инкубации с вторичными антителами, конъюгированными с пероксидазой, мембрану промывали 3 раза по 15 минут буфером TBS с 0.05% раствором Твина-20 и затем 2 раза по 15 минут буфером TBS. Связывание аптамеров или антител с прионным белком фиксировали на приборе для детекции хемилюминесценции фирмы Vilber Lourmat с использованием смеси проявляющих растворов ECL West Dura system (Thermo Scientific).
Пример 6. Влияние детергентов SDS и саркозила на эффективность адсорбции амилоидов PrP на ацетатцеллюлозной мембране.
На Фиг.4 представлены результаты экспериментов по концентрированию амилоидов PrP на ацетатцеллюлозную мембрану в присутствии детергентов SDS или саркозила (натрий лауроилсаркозина). Из Фиг.2 видно, что амилоиды PrP растворяются в SDS и не адсорбируются на ацетатцеллюлозной мембране. Для концентрирования амилоидов PrP в качестве детергента следует использовать саркозил.
Пример 7. Доказательство специфичности связывания аптамеров с прионным белком.
Для доказательства специфичности связывания аптамеров с прионным белком, сконцентрированным на ацетатцеллюлозной мембране, аналогичный эксперимент проводили с раствором аптамера, полученного к урокиназе и имеющего тот же размер (70 нуклеотидов), что и аптамер к прионному белку (Skrypina NA, Savochkina LP, Beabealashvilli RSh. In vitro selection of single-stranded DNA aptamers that bind human pro-urokinase. Nucleosides Nucleotides Nucleic Acids 2004; 23:891-3). Как видно из Фиг.5, аптамер к урокиназе не связывается как с полноразмерным, так и укороченным прионным белком. Также видно, что чувствительность аптамеров к прионному белку может быть выше, чем у моноклональных антител к этому же белку. Несмотря на то что используемый аптамер показывает некоторое неспецифическое связывание с контрольным лизатом, его взаимодействие с прионным белком не менее чем в 10 раз превышает фоновое связывание.
Для того чтобы выяснить, происходит ли на мембране неспецифическое связывание аптамера с ДНК и РНК, присутствующими в лизате дрожжей, которые могут частично задерживаться на мембране, был проведен эксперимент по удалению ДНК и РНК из лизатов путем обработки их ДНКазой и РНКазой (в концентрации 0,1 мг/мл каждая) в течение 30 минут при комнатной температуре. Как видно из Фиг.6, присутствие или отсутствие ДНК и РНК в лизате практически никак не влияло на эффективность связывания аптамера с прионным белком.
Хотя указанное изобретение описано в деталях со ссылкой на наилучший способ осуществления изобретения, для специалиста в указанной области техники очевидно, что могут быть совершены различные изменения и произведены эквивалентные замены, и такие изменения и замены не выходят за рамки настоящего изобретения.
Все цитируемые документы являются частью описания настоящего изобретения и включены в настоящее описание во всей полноте посредством ссылки.
1. Способ детекции белков в амилоидном состоянии, включающий следующие стадии:- получение образца лизата культуры дрожжей, или ткани млекопитающего, или биологической жидкости млекопитающего;- добавление к образцу ионного детергента;- концентрирование белков в амилоидной форме на ацетатцеллюлозной мембране; и- детектирование белков в амилоидном состоянии, адсорбированных на ацетатцеллюлозной мембране, с использованием аптамеров, их конъюгатов или антител, специфичных к амилоидной форме белков.
2. Способ по п.1, отличающийся тем, что биологической жидкостью является кровь, лимфа, слюна или моча млекопитающего.
3. Способ по п.1, отличающийся тем, что указанным детергентом является натрий лауроилсаркозин (саркозил).
4. Способ по п.1, отличающийся тем, что концентрирование белков в амилоидной форме на ацетатцеллюлозной мембране осуществляют пропусканием образца через ацетатцеллюлозную мембрану.
5. Способ по п.1, отличающийся тем, что используют ацетатцеллюлозную мембрану с размером пор 0,1-0,4 мкм.
6. Способ по п.1, отличающийся тем, что указанный конъюгат содержит метку, узнаваемую антителами.
7. Набор для детекции белков в амилоидном состоянии, содержащий:ацетатцеллюлозную мембрану; ионный детергент; аптамер, его конъюгат и/или антитело, специфичные к амилоидной форме белков; и инструкцию по применению набора в соответствии со способом по п.1.
8. Набор по п.7, отличающийся тем, что ацетатцеллюлозная мембрана имеет размер пор 0,1-0,4 мкм.
10. Набор по п.8, отличающийся тем, что указанным детергентом является натрий лауроилсаркозин (саркозил).