Лекарственное средство для лечения рассеянного склероза и способ лечения рассеянного склероза
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к неврологии, и касается лечения рассеянного склероза. Для этого вводятфармацевтическую композицию, содержащую активированную-потенцированную форму антител к гамма-интерферону человека (ИФН-γ) и активированную-потенцированную форму антител к мозгоспецифическому белку S-100. Это обеспечивает эффективное лечение рассеянного склероза за счет синергетического действия компонентов композиции. 2 н. и 7 з.п. ф-лы, 2 пр., 1 табл., 4 ил.
Реферат
Изобретение относится к области медицины и может быть использовано для эффективного лечения патологического синдрома, в частности, для лечения рассеянного склероза.
Рассеянный склероз - хроническое прогрессирующее рецидивирующее аутоиммунное заболевание, при котором поражается миелиновая оболочка нервных волокон головного и спинного мозга.
В этиологии развития рассеянного склероза до сих пор много неясного, вместе с тем, очевидно, что рассеянный склероз возникает у генетически предрасположенных индивидуумов при наличии определенных внешних факторов, приводящих к развитию аутоиммунного ответа и процессам воспаления, демиелинизации, нейродегенерации и нарушению репарации нейронов.
Из уровня техники известно лечение воспалительных заболеваний или аутоиммунных заболеваний, в том числе рассеянного склероза, анти-CD 40 - антителами (RU 2008121899 A, 10.12.2009). Однако данное лекарственное средство при лечении рассеянного склероза может не обеспечить необходимую терапевтическую эффективность.
Изобретение направлено на создание эффективного лекарственного средства для лечения рассеянного склероза.
Решение поставленной задачи обеспечивается тем, что лекарственное средство для лечения патологического синдрома, согласно изобретению, выполнено в виде фармацевтической композиции и содержит активированную-потенцированную форму антител к гамма-интерферону человека (ИФН - γ) и активированную-потенцированную форму антител к мозгоспецифическому белку S-100.
Предпочтительно фармацевтическую композицию, содержащую активированную-потенцированную форму антител к гамма-интерферону человека (ИФН - γ) и активированную-потенцированную форму антител к мозгоспецифическому белку S-100, используют для лечения рассеянного склероза.
При этом активированную-потенцированную форму антител к гамма-интерферону человека (ИФН - γ) и активированную-потенцированную форму антител к мозгоспецифическому белку S-100 используют в виде гамма-интерферон водного или водно - спиртового раствора, полученного в процессе последовательного многократного разведения в водном или водно-спиртовом растворителе и промежуточного внешнего механического воздействия - вертикального встряхивания.
Кроме того, лекарственное средство может быть выполнено в твердой лекарственной форме, которая содержит эффективное количество гранул нейтрального носителя, насыщенного смесью активированной - потенцированной формой антител к гамма-интерферону человека (ИФН - γ) и активированную-потенцированную форму антител к мозгоспецифическому белку S-100, и фармацевтически приемлемые добавки, которые могут включать лактозу, целлюлозу микрокристаллическую и магния стеарат.
При этом водные или водно - спиртовые растворы активированных-потенцированных форм антител к гамма-интерферону человека (ИФН - γ) и к мозгоспецифическому белку S-100 получены путем многократного последовательного разведения и промежуточного внешнего воздействия из матричных растворов аффинно очищенных антител к гамма-интерферону человека (ИФН - γ) и мозгоспецифическому белку S-100 с концентрацией 0,5÷5,0 мг/мл.
Предпочтительно каждый из компонентов используют в виде смеси различных, преимущественно сотенных, гомеопатических разведении.
Предпочтительно лекарственное средство содержит активированную-потенцированную форму антител к гамма-интерферону человека (ИФН - γ) и активированную-потенцированную форму антител к мозгоспецифическому белку S-100 в сверхмалой дозе, полученной разведением матричного раствора в 10012, 10030, 10050 раз, эквивалентной смеси сотенных гомеопатических разведении С12, С30 и С50.
Возможно использование смеси сотенных гомеопатических разведении С12, С30 и С200 или, соответственно, разведении матричного раствора в 10012, 10030, 10050 раз.
Решение поставленной задачи обеспечивается также тем, что в способе лечения рассеянного склероза путем введения в организм лекарственного средства, согласно изобретению, указанное лекарственное средство выполнено в виде фармацевтической композиции и содержит активированную-потенцированную форму антител к гамма-интерферону человека (ИФН - γ) и активированную-потенцированную форму антител к мозгоспецифическому белку S-100.
При этом активированную-потенцированную форму антител к гамма-интерферону человека (ИФН - γ) и активированную-потенцированную форму антител к мозгоспецифическому белку S-100 используют в виде гамма-интерферон водного или водно - спиртового раствора, полученного в процессе последовательного многократного разведения в водном или водно - спиртовом растворителе и промежуточного внешнего механического воздействия - вертикального встряхивания.
Кроме того, лекарственное средство содержит действующие компоненты в соотношении 1:1, при этом каждый компонент используют в виде смеси трех соответствующих матричных растворов, разведенных в 10012, 10030, и 10050 раз, что эквивалентно сотенным гомеопатическим разведениям С 12, С 30, С 50.
Заявленную фармацевтическую композицию рекомендуется принимать, предпочтительно, по 1÷2 таблетке 2÷6 раз в день, преимущественно 2÷4 раза в день.
При лечении рассеянного склероза, возможно раздельное применение в виде двух отдельно приготовленных препаратов как в виде растворов, так и в твердых лекарственных формах (таблеток), каждая из которых содержит активированную-потенцированную форму сверхмалых доз аффинно очищенных антител к гамма-интерферону человека (ИФН - γ) и, соответственно, активированную-потенцированную форму сверхмалых доз аффинно очищенных антител к мозгоспецифическому белку S-100.
Предложенное сочетание активированных-потенцированных форм антител к гамма-интерферону человека (ИФН - γ) и к мозгоспецифическому белку S-100 в фармацевтической композиции (т.е. формы антител к гамма-интерферону человека (ИФН - γ) и к мозгоспецифическому белку S-100, приготовленные по гомеопатической технологии потенцирования путем многократного последовательного разведения и дополнительного промежуточного внешнего воздействия - вертикального встряхивания, которые обладают активностью в фармакологических моделях и/или клинических методах лечения рассеянного склероза) обеспечивает получение неожиданного синергетического терапевтического эффекта, экспериментально подтвержденного на адекватной модели, который заключается в существенном улучшении эффективности лечения рассеянного склероза. Заявленный технический результат обусловлен тем, что в предложенной фармацевтической композиции активированная - потенцированная форма антител к мозгоспецифическому белку S-100 усиливает эффективность действия активированной - потенцированной формы антител к гамма-интерферону, заключающегося в нейропротекторном действии, нормализации нейрогуморальной регуляции при интерферонозависимых заболеваниях нервной системы, усилении сбалансированного влияния на интерфероночувствительные нейродизрегуляторные процессы. Синергетический эффект заявленного решения обусловлен проявлением аффинитета к внутриклеточному рецептору сигма- 1, локализованному в центральной нервной системе, большинстве периферических тканях, иммуноцитах, который регулирует через контроль концентрации внутриклеточного кальция внутриклеточные сигнальные каскады, что эффективно нормализует регуляцию процесса миелинизации-демиелинизации нервных волокон.
Кроме того, заявленное лекарственное средство расширяет арсенал препаратов, предназначенных для лечения рассеянного склероза.
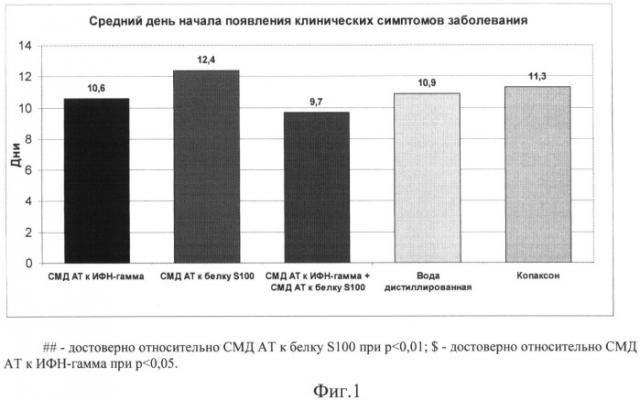
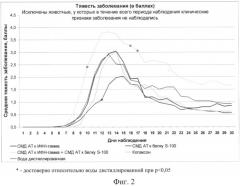
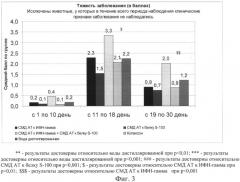
На Фиг.1 представлен график, на котором отображены сроки начала появления клинических симптомов заболевания; на Фиг.2 - тяжесть проявления клинических симптомов ЭАЭ; на Фиг.3 - тяжесть проявления ЭАЭ в зависимости от фазы заболевания; на Фиг.4 - частота возникновения рецидивов (возвращения симптомов ЭАЭ)
Лекарственное средство приготовляют, преимущественно, следующим образом.
Для приготовления гомеопатически активированной потенцированной формы действующих компонентов используют моноклональные или, преимущественно, поликлональные антитела, которые могут быть получены по известным технологиям - методикам, описанным, например, в книге: Иммунологические методы, под ред. Г. Фримеля, М., «Медицина», 1987, с.9-33; или, например, в статье Laffly E., Sodoyer R. Hum. Antibodies. Monoclonal and recombinant antibodies, 30 years after. - 2005 - Vol.14. - N 1-2. P.33-55.
Для проведения экспериментальных исследований могут быть использованы антитела, приготовленные по заказу специализированной фармацевтической фирмой.
Моноклональные антитела получают, например, с помощью гибридомной технологии. Причем начальная стадия процесса включает иммунизацию, основанную на принципах, уже разработанных при приготовлении поликлональных антисывороток. Дальнейшие этапы работы предусматривают получение гибридных клеток, продуцирующих клоны одинаковых по специфичности антител. Их выделение в индивидуальном виде проводится теми же методами, что и в случае поликлональных антисывороток.
Поликлональные антитела могут быть получены активной иммунизацией животных. Для этого по специально разработанной схеме животным делают серию инъекций требуемым в соответствии с изобретением веществом - антигеном: гамма-интерфероном человека (ИФН - γ) и мозгоспецифическим белком S-100. В результате проведения такой процедуры получают моноспецифическую антисыворотку с высоким содержанием антител, которую и используют для получения активированной-потенцированной формы. При необходимости проводят очистку антител, присутствующих в антисыворотке, например, методом аффинной хроматографии, путем применения фракционирования солевым осаждением или ионообменной хроматографии.
Предпочтительным для приготовления заявленного лекарственного препарата является использование поликлональных антител к гамма-интерферону человека и мозгоспецифический белок S-100, которые могут быть получены иммунизацией кроликов следующим образом.
Для получения поликлональных антител к гамма-интерферону человека в качестве иммуногена (антигена) для иммунизации кроликов используют адъювант и, например, цельную молекулу гамма-интерферон человека следующей последовательности:
1 MKYTSYILAF QLCIVLGSLG CYCQDPYVKE AENLKKYFNA
GHSDVADNGT LFLGILKNWK
61 EESDRKIMQS QIVSFYFKLF KNFKDDQSIQ KSVETIKEDM
NVKFFNSNKK KRDDFEKLTN
121 YSVTDLNVQR KAIHELIQVM AELSPAAKTG KRKRSQMLFR
GRRASQ
Возможно для получения поликлональных антител к гамма-интерферону человека в качестве иммуногена (антигена) для иммунизации кроликов использование адъюванта и, например, одного полипептидного фрагмента гамма-интерферона человека, выбранного из следующих последовательностей:
7-55:
ILAF QLCIVLGSLG CYCQDPYVKE AENLKKYFNA GHSDV
24-166:
QDPYVKEAE NLKKYFNAGH SDVADNGTLF LGILKNWKEE SDRKIMQSQI VSFYFKLFKN FKDDQSIQKS VETIKEDMNV KFFNSNKKKR DDFEKLTNYS VTDLNVQRKA IHELIQVMAE LSPAAKTGKR KRSQMLFRGR RASQ
24-166:
QDPYVKEAE NLKKYFNAGH SDVADNGTLF LGILKNWKEE SDRKIMQSQI VSFYFKLFKN FKDDQSIQKS VETIKEDMNV KFFNSNKKKR DDFEKLTNYS VTDLNVQRKA IHELIQVMAE LSPAAKTGKR KRSQMLFQGR RASQ
69-123:
QS QIVSFYFKLF KNFKDDQSIQ KSVETIKEDM NVKFFNSNKK KRDDFEKLTNYSV
100-145:
M NVKFFNSNKK KRDDFEKLTN YSVTDLNVQR KAIHELIQVM AELSP
92-130:
SVETIKEDM NVKFFNSNKK KRDDFEKLTN YSVTDLNVQR
123- 147:
VTDLNVQR KAIHELIQVM AELSPAA
24-166:
MQDPYVKEAE NLKKYFNAGH SDVADNGTLF LGILKNWKEE SDRKIMQSQI VSFYFKLFKN FKDDQSIQKS VETIKEDMNV KFFNSNKKKR DDFEKLTNYS VTDLNVQRKA IHELIQVMAE LSPAAKTGKR KRSQMLFQGR RASQ
5-45:
SYILAF QLCIVLGSLG CYCQDPYVKE AENLK
94-114:
ETIKEDM NVKFFNSNKK KRDD,
24-166:
MQDPYVKEAE NLKKYFNAGH SDVADNGTLF LGILKNWKEE SDRKIMQSQI VSFYFKLFKN FKDDQSIQKS VETIKEDMNV KFFNSNKKKR DDFEKLTNYS VTDLNVQRKA IHELIQVMAE LSPAAKTGKR KRSQMLFRGR RASQ
Перед отбором крови за 7-9 дней проводят 1-3 внутривенных инъекций для повышения уровня антител. В процессе иммунизации у кроликов отбирают небольшие пробы крови для оценки количества антител. Максимальный уровень иммунного ответа на введение большинства растворимых антигенов достигается через 40-60 дней после первой инъекции. После окончания первого цикла иммунизации кроликов в течение 30 дней дают восстановить здоровье и проводят реиммунизацию, включающую 1-3 внутривенные инъекции. Для получения антисыворотки из иммунизированных кроликов собирают кровь в центрифужную пробирку объемом 50 мл. С помощью деревянного шпателя удаляют со стенок пробирки образовавшиеся сгустки и помещают палочку в сгусток, образовавшийся в центре пробирки. Кровь помещают в холодильник (температура 4ºC) на ночь. На следующий день удаляют сгусток, прикрепившийся к шпателю, и центрифугируют оставшуюся жидкость при 13000g в течение 10 мин. Супернатант (надосадочная жидкость) является антисывороткой. Полученная антисыворотка должна быть желтого цвета. Добавляют к антисыворотке 20% (весовая концентрация) NaN3 до конечной концентрации 0,02% и хранят до использования в замороженном состоянии при температуре -20ºC (или без добавления NaN3 - при температуре -70ºC). Для выделения из антисыворотки антител к гамма-интерферону человека производят абсорбцию на твердой фазе в следующей последовательности:
1) 10 мл антисыворотки кролика разбавляют в 2 раза 0,15 М NaCl добавляют 6,26 г Na2SO4, перемешивают и инкубируют 12-16 ч при 4ºC;
2) выпавший осадок удаляют центрифугированием, растворяют в 10 мл фосфатного буфера и затем диализуют против того же буфера в течение ночи при комнатной температуре;
3) после удаления осадка центрифугированием раствор наносят на колонку с ДЭАЭ-целлюлозой, уравновешенную фосфатным буфером;
4) фракцию антител определяют, измеряя оптическую плотность элюата при 280 нм.
Затем производят очистку антител методом аффинной хроматографии путем прикрепления полученных антител к гамма-интерферону человека, который находится на нерастворимом матриксе с последующим элюированием концентрированными растворами соли.
Полученный, таким образом, буферный раствор поликлональных кроличьих антитела к гамма-интерферону человека, очищенных на антигене, с концентрацией 0,5÷5,0 мг/мл, предпочтительно 2,0÷3,0 мг/мл, используют в качестве матричного (первичного) раствора для последующего приготовления активированной - потенцированной формы.
Для получения поликлональных антител к мозгоспецифическому белку S-100 используют мозгоспецифический белок S-100, физико-химические свойства которого описаны в статье М.В. Старостина, С.М. Свиридов, Нейроспецифический белок S-100, Успехи современной биологии, 1977 г., т.5, с.170-178; книге М.Б. Штарк, Мозгоспецифические белки /антигены/ и функции нейрона, М., "Медицина", 1985 г.; с.12-14, выделенный из ткани головного мозга быка по следующей методике:
- замороженную в жидком азоте ткань головного мозга быка растирают в порошок на специальной мельнице;
- экстракцию белков проводят в соотношении 1:3 (вес/объем) в экстрагирующем буфере при гомогенизации;
- гомогенат прогревают в течение 10 мин при 60ºC и охлаждают до 4ºC на ледяной бане;
- термолабильные белки удаляют центрифугированием;
- проводят ступенчатое фракционирование сульфатом аммония с последующим удалением выпадающих в осадок примесных белков;
- содержащую белок S-100 фракцию осаждают 100% насыщенным сульфатом аммония при снижении pH до 4,0 и собирают центрифугированием;
- осадок растворяют в минимальном объеме буфера, содержащего ЭДТА и меркаптоэтанол, диализируют против деионизованной воды и лиофильно высушивают;
- фракционирование кислых белков продолжают хроматографией на ионообменных носителях - ДЭАЭ целлюлозе ДЕ-52 и затем ДЭАЭ-сефадексе А-50;
- собранные и отдиализованные фракции, содержащие белок S-100, разделяют по молекулярному весу гель-фильтрацией на сефадексе G-100;
- очищенный белок S-100 диализируют и лиофильно высушивают.
Молекулярный вес очищенного мозгоспецифического белка S-100 составляет - 21000 д.
Благодаря высокому содержанию аспарагиновой и глутаминовой кислот мозгоспецифический белок S-100 является сильнокислым и занимает крайнее анодное положение при электрофорезе в прерывистой буферной системе в полиакриламидном геле, что облегчает его идентификацию.
Для получения мозгоспецифической антисыворотки к выделенному мозгоспецифическому белку S-100 готовят смесь очищенного белка S-100 (антигена) в комплексе с метилированным бычьим сывороточным альбумином в качестве носителя с полным адъювантом Фрейнда, которую вводят подкожно лабораторному животному - кролику в область спины в количестве 1-2 мл. На 8-й, 15-й день проводят повторную иммунизацию. Забор крови производят (например, из вены уха) на 26-й и 28-й день.
Полученная антисыворотка имеет титр 1:500-1:1000, образует единственную полосу преципитации с экстрактом из нервной ткани, но не реагирует с экстрактами гетерологичных органов и формирует единственный пик преципитации как с чистым белком S-100, так и с экстрактом нервной ткани, что свидетельствует о моноспецифичности полученной антисыворотки.
Полученные, таким образом, буферные растворы каждого компонента поликлональных антител к гамма-интерферону человека (ИФН - γ) и мозгоспецифическому белку S-100 с концентрацией 0,5÷5,0 мг/мл, предпочтительно 2,0÷3,0 мг/мл используют в качестве матричных (первичных) растворов для последующего приготовления активированных-потенцированных форм лекарственного средства.
Активированную-потенцированную форму каждого компонента готовят путем равномерного уменьшения концентрации в результате последовательного разведения 1 части упомянутого матричного раствора в 9 частях (для десятичного разведения) или в 99 частях (для сотенного разведения) или в 999 частях (для тысячного разведения) нейтрального растворителя с многократным вертикальным встряхиванием ("динамизацией") каждого полученного разведения и использованием отдельных емкостей для каждого последующего разведения до получения требуемой потенции - кратности разведения по гомеопатическому методу (см., например, В. Швабе "Гомеопатические лекарственные средства", М., 1967 г., с.14-29).
Внешнюю обработку в процессе уменьшения концентрации также можно осуществлять ультразвуком, электромагнитным или иным физическим воздействием.
Например, для приготовления 12-го сотенного разведения С 12 одну часть упомянутого матричного раствора антител к гамма-интерферону человека (ИФН - γ) (или антител к мозгоспецифическому белку S-100) с концентрацией 3,0 мг/мл разводят в 99 частях нейтрального водного или водно - спиртового растворителя (преимущественно 15% этилового спирта) и многократно (10 и более раз) вертикально встряхивают - потенцируют полученное 1-е сотенное С1 разведение. Из 1-го сотенного С1 разведения приготовляют 2-ое сотенное разведение С2. Данную операцию повторяют 11 раз, получая 12-е сотенное разведение С 12. Таким образом, 12-е сотенное разведение С 12 представляет собой раствор, полученный разбавлением последовательно в разных емкостях 12 раз 1-ой части исходного матричного раствора антител к гамма-интерферону человека (ИФН -γ) с концентрацией 3,0 мг/мл в 99-ти частях нейтрального растворителя, т.е. раствор, полученный разведением матричного раствора в 10012 раз. Аналогичные операции с соответствующей кратностью разведения проводят для получения разведении С 30 и С 50.
При использовании в качестве действующих веществ каждого компонента смеси различных гомеопатических, преимущественно сотенных, разведении (например, С 12, С 30, С 50), действующее вещество каждого компонентов приготовляют раздельно по описанной выше технологии до их предпоследнего разведения (соответственно, до получения С 11, С29, С 49) и затем вносят в соответствии с составом смеси в одну емкость по одной части каждого компонента и смешивают с требуемым количеством растворителя (соответственно, с 97 частями для сотенного разведения). При этом получают активированную-потенцированную форму антител каждого из компонентов (к гамма-интерферону человека (ИФН - γ) и к мозгоспецифическому белку S-100) в сверхмалой дозе, полученной разведением матричного раствора в 10012, 10030, 10050 раз, эквивалентной смеси сотенных гомеопатических разведении С12, С30, С50.
Возможно использование действующего вещества в виде смеси других различных гомеопатических, разведении, например, десятичных, и/или сотенных, и/или тысячных (С12, С30, С200; D 20, С 30, С 100 или D 20, С 30, М 100 и т.д.), эффективность которых определяют экспериментально.
При потенцировании вместо встряхивания в процессе уменьшения концентрации также можно осуществлять внешнее воздействие ультразвуком, электромагнитным или иным физическим воздействием.
Для получения лекарственного средства водные или водно - спиртовые растворы действующих веществ компонентов смешивают, преимущественно, в соотношении 1:1 и используют в жидкой лекарственной форме.
Заявленное лекарственное средство может быть использовано и в твердой лекарственной форме, которая содержит эффективное количество гранул нейтрального носителя - лактозы, насыщенных путем пропитывания до насыщения смесью, приготовленных по вышеуказанной технологии, водных или водно - спиртовых растворов активированных-потенцированных форм антител к гамма-интерферону человека (ИФН - γ) и к мозгоспецифическому белку S-100, и фармацевтически приемлемые добавки, включающие, преимущественно, лактозу, целлюлозу микрокристаллическую и магния стеарат.
Для получения твердой оральной формы заявленного лекарственного средства производят в установке кипящего слоя (например, типа «Huttlin Pilotlab» производства компании Hiittlin GmbH) орошение до насыщения вводимых в псевдоожиженный - кипящий слой гранул нейтрального вещества - лактозы (молочного сахара) с размером частиц 100÷300 мкм, предварительно полученным водным или водно - спиртовым раствором активированных-потенцированных форм антител к гамма-интерферону человека (ИФН - γ) и к мозгоспецифическому белку S-100, преимущественно, в соотношении 1 кг раствора антител на 5 или 10 кг лактозы (1:5-1:10) с одновременной сушкой в потоке подаваемого под решетку нагретого воздуха при температуре не выше 40ºC. Расчетное количество 10÷34 масс частей высушенных гранул, насыщенных активированной - потенцированной формой антител, загружают в смеситель и смешивают с 25÷85 масс. частей от общей массы загрузки «ненасыщенной» чистой лактозы (для снижения стоимости и некоторого упрощения и ускорения технологического процесса без снижения эффективности лечебного воздействия). Затем в эту смесь добавляют стеарат магния в количестве 0,1÷1 масс. частей от общей массы загрузки и микрокристаллическую целлюлозу в количестве 3÷10 масс. частей от общей массы загрузки. Полученную таблеточную массу равномерно перемешивают и таблетируют прямым сухим прессованием (например, в таблет-прессе Korsch - XL 400) с формированием круглых таблеток массой 150÷500 мг, преимущественно массой 300 мг, пропитанных водно-спиртовым раствором (3,0-6,0 мг/табл.) активированной - потенцированной формой антител к гамма-интерферону человека (ИФН - γ) и к мозгоспецифическому белку S-100 в сверхмалой дозе каждого компонента, приготовленной из матричного раствора, разведенного в 10012, в 10030 в 100200, что эквивалентно смеси сотенных гомеопатических разведении С12, С30 и С200.
Предпочтительно использовать таблетки массой 250÷300 мг, которые включают 3,0÷6,0 мг/табл активированной потенцированной формы водно - спиртовых разведении субстанции - действующего вещества поликлональных кроличьих антител к гамма-интерферону человека (ИФН - γ) и к мозгоспецифическому белку S-100, очищенных на антигене, в сверхмалой дозе, полученной разведением матричного раствора в 10012, 10030, 10050 раз, эквивалентной смеси сотенных гомеопатических разведении С12, С30, С50.
В качестве нейтрального носителя возможно также использование глюкозы, сахарозы, мальтозы, крахмала, изомальтозы, изомальта и других моносахаридов, олигосахаридов и полисахаридов, использующихся в производстве фармацевтических препаратов, а также технологических смесей на основе последних с добавлением фармацевтически приемлемых добавок (например, изомальт, кросповидон, цикламат натрия, сахарин натрия, лимонная кислота безводная и т.д.), в том числе лубрикантов, дезинтегрантов, связующих и красителей.
Предпочтительно заявленное лекарственное средство рекомендуется принимать по 1÷2 таблетке 2÷6 раз в день, предпочтительно 2÷4 раза в день.
Для проведения экспериментальных исследований были использованы антитела, приготовленные по заказу специализированной фармацевтической фирмой.
Пример 1
Исследование влияния заявленного лекарственного средства в виде комплексного препарата СМД AT к ИФН - γ + СМД AT к S100, в состав которого входят сверхмалые дозы антител к белку S100 (смесь гомеопатических разведении С12+С30+С50) и сверхмалые дозы антител к интерферону гамма (смесь гомеопатических разведении С12+С30+С50) в соотношении 1:1, а также компонентов, входящий в его состав (сверхмалые дозы антител к белку S100 (смесь гомеопатических разведении С12+С30+С50) (СМД AT к S100) и сверхмалые дозы антител к интерферону гамма (смесь гомеопатических разведении С12+С30+С50) (СМД AT к ИФН - γ)) in vitro на связывание стандартного лиганда [3Н]пентазоцина с рекомбинантным сигма-1 рецептором человека оценивали радиолигандным методом.
Сигма-1 рецептор - внутриклеточный рецептор, локализованный в клетках центральной нервной системе, клетках большинства периферических тканей и иммунокомпетентных клетках. Этот рецептор посредством контроля гомеостаза внутриклеточного кальция, регулирует внутриклеточные сигнальные каскады, приводящие к активации соответствующих транскрипционных факторов и транскрипции целого семейства генов. Сигма-1 рецептор вовлечен в патогенез различных заболеваний, в том числе инфекционных и нейродегенеративных. В связи с этим препараты оказывающие влияние на данный рецептор и эффективность взаимодействия с ним лигандов могут рассматриваться, как эффективные лекарственные средства для лечения нейроинфекционных, нейродегенеративных и других заболеваний.
В качестве контроля в данной экспериментальной модели была использована потенцированная дистиллированная вода (смесь гомеопатических разведении С12+С30+С50) - (потенцированная вода).
В процессе исследования (для измерения общего связывания) в инкубационную среду вносили 20 мкл комплексного препарата или по 10 мкл СМД AT к S100 или СМД AT к ИФН - γ. Таким образом, количество СМД AT к S100 и СМД AT к ИФН - γ, вносимых в экспериментальную лунку при тестировании комплексного препарата, было идентично количеству СМД AT к S100 и СМД AT к ИФН - γ тестируемых в качестве монопрепаратов, что позволяет провести сравнение эффективности комплексного препарата с его отдельными компонентами, входящими в его состав. Потенцированную воду вносили в инкубационную среду в объеме 20 мкл и 10 мкл.
Затем вносили 160 мкл (~200 µg белка) гомогената мембран клеток линии Jurkat (линия лейкемических Т-лимфоцитов человека), и в последнюю очередь 20 мкл радиолиганда меченого тритием [3H]пентазоцин (15 нМ).
Для измерения неспецифического связывания вместо препаратов или потенцированной воды в инкубационную среду вносили 20 мкл немеченого лиганда - галоперидол (10 мкМ).
Радиоактивность измеряли на сцинтилляционном счетчике (Topcount, Packard) с использованием сцинтилляционной смеси (Microscint 0, Packard) после инкубации в течение 120 минут при температуре 22ºC в 50 мМ Tris-HCl буфере (pH=7,4) и фильтрации на стекловолоконных фильтрах (GF/B, Packard). Специфическое связывание (в опыте или контроле) рассчитывали как разницу между общим (в опыте или контроле) и неспецифическим связыванием.
Результаты исследований представлены в виде процента ингибирования специфического связывания в контроле (в качестве контроля использовали потенцированную воду) (Таблица 1).
| Таблица 1 | |||||
| Влияние препаратов и потенцированной воды на связывание стандартного радиолиганда [3Н]пентазоцина с рекомбинантным сигма 1 рецептором человека | |||||
| Экспериментальная группа | Количество, вносимое в экспериментальную лунку | % от специфического связывания радиолиганда в контроле | % ингибированя связывания радиолиганда в контроле | ||
| 1-е измерение | 2-е измерение | Среднее значение | |||
| Комплексный препарат | 20 мкл | 44,2 | 46,2 | 45,2 | 54,8 |
| СМД AT к S100 | 10 мкл | 70,9 | 62,9 | 66,9 | 33,1 |
| СМД AT к ИФН-γ | 10 мкл | 158,9 | 149,8 | 154,3 | -54,3 |
| Потенцированная вода | 20 мкл | 98,1 | 75,8 | 86,9 | 13,1 |
| Потенцированная вода | 10 мкл | 140,1 | 106,2 | 123,2 | -23,2 |
| Примечание: % специфического связывания в контроле = ((специфическое связывание в опыте / специфическое связывание в контроле)* 100% % ингибирования специфического связывания в контроле = 100% - (специфическое связывание в опыте / специфическое связывание в контроле)* 100% |
В условиях данной экспериментальной модели показано, что комплексный препарат (СМД AT к S100 + СМД AT к ИФН - γ) более эффективно, чем отдельные его компоненты (СМД AT к S100) и (СМД AT к ИФН - γ) ингибирует связывание стандартного радиолиганда [3H]пентазоцина с рекомбинантным сигма 1 рецептором человека, и может быть использован как эффективное лекарственное средства для лечения нейроинфекционных, нейродегенеративных и других заболеваний, в частности, для лечения рассеянного склероза.
Пример 2
Иммунный ответ при рассеянном склерозе характеризуется сложным, многокомпонентным каскадом событий. Широкое использование экспериментальных моделей рассеянного склероза, а именно: аутоиммунной энцефалопатии у грызунов и нокаутных мышей позволило ученым существенно продвинутся в понимании патогенеза данного заболевания.
Экспериментальный аллергический энцефаломиелит (ЭАЭ) является общепризнанной моделью рассеянного склероза - тяжелого аутоиммунного демиелинизирующего заболевания, поражающего людей трудоспособного возраста.
Индуцировать ЭАЭ у чувствительных животных можно гомогенатом гомологичной (Raine, Traugott, 1984) или гетерологичной (McCombe et al., 1994) мозговой ткани, очищенным миелином или белками, входящими в его состав. В настоящее время описано более 20 белков миелина (Baumann, Pham-Dinh, 2001), из которых обладают иммуногенными свойствами и наиболее часто используются для индукции ЭАЭ: основной белок миелина - ОБМ, протеолипидный протеин - ПЛП, гликопротеины: миелин ассоциированный гликопротеин - МАГ и миелин олигодендроцитарный гликопротеин - МОГ, олигодендроцитарный специфический белок - ОСБ. Выявлено, что не только целые белки, но и определенные фрагменты этих белков способны при введении животным вызывать ЭАЭ.
Заболевание типа ЭАЭ (с воспалительным процессом) можно воспроизвести на чувствительных животных белками ЦНС, не входящими в состав миелина: кальмодулином, белком S100, глиальным фибриллярным кислым белком, арестином и трансальдолазой.
Наиболее адекватной моделью PC является ЭАЭ, вызываемый введением гомогената спинного мозга. В этой модели, как и при исходном заболевании, осуществляется иммунный ответ на все компоненты миелина: индуцируется воспаление с последующей демиелинизацией, дегенерацией аксонов, а затем самих нервных клеток. Проявляется патологическая цепь событий с развитием парезов, параличей и других симптомов болезни.
Модель экспериментального аутоиммунного энцефаломиелита (ЭАЭ) у грызунов является основной моделью тестирования новых препаратов для лечения рассеянного склероза.
В НИИ экспериментальной медицины СЗО РАМН была использована модель экспериментальной аутоиммунной энцефалопатии у крыс, вызванной введением гомогената аутологичного спинного мозга в полном адъюванте Фрейнда (ПАФ).
В развитии ЭАЭ можно выделить четыре стадии:
1. Сенсибилизация Т-лимфоцитов на периферии под действием мозгового антигена с ПАФ и увеличение проницаемости ГЭБ.
2. Миграция активированных Т-клеток в ЦНС и активация антиген - представляющих клеток (астроцитов и микроглии) непосредственно в мозге.
Первые две стадии соответствуют латентному (индуктивному) периоду при котором не наблюдается клинических проявлений.
3. Развитие аутоиммунных и воспалительных реакций в мозге, приводящих к демиелинизации нервных волокон (клинический период).
4. Супрессия патологических процессов и репарация поврежденных тканей (фаза выздоровления). В этот период у большинства животных неврологические и двигательные нарушения сглаживаются, и наступает частичное или полное выздоровление, после которого животные резистентны к повторной индукции ЭАЭ.
Аналогичные фазы развития патологического процесса в ЦНС наблюдаются и при рассеянном склерозе.
Средняя продолжительность ЭАЭ - 30 дней: латентная стадия, клиническая стадия и стадия выздоровления. Продолжительность каждой стадии обычно 7-10 дней.
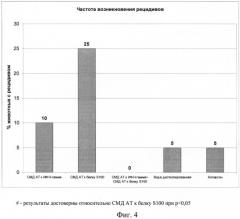
В НИИ экспериментальной медицины СЗО РАМН на модели рассеянного склероза (ЭАЭ) были проведены исследования эффективности заявленного лекарственного средства, выполненного в виде фармацевтической композиции - комплексного препарата, который включает водный раствор, содержащий активированную-потенцированную форму антител к гамма-интерферону человека, очищенных на антигене, в сверхмалой дозе, полученной сверхразведением исходного матричного раствора (концентрации 2.5 мг/мл) в 10012, 10030, 10050 раз эквивалентной смеси сотенных гомеопатических разведении С 12, С30, С50, и активированную -потенцированную форму антител к мозгоспецифическому белку S-100, очищенных на антигене, в сверхмалой дозе, полученной сверхразведением исходного матричного раствора (концентрации 2.5 мг/мл) в 10012, 10030, 10050 раз эквивалентной смеси сотенных гомеопатических разведении С 12, С30, С50 (СМД AT к ИФН - γ + СМД AT к S100). Для экспериментальных исследований были использованы крысы-самки линии Wistar (200-220 г), у которых индуцировали экспериментальный аутоиммунный энцефаломиелит (ЭАЭ) однократной инокуляцией энцефалитогенной смеси (ЭГС) из расчета 100 мг гомогената гомологичного спинного мозга, 0,2 мл полного адъюванта Фрейда (ПАФ) (содержание убитых микобактерий 5 мг/мл) и 0,2 мл физиологического раствора на одно животное. ЭГС вводили подкожно в основание хвоста вдоль хвостовой вены под легким эфирным наркозом в объеме 0,4 мл (по 0,2 мл справа и слева). Начиная со дня индукции ЭАЭ, вводили внутрижелудочно 2 раза в день с интервалом 7 часов в течение 30 дней (СМД AT к ИФН - γ + СМД AT к S100) (количество мышей n=10, в дозе 5 мл/кг/сут), препарат сравнения - активированную-потенцированную форму антител к гамма-интерферону человека, очищенных на антигене, в сверхмалой дозе, полученной сверхразведением исходного матричного раствора (концентрации 2.5 мг/мл) в 10012,10030, 10050 раз эквивалентной смеси сотенных гомеопатических разведении С 12, С30, С50 (СМД AT к ИФН - γ) (n=10; 2,5 мл/кг/сут), препарат сравнения - активированную-потенцированную форму антител к мозгоспецифическому белку S-100, очищенных на антигене, в сверхмалой дозе, полученной сверхразведением исходного матричного раствора (концентрации 2.5 мг/мл) в 10012,1003, 1005 раз эквивалентной смеси сотенных гомеопатических разведении С 12, С30, С50 (СМД AT к S100) (n=10, 2,5 мл/кг/сут) и дистиллированную воду (контроль; n=10; 5 мл/кг/сут). В качестве референсного препарата использовали иммуномодулятор копаксон (Тева, Израиль), который вводили внутримышечно крысам - самкам линии Wistar (n=10) в дозе 4 мг/кг, со 2-го по 25-й день после индукции ЭАЭ. Результаты исследований представлены на Фиг.1-4.
Препарат сравнения (СМД AT к S100) отодвигал сроки начала проявления клинических симптомов заболевания как по сравнению с отрицательным контролем (р<0,05), так и по сравнению с референсным препаратом копаксоном (р>0,05). Сроки начала заболевания (Фиг.1) группах, получавших (СМД AT к ИФН - γ) и в группе, получавшей копаксон, не отличались от контроля. В тоже время, у животных, которым вводили комплексный препарат(СМД AT к ИФН - γ + СМД AT к S100), наблюдали тенденцию к укорочению сроков появления клинических признаков рассеянного склероза по сравнению с контролем. Следует отметить, что были выявлены достоверные различия в сроках начала заболевания между группами (СМД AT к S100) и (СМД AT к ИФН - γ + СМД AT к S100).
Доля животных с тяжелым течением заболевания (>3 баллов) (Фиг.2) также была ниже в группе (СМД AT к S100) У животных, получавших (СМД AT к ИФН - γ + СМД AT к S100) процент животных с тяжелым течением был выше, чем в других исследуемых группах во все сроки заболевания.
В связи с тем, что в разные фазы развития рассеянного склероза задействованы разные механизмы патогенеза ЭАЭ, было проанализировано влияние тестируемых препаратов на тяжесть заболевания в латентный период, в фазе развития клин