Способ получения непрерывных клеточных линий и их применение
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и касается способа получения непрерывных клеточных линий живых клеток и их применений. Представленный способ включает облучение указанных живых клеток дозой УФ-света от около 20 мДж/см2 до около 300 мДж/см2 при длине волны между около 100 нм и около 400 нм в течение от около 30 сек до 5 мин и отбор клеток, способных к пролиферации после по меньшей мере 20 пассажей. Получаемые клеточные линии депонированы в ЕСАСС под номерами 08020602, 08020603 и 08020604 и могут быть использованы для получения вирусов или генных продуктов. Изобретение позволяет осуществлять рекомбинантную экспрессию биомолекул. 6 н. и 17 з.п. ф-лы, 4 ил., 1 табл., 6 пр.
Реферат
Область техники, к которой относится изобретение.
Изобретение относится к способам получения клеточных линий.
Предпосылки создания изобретения
Клеточные линии стали ценным инструментом в области получения вакцин. Получение некоторых важных вакцин и вирусных векторов все еще осуществляется в эмбрионах куриных яиц или в первичных фибробластах куриных эмбрионов. В основном, ткань птиц для репликации вирусов получают по методике SPF (свободной от специфических патогенов). Получаемые по процедуре SPF ткани являются дорогостоящими, а качество поставляемого материала зачастую трудно контролировать. В этой связи, несоответствие предъявляемым требованиям и дефицит поставляемой ткани являются основным недостатком методик, основанных на использовании яиц по процедуре SPF. То же самое справедливо для тех стратегий, где используются первичные монослойные культуры фибробластов. Для того чтобы клеточные линии можно было размножать неопределенно долго, необходимо достичь иммортализации клеток. Большинство используемых в настоящее время иммортализованных клеточных линий относится к потомству раковых клеток или слитых гибридомных клеток. Однако последняя из указанных технологий имеет ограничения, определяемые процедурой слияния с миеломными клетками. Соответственно, отсутствует основная технология, которая могла бы использоваться для создания иммортализованных клеток разных типов.
Краткое описание сущности изобретения
Целью настоящего изобретения является создание непрерывно растущей клеточной линии из клеточного материала, который не относится к непрерывно растущему. В частности, целью изобретения является создание непрерывных клеточных линий, которые обладают потенциалом к пролиферации, но в которые не вводятся чужеродные вирусные гены.
В этой связи, настоящее изобретение относится к способу получения непрерывных клеточных линий, где указанный способ включает получение живых клеток животных или человека, облучение указанных клеток УФ-светом, достижение пролиферации таких клеток и отбор клеток, способных пролиферировать по меньшей мере после 20 пассажей, в качестве клеток, составляющих непрерывную клеточную линию.
Такая непрерывная клеточная линия представляет собой культуру клеток, которая может размножаться и использоваться далее для рекомбинантной экспрессии биомолекул, таких как белки, или для производства вирусных продуктов, таких как вирусные антигены, или для создания целой вирусной популяции, в частности, для целей вакцинации.
Соответственно, настоящее изобретение также относится к способу получения вирусов, где указанный способ включает создание клеток, составляющих непрерывную клеточную линию, получаемых по методу настоящего изобретения, инфицирование указанных клеток указанным вирусом, размножение указанного вируса в указанных клетках и сбор указанного вируса.
В другом аспекте, настоящее изобретение относится к способу получения продукта рекомбинантного гена, где указанный способ включает создание клеток, составляющих непрерывную клеточную линию, которые получают по способу настоящего изобретения, трансфекцию указанных клеток нуклеиновой кислотой, кодирующей указанный генный продукт, экспрессию указанного генного продукта и затем, необязательно, отбор указанного генного продукта.
В еще одном варианте, настоящее изобретение относится к непрерывной клеточной линии, получаемой по способу, обеспечивающему наличие живых клеток животного или человека, с последующим облучением указанных клеток эффективной дозой УФ-света, достижением пролиферации указанных клеток и отбором клеток, способных пролиферировать после по меньшей мере 20 пассажей, в качестве клеток указанной непрерывной клеточной линии.
Описание чертежей
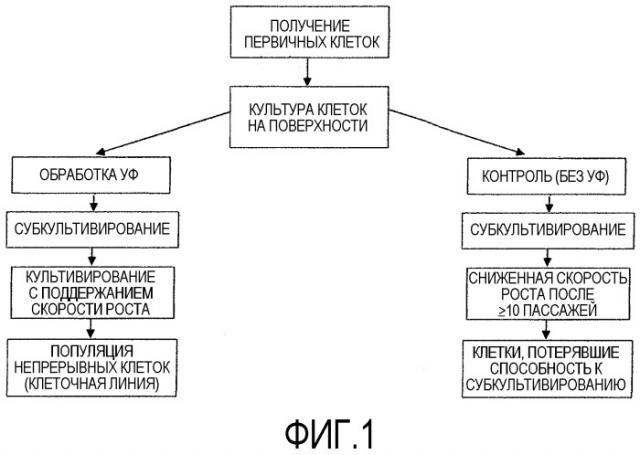
На фиг.1 приведено схематическое изображение процедуры УФ-обработки.
На фиг.2 проиллюстрированы непрерывные линии клеток перепелки.
На фиг.3 показано филогенетическое дерево и проиллюстрирован режим обработки при получении непрерывной линии клеток перепелки.
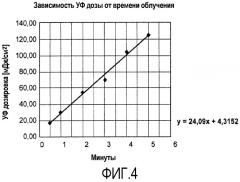
На фиг.4 проиллюстрирована корреляция УФ-дозировки и времени облучения при использовании параметров, подходящих для продукции непрерывных клеток.
Подробное описание изобретения
Настоящее изобретение относится к получению непрерывной клеточной линии путем УФ-обработки клеток.
Клеточная линия представляет собой популяцию клеток, образованных на основе одной или нескольких субкультур первичной клеточной культуры. Каждый раунд субкультивирования обозначается как пассаж. Когда клетки подвергают субкультивированию, это означает, что они прошли пассирование. Конкретная популяция клеток или конкретная клеточная линия может быть охарактеризована количеством пассажей, который она прошла. Первичная культура представляет собой первую культуру после выделения клеток из ткани. Получаемые из первой субкультуры клетки описываются как вторичные культуры (один пассаж). После вторичной субкультуры клетки становятся третичной культурой (пассаж 2) и т.д. Для специалиста в данной области понятно, что может быть множество удвоений популяций в ходе пассирования; в этой связи, количество удвоений популяций культуры больше, чем количество пассажей. Размножение клеток (то есть число удвоений популяций) в течение периода времени между пассажами зависит от многих факторов, включающих, без ограничения, плотность посева, используемый субстрат, среду, условия роста и промежуток времени между пассажами. Культивирование может проводиться путем инокуляции клеток в среду, при этом клеткам позволяют расти до слияния клеток в культуре или до образования непрерывной клеточной пленки и затем инокулируют в новую среду клетки, при отборе порции из слившихся клеток. При этом пассирование представляет собой инструмент для оценки способности клеток к размножению. В норме, клетки, включая необлученные клетки, выделенные из ткани, могут подвергаться 10-20 пассажам до достижения состояния, в котором размножение или удвоение клеток уже не происходит. Затем клетки вступают в фазу старения, на основе которой не может быть получено других субкультур. В отличие от них, непрерывные клеточные линии способны размножаться более чем после 20 пассажей, например более чем после 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 55, 60, 65, 70, 75 или 80 пассажей. Авторы настоящего изобретения обнаружили, что такая непрерывная клеточная линия, которая может пассироваться множество раз после 20 пассажей, в частности иммортализованные клетки, может быть получена при изменении клеток путем УФ-обработки, например при облучении таких клеток эффективной дозой УФ-света. Термин «эффективная доза УФ-света» согласно настоящему изобретению представляет собой количество облучения, необходимое для трансформирования клеточных линий, которые не являются непрерывными, в непрерывные клеточные линии. Эффективная доза УФ-света варьирует от минимальной дозировки, необходимой для таких трансформаций, до максимальной дозировки, которая является толерантной для этих клеток, не вызывая летальных последствий для всей клеточной культуры в целом. Очевидно, что за пределами эффективной дозы, выше или ниже ее, непрерывные клеточные линии не могут быть получены. Специалисты в данной области могут без труда определить оптимальные эффективные дозировки для каждой клеточной линии на основе информации и практического руководства, описанных в настоящем изобретении, без длительных подходов к оптимизации. Клетки могут представлять собой первичные клетки или клетки, способные к размножению, полученные после нескольких пассажей. Культивирование клеточных линий может осуществляться по методикам, применяемым для стандартных клеточных культур, например с использованием систем, включающих Т-образные колбы или качалочные колбы, или культивирования в перемешиваемом резервуаре или в другом варианте биореактора. В некоторых вариантах осуществления настоящего изобретения, культура адаптирована к условиям бессывороточной среды и выдерживается в таких условиях.
В контексте настоящего описания, термин «УФ-свет» обозначает ультрафиолетовое облучение с длиной волны от 10 до 400 нм, в частности от 100 до 400 нм. УФ-свет может быть выбран из группы, состоящей из УФ-С (100-280 нм), УФ-B (280-320 нм) и УФ-А (320-400 нм). В некоторых вариантах осуществления настоящего изобретения, длина волны составляет от 200 до 300 нм. Фотосенсибилизирующие агенты, такие как средства, которые интеркалируют ДНК и которые активируются УФ-светом, могут использоваться для усиления модифицирующего эффекта УФ-света, хотя они не являются обязательными во всех вариантах осуществления настоящего изобретения. В одном варианте осуществления настоящего изобретения, УФ-свет представляет собой УФ-С с длиной волны от примерно 100 до примерно 280 нм. В другом варианте осуществления настоящего изобретения, УФ-свет имеет длину волны от примерно 240 до примерно 290 нм. В другом варианте осуществления настоящего изобретения, примерно 85% или более применяемого для обработки УФ-света имеет длину волны 254 нм.
Без ограничения рамками какой-либо теории, следует отметить, что УФ-свет изменяет генетический материал клетки, вводя мутации. Хотя некоторые такие изменения могут в основном восстанавливаться репарирующими механизмами клетки, некоторые изменения остаются. Некоторые такие изменения могут вводить летальные мутации, а некоторые изменения могут приводить к иммортализации клеток. В экспериментах по УФ-облучению может быть отобрана оптимальная дозировка, которая приводит к тому, что значительная часть клеток будет иммортализована и далее может быть культивирована. После пассирования отбирают только жизнеспособные клетки, способные к размножению, которые, как ожидается, будут иметь лишь минорные изменения, включающие по меньшей мере одно изменение, которое приводит к иммортализации. Значительная часть облученных клеток не будет иммортализована, но будет содержать различные изменения, ведущие к апоптозу или к некрозу клеток. Однако, в принципе, уже только одной клетки с изменением, индуцирующим иммортализацию, будет достаточно для получения непрерывной клеточной культуры, поскольку такая клетка будет продолжать размножаться и выживать в течение большого числа раундов пассирования, согласно настоящему описанию.
Эмиссия УФ-света может быть представлена в форме непрерывной эмиссии УФ-света, например, при использовании ртутной лампы, или это может быть пульсирующий УФ-свет, например, в случае использования методики монохроматического лазера. Желательная интенсивность УФ-облучения может быть достигнута при объединении двух или нескольких ламп. При этом могут быть объединены по меньшей мере две процедуры облучения с введением между ними паузы. Настоящее изобретение относится к любой эффективной дозировке УФ-света, то есть к такой дозе УФ-света, которая изменяет клетку таким образом, что она начинает непрерывно пролиферировать. Эффективная дозировка может зависеть от множества факторов, в основном известных специалистам в данной области, например от физических параметров камер для проведения УФ-обучения, таких как размер и диаметр лампы и камер, расстояния между средой, содержащей клетки и источником УФ-света, светоабсорбирующими и отражающими свойствами материала камеры. В конкретных вариантах осуществления настоящего изобретения, клетки облучают в монослое, когда один клеточный слой лежит на поверхности. К тому же, длина волны и интенсивность УФ-света, а также время контакта экспонируемой клетки с УФ-светом являются также важными параметрами для определения эффективной дозировки. Кроме того, на эффективную дозировку также оказывает влияние сама клетка, среда, содержащая вирус, а также их светоабсорбирующая способность. В различных вариантах осуществления настоящего изобретения, эффективная дозировка является достаточной для изменения по меньшей мере 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100% клеток, содержащихся в образце, и в других вариантах осуществления настоящего изобретения, эффективная дозировка является достаточной для изменения клеток до уровня, когда по меньшей мере 10% клеток меняется так, что достигается их непрерывный рост. При этом, 10%-90% клеток может погибнуть под действием облучения. В некоторых вариантах осуществления настоящего изобретения, образец, содержащий клетки, подвергается воздействию эффективной дозировки, составляющей по меньшей мере примерно 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65 или 70 мДж/см2. В некоторых вариантах осуществления настоящего изобретения, эффективная дозировка составляет примерно 500, 450, 400, 350, 300, 250, 200, 180, 150, 130 или 105 мДж/см2. В конкретных вариантах осуществления настоящего изобретения, указанная УФ-дозировка составляет примерно от 70 до 105 мДж/см2. В некоторых вариантах осуществления настоящего изобретения, указанные дозировки используют применительно к УФ-С-свету. Термин «примерно» имеет отношению к качеству обычных УФ-ламп, которые не дают дискретного УФ-света при одной длине волны (как в случае лазеров), а характеризуются спектром с гауссовым распределением, когда испускается также свет, длина которого близка к указанным длинам волн. В тех вариантах осуществления настоящего изобретения, где используются некоторые такие лампы, термин «примерно» относится к отклонению от указанного значения длины волны на 10%.
Перед или после облучения или пассирования, клеточная линия может быть также отобрана для проведения контроля качества, с учетом таких критериев, как стерильность, отсутствие загрязнений микоплазмами, отсутствие загрязнений патогенными вирусами, и/или для проведения теста F-Pert с целью определение наличия активности обратной транскриптазы, а также для проведения других анализов, необходимых для контроля качества, согласно критериям, действующим в данной области применительно к отбору клеточных линий для использования в медицинской биотехнологии. В этом смысле, термин «свободный/не содержащий» следует понимать таким образом, что уровень загрязнений уменьшен до значений ниже пределов выявления, определяемых используемыми в настоящее время процедурами контроля качества. Поскольку способ по настоящему изобретению может использоваться для создания непрерывных клеточных линий без использования для этого вирусных векторов или без введения в среду ретровирусов, рассматриваемые клеточные линии зачастую свободны от любой ретровирусной активности, что может быть подтверждено в тесте на активность обратной транскриптазы. Однако такая ретровирусная активность может быть специально введена в клеточные линии по настоящему изобретению методами молекулярной инженерии, с целью, например, продукции вирусов или белков в клеточных линиях.
Рассматриваемая клеточная линия может состоять из любых эукариотических клеток, в частности клеток высших организмов, таких как клетки рыбы, птицы, рептилии, земноводных или млекопитающих и даже клетки насекомых или растений. В некоторых вариантах осуществления настоящего изобретения, используются клетки млекопитающих, таких как хомяк, мышь, крыса, собака, лошадь, корова, примат или человек; в других вариантах осуществления настоящего изобретения, используются клетки птиц, таких как курица, утка, канарейка, попугай, перепелка, страус, эму, индейка или гусь. В основном, любой вид птицы может служить в качестве источника птичьих клеток для их использования согласно настоящему изобретению. В некоторых вариантах осуществления настоящего изобретения, полезно применять менее распространенный одомашненный вид птиц (такой как перепелка или эму), с тем чтобы избежать потенциальной контаминации хранящихся тканей вирусами, распространенными среди преобладающих в домашнем хозяйстве видов птиц (таких как куры).
Облученные клетки могут относится к любому типу клеток. В некоторых вариантах осуществления настоящего изобретения, указанную ткань получают из эмбрионов. В ряде вариантов, используют смешанную культуру более чем одного типа тканей, которая может быть получена при разрушении ткани или множества тканей. В других вариантах осуществления настоящего изобретения, указанные клетки представляют собой клетки пуповины эмбриона. Облученные клетки, полученные из одной или нескольких тканей, могут представлять собой или могут включать, например, эндотелиальные клетки, эпителиальные клетки, плюрипотентные или тотипотентные стволовые клетки, эмбриональные стволовые клетки, нейрональные клетки, клетки почки, печени, мышечные клетки, клетки кишечника, лейкоциты, клетки легкого, клетки яичника, клетки кожи, клетки селезенки, клетки желудка, клетки щитовидной железы, клетки сосудов, клетки поджелудочной железы и/или могут представлять собой их клетки-предшественники, а также их сочетания.
Во многих вариантах осуществления настоящего изобретения, клетки фиксируют на поверхности в процессе их облучения или во время культивирования. Культивирование на поверхности особенно хорошо подходит для эндотелиальных клеток, поскольку далее такие клетки могут быть отобраны для проведения контроля качества согласно действующим критериям, таким как их способность образовывать монослои, которая может быть ухудшена, если УФ-дозировка будет вводить слишком много изменений повреждающего характера. На такой поверхности клетки могут формировать монослои. В частности, клетки культивируют или облучают на микроносителе. Альтернативно, указанные клетки либо подвергают облучению, либо культивируют, либо оба этих процесса могут быть объединены в суспензии. Клетки, которые ранее облучались или культивировались на поверхности, далее могут быть адаптированы для роста в суспензионной культуре.
В другом аспекте, настоящее изобретение относится к способу получения вируса, где указанный способ включает получение клеток в непрерывной клеточной линии, по способу настоящего изобретения, затем инфицирование указанных клеток указанным вирусом, размножение указанного вируса в указанных клетках и сбор указанного вируса.
В соответствии с настоящим изобретением, продуцируемые описанным в изобретении способом вирусы выбирают из ДНК или РНК вирусов, покрытых оболочкой или не покрытых оболочкой, содержащих одноцепочечные или двуцепочечные (ДНК) геномы, смысловые или антисмысловые цепи, непрерывные или сегментированные. Указанные вирусы могут быть выбраны из группы, состоящей из бакуловирусов, поксвирусов, аденовирусов. Паповавирусов, парвовирусов, гепаднавирусов, коронавирусов, флавивирусов, тогавирусов, астровирусов, пикорнавирусов, ретровирусов, ортомиксовирусов, филовирусов, парамиксовирусов, рабдовирусов, аренавирусов и буньявирусов. В некоторых вариантах осуществления настоящего изобретения, указанные вирусы выбирают из группы оболочечных вирусов, включающих флавивирусы, тогавирусы, ретровирусы, коронавирусы, филовирусы, рабдовирусы, буньявирусы, ортомиксовирусы, парамиксовирусы, аренавирусы, гепаднавирусы, герпесвирусы и поксвирусы. В других вариантах осуществления настоящего изобретения, указанные вирусы представляют собой оболочечные вирусы, такие как вирусы гриппа, включая вирус гриппа A, B или С, вирус лихорадки западного Нила, вирус осповакцины, модифицированный вирус осповакцины или вирусы реки Росс. В других вариантах осуществления настоящего изобретения, указанные вирусы выбирают из группы оболочечных РНК вирусов, включающих флавивирусы, тогавирусы, ретровирусы, коронавирусы, филовирусы, рабдовирусы, буньявирусы, ортомиксовирусы, парамиксовирусы и аренавирусы. В конкретных вариантах осуществления настоящего изобретения, указанный вирус представляет собой MVA (модифицированный вирус осповакцины Анкара (Ankara)), TBE вирус (вирус клещевого энцефалита), вирус желтой лихорадки, вирус лихорадки Западного Нила, вирус гриппа Новая Каледония или вирус гриппа.
После стадии сбора, указанный вирус может быть инактивирован любыми известными способами, применяемыми для инактивации вирусов, например с использованием методики, описанной в публикации по патенту США № 2006/0270017 A1, включенной в настоящую работу ссылкой. В частности, инактивация может быть проведена с использованием формальдегидной обработки и/или УФ-облучения, по отдельности или в сочетании.
В основном, сыворотка или получаемые из сыворотки вещества, такие как, например, альбумин, трансферрин или инсулин, могут включать нежелательные вещества, которые загрязняют клеточные культуры и получаемые из них биологические продукты. Кроме того, добавки, получаемые из сыворотки человека, должны тестироваться на наличие в них всех известных вирусов, включая вирусы гепатита и ВИЧ, которые могут переноситься через сыворотку. В этой связи, согласно некоторым вариантам осуществления способа по настоящему изобретению, клетки из рассматриваемой клеточной линии адаптируют для роста в бессывороточной среде, так что они могут быть отобраны по их способности расти в бессывороточных средах. Указанные среды могут быть свободны от сыворотки или фракций сыворотки или также от основных компонентов крови. Среды, подходящие для использования в таких вариантах осуществления настоящего изобретения, выбирают из DMEM/HAM's F12, RPMI, MEM, BME, среды Веймаута (Waymouth), в частности из среды, не содержащей олигопептидов или белков, как описано в патенте США 2007/0212770, который включен в настоящее описание полностью ссылкой, или могут использоваться их сочетания. Указанная не содержащая олигопептидов среда может быть также свободна от белков или олигопептидов крови с размерами, превышающими 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5 или 4 аминокислот(ы), но могут включать глютатион. Безбелковая среда по существу не содержит белков, но может включать белки, продуцируемые клеточными линиями, или протеазы. В частности, среда может также включать полиамид в качестве рост-стимулирующего средства, и/или это может быть среда, химический состав которой определен, как описано, в частности, в патенте США US 2007/0212770. Термин «химически определенный» означает, что данная среда не включает любые неопределенные добавки, такие как, например, экстракты компонентов животных, органов, желез, растений или дрожжей. Соответственно, каждый компонент химически определенной среды тщательным образом определяется. Химически определенные среды по существу не содержат белков или гидролизатов клеток, но могут содержать белки, продуцируемые клеточной линией, или протеазы. Примеры таких сред приведены в «Руководстве по бессывороточным клеточным культурам» («A guide to Serum-Free Cell Culture», GIBCO cell culture (2003)), которое доступно через Интернет на странице: www.invitrogen.com/content/sfs/brochures/332-032442_SFMBrochure.pdf).
Указанные среды, включающие бессывороточную среду, не содержащую олигопептидов, или химически определенную среду, могут также включать глютатион и/или протеазы, в частности трипсин, такой как свиной трипсин или рекомбинантный трипсин, до или после инокуляции вируса (Klenk et al. (1975) Virology, 68: 426-439). Такие протеазы могут также быть необходимыми при культивировании клеточных линий, поскольку клетки фиксировались на поверхности и степень такой фиксации могла варьировать от сильной до очень слабой. Сильно прикрепленные клетки могут быть отделены от поверхности с помощью протеаз и/или хелатирующих агентов, таких как ЭДТА (Doyle et al. Chapter 4: Core Techniques, in: Cell & Tissue Culture: Laboratory Procedures, ECACC, John Wiley & Sons, Chichester (1996)). Кроме того, указанная среда, в частности безбелковая среда, может включать гидролизаты растений или дрожжей, до или после инокуляции. Очевидно, что такая среда, как ожидается, будет также включать белки или метаболические продукты, продуцируемые клеточными линиями по настоящему изобретению.
Клеточные линии, получаемые с использованием способа по настоящему изобретению, в основном являются неопухолегенными и/или неканцерогенными. В некоторых вариантах осуществления настоящего изобретения, клетки клеточной линии тестируют и отбирают для проведении теста на качество, такого как F-pert тест.
В другом аспекте, настоящее изобретение относится к способу получения продукта рекомбинантного гена, где указанный способ включает получение клеток в непрерывной клеточной линии, создаваемой по описываемому в настоящем изобретении способу, с последующей трансфекцией клеток нуклеиновой кислотой, которая кодирует указанный генный продукт, экспрессией указанного генного продукта и, необязательно, сбором указанного генного продукта. Нуклеиновая кислота может представлять собой ДНК, РНК или ПНК. Кроме гена, нуклеиновая кислота может включать промоторы для экспрессии в клетке и маркеры селекции.
В другом аспекте, настоящее изобретение относится к непрерывной клеточной линии, получаемой по способу, включающему отбор живых клеток от животного или человека, облучение указанных клеток эффективной дозой УФ-света, достижение пролиферации указанных клеток и селекцию клеток, способных пролиферировать по меньшей мере после 20 пассажей, в качестве клеток указанной непрерывной клеточной линии. Клеточные линии по настоящему изобретению также включают потомство таких полученных клеточных линий. В частности, клеточная линия определяется как линия, получаемая согласно описанным вариантам осуществления способа по настоящему изобретению. Получаемые непрерывные клеточные линии могут характеризоваться такими особенностями, как теломеразная активность специфических кариотипов, ассоциированная с облучением, необходимая для создания непрерывной клеточной линии. В конкретных вариантах осуществления настоящего изобретения, клетки в указанной клеточной линии являются неопухолегенными и/или неканцерогенными и, в частности, также проходят тесты на качество, такие как F-pert тест.
В конкретных вариантах осуществления настоящего изобретения, клеточная линия представляет собой клеточную линию, депонированную в ECACC, с номером доступа 08020602, 08020603 или 08020604, соответствующую описаниям QOR/RE07-169, QOR1 CJ07 и CORECB/SF08-06, соответственно. Другие клеточные линии по настоящему изобретению имеют характерные особенности, такие как способность к размножению, характер клеточного роста, теломеразная активность, соответствующий кариотип, характер хромосом или длина теломеров, как и в указанных депонированных клеточных линиях, и, разумеется, представляют собой непрерывную клеточную линию.
Ниже настоящее изобретение иллюстрируется приведенными примерами, которые никоим образом не направлены на его ограничение.
Примеры
Пример 1: Различающееся по длительности облучение клеток Vero УФ-светом с целью получения мутантов
Материалы:
Среда TC-Vero
N1-буфер
Трипсин (разведение 1:10)
Ингибитор трипсина
6-луночные планшеты, Corning Cat. No. 3516
Т-образная колба на 25 см2, Nunc Cat. No.: 163371
УФ-лампа, VL 50C, 240 нм Grid-Tube, 50 Вт, Компания Vilber-Lourmet
Процедура
Проводят установку в 6-луночных планшетах с плотностью 1×106 клеток/лунку и добавляют 5 мл среды (в двойном повторе). Всего используют 7 планшетов (для каждого оцениваемого в эксперименте времени: 2 лунки/на планшет).
Через 24 часа образуется хорошая монослойная культура.
Отсасывают 5 мл среды до 1 мл и открытые планшеты облучают УФ-светом (расстояние планшетов от УФ-лампы = 9 см).
Планшет A: 15 минут
Планшет B: 30 минут
Планшет C: 45 минут
Планшет D: 60 минут
Планшет E: 90 минут
Планшет F: 120 минут
Планшет G: контроль, без облучения
После облучения клетки в обеих параллельных лунках обрабатывают трипсином (1 мл трипсина + 0,5 мл ингибитора трипсина /лунку), где клетки в первой лунке используют для определения количества клеток (CC) и их жизнеспособности, а клетки во второй лунке пассируют в колбе на 25 см2 с 10 мл среды.
| Тест, номер | Время облучения | TCC/лунку [×106] | Жизнеспособность по Буркеру-Турку [%] |
| A | 15 минут | 1,50 | 60,8 |
| B | 30 минут | 1,25 | 27,9 |
| C | 45 минут | 1,15 | 5,6 |
| D | 60 минут | 0,95 | 23,6 |
| E | 90 минут | 0,55 | не определяли |
| F | 120 минут | 0,30 | не определяли |
| G | контроль | 1,25 | 94,2 |
Содержание T-образной колбы на 25 мл обрабатывали трипсином и определяли показатели ТСС и жизнеспособность с использованием Cedex:
| Тест, номер | TCC/Roux [×106] | Жизнеспособность [%] | Картина при микроскопировании |
| A | 0,80 | 23,2 | сфероидальные клетки, не прилипающие |
| B | 0,60 | 18,8 | клетки в супернатанте, не прилипающие |
| C | 0,60 | 34,4 | отдельные клетки в супернатанте, не прилипающие |
| D | 0,50 | 25,0* | только остатки клеток |
| E | 0,50 | 22,7* | только остатки клеток |
| F | 0,40 | 11,1* | только остатки клеток |
| G | 1,80 | 96,6 | хороший монослой, 95-100% |
| * Фактические значения ниже, поскольку подсчет клеток с использованием Cedex дал слишком низкие результаты для корректного определения количества клеток. |
Пример 2: УФ-облучение клеток птицы
Целью данного испытания было исследовать возможность применения обработки УФ-светом в качестве инструмента для создания непрерывных клеточных линий, подходящих для производства вакцины.
Первичные куриные эмбрионы и эмбрионы перепелок использовали в качестве исходного материала для получения исходных первичных монослойных культур. Полученные из них клеточные культуры с контролируемым качеством использовались для разработки процедуры, основанной на воздействии УФ-света.
Воздействие на первичные клетки УФ-света (254 нм). Непрерывная клеточная линия была получена из первичных клеток эмбрионов виргинской перепелки или курицы путем УФ-облучения.
Детально процесс создания клеточной линии из первичных клеток эмбрионов перепелки до создания безопасных банков клеток проиллюстрирован на фиг.3 в форме филогенетического дерева.
В качестве материала для УФ-облучения, в каждом случае отбирают и оттаивают одну ампулу из клеточных банков, с учетом результатов первой оценки (клетки курицы, японской перепелки и виргинской перепелки), полученные на основе клеточного препарата из эмбрионов курицы, эмбрионов японской перепелки и виргинской перепелки (смешанная культура разрушенных полных эмбрионов).
Установку для УФ-облучения собирали в 6-луночных планшетах при посеве клеток с плотностью 1×106 клеток/лунку и при добавлении 5 мл среды. В качестве среды использовали TBE среду (FSME) с добавкой 5% ФСТ и антибиотиков (пенициллин, стрептомицин и гентамицин). Всего использовали 7 планшетов с двумя лунками на планшете для каждого варианта. Через 24 часа в лунках наблюдалось образование однородной монослойной культуры. Для облучения клеток, отсасывали 5 мл среды до остатка в 1 мл и открытые планшеты облучали УФ-светом в ламинарном потоке указанным ниже способом. Расстояние планшетов от УФ-лампы составляло 9 см. В качестве источника УФ-света использовали УФ-лампу от компании Vilber-Lourmet (VL 50C, 240 нм Grid-Tube, 50 Вт).
Планшет A: 0,5 минут
Планшет B: l минута
Планшет C: 2 минуты
Планшет D: 3 минуты
Планшет E: 4 минуты
Планшет F: 5 минут
Планшет G: контроль, не облучали
После облучения, клетки обрабатывали трипсином в лунках (1 мл трипсина при разведении N1 буфером в соотношении 1:10), где использовали 1 мл клеточной суспензии (всего 6 мл) для определения числа клеток и их жизнеспособности, а оставшиеся клетки пассировали в 5 мл среды в колбе на 25 см2. Результаты приведены в таблице, прилагаемой к данному примеру.
В ходе первого периода культивирования (25-35 дней) проводили только замену сред, а морфологию и адгезивность клеток оптически оценивали в отдельных тестах. Только после образования островков адгезивно растущих клеток в T-25 колбах, клетки в вариантах А-Е обрабатывали трипсином и переносили в 6-луночные планшеты (с меньшей площадью поверхности, чем в колбах Т-25), с тем чтобы достигалась гомогенная колонизация прилипающих клеток. При этом клетки, примерно на уровне K40-K50, которые достигли слияния на 80-100%, далее пассировали в Т-25 и Т-75 колбах, каждый вариант в течение 6-9 дней, и переносили в 1-2 герметично закрытые ампулы, которые служили в качестве исходного материала для получения и оценки банков клеток (примерно 10 ампул). Трипсиновая обработка и пассирование указанных клеточных популяций описаны в примере 3.
Используемые препараты
Среда: среда TBE (FSME) + 5% ФСТ + смесь антибиотиков (пенициллин/стрептомицин, 100 мг/л + гентамицин, 50 мг/л)
TBE среда (FSME) + 10% ФСТ
Среда TC Vero + 10% ФСТ
Буфер N1
Гамма-трипсин
ДМСО от компании Sigma
Сокращения: CC - количество клеток; T-25/75/175...25/75/175 см2 - Т-колбы
| Количество клеток и их жизнеспособность по данным отдельных тестов, проведенных после облучения | ||||
| Тест, номер | Время облучения | CC/мл [×106] | Жизнеспособность по Буркеру-Турку [%] | TCC/лунку [×106] |
| A | 30 секунд | 0,75 | 87,3 | 0,15 |
| B | 1 минута | 0,75 | 79,5 | 0,15 |
| C | 2 минуты | 0,80 | 84,1 | 0,16 |
| D | 3 минуты | 0,70 | 90,4 | 0,14 |
| E | 4 минуты | 0,80 | 80,0 | 0,16 |
| F | 5 минут | 0,70 | не определяли | 0,14 |
| G | контроль | 0,75 | 84,1 | 0,15 |
Поскольку в вариантах A-G были получены аналогичные значения по числу клеток и их жизнеспособности, по данным индивидуальных тестов, то, следовательно, не было выявлено существенных различий по результатам УФ-облучения клеток в зависимости от длительности облучения. Именно по этой причине морфологию и адгезивную способность сравниваемых культур оценивали практически ежедневно для выявления особенностей.
Из всех исследованных вариантов A-F, клеточная популяция из варианта E имела наилучшие свойства в качестве непрерывной, адгезивно растущей клеточной линии, такие как наличие гомогенных клеточных структур, возможность культивирования в различных Т-образных колбах, постоянный рост клеток после нескольких пассажей, способность к криоконсервации и пригодность для размножения вирусов (например, MVA вируса).
В случае клеток перепелки, клеточную популяцию из варианта F не удалось культивировать. Сниженный рост клеток при образовании негомогенной клеточной лужайки (крупные объединения) могли наблюдаться после более чем 6 пассажей клеток (тест G), которые не облучали УФ-светом. После 16 пассажа и далее, клетки потеряли способность делиться и не могли дальше культивироваться. При этом аналогичные результаты получали в тестах с клетками и перепелки, и курицы.
Пример 3: Трипсиновая обработка и пассирование клеток
Трипсиновая обработка и пассирование адгезивно растущих клеток перепелки проводили по схеме пассирования, аналогичной схеме, которая обычно используется для Vero клеток. После слива культуральной среды проводили стадию промывки N1 буфером, после чего на культуру наслаивали один или несколько слоев соответствующего количества гамма-трипсина, разведенного в соотношении 1:10, и затем все инкубировали при температуре (в случае 6-луночных планшетов и колб T-25 (T-25...25 см2 T-колбы) было достаточно комнатной температуры) 37°С до отделения клеток от сосуда для культивирования (при осторожном соскабливании). Добавление трипсинового ингибитора для остановки действия трипсина необязательно, поскольку культуральная среда содержала ФСТ. Затем клетки переносили в новую культуральную среду и распределяли по другим сосудам для культивирования, в соответствии с определенными схемами испытания, и затем снова растили.
Приведенная ниже таблица показывает количества, использованные при такой трипсиновой обработке.
| Сосуд для культивирования | Буфер N1 | Гамма-трипсин (разведенный 1:10 N1 буфером) |
| 6-луночный планшет | 2 мл | 1 мл |
| Т-колба, 25 см2 | 5 мл | 1 мл |
| Т-колба, 75 см2 | 10 мл | 1 мл |
| Т-колба, 175 см2 | 20 мл | 2 мл |
Пример 4: Дозиметрия УФ-С для иммортализации клеток с использованием УФ-ламп VL 50C
Определяли дозу, необходимую для получения непрерывных клеточных линий путем УФ-облучения. Установка для дозиметри