Способы и композиции, содержащие клонидин, предназначенные для лечения послеоперационной боли
Иллюстрации
Показать всеИзобретение относится к имплантируемой форме депо лекарственного средства, пригодной для ослабления, профилактики или лечения послеоперационной боли у пациента, нуждающегося в подобном лечении, причем имплантируемая форма депо лекарственного средства содержит терапевтически эффективное количество клонидина или его фармацевтически приемлемой соли и полимер, причем депо лекарственного средства является имплантируемым в участок под кожей с целью ослабления, профилактики или лечения послеоперационных болей и при этом депо лекарственного средства способно к высвобождению: 1) примерно от 5% примерно до 45% клонидина или его фармацевтически приемлемой соли по отношению к общему количеству клонидина или его фармацевтически приемлемой соли, содержащемуся в депо, в течение первого периода, составляющего до 48 часов; 2) примерно от 55% примерно до 95% клонидина или его фармацевтически приемлемой соли по отношению к общему количеству клонидина или его фармацевтически приемлемой соли, содержащемуся в депо, в течение последующего периода, составляющего по меньшей мере 3 суток. Имплантируемая форма обеспечивает легкую возможность аккуратной точной имплантации депо лекарственного средства при минимальных физических и психологический травмах для пациента. 3 н. и 12 з.п. ф-лы, 2 табл., 20 ил., 6 пр.
Реферат
Настоящая заявка испрашивает приоритет согласно дате подачи заявки на патент США №12/421144, поданной 9 апреля 2009 г.и озаглавленной "Способы и композиции, содержащие клонидин, предназначенные для лечения послеоперационных болей", и предварительной заявки США №61/046277, поданной 18 апреля 2008 г.и озаглавленной "Способы и композиции, содержащие клонидин, предназначенные для лечения послеоперационных болей", которые включены в настоящее описание посредством ссылки.
Область изобретения
Облегчение боли является первостепенной задачей при лечении пациентов, перенесших операции. Надлежащее облегчение боли приносит пациенту значительную пользу с точки зрения физиологии и психологии. Эффективное облегчение боли приводит не только к более мягкому и спокойному течению послеоперационного периода (например, улучшению настроения, сна, качества жизни и др.) и более ранней выписке из медицинских/хирургических/амбулаторных учреждений; оно также может замедлять развитие хронических болевых синдромов (например, фибромиалгии, миалгии и др.).
Боль обладает биологической функцией. Она часто сигнализирует о наличии повреждения или заболевания в организме и часто сопровождается воспалением (покраснением, припухлостью и/или жжением). В случае послеоперационной боли последняя может быть результатом операции или другого воздействия, как например, в случае терапии острых болей, возникших в результате ожогов или нехирургических травм. Целью терапии послеоперационной боли является ослабление или устранение боли и дискомфорта с применением лекарственных средств, вызывающих минимум побочных эффектов или не вызывающих таковых.
Сила послеоперационной боли, которой может страдать пациент, в значительной степени определяется тем, какая часть организма подверглась операции. Операции на грудной клетке и верхнем отделе брюшной полости обычно вызывают более сильные боли, чем операции на нижнем отделе брюшной полости, которые в свою очередь вызывают более сильные боли, чем периферические операции на конечностях. Тем не менее любую операцию, затрагивающую полости организма, поверхности крупных суставов, позвоночный столб или глубокие ткани, следует рассматривать как причиняющую боль. В частности, операции на грудной клетке и верхнем отделе брюшной полости могут вызвать сильные изменения легочной функции, повышение мышечного тонуса брюшной полости и связанное с ним снижение функции диафрагмы. Результатом является неспособность к отхаркиванию и отделению секретов, что может привести к коллапсу легких и пневмонии. Длительная боль может снижать физическую активность и приводить к венозному стазу и повышению риска тромбоза глубоких вен и последующей легочной эмболии. Кроме того, возможно проявление сильных воздействий на сократительную способность кишечного и мочевого тракта, что в свою очередь может привести к послеоперационной непроходимости кишечника, тошноте, рвоте и задержке мочи. Данные проблемы неприятны для пациента и могут увеличить срок пребывания в стационаре. Многие пациенты, испытывающие умеренные и сильные послеоперационные, посттравматические и послеожоговые боли, часто нуждаются в обезболивании по меньшей мере в течение первых 3 суток после травмы или операции.
Одним из известных классов лекарственных средств для лечения послеоперационных болей являются опиоиды. Хорошо известно, что данный класс соединений принадлежит к числу препаратов, наиболее эффективных для снятия послеоперационных болей. К сожалению, поскольку опиоиды применяют систематически, связанные с этим побочные эффекты вызывают существенные последствия, в том числе потерю пациентом дееспособности, угнетение дыхательной системы, запор и психоактивные эффекты, например, седативный эффект и эйфорию, что создает препятствия для выздоровления и восстановления подвижности. Кроме того, вследствие побочных эффектов врачи обычно ограничивают применение опиоидов первыми 24 сутками после операции. Поэтому предпочтительным является использование ненаркотических препаратов, обеспечивающих прямое локализованное снятие боли в месте проведения операции.
Одним из лекарственных средств, известных специалистам в области медицины, является клонидин, широко известный как антигипертензивное средство, действующее в качестве агониста альфа-2-адренергических рецепторов и агониста нервных рецепторов. В общем случае клонидин, также известный как 2,6-дихлор-N-2-имидазолидинилиденбензоламин (С9H9Сl2N3), может быть представлен следующей химической структурной формулой:
Однако до сегодняшнего дня в качестве эффективного средства против болей, в том числе послеоперационных болей или воспалений, он широко не рассматривался. Поэтому существует потребность в разработке эффективных составов на основе данного соединения для применения в данной области.
Краткое описание изобретения
Предложены новые способы и композиции для эффективной профилактики, лечения или ослабления послеоперационных болей или воспалений. В различных вариантах осуществления предложены композиции и способы, обладающие долговременными анальгетическим и противовоспалительным эффектами в течение по меньшей мере 3 суток после применения депо одного или нескольких лекарственных средств. Предложены новые композиции и способы, способные обеспечить легкую возможность аккуратной и точной имплантации депо лекарственного средства, содержащего антигипертензивное средство, при минимальных физических и психологических травмах для пациента. Депо лекарственного средства может быть легко доставлено к целевому участку тканей (например, в брюшную полость, синовиальное соединение, в позвоночный столб или в его область и др.) и может обеспечить облегчение и/или устранение боли в течение по меньшей мере 3-10 суток. Таким образом может быть осуществлена аккуратная и точная имплантация лекарственной формы при минимальной инвазивности процедуры.
В одном примере варианта осуществления изобретения предложено имплантируемое депо лекарственного средства, пригодное для ослабления, профилактики или лечения послеоперационных болей или воспалений у пациента, нуждающегося в подобном лечении. Имплантируемое депо лекарственного средства содержит терапевтически эффективное количество клонидина или его фармацевтически приемлемой соли и полимер. Депо лекарственного средства имплантируют в участок под кожей с целью ослабления, профилактики или лечения послеоперационных болей. Депо лекарственного средства способно к высвобождению:
1) примерно от 5% примерно до 45% клонидина или его фармацевтически приемлемой соли по отношению к общему количеству клонидина или его фармацевтически приемлемой соли, содержащемуся в депо лекарственного средства, в течение первого периода, составляющего до 48 часов, до 24 часов или примерно от 24 до 48 часов; 2) примерно от 55% примерно до 95% клонидина или его фармацевтически приемлемой соли по отношению к общему количеству клонидина или его фармацевтически приемлемой соли, содержащемуся в депо лекарственного средства, в течение последующего периода, составляющего по меньшей мере 3 суток, по меньшей мере 7 суток, от 3 до 30 суток или от 3 до 10 суток. Полимер содержит один или несколько следующих компонентов: сополимер лактида с гликолидом, полилактид, полигликолид, полиортоэфир, D-лактид, D,L-лактид, поли(D,L-лактид), L-лактид, сополимер D,L-лактида с капролактоном, сополимер D,L-лактида с гликолидом и капролактоном, поликапролактон или их сочетание. Полимер может быть биоразлагаемым. В различных вариантах осуществления, если первый период составляет до 24 ч или примерно 24-48 часов, депо лекарственного средства способно к высвобождению примерно от 5% примерно до 30% клонидина или его фармацевтически приемлемой соли.
В другом примерном варианте осуществления предложен способ изготовления имплантируемого депо лекарственного средства. Способ включает в себя смешение биосовместимого полимера с терапевтически эффективным количеством клонидина или его фармацевтически приемлемой соли и изготовление имплантируемого депо лекарственного средства из смеси.
В еще одном примерном варианте осуществления предложен способ лечения, профилактики или ослабления послеоперационных болей у пациента, нуждающегося в подобном лечении. Способ включает доставку одного или нескольких биоразлагаемых депо лекарственного средства, содержащих терапевтически эффективное количество клонидина или его фармацевтически приемлемой соли, в целевой участок тканей подкожно до, во время или после операции, причем депо лекарственного средства способно к высвобождению в участок под кожей начальной болюсной дозы эффективного количества клонидина или его фармацевтически приемлемой соли с последующим замедленным высвобождением дозы эффективного количества клонидина или его фармацевтически приемлемой соли за период по меньшей мере 3 суток, по меньшей мере 7 суток, от 3 до 30 суток, от 3 до 10 суток или от 5 до 7 суток. Депо лекарственного средства может содержать полимер; при этом полимер может содержать один или несколько следующих компонентов: сополимер лактида с гликолидом, полилактид, полигликолид, сложный полиортоэфир, D-лактид, D,L-лактид, поли(D,L-лактид), L-лактид, сополимер D,L-лактида с капролактоном, сополимер D,L-лактида с гликолидом и капролактоном, поликапролактон или их сочетание. Депо лекарственного средства способно к высвобождению примерно от 40 до 90% клонидина или его фармацевтически приемлемой соли по отношению к общему количеству клонидина или его фармацевтически приемлемой соли, содержащемуся в депо лекарственного средства, за период замедленного высвобождения, составляющий от 3 до 10 суток после применения депо лекарственного средства на целевом участке тканей. Начальная болюсная доза клонидина может составлять примерно от 15% примерно до 45% клонидина или его фармацевтически приемлемой соли по отношению к общему количеству клонидина, содержащемуся в депо лекарственного средства.
В другом примере варианта осуществления предложено имплантируемое депо лекарственного средства. Имплантируемая форма депо лекарственного средства содержит 1) терапевтически эффективное количество клонидина или его фармацевтически приемлемой соли; 2) полимер. Депо лекарственного средства способно к высвобождению в участок под кожей начальной болюсной дозы клонидина или его фармацевтически приемлемой соли; депо лекарственного средства также способно к замедленному высвобождению дозы эффективного количества клонидина или его фармацевтически приемлемой соли за последующий период, составляющий от 3 до 30 суток, от 3 до 10 суток или от 7 до 10 суток. Депо лекарственного средства способно к высвобождению примерно от 55 до 85% клонидина или его фармацевтически приемлемой соли по отношению к общему количеству клонидина или его фармацевтически приемлемой соли, содержащемуся в депо лекарственного средства, за период замедленного высвобождения, составляющий от 3 до 30 суток, от 3 до 10 суток или от 7 до 10 суток после применения депо лекарственного средства. Полимер содержит один или несколько следующих компонентов: сополимер лактида с гликолидом, полилактид, полигликолид, полиортоэфир, D-лактид, D,L-лактид, поли(D,L-лактид), L-лактид, сополимер D,L-лактида с капролактоном, сополимер D,L-лактида с гликолидом и капролактоном, поликапролактон или их сочетание. Начальная болюсная доза клонидина может составлять примерно от 15% примерно до 45% клонидина или его фармацевтически приемлемой соли по отношению к общему количеству клонидина, помещенному в депо лекарственного средства.
В различных вариантах осуществления клонидин может иметь форму соли. Одним из примеров соли является хлористоводородная соль. В различных вариантах осуществления клонидин может иметь форму основания. Кроме того, клонидин или его фармацевтически приемлемая соль могут быть капсулированы во множество емкостей, в том числе в микрочастицы, микросферы, микрокапсулы и/или микроволокна, которые могут быть суспендированы в геле. Депо лекарственного средства может иметь форму лентообразной полоски. Депо лекарственного средства также может представлять собой состав в виде геля.
В различных вариантах осуществления полимер может составлять примерно от 60% примерно до 90% от общей массы депо лекарственного средстваы. Полимер является способным к деструкции или деструктирует в течение 30 суток или менее после имплантации лекарственной формы в участок ткани. В различных вариантах осуществления полимер может содержать сополимер молочной и гликолевой кислот;
сополимер молочной и гликолевой кислот содержит смесь полигликолида и полилактида. Смесь содержит больше полилактида, чем полигликолида.
В различных вариантах осуществления депо лекарственного средства может содержать рентгенографический маркер, способный содействовать диагностической визуализации. Рентгенографический маркер может содержать барий, висмут, вольфрам, тантал, йод, фосфат кальция и/или металлические шарики.
В различных вариантах осуществления депо лекарственного средства может содержать по меньшей мере одно дополнительное противовоспалительное или анальгетическое средство, по меньшей мере один анаболический или антикатаболический фактор роста или их сочетание.
Депо лекарственного средства способно к высвобождению от 0,05 микрограммов (мкг) до 3 миллиграммов (мг) клонидина или его фармацевтически приемлемой соли в сутки с целью ослабления послеоперационных болей.
Целевой участок тканей включает в себя по меньшей мере один из следующих органов: мышцу, связку, сухожилие, хрящ, позвоночный диск, межпозвоночное пространство в области корешка спинномозгового нерва, фасет или синовиальное соединение либо спинномозговой канал.
Боль может быть связанной с хирургической ампутацией, геринопластикой, ортопедической или спинальной операцией или их сочетанием. Операция может представлять собой артроскопическую операцию, иссечение массы, геринопластику, спинную фузию, торакальную, цервикальную или люмбальную операцию, ампутацию, операцию на органах таза или их сочетание.
Одно или несколько депо лекарственного средства согласно настоящему изобретению могут быть использованы для лечения состояний боли и/или воспаления в хронической форме, в том числе ревматоидного артрита, остеоартрита, ишиаса, синдрома запястного канала, боли внизу спины, болей нижних конечностей, болей верхних конечностей, болей, связанных с ампутацией и часто называемых "фантомными болями", рака, болей в тканях и болей, связанных с травмами или восстановлением цервикальных, торакальных и/или люмбальных позвонков или межпозвоночных дисков, мышц плечевого пояса, суставных сочленений, височно-нижнечелюстного сустава (TMJ), сухожилий, связок, мышц и т.д.
Дополнительные признаки и преимущества различных вариантов осуществления частично раскрываются в нижеследующем описании, частично явно следуют из него, либо могут быть изучены при реализации различных вариантов осуществления на практике. Цели и другие преимущества различных вариантов осуществления реализуются и достигаются при помощи элементов и сочетаний, которым в описании и прилагаемой формуле изобретения уделяется особое внимание.
Краткое описание фигур
Другие аспекты, признаки, выгоды и преимущества вариантов осуществления становятся ясными исходя из следующих далее описания, прилагаемой формулы изобретения и прилагаемых чертежей, на которых:
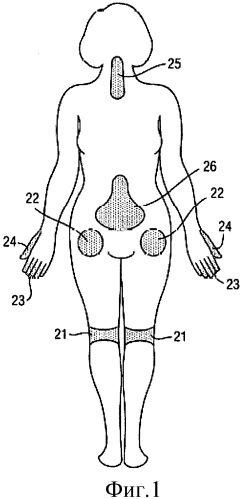
- на Фиг.1 показаны некоторые типичные для проведения операций области организма пациента, и области организма, где может применяться депо лекарственного средства, содержащее антигипертензивное средство или клонидин;
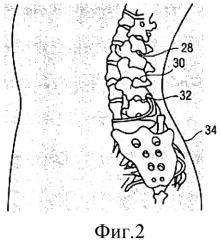
- на Фиг.2 показан схематический вид сзади позвоночного столба и областей организма, где может применяться депо лекарственного средства, содержащее антигипертензивное средство или клонидин;
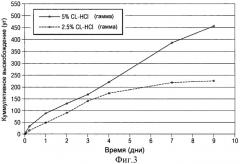
- на Фиг.3 показан график, представляющий собой результат исследований среднего кумулятивного высвобождения в мкг клонидина клонидиновых имплантатов в виде полосок, описанных в Примере 1;
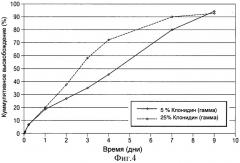
- на Фиг.4 показан график, представляющий собой результат исследований среднего процентного кумулятивного высвобождения клонидина клонидиновых имплантатов в виде полосок, описанных в Примере 1;
- на Фиг.5 показан график изменения порога термического отдергивания лап в граммах на сутки после операции для клонидиновых имплантатов из Примера 1;
- на Фиг.6 показан график изменения среднего процентного кумулятивного высвобождения клонидина для нескольких облученных имплантатов в виде полосок или лент на основе клонидина-НСl из Примера 2 в течение 1-8 суток;
- на Фиг.7 показан график изменения среднесуточного высвобождения клонидина рассчитанного в микрограммах в течение 1-8 суток для имплантатов в виде полосок или лент на основе клонидина-НСl из Примера 2;
- на Фиг.8 показан график изменения среднего процентного кумулятивного высвобождения клонидина для некоторых из имплантатов в виде полосок или лент на основе клонидина-HCl, показанных на Фиг.6;
- на Фиг.9 показан график изменения среднесуточного высвобождения клонидина в микрограммах в течение 1-8 суток для некоторых из имплантатов в виде полосок или лент на основе клонидина-HCl, показанных на Фиг.8;
- на Фиг.10 показан график изменения среднего процентного кумулятивного высвобождения клонидина в течение 1-14 суток для некоторых из имплантатов в виде полосок или лент на основе клонидина-HCl, показанных на Фиг.6;
- на Фиг.11 показан график изменения среднесуточного высвобождения клонидина в течение 1-14 суток для некоторых из имплантатов в виде полосок или лент на основе клонидина-HCl, показанных на Фиг.10;
- на Фиг.12 показан график изменения среднего процентного кумулятивного высвобождения клонидина в течение 1-14 суток для некоторых из имплантатов в виде полосок или лент на основе клонидина-HCl, показанных на Фиг.6;
- на Фиг.13 показан график изменения среднесуточного высвобождения клонидина в течение 1-14 суток для некоторых из имплантатов в виде полосок или лент на основе клонидина-HCl, показанных на Фиг.12;
- на Фиг.14 показан график изменения профиля среднего кумулятивного высвобождения in vitro из клонидиновых имплантатов в виде полосок из исследования, приведенного в Примере 3;
- на Фиг.15 показан профиль среднего кумулятивного высвобождения in vitro из клонидиновых имплантатов в виде полосок из исследования, приведенного в Примере 4;
- на Фиг.16 показан график изменения процентного кумулятивного высвобождения клонидина для трех клонидиновых имплантатов в виде полосок из исследования, приведенного в Примере 5;
- на Фиг.17 показан график изменения среднего процентного кумулятивного высвобождения клонидина для полосовых клонидиновых имплантатов, показанных на Фиг.16;
- на Фиг.18 показан график изменения кумулятивного высвобождения клонидина in vitro в мкг для трех клонидиновых имплантатов в виде полосок из Примера 5;
- на Фиг.19 показан график изменения среднего кумулятивного высвобождения клонидина in vitro в мкг для клонидиновых имплантатов в виде полосок, показанных на Фиг.18;
- на Фиг.20 показан график изменения показателя болевых ощущений для клонидиновых депо, имплантированных после операции в месте хирургического надреза.
Следует заметить, что фигуры выполнены без соблюдения масштаба. Кроме того, соотношение размеров объектов на одной фигуре может быть приведено не в масштабе; на практике отношение размеров может быть обратным. Фигуры приведены для лучшего понимания и пояснения конструкции каждого показанного объекта, вследствие чего некоторые признаки с целью иллюстрации особого признака структуры могут быть преувеличены.
Подробное описание изобретения
В настоящем описании и прилагаемой формуле изобретения, если не указано иное, все числа, выражающие количества ингредиентов, процентные или обычные доли материалов и условия реакций, и другие численные значения, использованные в описании и формуле, во всех случаях следует рассматривать как дополненные термином "примерно". Соответственно, если не указано противоположное, численные параметры, приведенные в нижеследующем описании и прилагаемой формуле изобретения, являются приближенными значениями, которые могут изменяться в зависимости от требуемых свойств, которых ставится целью достичь в настоящем изобретении. По крайней мере, и не в качестве попытки ограничить применение доктрины эквивалентов к объему формулы изобретения, каждый численный параметр следует истолковывать по меньшей мере с учетом количества приведенных значащих цифр и с применением обычных методов округления.
Несмотря на то, что численные интервалы и параметры, приведенные в настоящем изобретении, в общем случае являются приближенными, численные значения, приведенные в конкретных примерах, являются насколько возможно точными. Однако любое численное значение по своей природе содержит некоторые ошибки, необходимо следующие из стандартного отклонения, сопутствующего соответствующим методикам измерений. Кроме того, следует понимать, что все интервалы, упомянутые в настоящем описании, охватывают все подинтервалы, включенные в них. Например, интервал "от 1 до 10" включает в себя все подинтервалы между минимальным значением, равным 1, и максимальным значением, равным 10 (и включая упомянутые значения), то есть все подинтервалы с минимальным значением, большим или равным 1, и максимальным значением, меньшим или равным 10, например, от 5,5 до 10.
Следует отметить, что, согласно использованному в настоящем описании и приложенной формуле, единственное число имен существительных охватывает их множественное число, если ясно и недвусмысленно не используется только единственное число. Так, например, упоминание "лекарственной формы" охватывает одну, две, три или более лекарственных форм.
Далее приводится детальное описание некоторых вариантов осуществления настоящего изобретения, примеры которых проиллюстрированы на прилагаемых чертежах. Хотя настоящее изобретение описывается в соответствии с проиллюстрированными вариантами осуществления, следует понимать, что это не ограничивает настоящее изобретения упомянутыми вариантами осуществления. Напротив, подразумевается, что настоящее изобретение охватывает все альтернативы, модификации и эквиваленты, которые могут быть включены в объем настоящего изобретения в том виде, в каком он определен прилагаемой формулой.
Подразумевается, что разделы, следующие далее, никоим образом не ограничивают настоящее описание; варианты осуществления, описанные в любом абзаце, могут быть использованы в сочетании с вариантами осуществления, описанными в любом другом абзаце.
Предложены новые композиции и способы, эффективно предупреждающие, лечащие или ослабляющие послеоперационные боли или воспаления. В различных вариантах осуществления предложены композиции и способы, обладающие долговременными анальгетическим и противовоспалительным действием в течение по меньшей мере 3 суток после применения одной или нескольких лекарственных форм.
Предложены новые композиции и способы, легко позволяющие обеспечить возможность аккуратной и точной имплантации лекарственной формы, содержащей клонидин, при минимальных физических и психологических травмах для пациента. Депо лекарственного средства может быть легко доставлено к целевому участку тканей (например, в брюшную полость, синовиальное соединение, позвоночный столб или в его область и т.д.) и облегчает и/или лечит боль в течение по меньшей мере 3-10 суток. Подобным путем может быть осуществлена аккуратная и точная имплантация лекарственной формы при минимальной инвазивности процедуры, а также непосредственно при операции.
Клонидин
В депо лекарственного средства может содержаться клонидин. Депо лекарственного средства имеет физическую конструкцию, облегчающую имплантацию в нужный участок тканей (например, в синовиальное соединение, дисковое пространство, спинномозговой канал, область брюшины, ткань пациента и т.д.) и удерживание в нем. Депо лекарственного средства также содержит лекарственное средство. Термин "лекарственное средство" используемое в настоящем описании, в общем случае означает любое вещество, влияющее на физиологию пациента. Термин "лекарственное средство" в настоящем описании является взаимозаменяемым по отношению к терминам "терапевтический агент", "терапевтически эффективное количество" и "активный фармацевтический ингредиент" или "API". Следует понимать, что состав "лекарственного средства" может включать в себя более одного терапевтического агента, причем примерные сочетания терапевтических агентов включают в себя сочетание двух или более лекарственных средств. Депо лекарственного средства обеспечивает высвобождение терапевтического агента на целевом участке с градиентом концентрации. В различных вариантах осуществления депо лекарственного средства обеспечивает оптимальный градиент концентрации терапевтического агента на расстоянии примерно до 1 см - примерно до 10 см от места имплантации.
"Терапевтически эффективное количество" или "эффективное количество" представляет собой такое количество, которое при введении лекарственного средства приводит к изменению биологической активности, в том числе, например, подавлению воспаления, ослаблению или облегчению боли, улучшению состояния и т.д. В различных вариантах осуществления терапевтически эффективное количество клонидина составляет примерно от 0,1 мкг/сут до 100 мг/сут. В некоторых вариантах осуществления терапевтически эффективное количество клонидина составляет примерно от 30 мкг до 1 мг клонидина в сутки. В некоторых вариантах осуществления терапевтически эффективное количество клонидина составляет примерно от 30 мкг до 2,4 мг клонидина в сутки. В некоторых вариантах осуществления терапевтически эффективное количество клонидина составляет примерно от 0,1 мг до 0,3 мг клонидина в сутки. В некоторых вариантах осуществления терапевтически эффективное количество клонидина составляет 0,1 мкг, 0,2 мкг, 0,3 мкг, 0,4 мкг, 0,5 мкг, 0,6 мкг, 0,7 мкг, 0,8 мкг, 0,9 мкг, 1 мкг, 10 мкг, 20 мкг, 30 мкг, 40 мкг, 50 мкг, 60 мкг, 70 мкг, 80 мкг, 90 мкг, 0,1 мг, 0,2 мг, 0,3 мг, 0,4 мг, 0,5 мг, 0,6 мг, 0,7 мг, 0,8 мг, 0,9 мг, 1 мг, 1,1 мг, 1,2 мг, 1,3 мг, 1,4 мг, 1,5 мг, 1,6 мг, 1,7 мг, 1,8 мг, 1,9 мг, 2 мг, 3 мг, 4 мг, 5 мг, 6 мг, 7 мг, 8 мг, 9 мг, 10 мг, 11 мг, 12 мг, 13 мг, 14 мг, 15 мг, 16 мг, 17 мг, 18 мг, 19 мг, 20 мг, 21 мг, 22 мг, 23 мг, 24 мг, 25 мг, 30 мг, 35 мг или 40 мг (и все интервалы и подинтервалы между ними) клонидина в сутки. В одном из вариантов осуществления дозировка для человека составляет от 0,1 мг до 0,3 мг клонидина в сутки. Следует понимать, что дозировка, применяемая к пациенту, может содержаться как в одном, так и в нескольких депо лекарственного средства в зависимости от многих факторов, в том числе фармакокинетических свойств применяемого лекарственного средства, пути применения, состояния и свойств пациента (пола, возраста, массы тела, здоровья, комплекции и т.д.), степени проявления симптомов, сопутствующей терапии, частоты лечения и требуемого эффекта. Например, при проведении сопутствующей терапии опиоидом (например, морфином) могут оказаться необходимыми более низкие суточные дозы клонидина; в другом случае для контроля над послеоперационными болями при снижении или прекращении применения опиоида (например, морфина) пациенту могут потребоваться более высокие дозы клонидина.
В различных вариантах осуществления терапевтически эффективное количество клонидина применяется для подавления, ослабления, лечения и/или профилактики послеоперационных болей или воспалений. В общем случае химическое название клонидина представляет собой 2,6-дихлор-N-имидазолидинилиденбензоламин (С9Н9Сl2N3). Клонидин обладает молекулярной массой 230,09 и имеет следующую общую структурную формулу:
Если иное не указано или не следует из контекста, в случае упоминания клонидина в описании и в следующей далее формуле изобретения следует понимать, что авторами изобретения также имеются в виду его фармацевтически приемлемые соли. Одной из хорошо известных коммерчески доступных солей клонидина является его хлористоводородная соль. Некоторые другие примеры потенциальных фармацевтически приемлемых солей включают в себя соли солеобразующих кислот и оснований, существенно не уменьшающих токсичность соединения, в том числе соли щелочных металлов, в том числе магния, калия и аммония, соли неорганических кислот, в том числе йодистоводородной, бромистоводородной, фосфорной, метафосфорной, азотной и серной кислот, а также соли органических кислот, в том числе винной, уксусной, лимонной, яблочной, бензойной, гликолевой, глюконовой, гулоновой, янтарной кислот, арилсульфоновых кислот, например, n-толуолсульфокислоты, и т.п.
Кроме того, в случае упоминания клонидина активный ингредиент может быть представлен не только в форме соли, но и в форме основания (например, свободного основания). В различных вариантах осуществления, если клонидин имеет форму основания, он может быть смешан с полимерами в условиях, при которых не происходит сильной деструкции полимера, способной иметь место при термической переработке ПМГК или ПМК или их переработке из раствора. В качестве примера, не являющегося ограничительным, следует указать, что при составлении клонидина с полиортоэфирами желательным является использование клонидина в виде основания. Напротив, при составлении смесей клонидина с ПМГК может оказаться желательным применение формы в виде соли с НСl. В различных вариантах осуществления клонидин может представлять собой сочетание соли и основания.
В дополнение к клонидину депо лекарственного средства может содержать один или несколько дополнительных терапевтических агентов. Примеры терапевтических агентов включают в себя агенты, являющиеся модуляторами провоспалительных цитокинов, в том числе TNF-α и ИЛ-1, прямого или местного действия, в том числе растворимые рецепторы фактора некроза опухолей α, все пегилированные растворимые рецепторы фактора некроза опухолей α, моноклональные или поликлональные антитела или фрагменты антител либо их сочетания, но не ограничиваясь таковыми. Примеры пригодных терапевтических агентов включают в себя антагонисты рецепторов, молекулы, сочетающиеся с рецепторами для связывания с целевой молекулой, антисмысловые полинуклеотиды и ингибиторы транскрипции ДНК, кодирующей целевой белок. Примеры пригодных агентов включают в себя адалимумаб, инфликсимаб, этанерцепт, пегсунерцепт (PEG sTNF-R1), sTNF-R1, CDP-870, CDP-571, CNI-1493, RDP58, ISIS 104838, 1→3-β-D-глюканы, ленерцепт, PEG-sTNFRII Fc-мутеин, D2E7, афелимомаб и их сочетания, но не ограничиваются таковыми. В других вариантах осуществления терапевтические агенты включает в себя ингибиторы металлопротеазы, антагонисты глутамата, глиальные нейротрофические факторы (GDNF), антагонисты рецептора В2, антагонисты рецепторов субстанции Р (NK-1), в том числе капсаицин и цивамид, антагонистический модулятор нажележащего регуляторного элемента (DREAM), iNOS, ингибиторы рецепторов тетродотоксин (ТТХ)-резистентных натриевых каналов подтипов PN3 и SNS2, ингибиторы интерлейкинов, в том числе ИЛ-1, ИЛ-6 и ИЛ-8, и противовоспалительные цитокины, TNF-связывающий белок, онерцепт (r-hTBP-1), рекомбинантные векторы на основе аденоассоциированного вируса (rAAV), кодирующие ингибиторы, энхансеры, потенциаторы или нейтрализаторы, антитела, в том числе, но не ограничиваясь таковыми, природные или синтетические, двухцепочечные, одноцепочечные, или их фрагменты. Например, пригодные терапевтические агенты включают в себя молекулы, основанные на одноцепочечных антителах и называемые Nanobodies™ (компания Ablynx, Гент, Бельгия), определяемые как самый малый функциональный фрагмент природных однодоменных антител. В другом варианте осуществления терапевтические агенты включают в себя агенты, воздействующие на киназы и/или ингибирующие клеточные сигнальные митоген-активируемые протеинкиназы (МАРК), р38 МАРК, Src или протеинтирозинкиназу (РТК). Терапевтические агенты включают в себя ингибиторы киназ, в том числе, например, гливек, герцептин, иресса, иматиниб (STI571), гербимицин А, тирфостин 47, эрбстатин, генистеин, ставроспорин, PD98059, SB203580, CNI-1493, VX-50/702 (компании Vertex/Kissei), SB203580, BIRB 796 (компания Boehringer Ingelheim), ингибитор Р38 МАР-киназы Glaxo, RWJ67657 (компания J&J), U0126, Gd, SCIO-469 (компания Scios), R03201195 (компания Roche), Семипимод (компания Cytokine PharmaSciences) или их производные.
В различных вариантах осуществления терапевтические агенты блокируют транскрипцию или трансляцию TNF-α или других белков воспалительного каскада. Пригодные терапевтические агенты включают в себя антагонисты интегрина, антагонисты альфа-4-бета-7-интегрина, ингибиторы клеточной адгезии, антагонисты интерферона-гамма, агонисты/антагонисты CTLA4-Ig (BMS-188667), антагонисты лиганда CD40, гуманизированные моноклональные антитела к ИЛ-6 (MRA, тоцилизумаб, компания Chugai), моноклональные антитела к HMGB-1 (компания Critical Therapeutics, Inc.), антитела к ИЛ-2К (даклизумаб, базиликсимаб), АВХ (антитела к ИЛ-8), человеческий рекомбинантный ИЛ-10 или HuMax IL-15 (антитела к ИЛ-15), но не ограничиваются таковыми.
Другие пригодные терапевтические агенты включают в себя ингибиторы ИЛ-1, в том числе Кинерет® (анакинра), представляющий собой рекомбинантную, не подвергнутую гликозилированию форму человеческого антагониста рецептора интерлейкина-1 (ИЛ-1 Ra) либо AMG 108, представляющий собой моноклональное антитело, блокирующее действие ИЛ-1. Терапевтические агенты также включают в себя возбуждающие аминокислоты, в том числе глутамат и аспартат, антагонисты ингибиторов связывания глутамата с NDMA-рецепторами, АМРА-рецепторами и/или каинатными рецепторами. В качестве терапевтических агентов для ослабления воспаления также могут быть полезны, например, антагонисты рецептора интерлейкина-1, талидомид (ингибитор секреции TNF-α), аналоги талидомида (снижающие продуцирование TNF-α макрофагами), костный морфогенетический белок (BMP) типа 2 и ВМР-4 (ингибиторы каспазы 8, активаторы TNF-α), кинаприл (ингибитор ангиотензина II, активирующий TNF-α), интерфероны, в том числе ИЛ-11 (модулирующий экспрессию рецептора TNF-α) и ауринтрикарбоновая кислота (ингибирующая TNF-α). Подразумевается, что при необходимости могут быть использованы пегилированные формы упомянутых агентов. Примеры других терапевтических агентов включают в себя ингибиторы NF-каппа-В, в том числе глюкокортикоиды, клонидин, антиоксиданты, в том числе дитиокарбаматы, и другие соединения, в том числе, например, сульфасалазин.
Конкретные примеры пригодных для применения терапевтических агентов включают в себя противовоспалительные агенты, анальгетические агенты, остеоиднуктивный фактор роста или их сочетание, но не ограничиваются таковыми. Противовоспалительные агенты включают в себя салицилаты, дифлунизал, сульфасалазин, индометацин, ибупрофен, напроксен, толметин, диклофенак, кетопрофен, фенаматы (мефенамовую кислоту, меклофенамовую кислоту), эноловые кислоты (пироксикам, мелоксикам), набуметон, целекоксиб, этодолак, нимесулид, апазон, золото, сулиндак или тепоксалин; антиоксиданты, в том числе дитиокарбаматы, и другие соединения, в том числе сульфасалазин (2-окси-5-[-4-[(С2-пиридиниламино)сульфонил]азо]бензойную кислоту), стероиды, в том числе флуоцинолон, кортизол, кортизон, гидрокортизон, флудрокортизон, преднизон, преднизолон, метилпреднизолон, триамцинолон, бетаметазон, дексаметазон, беклометазон, флутиказон, либо их сочетания, но не ограничиваются таковыми.
Пригодные анаболические или антикатаболические факторы роста включают в себя костный морфогенетический белок, фактор дифференциации роста, белок минерализации LIM, CDMP, прогениторные клетки или их сочетания, но не ограничиваются таковыми.
Депо лекарственного средства также может содержать дополнительные анальгетические агенты. Пригодные анальгетические агенты включают в себя ацетаминофен, бупивакаин, лидокаин, опиоидные анальгетики, в том числе бупренорфин, буторфанол, декстроморамид, дезоцин, декстропропоксифен, диаморфин, фентанил, алфентанил, суфентанил, гидрокодон, гид