Меквитазин для лечения или предотвращения патологий, в которых задействованы н4 рецепторы гистамина
Иллюстрации
Показать всеПредложено применение 10-[(3R)-1-азабицикло[2.2.2]окт-3-илметил]-10Н-фенотиазина, 10-[(3S)-1-азабицикло[2.2.2]окт-3-илметил]-10Н-фенотиазина или 10-[(3R,3S)-1-азабицикло[2.2.2]окт-3-илметил]-10Н-фенотиазина или его фармацевтически приемлемой соли для получения лекарства для предупреждения или лечения обструктивной бронхопневмопатии, характеризующееся тем, что лекарство представлено в пероральной форме, обеспечивающей дозу введения от 1 мкг/кг до 10 мг/кг, и характеризующееся тем, что лекарство представлено в форме раствора для пероральной пульверизации или порошка для ингаляции. Изобретение обеспечивает восстановление дыхательной способности, главным образом частоты дыхания, и увеличивает поток инспирации и экспирации, снижение инфильтрованных нейтрофилов и прямое противовоспалительное действие. 3 з.п. ф-лы, 2 ил., 10 пр., 7 табл.
Реферат
Настоящее изобретение в целом относится к применению 10-[(3R,3S)-1-азабицикло[2.2.2]окт-3-илметил]-10H-фенотиазина, 10-[(3S)-1-азабицикло[2.2.2]окт-3-илметил]-10Н-фенотиазина или 10-[(3R)-1-азабицикло[2.2.2]окт-3-илметил]-10H-фенотиазина, а также их фармацевтически приемлемых солей для получения лекарства для предупреждения или лечения локальным, пероральным или легочным путем патологий, опосредованных активацией Н4 рецептора гистамина. 10-[(3R)-1-азабицикло[2.2.2]окт-3-илметил]-10H-фенотиазин и 10-[(3S)-1-азабицикло[2.2.2]окт-3-илметил]-10Н-фенотиазин образуются из рацемата. Изначально этот рацемат является лекарством, эффективным при лечении аллергических расстройств. Он представляет собой антигистаминное средство класса Н1. Он имеет асимметрический атом углерода, который приводит к двум различным пространственным конфигурациям: левовращающей (конфигурации S) и правовращающей (конфигурации R). Анализ фармакологических профилей двух энантиомеров и рацемической смеси показывает, что эти соединения неожиданно обладают сродством к Н4 рецептору гистамина. Это свойство является дополнением к их сродству к Н1 рецептору. Данное конкретное свойство не продемонстрировано или даже просто не рассмотрено на предшествующем уровне техники. Его пример приведен ниже.
Н4 рецептор, описанный Nakamura et al. (2000) и клонированный Morse et al. (2001), представляет собой трансмембранный белок из 390 аминокислот, сопряженный с гетеродимером Gi/o, активация которого индуцирует мобилизацию внутриклеточного кальция, снижение цАМФ и активацию биохимического пути MAP киназы. Хотя этот рецептор подобен по трехмерной структуре Н1 рецептору, они только на 35% гомологичны.
Широко постулировано, что активация рецептора гистамина того или другого подтипа должна выражаться в различных физиологических или патофизиологических эффектах. Эта селективность рецепторов должна подтверждать существование подтипов рецепторов гистамина. Активация Н1 рецептора индуцирует активацию белка Gq, активация Н2 рецептора индуцирует активацию белка Gs, активация H3 рецептора индуцирует активацию белка Gi/o (Lovenberg et al., 1999). Функционально активация трех рецепторов выражается в различных молекулярных эффектах. В зависимости от рассматриваемых лигандов H3 рецептора некоторые обладают сродством к Н4 рецептору. Они включают тиоперамид, клобенпропит, иметит и R-α-метилгистамин. Кроме того, распределение подтипов рецепторов также различно. Для людей Н4 рецептор, главным образом, экспрессируется в периферических тканях, таких как клетки костного мозга и гемопоэтические клетки (эозинофилы, базофилы, мастоциты, Т лимфоциты и дендритные клетки).
Помимо их анатомического распределения, специфичность роли рецепторов гистамина в патофизиологии зависит от вовлеченности гистамина в эти процессы. Функция гистамина как медиатора аллергии хорошо установлена. Значительно более недавние данные дают возможность приписать гистамину функцию в регуляции иммунного ответа, точнее, посредством недавно описанного Н4 рецептора. Антагонисты Н4 рецептора ингибируют ответ Т лимфоцитов, и клеточный иммунный ответ на антигенную стимуляцию ингибируется in vitro инактивацией Н4 рецептора в соответствии с процессом, зависимым от апоптических протеинкиназ (Sugata et al., 2007). Гистамин является важным медиатором немедленного аллергического ответа, но он также вмешивается в регуляцию антигенпрезентирующих клеток (Dy et al., 2004). Следовательно, активация Н4 рецептора индуцирует дифференциацию моноцитов в иммунокомпетентные дендритные клетки. Когда Н4 активирован, происходит снижение ИЛ-12 р70, и оно приводит к дифференциации моноцитов (Gutzner et al., 2005). Takeshita et al. (2003) показали, что Н4 рецептор непосредственно вмешивается в рекрутмент многоядерных нейтрофилов, причем этот рекрутмент или хемотаксис зависим от мастоцитов.
Таким образом, снижение хемотаксиса и, следовательно, снижение инфильтрации нейтрофилов посредством инактивации Н4 рецептора четко установлено. Например, в моделях воспаления, вызванного инъекцией агентов, таких как каррагенаны, или в моделях воспаления в результате провокации овальбумином, важность антагонистов Н4 рецептора выявляет их как предполагаемые агенты регуляции периферических воспалительных явлений. Большинство их связано с патофизиологией:
- атопического дерматита, дерматологического зуда,
- бронхиальных воспалений (астмы, обструктивной бронхопневмопатии),
- кишечного воспаления (синдрома раздраженной кишки),
- воспаления суставов (ревматоидного артрита),
- воспаление перитуморальной стромы, дающее возможность ангиогенеза и его последствий: развития опухоли.
Вовлеченность Н4 рецептора в дерматологическое воспаление/зуд Ингибирование Н4 рецептора специфичным лигандом, таким как JNJ7777120, ограничивает поведение чесания у животных, у которых зуд был заранее индуцирован подкожной инъекцией гистамина (Bell et al., 2004). Оказывается, что активность антагонистов Н4 рецептора является более высокой, чем активность антагонистов Н1, таких как дезлоратадин или цетиризин. Однако активность этих "классических" антигистаминных средств в данной модели не равна нулю, что, таким образом, показывает, что противозудный эффект Н1 антигистаминных средств не заключается в их седативном свойстве. Кроме того, данная противозудная активность была показана для некоторых антагонистов Н1, лишенных седативных эффектов. Кроме того, периферическая локализация Н4 рецептора подтверждает гипотезу, согласно которой его инактивация обеспечивает локальную регуляцию поражения, в противоположность центральному контролю. Экспрессия Н4 рецептора подтверждает эти данные. Действительно, согласно Lippert et al. (2004), человеческие кожные мастоциты экспрессируют Н4 рецептор гистамина, что подтверждает роль гистамина как аутокринного и паракринного регулятора воспаления кожи. Кроме того, показано, что в Т лимфоцитах от пациентов без атопии гистамин посредством Н4 рецептора действует путем ингибирования активации белка STAT1. Этот мессенджер представляет собой белок, который активирует транскрипцию факторов, регулирующих иммунный ответ и баланс Th1/Th2. В случае лимфоцитов пациентов с атопией сигнал все же опосредован Н4 рецептором посредством гистамина и, в конечном счете, выражается в образовании интерферона-γ. Этот фактор вызывает амплификацию воспалительных явлений. В клетках пациентов без атопии экспрессия STAT1 уже снижена, и уровень интерферона-γ низок. Следовательно, ингибирование Н4 рецептора является более эффективным среди пациентов с атопией, чем среди здоровых волонтеров (Horr et al., 2006).
Таким образом, можно сделать вывод, что сочетанный эффект Н1 антагониста, сопряженного с Н4 антагонистом, должен составлять свойство первого выбора для терапевтического агента, предназначенного для ограничения дерматологических последствий зуда, таких как чесание и связанные с ним осложнения (повреждения, инфекции).
Вовлеченность Н4 рецептора в воспаление дыхательных путей
Экспрессия Н4 рецептора в бронхах и альвеолярном эпителии привела исследователей к изучению его вовлеченности в бронхиальные воспалительные явления, такие как астма или обструктивная бронхопневмопатия. Модели этих патологий на животных, в которых используют провокацию овальбумином, дали возможность описать роль Н4 рецептора в данном контексте (Dunford et al., 2006). Как видели ранее, инактивация Н4 рецептора специфичными антагонистами ограничивает хемотаксис и, следовательно, инфильтрацию нейтрофилов внутрь воспаленного легочного эпителия. Последствием этого является прерывание иммунного и воспалительного каскада. Действительно, CD4 Т-лимфоциты больше не активируются, когда Н4 рецептор нейтрализован. Кроме того, уровни хемокинов и цитокинов снижаются, следствием чего является снижение ответа Т лимфоцитов. Таким образом, логично предложить любой антагонист Н4 рецептора в качестве агента для борьбы с воспалительными явлениями легочного эпителия независимо от его происхождения: интоксикации, аллергической реакции или хронического респираторного дистресса, индуцированного опухолью.
Вовлеченность Н4 рецептора в воспаление кишечного тракта
Другой пример ингибирования воспалительных явлений антагонистами Н4 рецептора приведен в исследованиях Varga et al. (2005). Воспаление ободочной кишки индуцируют у животного введением тринитробензола. Перед этим применяют лечение с использованием антагонистов Н4 рецептора. В конце концов, животные, предварительно обработанные таким образом, имеют более низкие гистологические баллы воспаления, чем контрольные животные. Параллельно отмечают снижение уровней воспалительных факторов, таких как TNF-α. Таким образом, важность ингибиторов Н4 рецептора проявляется при патологиях, таких как синдром раздраженной кишки.
Вовлеченность Н4 рецептора в воспаление суставов
Вовлеченность Н4 рецептора также установлена при воспалительных явлениях вследствие ревматоидного артрита. Ikawa et al. (2005) анализировали экспрессию Н4 рецептора путем косвенного измерения транскриптов (ОТ-ПЦР) в образцах синовиоцитов от пациентов с ревматоидным артритом. Эти анализы показывают, что экспрессия Н4 рецептора очень высока в этих образцах, что позволяет предположить, что Н4 рецептор гистамина играет роль в воспалительном каскаде вследствие ревматоидного артрита. Следовательно, важность ингибиторов Н4 рецептора в воспалительных патологиях синовиоцитов оказывается достоверной.
Вовлеченность Н4 рецептора в ангиогенез, обусловленный развитием опухоли
Активность гистидиндекарбоксилазы, фермента, который катализирует синтез гистамина, обнаруживают в ряде опухолевых тканей. Это не обязательно означает, что повышение уровней гистамина вызывает появление карциноматозных явлений, но, однако, четко установлено, что в воспаление, сопутствующее канцеризации ткани, вовлечен гистамин. Гистидиндекарбоксилаза экспрессируется в опухолях ободочной кишки, молочной железы и эндометрия, мелкоклеточных опухолях легких и в меланомах. В работе Cianchi et al. (2005) продемонстрирована гиперэкспрессия этого фермента в клетках Сасо2, НТ29 и НСТ116. In vitro гистамин индуцировал в этих культурах аденокарциномы ободочной кишки повышение продуцирования провоспалительных факторов, а именно простагландина Е2, и повышение продуцирования эндотелиальных факторов роста кровеносных сосудов (VEGF). Вероятно, этот агонистический эффект гистамина посредством Н4 рецептора выражается в стимуляции деления клеток. Действительно, эти два биомаркера участвуют в развитии перитуморальной сосудистой сети (ангиогенезе). Агонистическое действие гистамина на развитие кровеносных сосудов антагонизируется ингибиторами Н4 рецептора, а также ингибиторами циклооксигеназы 1 и 2. Хотя действие ингибиторов СОХ было известно в связи с их противовоспалительным потенциалом, действие антагонистов Н4 рецептора и их эффективность в отношении явлений развития перитуморальной сосудистой сети описаны вновь. Эти данные позволяют предположить пользу антагонистов Н4 рецептора при ангиогенезе. Кроме того, результаты этих исследований показывают, что ингибирование активности гистамина блокированием Н4 рецепторов уменьшает деление клеток для клеток аденокарциномы ободочной кишки в культуре.
По вышеизложенным причинам оказывается, что ингибитор-кандидат должен обладать двойным связывающим действием как на Н1 рецептор, так и на Н4 рецептор, чтобы обладать полным действием в отношении ингибирования опосредованного гистамином периферического воспаления.
В контексте дерматологических патологий, в которых задействован Н4 рецептор, и в целях снижения вредных эффектов, индуцированных антигистаминными средствами, чрескожный путь кажется обладающим преимуществом, поскольку молекула-кандидат имеет склонность проходить через роговой слой и достигать ее подкожной мишени, мастоцитов, экспрессирующих Н4 рецепторы. Подобным образом, в контексте воспалительных патологий дыхательных путей преимуществом обладает разработка галеновой формы, которая, вероятно, достигает мишени непосредственно в бронхиальном эпителии, путем ограничения системного проникновения интересующего агента.
Таким образом, ограничение уровней в плазме активных метаболитов лекарств может также основываться, кроме специфичного пути введения, на конкретном печеночном метаболизме, который не продуцирует активные метаболиты, способные к обострению эффекта исходно введенного лекарства или к повышению частоты и интенсивности побочных эффектов.
Кроме того, более длительное время полужизни препарата означает более низкую частоту введения, что облегчает соблюдение режима и схемы лечения.
Цель настоящего изобретения состоит в том, чтобы продемонстрировать конкретные и неожиданные свойства 10-[(3К)-1-азабицикло[2.2.2]окт-3-илметил]-10H-фенотиазина (правовращающего энантиомера меквитазина; здесь под кодовым названием V0162), 10-[(3S)-1-азабицикло[2.2.2]окт-3-илметил]-10Н-фенотиазина (левовращающего энантиомера меквитазина; здесь под кодовым названием V0114) и рацемической смеси двух энантиомеров 10-[(3R,3S)-1-азабицикло[2.2.2]окт-3-илметил]-10Н-фенотиазина (здесь под кодовым названием L0013).
Настоящее изобретение относится к применению 10-[(3R)-1-азабицикло[2.2.2]окт-3-илметил]-10H-фенотиазина, 10-[(3S)-1-азабицикло[2.2.2]окт-3-илметил]-10H-фенотиазина или 10-[(3R,3S)-1-азабицикло[2.2.2]окт-3-илметил]-10H-фенотиазина или его фармацевтически приемлемой соли для получения лекарства для предупреждения или лечения патологий, в которых задействованы Н4 рецепторы гистамина.
В соответствии с другой характеристикой изобретения патологии, в которых задействованы Н4 рецепторы гистамина, выбраны среди: атопического дерматита, зуда и бронхиальных воспалений, таких как астма и обструктивная бронхопневмопатия.
В соответствии с другой характеристикой изобретения предложено лекарство в форме, пригодной для перорального введения, содержащей достаточное количество активного ингредиента, чтобы антагонизировать целевые Н4 рецепторы гистамина.
В соответствии с другой характеристикой изобретения предложено лекарство в пероральной лекарственной форме, обеспечивающей введение дозы от 1 мкг/кгдо 10 мг/кг, предпочтительно от 0,01 мг/кг и 1 мг/кг.
В соответствии с другой характеристикой изобретения предложено лекарство в форме таблетки.
В соответствии с другой характеристикой изобретения предложено лекарство в форме перорального распыляемого раствора или порошка для ингаляции, особенно пригодного для лечения астмы или обструктивной бронхопневмопатии.
В соответствии с другой характеристикой изобретения лекарство применяют для предупреждения или лечения патологий, в которых задействованы Н4 рецепторы гистамина и одновременно мускариновые рецепторы.
В соответствии с другой характеристикой изобретения патологии, в которых задействованы вышеупомянутые рецепторы, выбраны среди дыхательных патологий.
В соответствии с другой характеристикой изобретения вышеупомянутые патологии выбраны среди эмфиземы, астмы и обструктивной бронхопневмопатии.
В соответствии с другой характеристикой изобретения изобретение распространяется на препарат, содержащий 10-[(3R)-1-азабицикло[2.2.2]окт-3-илметил]-10H-фенотиазин.
В соответствии с другой характеристикой изобретения предложено лекарство в форме, пригодной для введения местным путем.
В соответствии с другой характеристикой изобретения предложено лекарство в виде геля, эмульсии или крема с концентрацией активного ингредиента от 0,01% до 10% масс/масс.
В соответствии с другой характеристикой изобретения лекарство применяют для лечения атопического дерматита и зуда.
Атопический дерматит представляет собой воспалительное заболевание кожи, иногда называемое атопической экземой, характеризующееся вызывающими зуд повреждениями различного происхождения, например, бактериального, грибкового или аллергического.
В целом целью настоящего изобретения является лечение зуда, которые обычно рассматривают как симптом зудящей кожи, оказывающийся связанным с различными типами дерматологических повреждений.
Наконец, изобретение также распространяется на препарат, содержащий 10-[(3R)-1-азабицикло[2.2.2]окт-3-илметил]-10H-фенотиазин, 10-[(3S)-1-азабицикло[2.2.2]окт-3-илметил]-10H-фенотиазин или 10-[(3R,3S)-1-азабицикло[2.2.2]окт-3-илметил]-10H-фенотиазин или его фармацевтически приемлемую соль, а также лекарство класса H1 антигистаминных средств, кортикоидов, длительно или быстро действующих антимускариновых средств и β2-миметиков, в качестве комбинированного препарата для одновременного, отдельного или пролонгированного применения в противовоспалительной терапии посредством антагонизма Н4 рецепторов гистамина.
В приведенных ниже примерах показано, что:
- сродство in vitro к человеческому Н4 рецептору гистамина эффективно при микромолярных концентрациях трех соединений, приведенных выше.
- соединения ведут себя как обратные агонисты по отношению к Н4 рецептору, где это свойство никогда не было описано на предшествующем уровне техники.
- прохождение через кожу или через слизистую оболочку соединений V0114, V0162 и L0013 является значимым и специфичным для данного фармакофора.
- время полужизни этих соединений является длительным, что дает возможность рассматривать режимы дозировки, совместимые с потенциальными показаниями для этих препаратов.
Сочетание всех этих свойств, собранных в качестве примеров настоящего патента, неожиданно показывает, что 10-[(3К)-1-азабицикло[2.2.2]окт-3-илметил]-10Н-фенотиазин (правовращающий энантиомер; здесь под кодовым названием V0162), 10-[(3S)-1-азабицикло[2.2.2]окт-3-илметил]-10H-фенотиазин (левовращающий энантиомер; здесь под кодовым названием V0114) и рацемическая смесь двух энантиомеров 10-[(3R,3S)-1-азабицикло[2.2.2]окт-3-илметил]-10Н-фенотиазин (здесь под кодовым названием L0013) являются соединениями, активными при патологиях, в которых задействованы Н4 рецепторы, таких как перечислено выше.
ПРИМЕР 1: Сродство in vitro к человеческим Н4 рецепторам гистамина 10-F(3R)-1-азабицикло[2.2.2]окт-3-илметил]-10H-фенотиазина (правовращающего энантиомера: здесь под кодовым названием V0162), 10-[(3S)-1-азабицикло[2.2.2]окт-3-илметил]-10H-фенотиазина (левовращающего энантиомера: здесь под кодовым названием V0114) и рацемической смеси двух энантиомеров 10-[(3R,3S)-1-азабицикло[2.2.2]окт-3-илметил]-10H-фенотиазина (здесь под кодовым названием L0013)
Целью данного исследования является определение константы сродства соединения в отношении человеческого Н4 рецептора гистамина in vitro. Выбранной моделью являются клетки НЕК-293, стабильно трансфицированные кДНК, кодирующей человеческий Н4 рецептор (Liu et al., 2001). Сначала определяют сродство клеток, экспрессирующих каждый тип рецептора, к лиганду, для которого было также установлено, что он на 100% связываются с рецептором. Оптимальным лигандом для рекомбинантного рецептора является 10 нМ гистамин, меченый тритием. Связывание рецептора определяют, как описано ниже: разность между суммарным связыванием и неспецифическим связыванием определяют в присутствии избытка немеченого лиганда. Результаты выражают в виде процента оптимального связывания, полученного с моделью лиганда (100%).
| Таблица 1 | |||
| Связывание рецептора in vitro | |||
| Человеческий рецептор | Соединения, тестируемые при 10 мкМ | Код | Ингибирование (%) |
| Н4 | (10-[(3S)-1-азабицикло[2.2.2]окт-3-илметил]-10H-фенотиазин) | V0114 | 33 |
| (h) | (10-[(3R)-1-азабицикло[2.2.2]окт-3-илметил]-10H-фенотиазин) | V0162 | 52 |
| (10-[(3R,3S)-1-азабицикло[2.2.2]окт-3-илметил]-10H-фенотиазин |
Эти результаты показывают, что V0162, V0114 и L0013 являются соединениями, которые неожиданно сильно связываются с человеческими Н4 рецепторами гистамина.
Во второй серии экспериментов константы сродства этих трех соединений точно определяют на основании конкуренции с радиоактивным лигандом, представляющим собой меченый тритием гистамин, на мембранных препаратах из клеток СНО, стабильно экспрессирующих Н4 рецептор гистамина.
| Таблица 2 | ||
| Определение констант сродства по отношению к Н4 рецептору in vitro | ||
| Код | Тестируемые соединения | Ki (мкМ) |
| V0114 | (10-[(3S)-1-азабицикло[2.2.2]окт-3-илметил]10Н-фенотиазин) | 2,49±0,37 |
| V0162 | (10-[(3R)-1-азабицикло[2.2.2]окт-3-илметил]-10Н-фенотиазин) | 1,18±0,16 |
| L0013 | (10-[(3R,3S)-1-азабицикло[2.2.2]окт-3-илметил]-10Н-фенотиазин) | 1,63±0,20 |
Эти результаты показывают, что три соединения проявляют сродство по отношению к Н4 рецептору гистамина. Это сродство находится на микромолярном уровне. Активность этих соединений по отношению к Н4 рецепторам подкреплена тем фактом, что три соединения V0162, V0114 и L0013 обладают высокой способностью к прохождению кожного барьера. Кроме того, их длительное время полужизни в организме предполагает остаточный эффект на уровне рецептора-мишени.
ПРИМЕР 2: Характеристика соединений V0162. V0114 и L0013 как обратных агонистов Н4 рецептора
Эти исследования были проведены с целью определения функционального воздействия на Н4 рецептор (агонист, антагонист, обратный агонист) соединений 10-[(3R)-1-азабицикло[2.2.2]окт-3-илметил]-10Н-фенотиазина (правовращающего энантиомера; здесь под кодовым названием V0162), 10-[(3S)-1-азабицикло[2.2.2]окт-3-илметил]-10H-фенотиазина (левовращающего энантиомера; здесь под кодовым названием V0114) и рацемической смеси двух энантиомеров 10-[(3R,3S)-1-азабицикло[2.2.2]окт-3-илметил]-10H-фенотиазин (здесь под кодовым названием L0013).
G белки принадлежат к семейству белков, которые действуют как молекулярные переключатели при многочисленных существенных клеточных функциях. Их регуляторная активность основана на их способности к циклу между неактивной формой, связанной с ГДФ, и активной формой, связанной с ГТФ, где последний передает сигнал действия на так называемые эффекторные белки, расположенные дальше в сигнальном каскаде. С целью характеристики функционального воздействия трех соединений V0162, V0114 и L0013 на Н4 рецептор были проведены исследования, в которых использовали тест на активацию G белка. Кратко, этот тест основан на количественном определении [35S] радиоактивно меченого ГТФ, связанного с G белками, индуцированными в процессе связывания различных соединений на рецепторе.
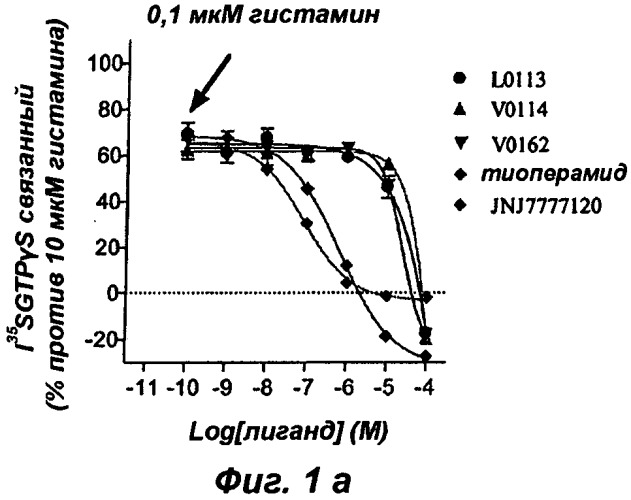
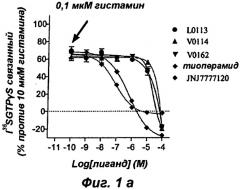
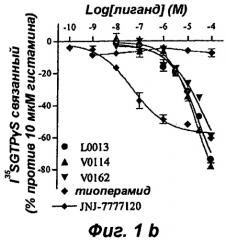
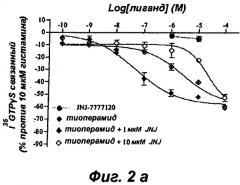
Эти результаты приведены в форме диаграмм, представленных на прилагаемых фиг.1 и 2.
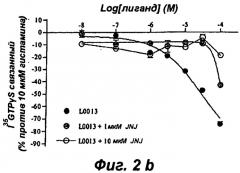
Результаты теста на активацию G белка, представленные на фиг.1а, показывают, что три соединения V0114, V0162 и L0013 антагонизируют активирующее действие, индуцированное 0,1 мкМ гистамина, на Н4 рецептор, как наблюдают с тиоперамидом и селективным Н4 антагонистом JNJ7777120. Известно, что Н4 рецептор обладает конститутивной активностью, и на фиг.1б показано, что соединения V0114, V0162 и L0013 ведут себя, подобно тиоперамиду, как обратные агонисты Н4 рецептора (снижение базальной активности в отсутствие агониста), тогда как соединение JNJ7777120 является нейтральным агонистом.
Эта обратная агонистическая активность соединений V0162, V0114, L0013 и тиоперамида, несомненно, является следствием действия на Н4 рецептор, поскольку на фиг.2а-2г показано, что нейтральный антагонист JNJ7777120 блокирует эту активность. Совокупность этих результатов впервые показывает, что соединения V0162, V0114 и L0013 являются обратными агонистами Н4 рецептора. Это функционирование по инактивации рецептора отличает V0162, V0114 и L0013 от семейства нейтральных антагонистов, таких как JNJ7777120.
ПРИМЕР 3: Противовоспалительная активность in vivo V0114 и L0013 в модели плантарного отека, индуцированного гистамином, у мыши
Целью данного эксперимента было обнаружение возможной противовоспалительной активности V0114, V0162 и L0013 по отношению к плантарному отеку, индуцированному гистамином, у мыши. Принцип этого испытания инспирирован публикацией Kreutner et al. (2000). Все группы состояли из 10 животных. Препараты вводили пероральным путем (25 мл/кг) при предварительной обработке, в различные моменты времени: за 120, 90, 60 и 30 минут до агента, производящего воспаление. Спустя шестьдесят минут проводили инъекцию (10 мкл) в лапу под анестезией изофлураном. В правую лапу вводили 13 мкг гистамина дигидрохлорида, а в левую лапу физиологический солевой раствор (носитель гистамина). Через тридцать минут после инъекций животных подвергали эвтаназии путем цервикальной дислокации. Лапы отделяли и взвешивали. Отеки определяли количественно по разности массы лап (масса правой лапы - масса левой лапы).
| Таблица 3 | ||||
| Определение противовоспалительной активности in vivo после перорального введения | ||||
| Тестируемые соединения | Подопытная группа | Дозы (мг/кг) | Предварительная обработка (мин) | Ингибирование воспаления (%) |
| Носитель | 10 | - | -120 | - |
| 10 | - | -90 | - | |
| 10 | - | -60 | - | |
| 10 | - | -30 | - | |
| V0114 | 10 | 3 | -120 | -71 |
| 10 | 3 | -90 | -72 | |
| 10 | 3 | -60 | -58 | |
| 10 | 3 | -30 | -63 | |
| V0162 | 10 | 3 | -120 | +12 |
| 10 | 3 | -90 | -5 | |
| 10 | 3 | -60 | +25 | |
| 10 | 3 | -30 | +2 | |
| L0013 | 10 | 3 | -120 | -80 |
| 10 | 3 | -90 | -82 | |
| 10 | 3 | -60 | -65 | |
| 10 | 3 | -30 | -54 |
V0114 и L0013 индуцируют сильный и статистически значимый противовоспалительный эффект по сравнению с группами, одновременно предварительно обработанными носителем. Эта активность (от -58% до -72%) для V0114 и (от -54% до -82%) для L0013 выше, когда животных предварительно обрабатывают за 90 и 120 минут до инъекции в лапу агента, производящего воспаление. В данных экспериментальных условиях V0114 и L0013, введенные пероральным путем за 120, 90, 60 и 30 минут до этого, показывают сильный противовоспалительный эффект в отношении гистаминового отека лапы мыши. V0162 не уменьшает этот отек, что склонно доказать отсутствие антигистаминного эффекта в данной модели. Однако препараты вводят пероральным путем. Еще в одном следующем испытании оказалось, что препарат V0162 активен при введении непосредственно внутривенным путем. В заключение, данное исследование показывает, что Н4 антигистаминная активность, продемонстрированная in vitro, подтверждена у животного in vivo.
ПРИМЕР 4: Антигистаминная активность in vivo V0114 и L0013 после введения внутривенным путем в модели индуцированной гистамином бронхоконстрикции у мыши
Целью данных экспериментов является оценка активности трех соединений V0162, V0114 и L0013 в отношении индуцированной гистамином бронхоконстрикции в модели морской свинки Konzett (1940). Ранее авторы изобретения наблюдали, что три соединения проявляли антигистаминную активность в отношении Н4 рецептора in vitro, хотя, с другой стороны, in vivo только V0114 и L0013 оказались противовоспалительными, когда воспаление генерировано гистамином. По-видимому, V0162 теряет свою активность при введении пероральным путем. С целью анализа активности в результате внутривенного введения трех препаратов было проведено нижеописанное испытание. Животных вентилировали с помощью дыхательного насоса постоянного давления избыточным объемом воздуха. Воздух, который не проникает в легкие, достигает датчика и измеряет каждый выдох. Наблюдаемые вариации представляют изменения тонуса бронхов. Индуцированная гистамином бронхоконстрикция вызывает увеличение избыточного объема, измеренного датчиком. Различные соединения вводят путем введения в яремную вену, в которую предварительно введен катетер. Затем проводят стимуляцию гистамином внутривенным путем в дозе 7 мкг/кг.
| Таблица 4 | ||||
| Определение антигистаминной активности in vivo после внутривенного введения соединений | ||||
| Тестируемые соединения | Подопытная группа | Дозы (мг/кг) | Ингибирование при 5 мин (%) | Ингибирование при 30 мин (%) |
| Носитель | 8 | - | 0 | 0 |
| V0114 | 6 | 12,5 | -15±3 | -35+6 |
| 5 | 25 | -29±3 | -71+5 | |
| 5 | 37,5 | -51±8 | -91+2 | |
| 5 | 50 | -48±6 | -97+2 | |
| V0162 | 5 | 25 | -17+3 | -9±8 |
| 5 | 37,5 | -23+4 | -9±9 | |
| 5 | 50 | -31+12 | -4±10 | |
| L0013 | 6 | 12,5 | -35±6 | -39±7 |
| 10 | 25 | -35±5 | -61±5 | |
| 6 | 37,5 | -26±4 | -51±8 | |
| 5 | 50 | -37±5 | -57±7 |
Гистамин индуцирует бронхоконстрикцию в данной модели. При введении внутривенным путем три соединения индуцируют Ингибирование эффектов гистамина. Следовательно, путь введения оказывается важным для достижения мишени. Но этот результат модифицирован, когда учитывают измерения через 30 мин. По-видимому, V0162 теряет свою антагонистическую активность, тогда как эта активность максимальна для V0114.
Эти эксперименты показывают, что in vivo после внутривенного введения соединения противодействуют действию гистамина на явления, которые генерируют этот медиатор на легочном уровне.
ПРИМЕР 5: Прохождение 10-[(3R.3S)-1-азабицикло[2.2.2]окт-3-илметил]-10H-Фенотиазина через кожу
Важность Н4 рецептора при зуде была недавно установлена. Следовательно, антагонист, направленный на Н4 рецепторы гистамина, задействованные в дерматологическом зуде, могут представлять собой средство выбора для прекращения поведения, связанного с зудом, и, следовательно, для избегания суперинфекций, генерируемых кожными повреждениями, вызванными зудом. Подобным образом, такое Н4 антигистаминное средство оказалось бы полезным при предупреждении или устранении симптомов, наблюдаемых в случае атопии, как показано ранее. Для этой цели полезно иметь Н4 антигистаминное средство, которое, вероятно, пересекает кожный барьер для достижения своей мишени на подкожных мастоцитах. Целью данных экспериментов является оценка способности 10-[(3R,3S)-1-азабицикло[2.2.2]окт-3-илметил]-10H-фенотиазина пересекать кожный барьер. Эксплантаты человеческой кожи помещали в динамическую диффузионную камеру (площадь диффузии 0,636 см2), где дерма находилась в контакте со средой рецептора (вода; 0,9% NaCl 0,9% NaN3 0,1%/этанол; 75/25; об/об). Скорость тока составляет 1,5 мл/ч. Исследование проводят при 32°С. Раствор, содержащий соединение (500 мкл до 2,5 мг/мл, или 10 мкКи на клетку) депонируют при Т=0. Исследование прохождения через кожу проводят при закупоривании. Образцы принимающей жидкости отбирают через 3, 6, 9, 12, 16, 20 и 24 часа.
Результаты показывают, что почти постоянный максимальный ток соединения достигается после 16 часов, и накапливаемые количества через 24 часа составляют 5,4 мкг/см2/ч; 107 мкг/см2.
Количество соединения в эпидермисе и дерме (фиг.3б) через 24 часа проявляет градиент концентрации и, следовательно, гомогенное распределение этой молекулы в коже:
- Эпидермис =56±17 мкг/см2
- Дерма =45±14 мкг/см2
- Всего =101 мкг/см2
- Зона рецептора =107±28 мкг/см2
Это исследование показывает, что 10-[(3R,33)-1-азабицикло[2.2.2]окт-3-илметил]-10Н-фенотиазин является молекулой с хорошим потенциалом для чрескожного прохождения (примерно 100 мкг/см2/24 ч). Количество соединения, отложившееся в коже, через 24 часа, эквивалентно или даже выше, чем накопленное количество, обнаруженное в принимающей жидкости за 24 часа.
ПРИМЕР 6: Оценка противовоспалительной активности соединений V0114 и V0162 в модели обструктивной хронической бронхопневмопатии у крысы
Важность соединения при снижении легочного воспаления оценивали в нижеописанной модели. Животных подвергали воздействию доз кадмия путем хронической пульверизации. В конечном счете, у животных развивается воспалительная реакция и легочная эмфизема. Данная модель была утверждена у крыс для использования при идентификации потенциально эффективных молекул для лечения хронических респираторных заболеваний, связанных с персистенцией нейтрофильной воспалительной реакции, опосредованной активацией Н4 рецептора. Как только патология присутствует, животных обрабатывают ежесуточно легочным введением доз, варьирующих от 10 мкг до 50 мкг интересующего соединения, вводимого путем пульверизации.
Результаты показывают, что тестируемые соединения частично восстанавливают дыхательный объем, наиболее примечательно частоту дыхания, и увеличивают поток инспирации и экспирации. Кроме того, по окончании эксперимента берут образцы бронхоальвеолярных жидкостей и подсчитывают иммунокомпетентные клетки. Результаты показывают снижение инфильтрированных нейтрофилов при сравнении групп обработки с животными, получившими только плацебо.
Совокупность этих результатов подтверждает противовоспалительную активность тестируемых соединений посредством антагонизма Н4 рецептора гистамина.
Три соединения проявляют сродство к рецептору в отношении Н4 рецептора. Авторы изобретения установили, что они являются обратными агонистами этого рецептора. Были показаны их противовоспалительные активности in vitro и in vivo и установлены в принятых моделях. Кроме того, эти соединения обладают качествами фармакокинетики и чрескожной проницаемости, которые дают возможность местного введения (кожного или легочного). Конкретные свойства этих трех соединений на Н4 рецепторе и вытекающие из них терапевтические применения никогда не были продемонстрированы ранее. Примеры этих свойств, взятых вместе или рассматриваемых по отдельности, приведены выше.
Эти примеры показывают рациональное применение 10-[(3R)-1-азабицикло[2.2.2]окт-3-илметил]-10H-фенотиазина, 10-[(3S)-1-азабицикло[2.2.2]окт-3-илметил]-10H-фенотиазина или 10-[(3R,3S)-1-азабицикло[2.2.2]окт-3-илметил]-10H-фенотиазина при патологиях, опосредованных Н4 рецептором гистамина. Кроме того, ранее установленная активность левовращающего производного (10-[(3S)-1-азабицикло[2.2.2]окт-3-илметил]-10H-фенотиазина) и рацемической смеси (10-[(3R,3S)-1-азабицикло[2.2.2]окт-3-илметил]-10H-фенотиазин) в качестве ингибиторов Н1 рецептора подтверждает на этих двух препаратах двойное антигистаминное свойство Н4 и Н1. Эта двойная способность делает эти соединения лучшими по сравнению с антигистаминными профилями, описанными на уровне техники до настоящего времени. Подобным образом, антимускариновая активность правовращающего производного (10-[(3R)-1-азабицикло[2.2.2]окт-3-илметил]-10Н-фенотиазина), четко установленная в другом месте, подтверждена его Н4 антигистаминной активностью. Это двойное свойство не описано для соединений (10-[(3R,3S)-1-азабицикло[2.2.2]окт-3-илметил]-10H-фенотиазин), (10-[(3R)-1-азабицикло[2.2.2]окт-3-илметил]-10H-фенотиазин) и (10-[(3S)-1-азабицикло[2.2.2]окт-3-илметил]-10H-фенотиазин) на предшествующем уровне техники.
В настоящем изобретении, кроме того, для V0162 и L0013 показана значимость двойной анти-Н4 и anti-M1/М3 активности при ингибировании воспалительных явлений и респираторного дистресса среди пациентов с астмой или обструктивной бронхопневмопатией.
Рецептор Н4 задействован в патологиях, в которые вовлечен рекрутмент иммунокомпетентных клеток, наиболее примечательно эозинофилов и макрофагов. Следовательно, рассмотрено применение лигандов этого рецептора с целью ограничения эозинофильных инфильтраций и рекрутмента макрофагов на легочном уровне в процессе эмфиземы, обструктивной бронхопневмопатии или астмы. Эта активность может быть предположительно дополнена спазмолитической активностью.
Неожиданно V0162 или (10-[(3R)-1-азабицикло[2.2.2]окт-3-илметил]-10H-фенотиазин) и L0013 или (10-[(3R,3S)-1-азабицикло[2.2.2]окт-3-илметил]-10H-фенотиазин) демонстрируют комплементарную антихолинергическую активность. Эту активность не наблюдают in vivo для левовращающего энантиомера V0114 или (10-[(3S)-1-азабицикпо[2.2.2]окт-3-илметил]-10H-фенотиазин).
Эти два свойства, объединенные в одном соединении, дают возможность рассматривать применение V0162 и/или L0013 для лечения дыхательных патологий, таких как астма и обструктивная бронхопневмопатия.
ПРИМЕР 7: Сродство V0162 по отношению к мускариновым рецепторам
Целью данного испытания является оценка ингибиторной активности соединений в отношении связывания ацетилхолина на М1, М2 и М3 рецепторах. С этой целью фиксированное количество радиоактивно меченого ацетилхолина инкубируют в присутствии варьирующих доз тестируемых соединений: V0162, L0013 и V0114.
| Человеческие рецепторы | Тестируемое соединение | IC50 (нМ) | Kj (нМ) | nH |
| М1 | V0114 | 5,9 |