Вакцина против пневмонии, вызываемой streptococcus pneumoniae, на основе гибридного белка
Иллюстрации
Показать всеИзобретение относится к области медицины. Предложена вакцина против пневмонии, вызываемой Streptococcus pneumoniae, на основе гибридного белка, соответствующего SEQ ID NO:1, включающего фрагменты белков Streptococcus pneumoniae PspA, Spr1895, PsaA, а также компоненты флагеллина в качестве адъюванта, соединенные гибкими мостиками. Изобретение обеспечивает эффективную профилактику и терапию пневмонии за счет того, что гибридный белок вакцины составлен из различных иммуногенных эпитопов, на которые вырабатывается специфический иммунный ответ с формированием иммунологической памяти. 4 ил., 8 пр.
Реферат
Изобретение относится к медицине, фармакологии, биотехнологии и может быть использовано для профилактики и лечения пневмонии, вызываемой пневмококками (латинское название вида - Streptococcus pneumoniae (S. pneumoniae)).
Термин «гибридный белок» здесь обозначает белок, полученный в результате экспрессии рекомбинантной молекулы ДНК, в которой соединены друг с другом в одной рамке считывания кодирующие участки нескольких разных генов.
Пневмония (син. воспаление легких) считается распространенным заболеванием как у взрослых, так и у детей, и требует ответственного проведения диагностических и лечебных мероприятий. По медицинской статистике, более одного миллиона россиян ежегодно заболевают воспалением легких, и у 5% пациентов болезнь заканчивается летальным исходом (http://www.who.int/mediacentre/factsheets/fs331/ru/index.html).
Термин «пневмония» объединяет большую группу болезней, каждая из которых имеет свою этиологию, патогенез, клиническую картину, рентгенологические признаки, данные лабораторных исследований и особенности терапии, может протекать как самостоятельное заболевание или как осложнение других болезней.
Пневмония - воспалительный процесс инфекционного происхождения дыхательных систем человека. Возбудителями пневмонии могут быть вирусы, грибы, но чаще всего ими являются бактерии. Самая частая причина бактериальной пневмонии - пневмококк (S. pneumoniae). Изучение глоточной микрофлоры выявляет носительство пневмококков у 5-25% здоровых людей.
Для пневмококков характерна мощная полисахаридная капсула, которая выполняет функцию защиты микроорганизма от опсонизации и последующего фагоцитоза. Вследствие того, что капсула пневмококков является основным поверхностным элементом, распознаваемым системой иммунитета, капсульный полисахарид характеризуется наибольшей вариабельностью. К настоящему времени обнаружен 91 различный капсульный тип пневмококков, но большинство (более 90%) инвазивных пневмококковых заболеваний вызывается 23 наиболее распространенными сероварами. Большое количество иммунологических вариантов капсульного полисахарида является фактором, осложняющим создание эффективных полисахаридных вакцинных препаратов.
Заболеть пневмококковой инфекцией может любой человек, но существуют группы риска, в большей степени подверженные заболеванию, это лица в возрасте от 65 лет, маленькие дети, лица, имеющие определенные проблемы со здоровьем, лица с ослабленной иммунной системой, курильщики.
Пневмококковая инфекция нередко с трудом поддается лечению, поскольку многие циркулирующие эпидемические штаммы пневмококков приобрели множественную лекарственную устойчивость к антибиотикам. Для предупреждения развития заболевания используются вакцины. Согласно позиции ВОЗ (Всемирная Организация Здравоохранения) и Российского респираторного общества, «Вакцинация - единственная возможность предотвратить развитие пневмококковой инфекции». На данный момент FDA(Food and Drag Administration) одобрило 2 типа вакцин: пневмококковую конъюгатную вакцину и пневмококковую полисахаридную вакцину (http://www.nlm.nih.gov/medlineplus/pneimiococcalinfections.html). В России зарегистрированы вакцина Пневмо 23 (PPSV23) - 23-валентная пневмококковая полисахаридная вакцина производства компании Санофи Авентис Пастер, Франция, и вакцина Превенар (PCV7) - семивалентная пневмококковая полисахаридная конъюгированная адсорбированная вакцина компании Вайет Фармасьютикалз, США.
Пневмококковая полисахаридная вакцина (ППСВ) показана взрослым. У большинства здоровых взрослых людей, прошедших вакцинацию ППСВ, вырабатывается сопротивляемость большинству типов бактерий (антигены которых имеются в вакцине) в течение 2-3 недель после прививки. У лиц очень пожилого возраста, детей до 2 лет и людей с хроническими заболеваниями вакцинация может не привести к созданию стойкого иммунитета, либо иммунитет к заболеванию не возникает совсем (http://www.nlm.nih.gov/medlineplus/languages/pneumococcalinfections.html#Russian). Кроме того, после вакцинации могут возникнуть осложнения: покраснение, болезненные ощущения в месте инъекции, высокая температура, мышечные боли или более серьезные местные реакции (Donalisio MR, Rodrigues SM, Mendes ET, Krutman M. Adverse events after pneumococcal vaccination. J Bras Pneumol. 2007 Feb; 33(1):51-6).
Однако, ППСВ оказалась достоверно эффективна лишь для людей с низким риском заболевания пневмококковой инфекцией. Для детей до 2 лет одновременно с вакцинацией показана профилактика с использованием антибиотиков (Bade A, Diot P, Lemarie E. Anti-pneumococcal vaccine: justifications and results. Rev Pneumol Clin. 1997; 53(3): 128-37).
Оказалось, что ППСВ не уменьшает частоту пневмонии и связанную с ней смертность и лишь немного уменьшает риск заражения тяжелой пневмококковой инфекцией. Также показано, что данная вакцина не защищает от пневмококков, чувствительных к пенициллину в больших концентрациях (Pneumococcal vaccine: a second look. Solution for SC or IM injection: pneumococcal vaccine. Prescrire Int. 1998 Feb; 7(33):16-8). Такие же результаты были показаны и для людей страрше 65 лет (Pneumococcal vaccination for elderly subjects: license extension. Still no proof of clinical efficacy. Prescrire Int. 2000 Aug; 9(48):106-9).
Действующим веществом ППСВ являются полисахариды 23 серотипов Streptococcus, вызывающих до 90% инвазивных заболеваний пневмококковой этиологии. Полисахарид - это антиген, не связанный с реакцией Т-клеток, потому вызывает лишь краткосрочный иммунитет без иммунной памяти; вакцины, содержащие только данные вещества, неэффективны, что показано у детей до 2 лет (Greenwood В М et al., Trans R Soc Trop Med Hyg, 1980, 74:756-760; международная заявка на изобретение WO 2010120921 A1, дата приоритета 16.04.2009). Также тот факт, что существует порядка 90 серотипов пневмококков, поскольку возбудители заболеваний в разных областях земного шара различаются, затрудняет создание универсальной вакцины на основе полисахаридов.
В конъюгированной вакцине, показанной детям, наряду с полисахаридами 7 сероваров пневмококков, которые наиболее часто вызывают заболевания среди детей, также содержится белок-носитель CRM 197 (мутант дифтерийного токсина), в качестве адъюванта. Благодаря наличию адъюванта в препарате вакцины данный антигенный комплекс хорошо распознается Т-клетками, обеспечивая устойчивый иммунитет (Schneerson R, Barrera O, Sutton A, Robbins JB. Preparation, characterization, and immunogenicity of Haemophilus influenzae type b polysaccharide-protein conjugates. J Exp Med. 1980 Aug 1; 152(2):361-76). CRM 197 связывается с гепарин-связывающим эпидермальным фактором роста и может ингибировать heparin-binding EGF-like growth factor (HB-EGF). Несмотря на то, что токсичность CRM197 примерно в 106 раз меньше, чем дифтерийного токсина, все же его использование должно быть осторожным, особенно в высоких дозировках (Takuya Kageyama, Minako Ohishil, Shingo Miyamoto, Hiroto Mizushima, Ryo Iwamoto and Eisuke Mekada. Diphtheria Toxin Mutant CRM197 Possesses Weak EF2-ADP-ribosyl Activity that Potentiates its Anti-tumorigenic Activity. Received April 16, 2007. Accepted May 2, 2007). Кроме того, после вакцинации могут возникнуть осложнения: покраснение, чувствительность или припухлость в месте введения препарата, температура выше 38-39 ОС, а также беспокойность, сонливость, потеря аппетита. Более того, вакцинацию рекомендуют проводить детям до 2 лет четыре раза, от 2 до 5 лет - в зависимости от возраста ребенка, В общей сложности для вакцинации ребенка требуется введение как минимум 4 доз, что дорого и небезопасно.
Известна вакцина, двумя главными компонентами которой являются полисахарид оболочки N. meningitidi и белок PsaA S.pneumoniae (может также использоваться белок PspA) (международная заявка на изобретение WO2010120921 A1, дата приоритета 16.04.2009). Ввиду невозможности выработки иммунной памяти на полисахариды, считаем использование полисахарида оболочки N. meningitidi в качестве компонента вакцины неоправданным. Использование же белков PsaA и PspA целесообразно - это поверхностные антигены пневмококков, которые способны вызывать и иммунный ответ, и формирование иммунологической памяти.
При создании патентуемой вакцины опирались на индукцию сильного иммунного ответа с последующим формированием иммунной памяти. Для этого в нашей разработке центральное место заняли не полисахариды, а белки пневмококков, полученные с использованием методов молекулярной биологии и рекомбинантной ДНК. По литературным данным, в качестве вакцинных кандидатов белковой природы наиболее перспективными антигенами являются три поверхностных белка пневмококков: PsaA, PspA, Spr1895.
Белок PsaA считают перспективным иммуногеном и авторы международной заявки на изобретение WO 2004102199 A2, дата приоритета 16.05.2003. Авторы приводят данный белок и еще несколько белков (SlrA - ротамаза липопротеинов, IgA1 - протеаза, PpmA - белок созревания стрептококков) или их компонентов в качестве основы для создания вакцины. Однако, мы считаем более перспективным подход с использованием других поверхностных белков S. pneumoniae - помимо PsaA, PspA и Spr1895.
Описан гибридный белок, включающий PsaA и В-субъединицу холерного токсина в качестве адъюванта (Areas АР, Oliveira ML, Miyaji EN, Leite LC, Aires KA, Dias WO, Ho PL. Expression and characterization of cholera toxin B-pneumococcal surface adhesin A fusion protein in Escherichia coli: ability of CTB-PsaA to induce humoral immune response in mice. Biochem Biophys Res Commun. 2004 Aug 13; 321(1):192-6). Однако мы считаем использование холерного токсина, либо его компонентов в качестве компонента вакцины менее безопасным, чем флагеллина, ввиду того, что люди высокочувствительны к холерному токсину, и даже 8 мкг токсина может вызвать сильную диарею.
Исследования показали, что белки PsaA и PspA целесообразно использовать как основу для вакцин от пневмококковой инфекции. Белок PsaA высококонсервативен среди различных серотипов пневмококков и обусловливает адгезию бактерии и ее вирулентность (Berry AM, and Paton JC: Sequence heterogeneity of psaA, a 37-kilodalton putative adhesin essential for virulence of Streptococcus pneumoniae. Infect Immun 1996; 64:5255-5262). Показано, что антитела к PsaA обладают перекрестной активностью относительно всех серотипов S. pneumonia.
PspA - это холин-связывающий поверхностный антиген, который ингибирует комплемент-опосредованный фагоцитоз, связывается с лактоферрином и предотвращает лактоферрин-опосредованную элиминацию бактериальных клеток (Hammerschmidt S, Bethe G, Remane PH, Chhatwal GS(1999) Identification of pneumococcal surface protein A as a lactoferrin-binding protein of Streptococcus pneumoniae. Infect Immun 67:1683-1687). В данной статье также указывается белок PsaA как перспективный для создания вакцины. Авторами показан еще ряд белков, кандидатных для создания вакцин для защиты от пневмококковой инфекции, однако мы сочли целесообразным использование именно белков PsaA и PspA ввиду их консервативности среди серотипов пневмококков и некоторых других бактерий.
Одним из главных компонентов предлагаемой вакцины также является белок Spr1895, закодированный в гене фосфат-связывающего белка фосфатного ABC транспортера. Данный белок является жизненно важным для бактерий, константным, что обуславливает его выбор для создания вакцины от пневмонии, вызываемой S. pneumonia.
В настоящем изобретении также фигурирует белок флагеллин (FliC) в качестве адъюванта. FliC, взаимодействуя с Toll-like receptor-5 (TLR-5), стимулирует созревание макрофагов и дендритных клеток - антиген-презентирующих клеток, что приводит к выработке иммунного ответа (Me Dermott P.F..High-affinity interaction between Gram-negative flagellin and a cell surface polypeptide results in human monocyte activation. Infect. Immun. - 2000. - V.68. - p.:5525-5529; Means Т.K. et al. The Toll-like receptor 5 stimulus bacterial flagellin induces maturation and chemokine production in human dendritic cells. J.Immunol. - 2003. - V.170. - p.:5165-5175).
На данный момент флагеллин является одним из наиболее перспективных и хорошо изученных адьювантов нового поколения. Результаты исследований показывают, что рекомбинантные белки, вводимые с флагеллином, имеют повышенные иммуногенные и антигенные характеристики. Ответы на них регистрируются в более короткие сроки и вызывают более сильный клеточный и гуморальный иммунный ответ (Balaram, 2008).
В настоящем изобретении указывается, что в качестве адъюванта могут быть использованы компоненты флагеллина. Во флагеллине обнаружены два рецептор -активирующих участка в терминальных областях (а.о. 79-117 и а.о. 408-439) (Tonyia, 2001).
Таким образом, оправдан подход с использованием в качестве адъюванта определенных компонентов флагеллина (FliC domain I, FliC domain 2).
TLR-5 экспрессирован на клетках врожденного иммунитета, на эпителиальных и эндотелиальных клетках (Sebastiani G. et al. Cloning and characterization of the murine Toll-like receptor 5(Tlr5) gene: sequence and mRNA expression studies in Salmonella-susceptibleMOLF/Eimice. Genomics. - 2000. - V.64. - p.230-240; Zarember K.A. and Godowski P.J. Tissue expression of human Toll-like receptors and differential regulation of Toll-like receptor mRNAs in leukocytes in response to microbes, their products, and cytokines. J.Immunol. - 2002. - V.168. - p.554-561; Delneste, 2007). Ввиду этого целесообразно использование для иммунизации поверхности слизистой, что значительно облегчает доставку иммуногена.
Таким образом, к наиболее близким к настоящему изобретению можно отнести изобретение, описанное в WO2004102199 А2, и конструкцию CTB-PsaA, описанную в вышеприведенной статье. В международной заявке, однако, предлагается использовать белки или их функциональные части в качестве отдельных компонентов вакцины. В основе же нашего изобретения лежит гибридный белок, который, помимо специфической белковой компоненты S.pneumoniae, также включает адъювант.В связи с этим, прототипом настоящего изобретения является гибридный белок, описанный бразильскими авторами.
Гибридный белок CTB-PsaA включает PsaA серотипа 6 В S.pneumoniae (289 а.о.), а также В-субъединицу холерного токсина в качестве адъюванта (Areas АР, Oliveira ML, Miyaji EN, Leite LC, Aires KA, Dias WO, Ho PL. Expression and characterization of cholera toxin B-pneumococcal surface adhesin A fusion protein in Escherichia coli: ability of CTB-PsaA to induce humoral immune response in mice. Biochem Biophys Res Commun. 2004 Aug 13; 321(1):192-6). Однако, выгоднее и удобнее (для обеспечения правильного фолдинга молекулы) использовать фрагмент белка - антигенную детерминанту - вместо полноразмерного белка. Именно такой подход - использование наиболее иммуногенных фрагментов белков - был использован при создании настоящего изобретения. Кроме того, мы считаем использование холерного токсина, либо его компонентов в качестве компонента вакцины менее безопасным, чем флагеллина, ввиду того, что люди высокочувствительны к холерному токсину, и даже 8 мкг токсина может вызвать сильную диарею. Относительно метода получения данного гибридного белка, ген, кодирующий белок PsaA, амплифицируется отдельно с плазмиды, в которую он введен, с последующим клонированием по сайтам рестрикции в вектор, содержащий ген, кодирующий СТВ. В нашем же случае использовался подход с применением синтеза полноразмерного гена, кодирующего гибридный белок.
Настоящее изобретение представляет собой вакцину на основе высокоочищенного гибридного белка, соответствующего SEQ ID NO:1, включающего иммуногенные фрагменты белков PspA (160-262 а.о. gb|EHD89266.1| pneumococcal surface protein A [Streptococcus pneumoniae]), Spr1895 (94-161 a.o. ref|ZP 01836139.1| LysM domain protein [Streptococcus pneumoniae]), PsaA (238-309 a.o. gb|AAF70667.1| PsaA [Streptococcus pneumoniae]), а также компоненты флагеллина в качестве адъюванта (1-169 а.о. gb|AAB33952.1| flagellin {alternatively spliced} [Salmonella typhimurium], 311-405 a.o. gb|AAB33952.1| flagellin {alternatively spliced} [Salmonella typhimurium]), соединенные гибкими мостиками.
Для получения в соответствии с настоящим изобретением гибридного белка могут быть использованы стандартные методы молекулярной биологии и микробиологии, известные специалистам в данной области техники. Такие методы полно представлены в научной литературе.
После вакцинации на входящие в состав гибридного белка вакцины эпитопы бактериальных поверхностных белков вырабатываются антитела, и формируется способность вырабатывать антитела в ответ на попадание в организм S. pneumoniae. В гибридном белке вакцины представлены антигенные детерминанты консервативных белков пневмококка, которые присутствуют у всех сероваров данного микроорганизма, поэтому иммунный ответ, который вырабатывается после вакцинации, будет вырабатываться при встрече с любым сероваром пневмококка. Использование эпитопов нескольких белков позволит увеличить эффективность вакцины. Наличие в сыворотке крови человека протективных антител к S. pneumoniae приведет к тому, что человек не заболеет или легко перенесет болезнь.
Вакцина обладает как профилактическим, так и терапевтическим эффектом.
Технический результат от использования изобретения заключается в обеспечении универсальной защиты от пневмококков, благодаря возможности и профилактики, и терапии заболеваний, вызываемых S.pneumoniae, за счет того, что белок вакцины составлен из иммуногенных эпитопов нескольких консервативных белков пневмококков, на которые вырабатывается специфический иммунный ответ с формированием иммунологической памяти.
Технический результат от использования изобретения также заключается в усилении иммунного ответа на активный компонент вакцины, за счет использования в составе конструкции адъюванта, компонентов флагеллина.
Технический результат выражается и в увеличении безопасности вакцины, благодаря использованию в качестве адъюванта нетоксичного агента (компонентов флагеллина).
Изобретение проиллюстрировано следующими графическими материалами.
Фигура 1. 3D-структура гибридного белка, показаны α-спирали и β-слои.
Фигура 2. 3D-структура гибридного белка, показаны аминокислотные остатки.
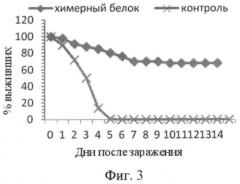
Фигура 3. Динамика выживаемости мышей (%) после заражения 1 LD S. pneumoniae (профилактическая модель).
Фигура 4. Динамика выживаемости мышей (%) после заражения 1 LD S. pneumoniae (терапевтическая модель).
Осуществление настоящего изобретения.
Пример 1. Моделирование гибридного белка.
Спланированный гибридный полипептид является сложным мультидоменным белком (5 доменов: FHCdomainl, FliCdomain2, PspA, Spr1895, PsaA). Для моделирования мультидоменных белков были произведены определение границ доменов, построение модели целого белка для определения ориентации доменов, построение моделей для каждого домена (с использованием образцов 3D структур и ab initio) и докинг моделей с использованием модели целого белка.
В спланированном гибридном полипептиде два домена имели образцы, а три нуждались в ab initio моделировании, кроме этого, в ab initio моделировании требовалось сформировать гибкие мостики между доменами.
Для получения более приближенных к реальности результатов в автоматическом режиме использовали алгоритм I-Tasser, признанный лучшим на последних трех CASP (Critical Assessment of protein Structure Prediction) - соревнованиях по моделированию белков. Данный анализ проводили в течение трех дней. Однако, даже с использованием данного мощного алгоритма получение адекватных данных для мультидоменного белка с необходимостью ab initio моделирования доменов и их границ не полностью достоверно (70%).
Для получения более точных данных разбили белок на используемые домены, провели их моделирование с использованеием I-Tasser и далее провели их докинг.
Проделав все шаги, получили конструкцию, представленную на фиг.1, 2.
Смоделированный гибридный белок состоит из 536 а.о., представлена его аминокислотная последовательность - SEQ ID NO:1. Анализ аминокислотной последовательности данного белка с помощью программы ProtParam (http://au.expasy.org/tools/protparam.html) показал, что гибридный белок имеет молекулярную массу 56,6 кДа, pI 4.56.
Пример 2. Создание нуклеотидной последовательности, кодирующей гибридный белок.
Перевели аминокислотную последовательность гибридного белка, включающего FliCdomainl, FliCdomain2, PspA, Spr1895, PsaA, в нуклеотидную (1623 п.н.), оптимизировав последнюю для экспрессии в клетках E. coli.
Синтез данной нуклеотидной последовательности осуществляли путем удлиннения взаимоперекрывающихся олигонуклеотидов согласно описанным методам (Majumder, 1992). Олигонуклеотиды представляли собой фрагменты гибридного гена длиной около 70 нуклеотидов со взаимоперекрывающимися участками длиной около 20 нуклеотидов. Основные требования к праймерам заключались в том, что их длина не должна была превышать 60 нуклеотидов, а участки гибридизации должны были быть не меньше 20 нуклеотидов. Кроме того, на концах олигонуклеотидов не должно было быть длинных участков с повторяющимися G или C. В ряде случаев подбор оптимальных праймеров осуществляли эмпирически путем сдвига праймера по отношеню к матрице или изменения длины праймера на 3-6 нуклеотидов. В общей сложности для синтеза гибридного гена длиной 1623 п.н. было использовано 59 праймеров. Синтезированные фрагменты по 300 п.н. выделяли с помощью гель-электрофореза и клонировали в плазмидный вектор pGEM-T Easy. Клонирование осуществляли с использованием рестрикционных сайтов Kpnl, SacII, EcoRV, BamHI или посредством „тупых" концов. После секвенирования фрагменты амплифицировали, после чего соединяли в нуклеотидную последовательность гибридного белка путем их сплавления методом полимеразной цепной реакции (ПЦР). После заключительного этапа синтеза гибридного гена путем лигирования фрагментов искусственный ген клонировали в вектор pGEM-T по рестрикционным сайтам KpnI и SacI. Полученный ген был фланкирован дополнительными рестрикционными сайтами EcoRI на 5′-конце и XhoI на 3′-конце. Далее искусственный ген переклонировали в экспрессионный вектор рЕТ24а по рестрикционным сайтам EcoRI и XhoI.
Пример 3. Создание плазмидной ДНК, кодирующей гибридный белок.
По методике, описанной в примере 2, получили нуклеотидную последовательность гибридного белка для создания вакцины от пневмонии.
Клонировали полученный ген в плазмиде рЕТ24а для последующей экспрессии. Для этого провели реакцию лигирования гена и вектора рЕТ24а, с использованием соответствующего буфера и лигазы. Реакцию проводили при +20°C в течение 2 часов.
Смесь прогрели при +95°C в течение 10 мин и очистили от солей диализом на нитроцелюлозных фильтрах с диаметром пор 0,025 мкм (Millipore, США). Диализ провели против раствора, содержащего 0,5 мМ ЭДТА в 10% глицерине, в течение 10 мин.
Пример 4. Создание штамма E. coli для амплификации плазмидной ДНК, содержащей гибридный ген.
По методике, описанной в примере 3, получили нуклеотидную последовательность белка для создания вакцины от пневмонии и клонировали ее в плазмиде рЕТ24а. Полученной плазмидой были трансформированы клетки Е. coli штамма DH10B/R (Gibko BRL, США) с генотипом F-mcrA Δ(mrr-hsdRMS-mcrBC) φ80dlacZΔM 15 ΔlacX74 deoR recA1 endA1 araD139 Δ(ara, leu)769 galU galKλ- rpsL nupG методом электропорации.
После трансформации клетки инкубировали в SOC-среде (2% бакто-триптон, 0.5% дрожжевой экстракт, 10 мМ NaCl, 2.5 мМ KCl, 10 мМ MgCl2, 10 мМ MgSO4, 20 мМ глюкоза) в течение 40 мин при +37°C.
С помощью скрининга клеток E.coli на наличие плазмид на селективной среде, содержащей LB-arap, 100 мкг/мл ампициллина, отобрали колонии клеток E. coli - штамм E. coli для амплификации плазмидной ДНК, содержащей гибридный ген.
Из выросших клонов была выделена плазмидная ДНК с использованием набора Wizard Minipreps DNA Purification System (Promega, США).
Очищенная плазмидная ДНК была проверена с помощью рестрикционного анализа и секвенирования. В ходе работы были отобраны клоны, содержащие фрагменты ДНК требуемого размера в составе плазмиды, из которых такие плазмиды были выделены для дальнейшей индукции экспрессии гена.
Пример 5. Создание штамма E. coli - продуцента гибридного белка.
По методике, описанной в примере 4, получили нуклеотидную последовательность белка для создания вакцины от пневмонии и клонировали ее в плазмиде рЕТ24а, амплифицировали полученную плазмиду в клетках E. coli штамма DH10B/R с последующим ее выделением.
Для экспрессии белка использовали клетки E.coli штамма BL21 Star (DE3) (Invitrogen, USA), с генотипом F-ompT hsdSB (rB-mB-) gal dcm rne131 (DE3), содержащие в геноме λDe3 лизоген и мутацию rne131. Мутированный ген те (rne131) кодирует усеченную форму РНКазы Е, что уменьшает внутриклеточное разрушение мРНК, приводя к увеличению ее ферментативной стабильности. Ion- и ompT-мутации по генам протеаз позволяют получать непротеолизированные рекомбинантные белки в больших количествах.
Подготовили клетки Е. coli штамма BL 21 с генотипом F- ompT hsdSB (rB-mB-) gal dcm rne131 (DE3) следующим образом. Инкубировали клетки при +37°C в течение ночи в 5 мл L-бульона, содержащего 1% триптон, 1% дрожжевой экстракт и 1% натрий хлористый. Развели культуру свежим L-бульоном в 50-100 раз и вырастили на качалке при +37°C до оптической плотности 0,2-0,3 при длине волны 590 нм. При достижении оптической плотности более 0,3 культуру развели свежим L-бульоном до оптической плотности 0,1 и растили 30 мин. Перенесли 100 мл культуры в стерильную центрифужную пробирку и осадили клетки при +4°C на 5000g в течение 10 мин. Супернатант слили, клетки ресуспендировали в деионизованной воде в исходном объеме с последующим центрифугированием. Процедура отмывки повторялась трижды. После отмывки осадок клеток ресуспендировали в малом объеме деионизованной воды и центрифугировали 30 сек. при 5000 об/мин, на микроцентрифуге.
Трансформацию компетентных клеток осуществляли методом электропорации. Для этого 1 мкл плазмидной ДНК добавляли к 12 мкл компетентных клеток, перемешивали и проводили электропорацию на генераторе высоковольтных импульсов ГВИ-1 (СПбГТУ, Санкт-Петербург) в стерильных ячейках при электрическом импульсе напряженностью 10 кВ/см длительностью 4 мсек.
После трансформации клетки инкубировали в SOC-среде (2% бакто-триптон, 0,5% дрожжевой экстракт, 10 мМ NaCl, 2,5 мМ КС1, 10 мМ MgCl2, 10 мМ MgSO4, 20 мМ глюкоза) в течение 40 мин. при +37°C. 10-100 мкл клеточной суспензии высеивались на селективную LB-среду (Gibko BRL, США), содержащую ампициллин (100 мкг/мл), для отбора клонов, содержащих плазмиды (штаммов-продуцентов).
Полученная после трансформации компетентных клеток штаммов Е. coli плазмида обеспечивает высокий уровень биосинтеза рекомбинантного белка, закодированного в ней.
Пример 6. Получение гибридного белка для создания вакцины от пневмонии в клетках E. coli индукцией синтеза белка 0.2% лактозой по методу Штудиера.
По методике, описанной в примере 5, получили нуклеотидную последовательность гибридного белка для создания вакцины от пневмонии и клонировали ее в плазмиде рЕТ24а, амплифицировали полученную плазмиду в клетках E.coli штамма DH10B/R с последующим ее выделением, трансформировали ею клетки E.coli штамма BL21 для последующей индукции экспрессии целевого гена.
Для культивирования полученных штаммов-продуцентов использовалась стандартная агаризованная LB-среда, содержащая ампициллин в концентрации 100 мкг/мл и глюкозу в концентрации 1% для блокирования неспецифической экспрессии.
Индукция экспрессии проводилась при достижении культурой клеток оптической плотности 0.6-0.8 оптических единиц при длине волны 600 нм.
В качестве индуктора использовалась 0.2% лактоза (Studier, 2005).
Для автоиндукции экспрессии по методу Штудиера (Studier, 2005) использовалась среда PYP-5052, состоящая из 1% пептона (Gibco, США), 0.5% дрожжевого экстракта (Gibco, США), 50 мМ Na2HPO4, 50 мМ K2HPO4, 25 мМ (NH4)2SO4, 2 мМ MgSO4, 0.5% глицерола, 0.05% глюкозы и 0.2% лактозы.
В среду PYP-5052, содержащую ампициллин в концентрации 100 мкг/мл, была инокулирована единичная колония штамма-продуцента. Ферментация проводилась при +37°C в термостатированном шейкере роторного типа при 250 об. мин. в течение 20 часов до отсутствия существенного изменения ОП600 за 1 час. Отбиралась аликвота клеток на анализ экспрессии гена, кодирующего вакцинный белок, методом электрофореза в ПААГ, а оставшуюся биомассу осаждали центрифугированием при 9000g.
Белок выделяли из клеток E. coli посредством лизиса клеток. Клетки ресуспендировали в лизирующем буфере, содержащем 20 мМ трис-HCl рН 7,5, 5 мМ ЭДТА и 1 мМ феноксиметилсульфонилфторид, из расчета на 1 г клеток 5-7 мл буфера. Суспензию клеток обрабатывали ультразвуком 7 раз по 30 сек с интервалом в 30 сек (частота ультразвука составляет 22 кГц). Лизат центрифугировали 10 мин при +4°C, 5000 g. Надосадочную жидкость сливали, к осадку добавляли раствор 1 М мочевины из расчета 10 мл на 1 г клеток, интенсивно перемешивали. Повторяли центрифугирование. Супернатант сливали, осадок ресуспендировали в растворе 2М мочевины того же объема. Повторяли центрифугирование. Супернатант сливали.
Полученный препарат содержал по данным SDS-PAGE (PolyAcrylamide Gel Electrophoresis with Sodium dodecyl sulfate) около 97% гибридного белка в концентрации 1 мг/мл.
Условия выделения и очистки подбирались экспериментальным путем и могут варьировать в известных среднему специалисту в этой области значениях.
Пример 7. Протективное действие вакцины на основе гибридного белка, содержащего PspA, Sprl895, PsaA, FliCdomainl, FliCdomain2, на профилактической модели летальной инфекции S. pneumoniae.
Для определения протективного действия препарата гибридного белка использовали мышей.
Опытная и контрольная группы содержали по 30 мышей линии Balb/c (самки), 7-8 недель (массой 18-20 г), каждая. Гибридный белок вводили в количестве 10 мкг на мышь. Через 1 месяц заражали вакцинированных мышей пневмококковой инфекцией: вводили внутрибрюшинно 104 КОЕ (колониеобразуещих единиц) S.pneumoniae (это минимальная летальная доза для мыши). Наблюдали выживаемость таких мышей в течение 14 дней после введения летальной дозы пневмококка (Фиг.3).
Иммунизированные вакциной на основе рекомбинантного гибридного белка мыши показали выживаемость 80% через неделю после заражения и 68% на 14 день наблюдений. В контрольной группе выживаемость составила 0% уже на 5 день эксперимента.
Таким образом, препарат предлагаемой вакцины обладает протективным действием. Кроме того, исследуемая доза препарата вакцины (10 мкг/мышь) не оказывает токсического действия на мышей.
Пример 8. Протективное действие вакцины на основе гибридного белка, содержащего PspA, Sprl895, PsaA, FliCdomainl, FliCdomain2, на терапевтической модели летальной инфекции S. pneumoniae.
Опытная и контрольная группы содержали по 30 мышей линии Balb/c (самки), 7-8 недель (массой 18-20 г), каждая. Мышей заражали пневмококковой инфекцией: вводили внутрибрюшинно 104 КОЕ (колониеобразуещих единиц) S. pneumoniae (это минимальная летальная доза для мыши). В этот же день мышам вводили гибридный белок в количестве 10 мкг на мышь. Наблюдали выживаемость таких мышей в течение 14 дней после введения летальной дозы пневмококка.
При совместном введении пневмококка и вакцины на основе гибридного белка мыши показали выживаемость 76% через неделю после заражения и 65% на 14 день наблюдений. В контрольной группе выживаемость составила 0% уже на 6 день эксперимента. Такие результаты доказывают хорошую иммуногенность вакцины, предлагаемой в данном изобретении. Таким образом, вакцина может использоваться для терапии пневмококковой инфекции.
Вакцина против пневмонии, вызываемой Streptococcus pneumoniae, на основе гибридного белка, соответствующего SEQ ID NO:1, включающего фрагменты белков Streptococcus pneumoniae PspA, Spr1895, PsaA, а также компоненты флагеллина в качестве адъюванта, соединенные гибкими мостиками.