Способ коррекции избыточного накопления микроэлементов в сосудах при атеросклерозе
Иллюстрации
Показать всеСпособ относится к медицине, а именно к терапии, и касается коррекции избыточного накопления микроэлементов в сосудах при атеросклерозе. Для этого вводят эффективные количества бисфосфонатов - ксидифон, или медифон, или золедронат. Способ обеспечивает уменьшение отложения микроконгломератов солей кальция и других микроэлементов в стенках сосудов при экспериментальном актеросклерозе. 1 ил., 4 табл., 2 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ. Изобретение относится к биофизике, биологии, медицине, а именно к профилактике и коррекции нарушения микроэлементного баланса в тканях при различных обменных патологиях, в первую очередь при атеросклерозе.
УРОВЕНЬ ТЕХНИКИ. Предупреждение накопления микроэлементов в атеросклеротических сосудах является актуальной задачей биологии и медицины. (А.В. Скальный. Микроэлементозы человека, М., 1999, Научный Мир, 96 С, Watt F., Rajendran R., Ren M.Q., et al. A nuclear microscopy study of trace elements Ca, Fe, Zn and Cu in ateroscltrosis. Nuclear instr. and method in Physics Res., 2006, В 249, 646-652. Abdelhalim M.A.K. The change of Fe and Zn concentrations in heart and aortic tissues of rabbits fed on high fat diet during the progression of atherosclerosis. Afr. J. Microbiol Res., 2010, Vol.4(15), 1670-1675). Отложение избыточного количества таких микроэлементов как Fe, Cu, Ni, Zn в атеросклеротических сосудах всегда имеет место, при этом Fe и Cu обладают прооксидантными свойствами и способствуют усилению перекисного окисления с сопутствующим образованием провоспалительных медиаторов, а также развитием пролиферативных процессов в интиме сосудов (Lanch S.M., Frei В. Mechanism of Cu and Fe-dependent oxydative modification Of human low density lipoprotein. J. Lipid Res., 1993, 34(10), 1745-1753. Stocker J.I., Keaney J.F.Jr. Oxydative modifications in atherosclerosis. Physiol Rev., 2004, 84(4), 1381-1478).
Известно применение ряда препаратов при избыточном накоплении микроэлементов при генетически обусловленных заболеваниях: десферриоксамин используют при гемохроматозе (Kalie Allen. Diagnosis and management paradigm for hereditary haemochromatosis. 2011, v.35, 14-18), Д-пеницилламин при болезни Вильсона-Коновалова с отложением меди в тканях и др. Однако эти препараты вызывают множество побочных явлений вплоть до острой почечной недостаточности, хотя их применение необходимо практически постоянно.
ПРОТОТИПОМ способа является метод коррекции нарушения микроэлементного состава в атеромах при экспериментальном воспроизведении атеросклероза у генетически подверженных атеросклерозу мышей (апо E/LDRL), содержащихся на атерогенной диете, с помощью одного из антиатеросклеротических препаратов - периндоприлата (ингибитора ангиотензинпревращающего фермента) в течение 2 месяцев. Было отмечено, что данный препарат обусловил «тенденцию» приближения концентрации Cl, Cu, Fe, Se, Zn в атеромах к таковой у животных, содержащихся на диете без холестерина. (Gajda М, Kowalska J., Banas A., Banas К., et al. Distribution of selected elements in atheroscltrotic plaqes in apoe/LDLR-double knockout mice subjected to dietary and pharmacological treatments. Synchrotron Radiation in Natur. Science., 2010, Vol 9, №1-2, 114). Регистрационное удостоверение выдано фирме «Лаборатория Сервье», Франция, ЛСР-010490/08, производится «Лаб.Серве Индастрис», Франция.
Недостатком способа является нередкие осложнения, возникающие при лечении периндоприлатом (нолепрел) - гипокалиемия, нарушение функции почек, водно-электролитного баланса, возможна нейтропения, ангионевротический отек, возникновение сухого кашля, противопоказание при сердечной недостаточности, почечной недостаточности, ишемической болезни сердца, недостатке мозгового кровообращения.
ЦЕЛЬЮ изобретения является обеспечение коррекции отложений микроэлементов (Fe, Cu, Cr, Zn) в сосудах и тканях, а также снижение степени медикаментозных осложнений и повреждения сосудов и тканей при хронических обменных нарушениях, в первую очередь при атеросклерозе.
Для достижения указанного результата предложен способ коррекции избыточного накопления микроэлементов в сосудах при атеросклерозе с помощью комплекса лечебных мероприятий, включающий применение антиатеросклеротических препаратов, при этом в качестве антиатеросклеротических препаратов используют бисфосфонаты ксидифон, или медифон или золедронат,
Эта цель достигается с помощью применения в комплексе антиатеросклеротического лечения бисфосфонатов отечественного синтеза: ксидифон, медифон или золедронат, которые являются синтетическими регуляторами обмена кальция в организме и не вызывают осложнений при длительном применении в терапевтических дозах, которые помимо нормализации микроэлементного состава сосудистой стенки, снижают степень изменения биохимических показателей атеросклероза на ранних стадиях атеросклероза.
РАСКРЫТИЕ изобретения. Способ осуществляется in vivo с помощью бисфосфонатов, вводимых внутрь экспериментальным животным после воспроизведения атеросклеротического процесса с образованием сосудистых бляшек с помощью лески на фоне холестериновой (1%) диеты и субтоксических доз витамина D2 (как факторов воспроизведения атеросклероза). Применяются 3 отечественных бисфосфоната: ксидифон (оксиэтилиденбисфосфонат K,Na соль - ООО Мосхимфармпрепараты, per. номер 001642/01), медифон (диметиламинопропилиден бисфосфоновая кислота, сертификат номер РОСС RU ПР73 В33974 27.03.2011) и золедронат (1-гидрокси-2-имидазол этилиденбисфосфонат, коммерческое название лекарственной формы компании Giba Geigy). Бисфосфонаты являются синтетическими аналогами регуляторов обмена кальция на клеточном уровне, обладающими хелатирующими свойствами (Матковская Т.А., Попов Л.И., Юрьева Э.А. Бисфосфонаты, 2001, М.: Химия, 224 С).
Контроль за содержанием микроэлементов в сыворотке крови и сосудах (брюшная аорта) проводится методом рентгенофлуоресцентного анализа в полном внешнем отражении на рентгеновском спектрометре PICOFOX S2 (BRUKER, Германия). Метод позволяет проводить исследование элементного состава в микроколичествах изучаемого материала в диапазоне концентраций вплоть до мкг/л.
ОСУЩЕСТВЛЕНИЕ изобретения.
Проводится экспериментальное воспроизведение атеросклероза и бляшкообразования в сосудах.
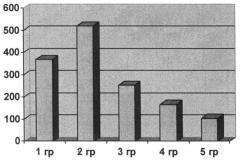
На фигуре показано среднее количество гранул солей кальция (на площади среза 6000 мкм2) в стенке аорты экспериментальных животных.
Используются белые беспородные крысы, самцы, весом 250 г в 5 рандомизированных группах. Всем животным проводится вживление фрагмента лески в грудную аорту для воспроизведения бляшкообразования.
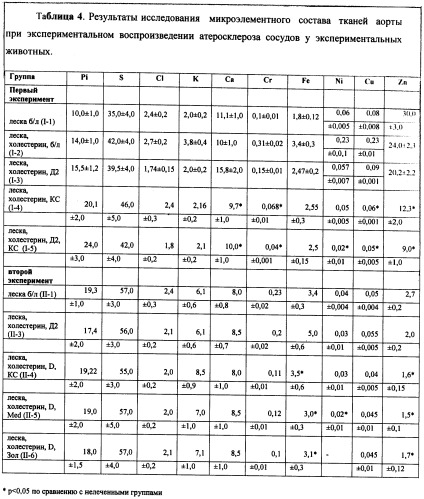
На лабораторных животных при экспериментальном моделировании атеросклероза сосудов с кальцификацией проводилось изучение коррегирующего влияния бисфосфонатов - ксидифон, медифон или золедронат, на избыточное накопление микроэлементов в атеросклеротически измененных сосудах, а также на степень отложения солей кальция в стенке сосудов.
В конце эксперимента производился сбор морфометрических данных и световой микроскопии. Проводился биохимический анализ сыворотки крови, а также исследование микроэлементного состава сыворотки и тканей аорты.
ПРИМЕР 1 (1-й эксперимент).
Экспериментальный материал разделен на пять групп:
Группа 1 - экспериментальный атеросклероз, вызванный прижизненным введением лески в аорту крыс;
Группа 2 - экспериментальный атеросклероз, вызванный прижизненным введением лески в аорту крыс; кроме того, в диету животным включается 1% холестерина;
Группа 3 - экспериментальный атеросклероз, вызванный прижизненным введением лески в аорту крыс, кроме того, в диету животным включается 1% холестерина. В первые 3 дня через зонд в желудок вводится эргокальциферол (витамин D2), в дозе 75000 ИЕ;
Группа 4 - экспериментальный атеросклероз, вызванный прижизненным введением лески в аорту крыс и включением в диету 1% холестерина. В качестве лечебного фактора, начиная с 4 дня, животным вводился через желудочный зонд в виде раствора бисфосфонат - ксидифон 50 мг/кг ежедневно;
Группа 5 - экспериментальный атеросклероз, вызванный прижизненным введением лески в аорту крыс, кроме того, в диету животным включается 1% холестерина. В первые 3 дня через зонд в желудок вводится эргокальциферол (витамин D2), в дозе 75000 ИЕ. Начиная с 4 дня, животным вводился через желудочный зонд в виде раствора бисфосфонат ксидифон 50 мг/кг ежедневно.
При анализе материала, полученного от животных 2-5 групп исследования определен атеросклеротический патоморфоз стенки аорты умеренной степени. Указанные изменения сопровождались кальцификацией стенки аорты. Результаты морфометрического анализа распределения микроконгломератов солей кальция представлены в таблице 1.
| Таблица 1 | ||||
| Морфометрические характеристики гранул микроконгломератов солей кальция на поперечных срезах аорты экспериментальных животных при окраске по Косса. | ||||
| группа 2 | группа 3 | группа 4 | группа 5 | |
| Площадь, мкм2 | 1,23±0,04 | 1,66±0,16 | 1,18±0,06 | 1,20±0,05∗ |
| Периметр, мкм | 1,76±0,07 | 2,20±0,12 | 1,74±0,13 | 1,90±0,1∗ |
| Средний габарит, мкм | 0,91±0,02 | 1,02±0,02 | 0,90±0,04 | 0,95±0,03∗ |
| Диаметр Фере максимальный, мкм | 1,30±0,03 | 1,39±0,03 | 1,30±0,06 | 1,41±0,05 |
| Диаметр Фере минимальный, мкм | 0,49±0,01 | 0,59±0,01 | 0,44±0,02∗ | 0,45±0,02∗ |
| Диаметр Фере средний, мкм | 0,95±0,02 | 1,05±0,02 | 0,93±0,04 | 1,00±0,04 |
| Средняя оптическая плотность гранулы, у.е. | 0,04±0,0004 | 0,06±0,0004 | 0,06±0,0007∗ | 0,08±0,0008∗ |
| Интегральная оптическая плотность гранул, у.е. | 0,36±0,03 | 1,04±0,29 | 0,56±0,05∗ | 0,67±0,03∗ |
| Среднее количество гранул на один поперечный срез | 4738±560 | 7016±731 | 1980±424∗ | 1898±315∗ |
∗Звездочкой отмечена достоверность отличия (p<0,05): в группе 4 относительно группы 2, а в группе 5 относительно группы 3.
Результаты, полученные при анализе морфометрии гистохимических препаратов аорты экспериментальных животных, позволяют сделать заключение о том, что применение бисфосфоната ксидифона оказывает позитивное действие на тканевые процессы в стенке сосудов при атеросклерозе, снижающее степень отложения микроконгломератов солей кальция.
Несмотря на отсутствие в лечебном комплексе антиоксидантов, ксидифон в сочетании с коротким курсом субтоксических доз витамина D2 оказали наилучшее влияние на различные стороны обменных процессов, изменение которых сочетается обычно с высоким риском развития атеросклероза (таблица 2).
| Таблица 2 | |||||
| Биохимическая и морфометрическая характеристики экспериментального атеросклероза у экспериментальных животных. | |||||
| Группы | 1 | 2 | 3 | 4 | 5 |
| Показатели | Л | Л+Х | Л+X+D | Л+Х+Кс | Л+Х+D+Kc |
| ЛПВП г/л | 0,76±0,06 | 0,70±0,04 | 0,77±0,04 | 0,86±0,072 | 0,77±0,07 |
| ЛПНП г/л | 0,37±0,03 | 0,28±0,021 | 0,23±0,011 | 0,28±0,02 | 0,25±0,04 |
| Индекс атерогенности | 2,20±0,06 | 2,62±0,11 | 2,17±0,15 | 2,09±0,112 | 2,32±0,22 |
| Индекс токсичности | 0,23±0,07 | 0,22±0,04 | 0,27±0,05 | 0,24±0,06 | 0,11±0,013 |
| МДА ед/мл | 2,29±0,57 | 1,93±0,38 | 2,10±0,28 | 2,19±0,28 | 2,40±0,42 |
| АОА % | 65,80±5,16 | 71,98±2,83 | 61,66±4,95 | 62,54±4,15 | 59,00±4,83 |
| ЛДГ ед/л | 333,00±32,60 | 414,30±12,501 | 415,70±42,001 | 442,60±42,84 | 484,20±42,56 |
| КФК ед/л | 52,00±4,51 | 56,60±5,29 | 67,00±17,271 | 55,90±7,03 | 52,90±8,14 |
| КО моль/л.мин | 280,50±22,70 | 261,50±23,70 | 249,66±24,85 | 256,30±12,30 | 277,30±15,60 |
| Щелочная фосфатаза | 377,00±26,60 | 278,40±14,501 | 285,00±19,571 | 319,00±25,90 | 301,00±21,54 |
| Холестерин моль/л | 2,43±0,15 | 2,46±0,13 | 2,39±0,18 | 2,64±0,18 | 2,48±0,26 |
| Триглицириды моль/л | 1,27±0,16 | 1,26±0,11 | 0,90±0,091 | 0,85±0,062 | 0,86±0,11 |
| МК мкмоль/л | 0,64±0,09 | 0,60±0,06 | 0,50±0,03 | 0,52±0,03 | 0,39±0,043 |
| Количество гранул∗ | 3600±350 | 4738±5601 | 7016±7361 | 1980±4242 | 1898±3153 |
| Σ площадь гранул∗ | 4431±400 | 5827±4001 | 11646±11001 | 2336±3802 | 2277±3953 |
∗Количество гранул кальция и Σ площадь гранул на единицу поперечного среза аорты
Л - леска, X - холестерин, D - витамин D2, Кс - ксидифон, МК - мочевая кислота, ЛПВП-липопротеиды высокой плотности крови, ЛПНП - липопротеиды низкой плотности крови, МДА - малоновый диальдегид, АОА - антиоксидантная активность, ЛДГ - лактатдегидрогеназа, КФК - креатинфосфокиназа, КО - ксантиноксидаза.
1р меньше 0,05 по сравнению с первой группой, 2 - со второй группой, 3 - с третьей группой.
Следует отметить, что при сравнении полученных биохимических показателей с морфометрическими параметрами отложения кальция в стенке аорты, была выявлена сильная положительная корреляция между размерами гранул солей кальция с одной стороны и уровнем ЛПНП (r=0,90), уровнем ксантиноксидазы (r=0,61), уровнем щелочной фосфатазы (r=0,90), уровнем триглицеридов (r=0,60), уровнем мочевой кислоты (r=0,64). В отличие от размеров, плотность кальцификатов обратно коррелировала с индексом атерогенности (r=-0,61), АОА (r=-0,98), уровнями триглицеридов (r=-0,8) и мочевой кислоты (г=-0,79). То есть, гранулы отличались большей плотностью кальциевых отложений при нормализации АОА, уровня триглицеридов, мочевой кислоты и уровня индекса атерогенности, что можно расценивать как некий фактор упорядоченности распределения кальция в клетках, отмеченный нами раннее при воздействии кальциевого регулятора - ксидифона.
По результатам представленных исследований можно сделать следующие выводы:
1. Биохимическими признаками риска атеросклероза явились снижение ЛПВП, повышение ЛПНП и индекса атерогенности, повышение индекса токсичности по альбумину, высокое содержание триглицеридов и мочевой кислоты в сыворотке крови, а также повышение активности щелочной фосфатазы (таблица 2).
2. Субтоксические дозы витамина D2, введенные животным в начале эксперимента (в первые 3 дня), через 1 месяц обусловили повышение индекса токсичности, содержания в сыворотке МДА и КФК в сыворотке крови. Однако отмечено умеренное снижение активности ксантиноксидазы, содержания триглицеридов и мочевой кислоты.
3. Ксидифон, используемый в лечебных целях повышает уровень ЛПВП, снижает индекс атерогенности, содержание триглицеридов и мочевой кислоты.
4. Применение двух регуляторов обмена кальция - лечебных доз ксидифона в течение длительного времени и короткого начального курса субтоксических доз витамина D2 - к концу месяца приводит к снижению ЛПНП и индекса атерогенности, высоко достоверно и значительно снижает индекс токсичности по альбумину, концентрацию мочевой кислоты и содержание триглицеридов в сыворотке.
5. Исследованные биохимические параметры крови достоверно коррелируют с уровнем отложения кальция в стенке аорты, причем размеры кальцификатов и их плотность зависят от разных условий эксперимента.
ПРИМЕР 2 (2-й эксперимент).
Экспериментальный материал разделен на пять групп:
Группа 1 - экспериментальный атеросклероз, вызванный прижизненным введением лески в аорту крыс;
Группа 2 - экспериментальный атеросклероз, вызванный прижизненным введением лески в аорту крыс и включением в диету 1% холестерина. В первые 3 дня через зонд в желудок вводится эргокальциферол (витамин D2), в дозе 75000 ИЕ;
Группа 3 - экспериментальный атеросклероз, вызванный прижизненным введением лески в аорту крыс и включением в диету 1% холестерина. В первые 3 дня через зонд в желудок вводится эргокальциферол (витамин D2), в дозе 75000 ИЕ. Начиная с 4 дня, животным вводился через желудочный зонд в виде раствора бисфосфонат ксидифон в дозе 50 мг/кг ежедневно;
Группа 4 - экспериментальный атеросклероз, вызванный прижизненным введением лески в аорту крыс и включением в диету 1% холестерина. В первые 3 дня через зонд в желудок вводится эргокальциферол (витамин D2), в дозе 75000 ИЕ. Начиная с 4 дня, животным вводился через желудочный зонд в виде раствора бисфосфонат медифон в дозе 20 мг/кг ежедневно;
Группа 5 - экспериментальный атеросклероз, вызванный прижизненным введением лески в аорту крыс и включением в диету 1% холестерина. В первые 3 дня через зонд в желудок вводится эргокальциферол (витамин D2), в дозе 75000 ИЕ. Начиная с 4 дня, животным вводился через желудочный зонд в виде раствора бисфосфонат золедронат в дозе 20 мг/кг ежедневно.
Результаты морфометрического анализа распределения микроконгломератов солей кальция представлены в таблице 3 и на чертеже.
| Таблица 3 | |||||
| Морфометрические характеристики гранул микроконгломератов солей кальция на поперечных срезах аорты экспериментальных животных при окраске по Косса. | |||||
| Параметр | группа 1 (контроль) | группа 2 (кальци-фикация) | группа 3 (ксидифон) | группа 4 (медифон) | группа 5 (золедронат) |
| Среднее количество гранул в бляшке (на площади 6000 мкм2) | 369 | 518 | 253 | 167 | 104 |
| Площадь, мкм2 | 2,03±0,19 | 2,63±0,2 | 1,78±0,07 | 2,92±0,27 | 2,11±0.2 |
| Периметр, мкм | 3,06±0,25 | 3,43±0,24 | 2,53±0,08 | 3,37±0,2 | 2,93±0,2 |
| Средний габарит, мкм | 1,27±0,06 | 1,38±0,06 | 0,8±0,02 | 1,37±0,05 | 1.25±0,06 |
| Диаметр Фере максимальный, мкм | 1,84±0,1 | 1,88±0,08 | 1,61±0,03 | 1,87±0,07 | 1,74±0.08 |
| Диаметр Фере минимальный, мкм | 0,67±0,03 | 0,86±0,04 | 1,03±0,02 | 0,84±0,03 | 0,72±0,04 |
| Диаметр Фере средний, мкм | 1,34±0.07 | 1.43±0,06 | 1.16±0,02 | 1.42±0.05 | 1.3±0.06 |
| Средняя оптическая плотность гранулы, у.е. | 0.078±0.0006 | 0.0695±0.001 | 0.0593±0.0007 | 0,1031±0.0007 | 0,109±0.001 |
| Интегральная оптическая плотность гранул, у.е. | 1,18±0,18 | 1.469±0.14 | 0,85±0,06 | 2,58±0,3 | 1,86±0,3 |
Как видно из представленных данных использованные бисфосфонаты оказывали различное действие на оцениваемое по гистохимическим признакам отложение солей кальция в стенке аорты. По действию ксидифона результаты в основном были сходны с зарегистрированными в эксперименте 1. Число гранул снижалось примерно вдвое по сравнению таковым у животных, получавших только кальцифицирующие и атерогенные агенты. Размеры гранул также снижались, причем в этом отношении ксидифон оказался наиболее эффективным. Размеры гранул по большинству показателей были ниже не только таковых параметров у животных второй группы (кальцификация), но и у животных первой группы (контроль). Следует отметить, что особенностью этой группы было наибольшее значение минимального коэффициента Фере (минимального размера проекции гранул). Это говорит о том, что при действии ксидифона, кроме всего прочего, уменьшается относительное число самых мелких гранул. Но не только размеры и количество гранул микроконгломератов солей кальция уменьшается при действии ксидифона. Достоверно снижается также и их оптическая плотность.
Действие медифона на количество кальцийсодержащих гранул было еще более эффективным по сравнению с действием ксидифона. Однако размеры гранул оказались в этой группе животных максимальными по сравнению с остальными. Также максимальной была и средняя оптическая плотность гранул. Наибольшее (пятикратное по сравнению с животными второй группы) снижение количества гранул кальциевых солей отмечено у животных, получавших золедроновую кислоту. Размеры гранул несколько снижались по сравнению со второй группой, но были значительно выше, чем у животных, получавших ксидифон. При этом средняя оптическая плотность гранул была максимальной.
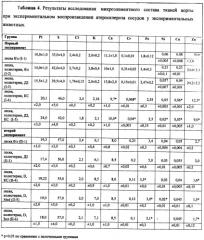
Результаты проведенных исследований подтвердили гипотезу о позитивном действии бисфосфонатов на тканевые изменения в стенке сосудов при атеросклерозе, что выразилось в снижении степени отложения микроконгломератов солей кальция. Наиболее эффективным из трех исследованных препаратов можно считать ксидифон, так как он воздействует на все морфометрически определенные параметры кальциевых включений. Положительное действие все три исследуемые бисфосфонаты оказывали на биохимические маркеры атерогенеза и на микроэлементный состав тканей аорты (таблица 4).
Для анализа микроэлементного состава тканей аорты экспериментальных животных, исследованных в первом и втором экспериментах, был использован метод рентгенофлуоресцентного анализа в геометрии полного внешнего отражения. Главным достоинством рентгенофлуоресцентных измерений в геометрии полного внешнего отражения является возможность значительно уменьшить интенсивность фонового излучения от подложки, так как в условиях полного внешнего отражения первичное излучение практически не проникает в подложку. Что позволяет заметно увеличить отношение сигнал/шум и существенно снизить пределы обнаружения химических элементов в образце. Измерения были выполнены на рентгеновском спектрометре настольного типа PICOFOX S2 компании Bruker, оснащенном рентгеновской трубкой с Mo-анодом с воздушным охлаждением. Для исследования микроэлементного состава стенок сосудов ткани растворяли в азотной кислоте, аликвоту раствора 5 мкл наносили на подложки. Нанесенные на подложки образцы высушивали при комнатной температуре. Полученные результаты представлены в таблице 4.
В таблице 4 показано достоверное снижение различных микроэлементов в ткани сосудов при лечении ксидифоном, медифоном или золедронатом по сравнению с аналогичными нелеченными группами при аналогичных атерогенных воздействиях. Таким образом, показано корригирующее действие использованных бисфосфонатов на микроэлементный состав аорты при экспериментальном воспроизведении атеросклероза.
Способ коррекции избыточного накопления микроэлементов в сосудах при атеросклерозе с помощью комплекса лечебных мероприятий, включающий применение антиатеросклеротических препаратов, отличающийся тем, что в качестве антиатеросклеротических препаратов используют бисфосфонаты ксидифон, или медифон, или золедронат.