Способ определения оптических и биофизических параметров биоткани
Иллюстрации
Показать всеИзобретение относится к области медицинского приборостроения и применяется для определения оптических и биофизических параметров биоткани. Сущность способа: посылку излучения на ткань в одну или несколько точек осуществляют на длинах волн λ из диапазона 350-1600 нм, измеряют диффузное отражение P(L, λ) на длинах волн посылаемого излучения для каждой из точек освещения, определяют абсолютный R(L, λ) или нормированный r(L, λ) спектрально-пространственный профиль коэффициента диффузного отражения ткани, а оптические и биофизические параметры (X) определяют на основе аналитических выражений, представляющих собой множественные регрессии между Х и R(L, λ) или между Х и r(L, λ), которые получают путем измерения или расчета методом Монте-Карло R(L, λ), r(L, λ) для множества образцов биоткани или моделирующих ее фантомов с известными оптическими и биофизическими параметрами, накопления ансамбля реализации оптических и биофизических параметров биоткани и соответствующих им спектрально-пространственных профилей R(L, λ), r(L, λ) для возможных диапазонов вариаций оптических и биофизических параметров ткани. Использование способа позволяет расширить функциональные возможности за счет одновременного определения комплекса как оптических, так и биофизических параметров биологической ткани в режиме реального времени, обеспечивает повышение точности измерения данных параметров за счет учета их общей вариативности, а также за счет исключения калибровочных измерений и использования априорной информации. 4 з.п. ф-лы, 6 табл., 7 ил.
Реферат
Изобретение относится к области медицинского приборостроения.
Известны диагностическое устройство [1] и диагностический комплекс [2] для измерения медико-биологических характеристик кожи и слизистых оболочек in vivo включающий посылку оптического излучения на тестируемую ткань и регистрацию отраженного тканью излучения, которые определяют соответственно степень насыщения кислородом гемоглобина артериальной крови, частоту пульса и состояние кровотока в системе микроциркуляции. При этом коэффициент рассеяния ткани не определяется, а значит результат измерения вышеуказанных параметров подвержен существенному влиянию рассеивающих свойств ткани.
Известны также способы определения оптических и биофизических параметров биологических тканей по отраженному излучению с использованием интегрирующей сферы [3, 4] и оптоволоконного устройства, содержащего два соосных волновода, расположенных на фиксированном расстоянии друг от друга, для посылки и регистрации излучения [5]. В обоих случаях обратная задача по интерпретации спектральных коэффициентов диффузного отражения (КДО) ткани осуществляется путем минимизации разницы между экспериментальными и рассчитанными в рамках модели биоткани спектрами КДО. В [3, 4] предполагается измерение таких параметров кожи, как толщина эпидермиса, концентрация меланина и степень оксигенации гемоглобина. В [5] определяются коэффициент поглощения и транспортный коэффициент рассеяния слизистых оболочек полости рта, пищевода, желудка и легких, концентрации в них кровеносных сосудов и насыщение крови кислородом. К недостаткам данных способов следует отнести узкую область корректности используемых методов расчета характеристик переноса излучения, неоднозначность решения обратной задачи, вследствие невозможности разделения вкладов рассеяния и поглощения ткани в измеряемый спектр, и необходимость использования большого объема априорной информации об исследуемой среде (в частности, для корректной оценки поглощающих свойств ткани необходимо располагать информацией об ее рассеивающих свойствах, и наоборот).
Известны способы и устройства для определения оптических параметров однородной [6, 7] биоткани с использованием измерений рассеянного тканью света на нескольких расстояниях L от точки освещения. Способы позволяют определять коэффициент поглощения k и транспортный коэффициент µs рассеяния ткани. В [6] это достигается путем сопоставления расчетных и экспериментальных пространственных профилей диффузного отражения. Для расчета пространственного профиля КДО - R(L) используется уравнение полиномиальной множественной регрессии между R(L) и оптическими параметрами среды - k и µs, установленное на основе измерений R(L) для множества калибровочных образцов с известными оптическими параметрами. Данный способ требует строгое совпадения показателей преломления и индикатрис рассеяния реальных тканей и калибровочных образцов, что редко достигается в действительности. Кроме того, способ может давать неадекватные или не соответствующие реальности результаты, если значения параметров k и µs выйдут за пределы области, охватываемой калибровочными образцами. В способе [7] для восстановления параметров k и µs из измерений R(L) используется специально обученная нейронная сеть. Обучающий массив данных получен на основе расчета R(L) методом Монте-Карло для множества комбинаций значений k и µs. При этом в расчетах не учитываются вариации показателя преломления среды и фактора анизотропии рассеяния, что приводит к неудовлетворительным результатам использования данного метода для расстояний L<2 мм. В способах [6, 7] не учитывается многослойное строение ткани, поэтому их использование для кожи и других тканей, состоящих из нескольких слоев с принципиально отличающимся биохимическим составом и оптическими свойствами, не является корректным. Кроме того, данные способы предполагают, что КДО измеряются в спектральной области малых поглощений хромофоров ткани (меланин, билирубин, гемоглобин, оксигемоглобин и т.п.) - λ=660-1000 нм. Это обуславливает высокую чувствительность коэффициентов поглощения, определяемых на основе данных способов, к погрешностям измерения диффузного рассеяния и делает необходимым использования больших расстояний между точками освещения и регистрации, что, в свою очередь, приводит к невысокому уровню сигнала на фоне шумов измерительного устройства и большой вероятности искажения результатов измерений неоднородностью объема ткани, с которым взаимодействует излучение.
Наиболее близким к заявляемому изобретению является способ определения концентрации гемоглобина, основанный на измерении диффузного отражения ткани на двух изобестических длинах волн окси- и деоксигемоглобина, включающий посылку излучения на образец ткани, измерение диффузного отражения от ткани, вычисление отношения интенсивностей диффузного отражения на двух изобестических длинах волн с использованием измеренного диффузного отражения и определение концентрации гемоглобина в ткани посредством подстановки вычисленного отношения в предопределенное аналитическое выражение, соответствующее используемым изобестическим длинам волн [8]. К недостаткам данного способа следует отнести влияние вариаций рассеивающих свойств ткани и ее многослойного строения на точность измерений гемоглобина, а также невозможность определения комплекса других важных биофизических и оптических параметров ткани. Кроме того, при использовании данного способа для кожи, результаты измерения гемоглобина будут существенно искажены влиянием пигментации кожи.
Предлагаемое изобретение направлено на решение задачи расширения функциональных возможностей за счет одновременного определения комплекса как оптических, так и биофизических параметров биологической ткани в режиме реального времени, повышение точности измерения данных параметров за счет учета их общей вариативности, а также за счет исключения калибровочных измерений для нормированного r(Z, λ) спектрально-пространственного профиля коэффициента диффузного отражения ткани и использования априорной информации.
Для решения данной задачи посылку излучения на ткань в одну или несколько точек осуществляют на длинах волн λ из диапазона 350-1600 нм, измеряют диффузное отражение P(L, λ) на длинах волн посылаемого излучения для каждой из точек освещения, где L - расстояние между точками освещения и регистрации диффузного отражения на поверхности ткани, определяют абсолютный R(L, λ) или нормированный r(L, λ) спектрально-пространственный профиль коэффициента диффузного отражения ткани, как R(L, λ)=P(L, λ)/(P0 (λ)A(L,λ)) или r(L, λ)=P(L, λ)/P(L0, λ), где Р0(λ) - мощность излучения, посылаемого на ткань; A(L, λ) - аппаратурная константа, определяемая экспериментально с использованием эталонного отражателя, или рассчитываемая по известным геометрическим параметрам и спектральным характеристикам измерительного устройства; L0 - одно из расстояний между точками освещения и регистрации диффузного отражения; а оптические и биофизические параметры (X) определяют на основе аналитических выражений, представляющих собой множественные регрессии между X и R(L, λ) или между X и r(L, λ), которые получают путем измерения или расчета методом Монте-Карло коэффициентов диффузного отражения для множества образцов биоткани или моделирующих ее фантомов с известными оптическими и биофизическими параметрами, накопления ансамбля реализации оптических и биофизических параметров биоткани и соответствующих им спектрально-пространственных профилей R(L, λ), r(L, λ) для возможных диапазонов вариаций оптических и биофизических параметров ткани.
В качестве биоткани в предлагаемом изобретении используют кожу, молочную железу, слизистую оболочку полости рта, пищевода, органов желудочно-кишечного тракта и легких как in vivo, так и in vitro. Определяют такие оптические параметры ткани как коэффициент поглощения, транспортный коэффициент рассеяния, фактор анизотропии рассеяния, и такие биофизические параметры как объемная концентрация меланина, интегральное содержание меланина в эпидермисе, концентрация общего гемоглобина, насыщение гемоглобина кислородом, концентрация билирубина, средний диаметр и объемная концентрация капилляров с кровью, концентрация и размер эффективных рассеивателей ткани, содержание воды в ткани.
Коэффициенты диффузного отражения определяют или на характеристических длинах волн спектров поглощения и рассеяния компонентов исследуемой ткани, или же во всем диапазоне посылаемого излучения с последующей интерполяцией или экстраполяцией полученных коэффициентов R(L, λ) и r(L, λ) к длинам волн, соответствующим аналитическим выражениям, на основе которых осуществляется переход от R(L, λ) и r(L, λ) к определяемым параметрам ткани.
Предопределенные аналитические выражения между профилями R(L, λ), r(L, λ) и определяемыми оптическими и биофизическими параметрами ткани в виде множественных регрессий устанавливают путем измерения или расчета методом Монте-Карло коэффициентов диффузного отражения для множества образцов биоткани или моделирующих ее фантомов с известными оптическими и биофизическими параметрами, накопления ансамбля реализации оптических и биофизических параметров биоткани и соответствующих им спектрально-пространственных профилей R (L, λ), r(L, λ) и использования регрессионного или других математических методов анализа полученного ансамбля реализации.
Оптические и биофизические параметры ткани можно также определять на основе множественных регрессий между X и линейно-независимыми компонентами профиля R(L, λ) или r(L, λ), определяемыми как проекции профиля R(L, λ) или r(L, λ) на пространство из собственных векторов его ковариационной матрицы.
Свойства, появляющиеся у заявляемого технического решения, следующие:
1) повышение точности определения оптических и биофизических параметры ткани за счет учета их общей вариативности, исключения использования априорной информации, устранения калибровочных измерений для нормированного r(L, λ) спектрально-пространственного профиля коэффициента диффузного отражения ткани
2) расширение функциональных возможностей за счет одновременного определения комплекса оптических и биофизических параметров ткани в режиме реального времени, что не достигается с использованием известных способов.
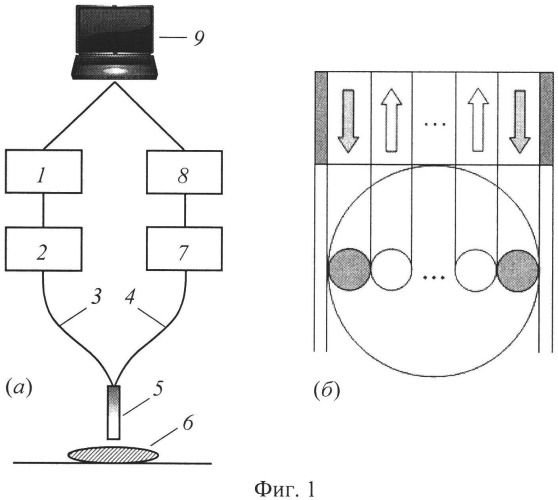
Сущность данного изобретения поясняется с помощью фиг.1-8. На фиг.1, а изображена блок-схема устройства, реализующая предлагаемый способ, включающая блок светового излучения (1), оптоволоконный зонд (5), оснащенный освещающими (3) и принимающими (4) волокнами, монохроматор (2) или спектрометр (7), устройство регистрации (8) и устройство обработки измерительной информации (9). В качестве альтернативы оптоволоконному зонду 5 для посылки света на образец биоткани 6 и сбора отраженного ей потока может использоваться светопередающая оптика. Устройство регистрации 8 может быть выполнено как прибор с зарядовой связью (ПЗС). Вместо ПЗС могут использоваться фотоумножитель (ФЭУ) или фотодиоды. Блоком светового излучения 1 может служить лампа белого света (ксеноновая, аргоновая или криптоновая) или светодиоды (СД). Альтернативой монохроматору 2 является набор сменных фильтров. Оптоволоконный зонд 5 может включать эластичную трубку, содержащую множество оптических волокон (т.е., по крайней мере, одно освещающее и не менее двух принимающих), позволяя тем самым регистрировать спектрально-пространственный профиль сигналов диффузного отражения относительно освещающих волокон. Зонд 5 может быть также оснащен твердым наконечником, в котором множество волокон расставляются в различные геометрические конфигурации «освещение-регистрация».
Свет от источника излучения 1, пропущенный через монохроматор 2, поступает в оптоволоконный зонд 5, в котором по одному или нескольким освещающим волокнам 3 попадает на биоткань 6. Принимающие волокна 4 в оптоволоконном зонде 5 собирают диффузно отраженный свет и передают его на спектрометр 7. Сигналы диффузного отражения от различных принимающих волокон пространственно разделяются при помощи ПЗС 8, позволяя, таким образом, одновременно измерять спектры диффузного отражения для различных расстояний между каналами освещения и приема излучения.
На фиг.1, б представлен один из возможных вариантов расположения каналов возбуждения и регистрации сигналов диффузного отражения. Оптическое излучение подается в каналы возбуждения, расположенные на различных расстояниях L от точек регистрации сигналов отражения (в данном варианте по двум каналам). Сравнение профилей рассеянного излучения от каналов возбуждения позволяет оценить степень неоднородности освещаемого объема и тем самым выбрать оптимальный для проведения измерений участок объекта. Диффузное отражение измеряют или во всем спектральном диапазоне посылаемого на ткань излучения с некоторым спектральным разрешением, или же, на характеристических длинах волн спектров поглощения и рассеяния компонентов исследуемой биоткани с последующей интерполяцией или экстраполяцией к длинам волн, соответствующим используемым аналитическим выражениям для перехода к определяемым параметрам биоткани. Для получения пространственных значений коэффициентов отражения диффузное отражение измеряют не менее чем на двух расстояниях от точек освещения. После измерения спектра отражения ткани, полученные данные поступают на блок обработки 9, позволяющий получать абсолютные R(L, λ) или нормированные r(L, λ) спектрально-пространственные профили КДО ткани, а также вычисляющий значения оптических и биофизических параметров ткани (X) на основе множественных регрессий между X и спектрально-пространственными профилями КДО ткани или их линейно-независимыми компонентами.
Регистрируемые сигналы P(L, λ) зависят от спектрально-пространственного профиля КДО ткани - R(L, λ), а также от аппаратурной константы A(L, λ) и спектральной мощности источника света P0(λ):
где A(L, λ)=G(L)τ(λ)S(λ), L - расстояние между освещающим и принимающим волокнами, G(L) - числовая апертура оптических волокон, S(λ) - спектральная чувствительности приемника, τ(λ) - функция пропускания оптической системы. Профили R(L, λ) определяются путем сопоставления соответствующих им сигналов P(L, λ) с сигналами Pstd(L, λ), соответствующими эталонному диффузному отражателю:
где Rstd - КДО эталонного диффузного отражателя; Pdark - мощность сигнала в отсутствии освещения, соответствующая темновому току.
Для устранения необходимости проведения калибровочных измерений параметры ткани следует определять по нормированному профилю ее КДО R(L, λ)/R(L0, λ), который можно получить в виде отношения сигналов диффузного отражения для пространственно разнесенных каналов регистрации, как r(L, λ)=P(L, λ)/P(L0, λ), где L0 - расстояние между освещающим и одним из светопринимающих волокон. Профили r(L, λ) не зависят от спектральных характеристик компонент измерительного устройства, а определяются только разностью оптических путей световых потоков для двух пространственно разнесенных каналов регистрации.
Для получения множественных регрессий, на основе которых определяются параметры ткани X, используется ансамбль реализации X и профилей R(L, λ), получаемый путем моделирования процесса переноса излучения в исследуемой ткани при широкой вариации ее параметров и расчета R(L, λ), r(L, λ) методом Монте-Карло [9] с учетом конструктивных параметров измерительного устройства (геометрической конфигурации волокон и их числовых апертур). Таким образом, аналитические выражения, связывающие X с профилями КДО ткани, получают путем многократных решений прямой задачи методом Монте-Карло (расчета КДО ткани) при различных комбинациях параметров оптической модели ткани и последующего статистического анализа полученных данных.
Ниже, возможности и достоинства предлагаемого способа демонстрируются на примере кожной ткани и слизистых оболочек полых органов (полости рта, пищевода, желудочно-кишечного тракта и легких).
Оптическая модель слизистой оболочки. Известно, что основными параметрами, характеризующими распространение оптического излучения в рассеивающей среде, являются коэффициенты поглощения k, рассеяния β и индикатриса рассеяния или ее средний косинус g. Причем, в оптике биологических тканей, как очень мутных сред, для описания световых полей достаточно знать не сами величины β и g, а их комбинацию - транспортный коэффициент рассеяния µs=β(1-g).
Спектр коэффициента поглощения слизистой оболочки k(λ) моделируется в виде линейной комбинации спектров поглощения ее хромофоров. В видимой области основными поглощающими хромофорами биоткани являются оксигемоглобин и деоксигемоглобин. В связи с этим, выражение для коэффициента поглощения имеет вид:
где kt(λ)=A·exp[-B[λ-λ0)] - коэффициент поглощения обескровленной ткани, λ0=632 нм, A (мм-1) и B (нм-1) - параметры, характеризующие спектральную зависимость kt; FtHb (г/л) - концентрация общего гемоглобина в биологической ткани; µHb=64.5 мг/моль - молярная масса гемоглобина; и εHb - молярные коэффициенты поглощения соответственно оксигемоглобина и деоксигемоглобина [10]; S - насыщение гемоглобина кислородом; α - поправочный коэффициент, учитывающий эффект локализованного поглощения света кровеносными сосудами [11]. Суть введения коэффициента α состоит в учете того, что кровь не равномерно распределена в объеме ткани, а локализована в капиллярах. Для хаотически распределенных капилляров с диаметром D коэффициент α определяется на основе следующего выражения [11]:
где - коэффициент поглощения крови, CHb=150 г/литр - концентрация гемоглобина в крови.
Транспортный коэффициент рассеяния биологических тканей в видимой области спектра с хорошей точностью аппроксимируется степенной зависимостью:
где λ0=632 нм; Cs и ν - структурные параметры ткани, характеризующие объемное содержание и размер ее «эффективных» рассеивателей. Для описания процесса рассеяния излучения используется однопараметрическая функция Хеньи-Гринштейна [9] с фактором анизотропии рассеяния g.
Таким образом, оптическая модель слизистой оболочки определяется параметрами g, A, B, C, ν, FtHb, D, S. Кроме того, для учета отражения падающего света от поверхности ткани, а также многократных переотражений вызванного им диффузного излучения между внутренними слоями и поверхностью ткани необходимо располагать информацией о ее показателе преломления nt. В табл.1 приведены диапазоны вариаций модельных параметров, выбранные путем критического анализа результатов различных авторов [5, 12-22] для нормальных и опухолевых тканей организма (слизистых оболочек полости рта, пищевода, органов желудочно-кишечного тракта и легких).
Вариации модельных параметров будем осуществлять независимо друг от друга, но при этом будем контролировать, чтобы при каждой их комбинации значения оптических параметров ткани, получаемые по формулам (1) и (2), не выходили из диапазонов, наблюдаемых в эксперименте. Исходя их вышеуказанных литературных данных, выбраны следующие ограничения: 1) β'(700 нм)≥0.2 мм-1; 2) k(632 нм)=0.02-0.5 мм-1; 3) ktis(450 нм)≤0.35 мм-1; 4) Λ'(632 нм)=0.5-0.98, где Λ'=β'/(k+β') - транспортное альбедо однократного рассеяния ткани.
| Табл.1 | |
| Диапазоны вариаций параметров оптической модели слизистой оболочки | |
| Параметр | Диапазон |
| nt | 1.35-1.45 |
| A | 0.01-0.1 мм-1 |
| B | 0.001-0.028 нм-1 |
| CS | 0.5-3.0 мм-1 |
| x | 1.0-2.5 мкм |
| g | 0.5-0.95 |
| FtHb | 1.5-35 г/л |
| D | 5-30 мкм |
| S | 40-98% |
Оптико-статистическая модель кожи. Верхний слой кожи - эпидермис с толщиной Lepi, нижний - дерма, которая в оптическом плане считается бесконечно толстой. Показатель преломления слоев кожи nskin относительно воздуха считается одинаковым, поэтому френелевское отражение излучения имеет место только на границе раздела кожи с внешней средой.
Полагаем, что основой кожи является слабопоглощающая, обескровленная ткань. Зависимость ее коэффициента поглощения kt [см-1] от длины волны λ [нм] аппроксимируется следующим выражением:
В качестве индикатрисы рассеяния "эффективных" рассеивателей ткани (основными из которых являются упакованные в жгуты коллагеновые и эластиновые волокна дермы, а также кератиноциты и меланоциты эпидермиса) используем функцию Хеньи-Гринштейна, спектральная зависимость фактора анизотропии (среднего косинуса) которой может быть описана эмпирическим соотношением:
Спектр транспортного коэффициента рассеяния µs(λ) кожи в видимой и ближней ИК-областях спектра рассчитывается как суперпозиция спектров µs(λ), соответствующих рассеивателям Ми и Рэлея с размерами d≥λ и d<<λ соответственно:
где λ0=400 нм; ρMie - доля рассеяния Ми; x - параметр спектральной зависимости редуцированного коэффициента рассеяния Ми, зависящий от размера рассеивателей и их показателя преломления.
Коэффициенты поглощения слоев кожи определяются по известным правилам сложения оптических величин как сумма коэффициентов поглощения отдельных компонент с весами, равными их объемным концентрациям. Спектр коэффициента поглощения эпидермиса рассчитывается в соответствии с объемными концентрациями меланина fmel и воды wepi в его составе:
где kmel и kw - коэффициенты поглощения меланина и воды.
Коэффициент поглощения дермы зависит от содержания в ней капилляров с кровью fblood, воды wderm и билирубина Gbil:
где εbil - молярный коэффициент поглощения билирубина в см-1/(моль/л); µbil=585 г/моль - молярная масса билирубина; kblood - коэффициент поглощения крови; α - корректирующий фактор, учитывающий эффект локализованного поглощения света кровеносными сосудами.
Коэффициент поглощения крови kblood в зависимости от длины волны излучения может быть представлен в виде суммы коэффициентов поглощения гемоглобина (окисленного и не окисленного) и билирубина:
где CHb [г/л] - концентрации общего гемоглобина в крови; µHb=64500 г/моль - молярная масса гемоглобина; и εHb - молярные коэффициенты поглощения оки- и деоксигемоглобина в см-1 моль/литр); S - насыщение крови кислородом (доля окисленного гемоглобина в общем гемоглобине); tdif=5 - отношение концентраций билирубина в крови и в окружающей ткани (полагается фиксированным).
Таким образом, оптическая модель кожи определяется следующими параметрами: показатель преломления цельной кожи - nskin, параметры спектральной зависимости редуцированного коэффициента рассеяния - µs(λ0), ρMie и x; толщина эпидермиса Lepi; объемные концентрации меланина и воды в эпидермисе -fmel и wepi; объемные концентрации капилляров с кровью, воды и билирубина в дерме - fblood, wderm и Cbil; средний диаметр капилляров - D; концентрация общего гемоглобина в крови - CtHb; насыщение крови кислородом - S. Диапазоны вариаций модельных параметров, выбранные путем критического анализа результатов различных авторов, приведены в табл.2.
Схема моделируемого эксперимента. Будем полагать, что излучение инжектируются в среду посредством передающего волновода с диаметром сердцевины 0.2 мм. Рассеянное тканью в заднее полупространство излучение попадает в принимающие волноводы, расположенные на расстояниях L=0.23, 0.46, 0.69, 0.92, 1.15 мм от центра передающего волновода (диаметр сердцевины всех волноводов 0.2 мм). Для кожи канал регистрации с L=1.15 мм не рассматривается из-за низкого уровня сигнала при λ≤500 нм на фоне шума за счет сильного поглощения меланином и билирубином.
| Табл.2 | |||
| Диапазоны вариаций параметров оптической модели кожи | |||
| Параметр | Диапазон | Параметр | Диапазон |
| nskin | 1.4-1.5 | fmelLepi, мкм | 0.6-10 |
| µs(λ0), мм-1 | 3-11 | fblood, % | 0.2-7.0 |
| x | 0.5-1.0 | CtHb, г/л | 120-200 |
| ρMie | 0.1-0.6 | S, % | 40-98 |
| µs(λ0)/µs(900) | 3-10 | Cbil мг/л | 0.0'1-50 |
| Lepi, мкм | 50-150 | D, мкм | 5-30 |
Расчет R(L, λ) осуществляется по следующей схеме. Случайным образом выбираются значения модельных параметров из диапазонов, указанных в табл.1 и 2. Для каждой реализации параметров производится расчет k(λ) и µs(λ) по формулам (1)-(8) на 26 длинах волн (λ=450, 460, 470, 480, 495, 506, 514, 522, 530, 540, 548, 560, 564, 568, 574, 580, 586, 594, 600, 610, 620, 630, 640, 660, 676, 700 нм) для слизистой оболочки и на 30 длинах волн (λ=452, 460, 470, 480, 495, 506, 514, 522, 530, 540, 548, 560, 564, 568, 574, 580, 586, 594, 600, 610, 620, 630, 640, 660, 676, 700, 720, 740, 760, 780, 800 нм) для кожи. Указанные λ характеризуют основные особенности спектральных кривых поглощения хромофоров ткани в видимой области спектра. В соответствии с рассчитанными спектральными значениями оптических параметров, а также фактора анизотропии рассеяния и показателя преломления ткани методом Монте-Карло моделируется профиль R(L, λ). Фантом ткани представляет собой цилиндр с радиусом 10 мм и высотой 5 мм. Такие размеры выбираются с тем расчетом, чтобы, с одной стороны, устранить эффект границ, а с другой - уменьшить время счета. В расчете принимается, что излучение вводится в среду в направлении нормали к ее поверхности и равномерно распределено по площади сечения освещающего световода. Числовые апертуры всех волокон условно приняты равными 1.0 (разумеется, что при решении задачи интерпретации реальных оптоволоконных измерений расчет профилей R(L, λ) должен осуществляться в строгом соответствии со значениями апертур волокон и угловым распределением инжектируемого в среду излучения). Количество фотонов, вводимых в среду, зависит от транспортного альбедо однократного рассеяния среды - Λ=µs/k и варьируется от 6·106 при Λ≤0.5 до 2·105 при Λ≥10. Данная процедура повторяется для 2·103 реализации R(L, λ), что, как будет видно ниже, является достаточным для получения статистически-значимых результатов.
Следует отметить, что при использовании в качестве источников излучения светодиодов, расчет диффузного отражения в соответствующих им спектральных интервалах Δλ должен осуществляться с учетом реальной формы линии излучения P0(λ) и спектральной чувствительности приемника S(λ). Для того, чтобы избежать трудоемких вычислений монохроматического КДО и его последующего интегрирования в интервале Δλ с учетом аппаратурных функций, можно моделировать длину волны каждого фотона как случайное число, равномерно распределенное на интервале интегрирования и по значениям счетчиков вылетающих из среды фотонов получать оценку значений искомого интеграла как:
где Nλ - число подинтервалов на которые разбивается интервал интегрирования Δλ; Nph,i - общее число фотонов с длиной волны из i-го подинтервала, пропущенных через среду (начальный "вес" каждого фотона равен единице); ri - суммарный "вес" фотонов с длиной волны из i-го подинтервала, вылетевших из среды; wi - квадратурные коэффициенты, зависящие от используемого метода численного интегрирования.
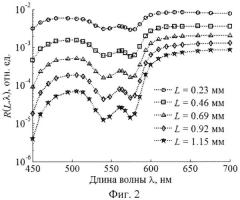
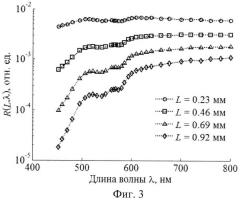
Решение обратной задачи. На фиг.2 изображен пример смоделированных спектральных зависимостей КДО слизистой оболочки на пяти различных расстояниях от точки освещения, образующих в совокупности спектрально-пространственный профиль R(L, λ). На фиг.3 изображен аналогичный профиль для кожи. Обратная задача состоит в восстановлении модельных параметров из профилей R(L, λ), Совокупность значений R(L, λ), определяемых в моделируемом эксперименте, удобно представлять в виде вектора измерений r из NλNL компонент, где Nλ и NL - количество спектральных и пространственных каналов регистрации КДО ткани соответственно (для кожи Nλ=30, NL=4; для слизистой оболочки Nλ=26, NL=5). Для удобства работы с числами одного порядка будем использовать логарифмическое представление измерений, т.е. компонентами r будут lnR(L, λ).
С помощью метода главных компонент [23, 24] вектор r разлагается по системе ортогональных векторов, причем оптимальной аппроксимацией r является разложение по собственным векторам его ковариационной матрицы
где и σ - среднее значение и дисперсия r, рассчитанные по набору векторов rk, K - число векторов в наборе (количество реализации параметров вышерассмотренной модели кожи); 1≤i, j≤Nmes. Искомое разложение любой реализации r имеет вид:
где V - матрица размером Nmes×NPC, столбцами которой являются собственные векторы vn матрицы S; NPC - число главных компонент; ξ - вектор из коэффициентов разложения ξn (линейно-независимых компонент), которые находятся по формуле
В связи с быстрой сходимостью рассматриваемого разложения на первые ортогональные функции (собственные векторы) приходится большая часть изменчивости компонент вектора r. Таким образом, метод главных компонент позволяет значительно уменьшить размерность исходных данных и выделить из них несколько линейно-независимых компонент, содержащих в себе столько же информации, сколько ее было в исходных данных. Очевидно, что при малом количестве измеряемой информации, когда суммарное количество спектральных и пространственных каналов регистрации не превышает количества линейно-независимых компонент в профилях R(L, λ), определять искомые параметры ткани можно напрямую из измеряемых значений R(L, λ) без извлечения из них линейно-независимых компонент, например при помощи полиномиальных регрессий
где Rij=R(Li, λj) или Rij=lnR(Li, λj); rij=r(Li, λj) или rij=lnr(Li, λj); Nλ и NL - соответственно количество длин волн и расстояний от точки освещения, на которых осуществляются измерения диффузного отражения, a ijm - коэффициенты регрессий, численные значения которых определяются методом наименьших квадратов; M - степень полинома; X - оптический или биофизический параметр (или его логарифм).
При большом количестве оптических измерений Nmes восстанавливать параметры ткани предпочтительно не из самих КДО, измеряемых непосредственно в эксперименте, а из коэффициентов их разложения по ортогональным функциям, например, по собственным векторам ковариационной матрицы (9). При этом для определения количественных значений оптических биофизических параметров биоткани удобно использовать полиномиальные регрессии
где a nm - коэффициенты регрессий; M≥1 - степень полинома; X - оптический или биофизический параметр (или его логарифм); ξn - линейно-независимые компоненты спектрально-пространственных профилей R(L, λ), r(L, λ) или их логарифмов, NPC - количество главных компонент (собственных векторов vn), используемых для определения параметра X (NPC=1, …, NLNλ). Использование в (14) логарифмического представления измерений и искомых параметров позволяет оперировать с числами одного порядка и устраняет возможность получения отрицательных значений определяемых параметров.
Степень полиномов M в (14) выбирается, исходя из среднеквадратичной погрешности аппроксимации статистической связи между ξn и X. Как правило, для аппроксимации достаточно использовать М=3. Оптимальное количество главных компонент NPC в (14) для каждого из модельных параметров X определяется путем замкнутого численного эксперимента, заключающегося в следующем. Первоначально по формуле (11) определяются линейно-независимые компоненты всех реализации профилей R(L, λ) и устанавливаются регрессии между первыми NPC компонентами ξn и параметром X. Далее перебираются все реализации модельных параметров и для каждой реализации осуществляется расчет X с использованием (11), (14) при наложении на R(L, λ) случайных отклонений в пределах δR (моделирующих погрешности измерения КДО). Полученное в результате значение X* сравнивается со значением X, соответствующем рассматриваемой реализации, и рассчитывается погрешность восстановления X. После перебора всех реализации вычисляется средняя погрешность восстановления X. Оптимальное значение NPC соответствует минимуму этой погрешности.
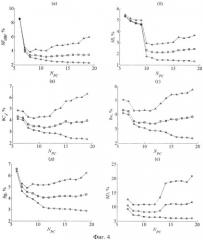
На фиг.4 приведены результаты вышеописанного численного эксперимента для следующих параметров слизистой оболочки: FtHb - концентрация общего гемоглобина в ткани; S - насыщение гемоглобина кислородом; Cs и ν - параметры спектральной зависимости редуцированного коэффициента рассеяния ткани, характеризующие объемную концентрацию и размер «эффективных» рассеивателей ткани соответственно. Зависимости средних по ансамблю погрешностей восстановления модельных параметров от количества главных компонент получены при наложении на R(L, λ) случайных отклонений в пределах 1% (окружности), 5% (квадраты) и 10% (треугольники). Видно, что при малых погрешностях оптических измерений (δR=1%) погрешности восстановления модельных параметров - δX уменьшаются с увеличением NPC. При δR=5-10% для восстановления рассматриваемых параметров оптимально использовать от 9 до 12 главных компонент. На фиг.5 приведены результаты сопоставления значений параметров FtHb S, Cs и ν, восстановленных из смоделированных профилей R(L, λ) при NPC=12, со значениями этих же параметров, соответствующих модельным реализациям R(L, λ). На рисунках также указаны средние погрешности восстановления параметров. Поскольку восстановление искомых параметров осуществлялось без наложения на профили R(L, λ) случайных отклонений, то разброс точек на диаграммах относительно прямой X=X* характеризует чувствительность результатов восстановления параметра X к вариациям всех других модельных параметров.
На фиг.6 представлены результаты восстановления биофизических параметров кожи. Вышеописанный численный эксперимент проводился для наиболее важных диагностических параметров: концентрация общего гемоглобина в дерме FtHb=fbloodCtHb (г/л); насыщение гемоглобина кислородом S; концентрация билирубина в крови Cbil (мг/л); интегральное содержание меланина в эпидермисе ODepi=fmelLepi (мкм); параметры Cs и ν спектральной зависимости редуцированного коэффициента рассеяния кожи µs(λ)=Cs·(632/λ)ν в диапазоне 600-700 нм, характеризующие структурные свойства ткани (объемную концентрацию и размер «эффективных» рассеивателей). Параметр ODepi восстанавливался из абсолютных значений R(L, λ). Для восстановления параметров FtHb, S, Cbil, Cs и ν использовались нормированные профили КДО - r(L, λ), где L0=0.23 мм. Невозможность восстановления параметра ODepi из профилей r(L, λ) связана с тем, что профили r(L, λ) практически не зависят от меланиновой пигментации кожи, поскольку оптические пути, проходимых светом в тонком верхнем слое кожи (эпидермисе), для рядом расположенных пр